毛蕊异黄酮对肺腺癌SPC-A1细胞增殖和凋亡的影响*
2020-09-25周立霞关洪全马贤德王丹
周立霞,关洪全,马贤德,王丹
[1.遵义医科大学第五附属 (珠海) 医院,广东 珠海 519100;2.辽宁中医药大学基础医学院,辽宁 沈阳 110847;3.锦州医科大学研究生学院,辽宁 锦州 121001]
近年来,全世界肺癌的发病率和病死率呈上升趋势,尽管手术、放疗、化疗、靶向和免疫治疗等综合治疗措施能提高患者的治愈率,但是大部分患者生存率仍偏低[1]。因此,寻找新的肺癌治疗方法显得尤为迫切。我国应用中草药治病历史悠久,中草药具有活血化瘀、清热解毒、扶正固本等功效,且其抗肿瘤毒副作用较小,不易产生耐药性,备受患者青睐。目前研究结果显示,中药在诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖、逆转肿瘤细胞多药耐药、抑制肿瘤细胞侵袭转移等方面发挥重要作用。因此,本研究探讨中药对肺癌患者的治疗价值,以期为肺癌患者的多学科综合治疗开拓一种新的途径。
毛蕊异黄酮是中药黄芪有效活性成分之一,具有低毒、作用靶点多等特点[2-4]。大量流行病学研究表明,毛蕊异黄酮具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤转移等多种活性,在预防和治疗肿瘤上有广泛的应用前景。有研究报道,毛蕊异黄酮在乳腺癌、卵巢癌、结肠癌、膀胱癌、骨肉瘤等肿瘤中都具有抗肿瘤作用[5-6]。但对肺癌的抗肿瘤作用机制的研究较少。CHENG 等[7]在毛蕊异黄酮抑制肺癌A549 细胞侵袭的体外研究中发现,毛蕊异黄酮可能通过抑制ERK1/2 通路下调MMP-2和MMP-9的表达,抑制A549 细胞的侵袭。同时,在裸鼠的研究中发现,毛蕊异黄酮能明显抑制肿瘤细胞的生长,生存曲线显示毛蕊异黄酮可以明显延长荷瘤小鼠的生存周期。
本研究以肺癌细胞系SPC-A1细胞为研究对象,探讨毛蕊异黄酮对SPC-A1细胞的增殖和凋亡的影响,并初步探索其简单机制,为临床上毛蕊异黄酮的应用提供更多的理论依据。
1 材料与方法
1.1 材料
人SPC-A1肺癌细胞株 (中国医学科学院肿瘤细胞库),DMEM培养基 (美国Invitrogen公司),胎牛血清 (天津灏洋公司),毛蕊异黄酮 (美国Selleck公司),四甲基偶氮唑蓝 (MTT) 、Cyclin D1、CDK4、CDK6和GAPDH (美国Santa Cruz公司),逆转录聚合酶链反应 (RT-PCR) 试剂盒 (大连宝生生物工程有限公司),引物合成 (北京华大基因)。
1.2 仪器与设备
超纯水处理装置 (明澈-D 24 UV,美国Merck Millipore公司),SANYO MCO-20AIC型二氧化碳培养箱 (日本三洋公司),激光共聚焦显微镜Leica TCS SP5 Ⅱ (美国Leica公司),FACS Calibur 流式细胞仪 (美国BD公司),Applied Biosystems Veriti PCR仪 (美国Bio Rad公司),QuixellTM定量PCR仪 (美国Bio Rad公司),实时定量PCR仪 (美国Miniopticon公司),Nanodrop 2000c分光光度计 (中国Thermo公司)。
1.3 实验方法
1.3.1 实验分组对照组:人肺腺癌SPC-A1细胞培养基中不含毛蕊异黄酮;实验组 (分成25 μg/ml组、50 μg/ml组及100 μg/ml组) :人肺腺癌SPC-A1细胞培养基更换成含毛蕊异黄酮培养基,终浓度分别为25、50及100 μg/ml。
1.3.2 细胞培养以含10%胎牛血清的DMEM (表达载体) 培养基,在37℃、5%的二氧化碳培养箱中孵化人肺腺癌SPC-A1细胞株,传代时用胰酶消化,以胰酶抑制剂终止消化。将人肺腺癌SPC-A1细胞株以1×105个/ml 浓度接种于96 孔培养板,细胞贴壁后,分别加入0、25、50及100 μg/ml 毛蕊异黄酮0.1 ml。
1.3.3 MTT实验取各个药物浓度处理后的SPC-A1细胞,于0、12、24、36及48 h时间点,通过MTT法检测细胞增殖情况。以二甲基亚砜 (DMSO) 处理作为对照。于0、12、24、36及48 h分别加入5 mg/ml MTT 10 μl,培养4 h后弃上清,每孔中加入DMSO 200 μl,溶解后在波长490 nm处记录光密度 (OD) 值,计算细胞增殖抑制率。药物对细胞抑制率计算方法:细胞生长抑制率= (对照组OD值-药物组OD值) /对照组OD值×100%,半数抑制浓度 (IC50) 计算方法:用细胞存活率做剂量对数图,并按作图法求出IC50值。
1.3.4 流式细胞术取处于对数生长期的SPC-A1细胞,常规培养24 h后,一组加入0、25、50及100 μg/ml的毛蕊异黄酮培养液,培养细胞48 h。另一组加入100 μg/ml的毛蕊异黄酮,培养细胞12、24及48 h。将收集的细胞离心洗涤后加入预冷的70%乙醇,吹打均匀,4℃过夜。磷酸盐缓冲液 (PBS) 洗涤重悬细胞后,加入碘化丙啶染液,4℃染色30 min,用流式细胞仪进行检测。
1.3.5 Hoechst33258染色SPC-A1细胞与NaCl、25、50及100 μg/ml 毛蕊异黄酮孵育48 h。孵育结束后,细胞以4%多聚甲醛固定,然后用PBS 冲洗2次,加入10 μg/ml Hoechst 33258 室温下染色5 min,用PBS 冲洗3次。荧光显微镜下观察。
1.3.6 Westernblotting 取不同浓度毛蕊异黄酮处理48 h后的SPC-A1细胞,弃去培养液,PBS 洗涤3次,裂解液在冰上裂解细胞30 min,用吸管反复吹打细胞使其悬浮,提取出来的蛋白4℃、12 000 r/min 离心20 min。将提取出来的总蛋白电泳,将不同分子量的蛋白分离开来,再转至PVDF 膜上,5%脱脂牛奶室温孵育2 h,TBST缓冲液洗涤3次,接着孵育抗Cyclin D1、CDK4、CDK6 抗体 (1∶1 000)和抗GAPDH 抗体 (1∶1 000),在4℃条件下过夜。二抗 (1∶5 000) 孵育1 h,TBST缓冲液洗涤3次,超敏发光液发光,用凝胶成像系统照相扫描对其灰度值进行分析,以Cyclin D1、CDK4、CDK6 灰度值与内参GAPDH的比值表示其蛋白表达水平。
1.3.7 RT-PCR取不同浓度毛蕊异黄酮处理48 h后的SPC-A1细胞,用Trizol 法提取各组SPC-A1细胞总RNA,使用逆转录试剂盒,在20 μl 总体积中取1 μg,逆转录成cDNA。使用实时荧光定量PCR 仪及试剂盒进行检测。PCR 反应条件为60℃预变性30 s,95℃变性10 s,共50个循环。所有反应至少重复3次。计算目的基因mRNA的相对表达量。
1.4 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差 (±s)表示,比较采用单因素方差分析或重复测量设计的方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 毛蕊异黄酮抑制SPC-A1细胞增殖
0、25、50及100μg/ml毛蕊异黄酮分别作用于SPC-A1细胞12、24、36和48h后细胞增殖抑制率的变化采用重复测量设计的方差分析,结果:①不同时间点比较,SPC-A1细胞增殖抑制率有差异 (F=25.074,P=0.012) ;②各组比较,SPC-A1细胞增殖抑制率有差异 (F=67.536,P=0.003) ;③各组SPC-A1细胞增殖抑制率变化趋势有差异 (F=18.536,P=0.026)。实验结果表明,毛蕊异黄酮可以显著抑制SPC-A1细胞的增殖,且随着毛蕊异黄酮浓度的增加和作用时间的延长,对细胞的增殖抑制作用明显增加,说明毛蕊异黄酮对细胞增殖的抑制作用具有浓度和时间依赖性。见表1和图1。毛蕊异黄酮对SPC-A1细胞24、36及48h的IC50分别为71.2、30.4和22.6μg/ml。
2.2 毛蕊异黄酮提高SPC-A1细胞凋亡率
流式细胞仪结果显示:不同浓度毛蕊异黄酮作用SPC-A1细胞48h后,4组SPC-A1细胞凋亡率比较,采用方差分析,差异有统计学意义 (P<0.05)。见表2和图2。
毛蕊异黄酮100μg/ml作用于SPC-A1细胞12、24和48h后对其细胞凋亡率的影响采用重复测量设计的方差分析,结果:①不同时间点比较,SPC-A1细胞凋亡率有差异 (F=46.148,P=0.004) ;②两组SPC-A1细胞凋亡率有差异 (F=68.741,P=0.001) ;③两组SPC-A1细胞凋亡率变化趋势有差异 (F=14.536,P=0.032)。实验结果表明,毛蕊异黄酮可以诱导SPC-A1细胞发生凋亡,且随着毛蕊异黄酮浓度的增加和作用时间的延长,细胞的凋亡率升高。见表3和图3。
表1 各组不同时间点SPC-A1细胞的增殖抑制率 (%,±s)

表1 各组不同时间点SPC-A1细胞的增殖抑制率 (%,±s)
注:①与对照组比较,P<0.05;②与25 μm/l组比较,P<0.05;③与50 μm/l组比较,P<0.05。
组别 12 h 24 h 36 h 48 h对照组 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 25 μg/ml组 8.89±0.08 34.56±1.83 47.56±1.78 56.67±0.85 50 μg/ml组 14.36±0.96①② 48.34±0.43①② 60.56±0.38①② 72.56±1.34①②100 μg/ml组 17.96±1.23①②③ 56.56±0.04①②③ 69.56±1.45①②③ 81.26±0.05①②③
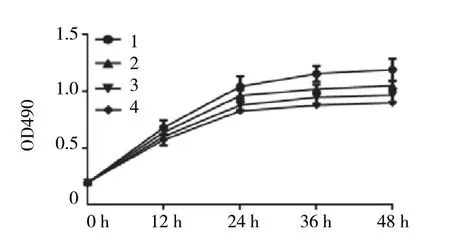
图1 不同浓度毛蕊异黄酮作用下SPC-A1细胞的增殖情况 (±s)
表2 不同浓度毛蕊异黄酮作用48 h后SPC-A1细胞凋亡率的比较 (%,±s)
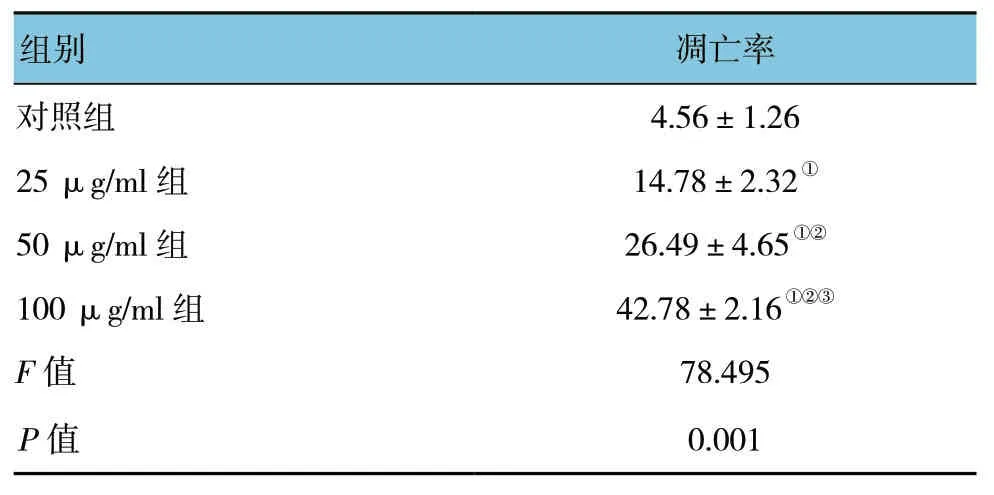
表2 不同浓度毛蕊异黄酮作用48 h后SPC-A1细胞凋亡率的比较 (%,±s)
注:①与对照组比较,P<0.05;②与25μg/ml组比较,P<0.05;③与50μg/ml组比较,P<0.05。
组别 凋亡率对照组 4.56±1.26 25 μg/ml组 14.78±2.32①50 μg/ml组 26.49±4.65①②100 μg/ml组 42.78±2.16①②③F值 78.495 P值 0.001
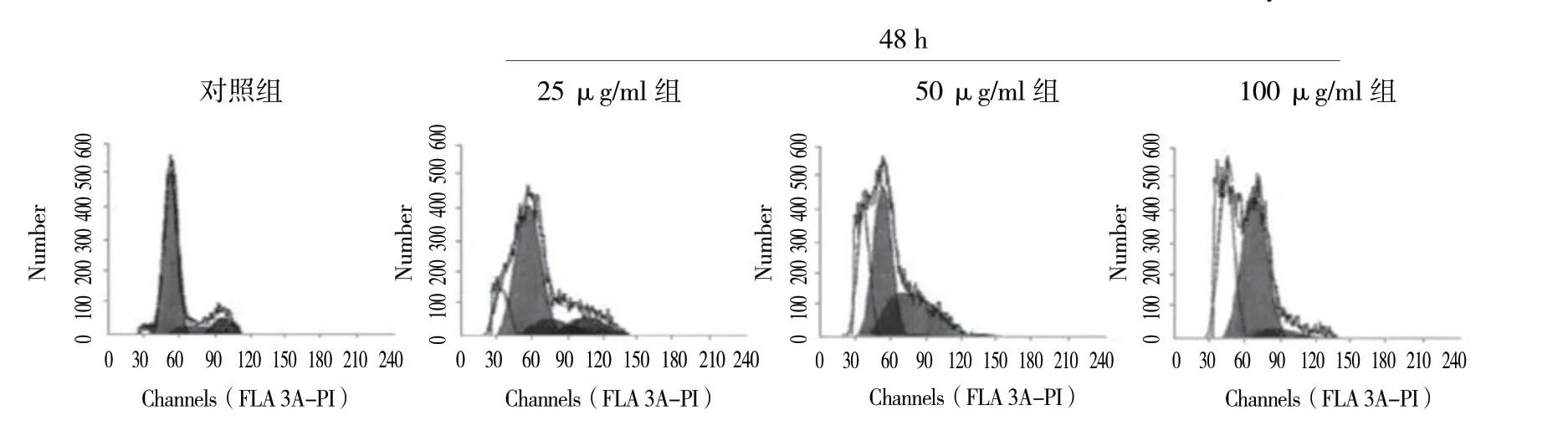
图2 不同浓度毛蕊异黄酮作用48 h后对SPC-A1细胞凋亡率的影响
2.3 毛蕊异黄酮诱导SPC-A1细胞凋亡
Hoechst 33258 染色后荧光显微镜下观察,发现对照组几乎所有细胞核形态完整,呈圆形,淡蓝色,染色质在核内均匀分布;毛蕊异黄酮作用48h后,细胞核呈亮蓝色,固缩状或团块状结构,核内染色质浓缩,边集凝聚成大小不同的块,形成凋亡小体。随着毛蕊异黄酮浓度的增加,细胞核碎裂程度也明显增加,具有凋亡形态的细胞数目也增加。见图4。
2.4 毛蕊异黄酮抑制Cyclin D1、CDK4、CDK6蛋白及mRNA表达
0、25、50及100μg/ml 毛蕊异黄酮分别加入SPC-A1细胞中,作用24h后,结果显示,毛蕊异黄酮可以抑制细胞在G1期进行G1/S期的转换,随着浓度的增加,G0/G1期细胞比例升高,S期及G2/M期细胞比例降低,4组比较,差异有统计学意义 (P<0.05)。见表4。
不同浓度毛蕊异黄酮对Cyclin D1、CDK4、CDK6蛋白表达的影响见图4。不同浓度毛蕊异黄酮对Cyclin D1、CDK4、CDK6 mRNA表达的影响见表5,差异有统计学意义 (P<0.05),实验组与对照组比较,差异有统计学意义 (P<0.05)。不同浓度毛蕊异黄酮对Cyclin D1、CDK4、CDK6蛋白及mRNA表达均有一定程度抑制作用,随着药物浓度的升高作用增强。
表3 100 μg/ml 毛蕊异黄酮作用不同时间后SPC-A1细胞凋亡率的比较 (%,±s)
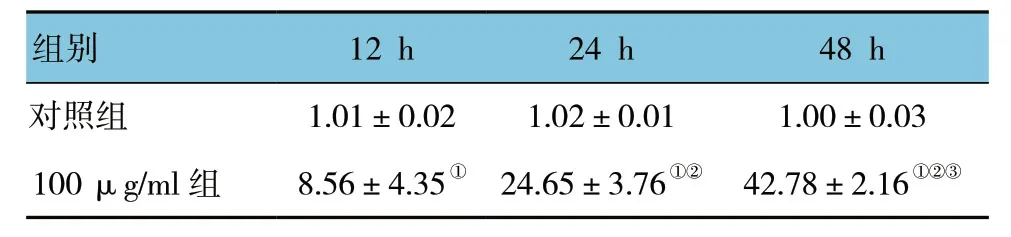
表3 100 μg/ml 毛蕊异黄酮作用不同时间后SPC-A1细胞凋亡率的比较 (%,±s)
注:①与对照组比较,P<0.05;②与12 h比较,P<0.05;③与24 h比较,P<0.05。
组别 12 h 24 h 48 h对照组 1.01±0.02 1.02±0.01 1.00±0.03 100 μg/ml组 8.56±4.35① 24.65±3.76①② 42.78±2.16①②③
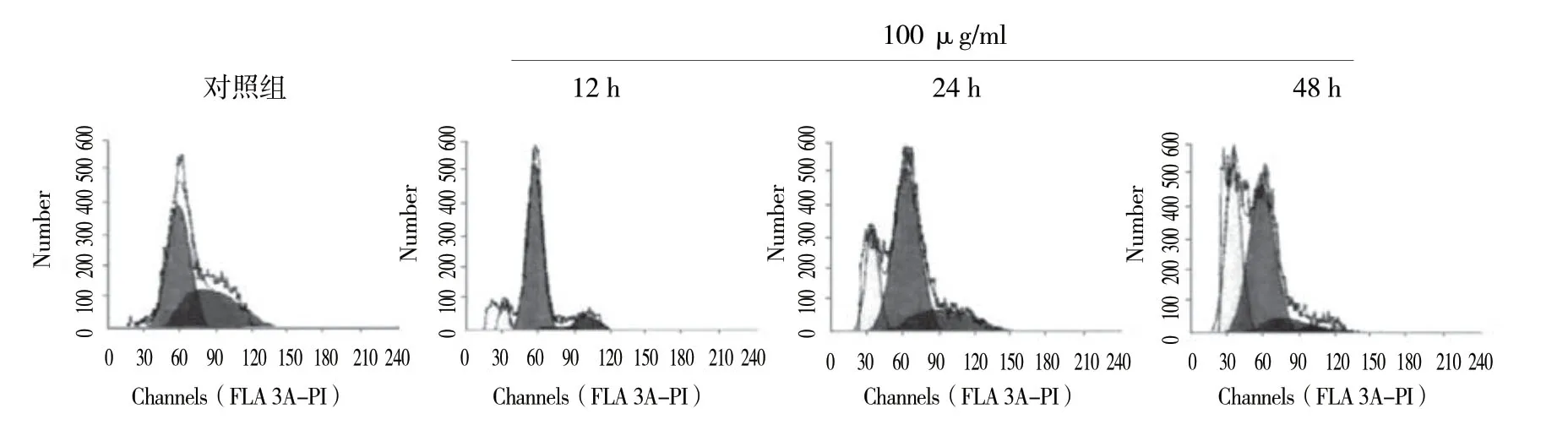
图3 100 μg/ml 毛蕊异黄酮作用不同时间后对SPC-A1细胞凋亡率的影响

图4 不同浓度毛蕊异黄酮作用48 h后SPC-A1细胞凋亡情况 (Hoechst33258 染色×200)
表4 不同浓度毛蕊异黄酮作用24 h后SPC-A1细胞周期分布 (%,±s)

表4 不同浓度毛蕊异黄酮作用24 h后SPC-A1细胞周期分布 (%,±s)
注:†与对照组比较,P<0.05。
组别 G0/G1期 S期 G2/M期对照组 10.63±1.04 53.60±1.49 37.16±2.08 25 μg/ml组 16.58±1.27 50.07±2.02 34.04±1.67†50 μg/ml组 28.13±1.96† 44.89±1.46† 30.69±2.24†100 μg/ml组 41.58±3.34† 33.07±2.02† 25.04±1.96†F值 52.178 39.482 18.015 P值 0.001 0.006 0.021
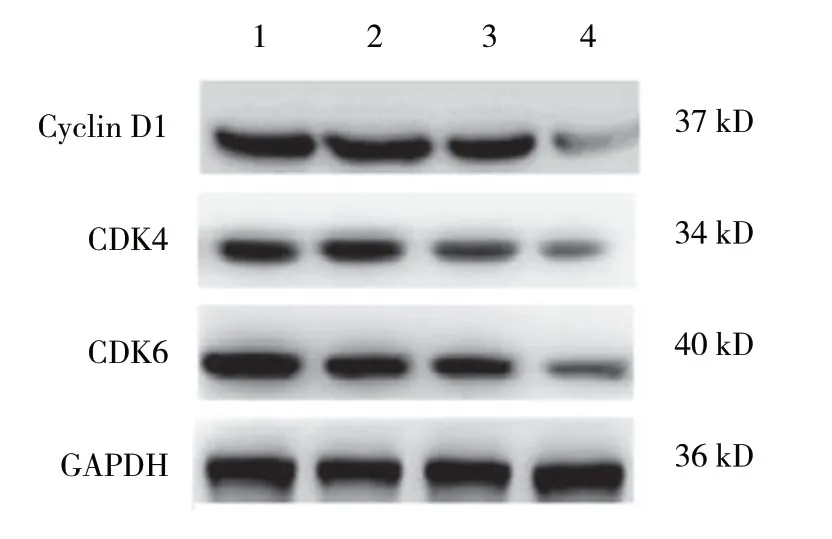
图4 不同浓度毛蕊异黄酮Cyclin D1、CDK4、CDK6蛋白表达的影响
表5 不同浓度毛蕊异黄酮对Cyclin D1、CDK4、CDK6 mRNA表达的影响 (±s)
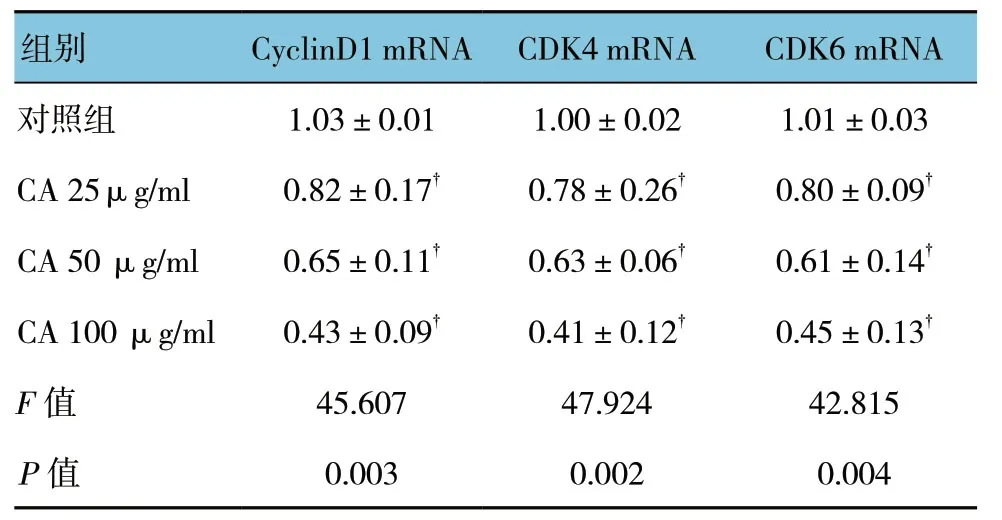
表5 不同浓度毛蕊异黄酮对Cyclin D1、CDK4、CDK6 mRNA表达的影响 (±s)
注:†与对照组比较,P<0.05。
组别 CyclinD1 mRNA CDK4 mRNA CDK6 mRNA对照组 1.03±0.01 1.00±0.02 1.01±0.03 CA 25μg/ml 0.82±0.17† 0.78±0.26† 0.80±0.09†CA 50 μg/ml 0.65±0.11† 0.63±0.06† 0.61±0.14†CA 100 μg/ml 0.43±0.09† 0.41±0.12† 0.45±0.13†F值 45.607 47.924 42.815 P值 0.003 0.002 0.004
3 讨论
肺癌是恶性肿瘤中最常见的一种,其发病率和病死率仍在逐年升高。中医中药治疗在改善肿瘤患者症状、提高生存质量、延长生存期、减轻放化疗毒副作用等方面独具特色。从肺癌的病因病机、辨证论治和中西医结合治疗方面总结近几年中非小细胞肺癌治疗的经验,提出中药及中西医结合治疗在放化疗阶段及晚期患者的治疗中起着不可忽视的作用[8]。毛蕊异黄酮是黄芪的主要有效成分,临床前研究结果表明其活性化合物具有延缓多种肿瘤发展的作用[9]。毛蕊异黄酮可以影响肿瘤发生、发展的多个环节,进而达到抑制肿瘤的效果。毛蕊异黄酮对肿瘤的抑制作用主要表现在其抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤细胞转移和侵袭。目前研究指出,毛蕊异黄酮可以通过调节细胞周期蛋白Cyclin D1表达来调控细胞的增殖[10]。Cyclin D1 是一类在细胞周期中含量呈周期性变化的细胞周期调节蛋白,与CDK4/CDK6 结合而形成复合物,加速细胞周期调控点G1/S的转变,从而促进细胞增殖。研究表明,毛蕊异黄酮通过抑制Cyclin D1蛋白及mRNA的表达,使细胞生长周期阻滞在G0/G1期来抑制细胞的增殖[11]。毛蕊异黄酮也可以通过调节Bax/Bcl-2 蛋白表达水平,增加细胞Caspase-3、Caspase-9 活性来诱导肿瘤细胞的凋亡[12]。也有研究指出,毛蕊异黄酮可以通过调节PI3K/Akt信号通路、Ras-Raf-p38 MAPK 信号通路、调控ERβ/miR-17 信号通路诱导细胞凋亡或者启动线粒体凋亡途径等来影响肿瘤细胞的生长[13-14]。有学者证明,毛蕊异黄酮也可以通过影响MMPs或影响钙黏素来抑制肿瘤细胞的侵袭和转移[15-16]。
本实验证实,毛蕊异黄酮可以显著抑制人肺癌细胞株SPC-A1的增殖,并且其抑制作用随着药物浓度增加而增强。毛蕊异黄酮能够引起核固缩,形成凋亡小体,诱导SPC-A1细胞凋亡。毛蕊异黄酮可以在蛋白与mRNA水平上抑制Cyclin D1、CDK4、CDK6蛋白及mRNA的表达,即毛蕊异黄酮可以通过影响这些蛋白来起到对SPC-A1细胞增殖的抑制作用。
综上所述,毛蕊异黄酮可以明显抑制肺腺癌细胞的增殖、诱导其凋亡,这为毛蕊异黄酮的临床应用提供更多的理论基础,但其作用机制有待于进一步深入探讨研究。
