多发性硬化症显像剂11C-CIC的合成
2015-05-16张锦明张晓军黄德晖田嘉禾
张锦明,张晓军,黄德晖,王 卉,刘 健,田嘉禾
(1.解放军总医院 核 医学科,北京 100853;2.解放军总医院 神 经内科,北京 100853)
多发性硬化(multiple sclerosis,MS)是一种慢性、炎症性、脱髓鞘的中枢神经(CNS)疾病,病理改变为大脑和脊髓的神经髓鞘斑块性的破坏,由于PET缺少特异性显像剂,目前影像学诊断MS以MRI为主。与MRI相比,PET/CT诊断MS灵敏性更高,18F-FDG结果表明,与正常人相比,MS病人整脑的FDG摄取降低了3%~18%,摄取降低的主要区域为皮层和白质[1]。但在稳定的 MS病人中,由于大面积的髓鞘斑块,FDG摄取反而增高,增加了MS鉴别诊断的难度。Stankoff等[2]发现用于早老痴呆(AD)诊断的刚果红可与CNS的髓磷脂结合,因此用诊断AD的11C-PIB用于诊断MS,经二例患者的动态PET显像表明,可以定量分析脱髓鞘情况。最新研究表明[3],11C-PIB在髓磷脂密度很高的区域的放射性分布很低,不适用于研究MS。因此,MS显像剂的特异性是关键问题。2006年,Wu CY等[4]研制第一个靶向髓磷脂 (myelin)的PET显像剂4-(4-(4-氨 基 苯 乙 烯基)-2,5-二 甲 氧 基苯乙烯基)-[N-甲基-11碳]苯胺(11C-CIC),体外研究表明CIC与CNS的髓磷脂结合,而与髓鞘斑块不结合。经MS动物模型证实,11C-CIC能特异性反映髓鞘病变的范围和程度,甚至在功能代偿期而病理尚未出现明显变化时就已发现摄取异常。随后比较了11C-CIC与其他MS显像剂的区别,认为11C-CIC在诊断MS方面有一定的价值[5-6]。Wang YM 采用碘代甲烷与 CIC前体反应,在弱碱条件下甲基化,但甲基化效率不高[7]。本研究尝试用活性更高的Triflate-CH3作甲基化试剂,自动化合成了11C-CIC,提高合成效率,同时研究其体外稳定性,并进行Micro PET/CT显像研究。
1 实验材料
HM-20回旋加速器:日本住友重机械株式会社;PET自动化碳-11多功能合成模块:内置液相碘代甲烷、Triflate在线转换、甲基化和HPLC纯化(配紫外和放射性检测器)及固相萃取等设备:派特(北京)科技公司;分析HPLC仪,配Biocan Flow Count放射性检测器和2487紫外检测器,C-18柱:美国 Waters公司;1 mol/L的氢化锂铝四氢呋喃溶液:德国,ABX公司;57%HI:AR,美国Acros公司;100 g/L的Vc溶液:美国 Mc Guff公司;乙醇(USP级,美国Milenniu m公司;丙酮:AR,美国Sigma公司;前体:4-(4-(4-氨基苯乙烯基)-2,5-二甲氧基苯乙烯基)-苯胺和标准品4-(4-(4-氨基苯乙烯基)-2,5-二甲氧基苯乙烯基)-[N-甲基]苯胺:美国Case大学Wang YM教授赠送;e XPlore Vista小动物PET/CT成像系统:美国GE公司。
2 实验方法
2.1 在线转换11 C-CH3-Triflate
采用 H M-20加速器经14N(p,α)11C反应,在靶内生成11CO2。将11CO2传到浸于液氮中的LOOP环(0.3 mm×5 000 mm)上,11CO2经LOOP时被固化成干冰滞留在LOOP环内。自动化碳-11多功能合成模块合成11C-碘代甲烷,LOOP环脱离液氮后经空气加热,干冰重新转化成气态的11CO2,由40 mL/min的氮气将11CO2输送到含0.2 mL 1 mol/L的氢化锂铝四氢呋喃(T HF)溶液的反应管中,11CO2与氢化锂铝反应生成复合盐,复合盐与氢碘酸反应生成碳-11碘代甲烷。由氮气将碳-11碘代甲烷载带入已加热到200℃不锈钢管(10 mm×70 mm),管内有0.4 g三氟甲基磺酰基银与0.65 g石墨混合物,碳-11碘代甲烷在线转换成11C-CH3-Triflate[8],进入下一反应瓶。
2.2 11 C-CIC的合成
将11C-CH3-Triflate通入到新配制含1~2 mg的去甲基CIC前体的200μL丙酮溶液内,反应瓶冷却到6℃左右,观察R4的放射性计数,待R4的放射性计数达到最大,停止通入11C-CH3-Triflate。反应瓶在室温或加热到90℃,维持3 min。将V14瓶内HPLC流动相液体加到反应瓶终止反应,并液体转移到半制备 HPLC柱(Alltech C-18 10 mm×150 mm)上纯化(图1中D部分);流动相为V(乙腈)∶V(水)=8∶2的溶液,流速为5 mL/min,收集7~8 min的放射性液体,将收集的放射性液体与60 mL注射用水混合,混合液过Sep-Pak C-18柱(Sep-Pak C-18柱预先用10 mL乙醇活化,再用10 mL水清洗),11C-CIC吸附在Sep-Pak C-18柱上,将24号瓶内10 mL水清洗该柱后,用22号瓶内1 mL乙醇将产品从柱上洗脱,并用25号瓶内9 mL生理盐水稀释,过无菌膜即可。
2.3 放化纯度
HPLC方法测量条件为:Waters的HPLC,2487紫外分光光度计,检测波长254 nm;515泵,分析柱为反相Phenomens C-18柱(3.9 mm×150 mm),Bio-Scan的Flow-Count放射性检测器。流动相为V(乙腈)∶V(水)=7∶3的混合溶液,流速为1 mL/min,未反应的11C-CH3-Triflate的tR=2.6 min,11C-CIC的tR=7.1 min,副产品的tR=4.4 min。

图1 11 C-CIC的化学合成模块Fig.1 The chemical module of radio-synthesis for 11 C-CIC

图2 合成11 C-CIC线路图Fig.2 Scheme of 11 C-CIC synthesis
2.4 11 C-CIC体外稳定性
将最后形成的含10%乙醇、浓度为300 TBq/L的11C-CIC室温放置,每间隔10 min用 HPLC测量11C-CIC的放化纯度。从SEP-PAK C-18柱上淋洗下来的11C-CIC乙醇溶液,用100 g/L的Vc和生理盐水溶液稀释,最终得含10%乙醇及10 g/L Vc、浓度为300 TBq/L的11C-CIC,相同方法测放化纯度。
2.5 11 C-CIC在正常小鼠体内的生物分布
取20±2 g的NH雄性小鼠(中国人民解放军总医院动物中心提供)20只,编号后计算机随机分成4组,尾静脉注射11C-CIC 的3.7 MBq/0.1 mL,于注射后5、15、30、60 min分别处死小鼠,取血、心、肝、脑等主要器官,称重并在井型计数器上计数,计算各器官的放射性摄取率(ID%/g)。
2.6 Micro PET/CT显像
NH小鼠和SD正常大鼠(军事医学科学院动物中心提供)2只。腹腔注射5%的水合氯醛麻醉,注射后30 min置于e Xpl ore Vista Micr o PET/CT上扫描,NH小鼠行全身扫描,大鼠仅做头部扫描。先行PET再行CT以定位,确定放射性浓集的部位。
3 结果与讨论
3.1 11 C-CIC的合成
从4-(4-(4-氨基苯乙烯基)-2,5-二甲氧基苯乙烯基)-苯胺的化学结构分析,其分子式上有二个对称的苯胺;苯胺很容易发生甲基化反应,如11C-PIB的合成,在室温下甲基化效率高达65%。Ono M等[9]采用的顺式二苯乙烯胺也可以在室温下与11C-Triflate-CH3反应。但本研究中CIC前体在丙酮或DMSO等溶剂中,在常温下不发生甲基化反应,加热后才能发生反应,可能是受两个共轭健影响。
图3a为经半制备HPLC纯化11C-CIC的放射性色谱图分析,流动相为60%的乙腈,在4.0 min到15 min处一个较大的放射性峰,该峰不是11C-Triflate-CH3,而是其他杂质。收集16 min处的放射性液体,HPLC分析发现产品的放化纯度很低,出现了多个杂质峰(图3b),说明60%的乙腈作半制备的流动相不合适。分别采用60%、70%和80%的乙腈作流动相,发现升高乙腈的浓度,缩短了产品在HPLC柱上的保留时间,杂质峰随浓度升高而降低。采用80%乙腈作HPLC流动相分离,最终产品的放化纯度仍低于95%。
3.2 11 C-CIC体外稳定性
采用不同浓度的乙腈作流动相,发现提高流动相中乙腈的浓度,产品在HPLC柱上的保留时间缩短,杂质峰面积随乙腈浓度升高而降低,分析收集到产品的放化纯度,产品的放化纯度随流动相中乙腈的上升而提高,说明可能产品在Semi-HPLC分离过程中分解。最终产品经SEP-PAK C-18柱固相萃取,加入10%的乙醇,室温放置;产品在常温下分解很快,说明11C-CIC体外不稳定。文献在合成18F-W372中加入抗坏血酸以提高体外稳定性[10],在分离11C-CIC的HPLC流动相中加入10 g/L的抗坏血酸,发现杂质峰面积下降(图4a),同时收集半成品的放化纯度大于99%(图4b),与图3b相比,在3~5 min的杂质峰消失,说明10 g/L的抗坏血酸防止了11C-CIC的分解。在最终产品中加入10 g/L抗坏血酸,室温放置,观察60 min,产品11C-CIC的放化纯度仍大于99%,体外稳定性良好。
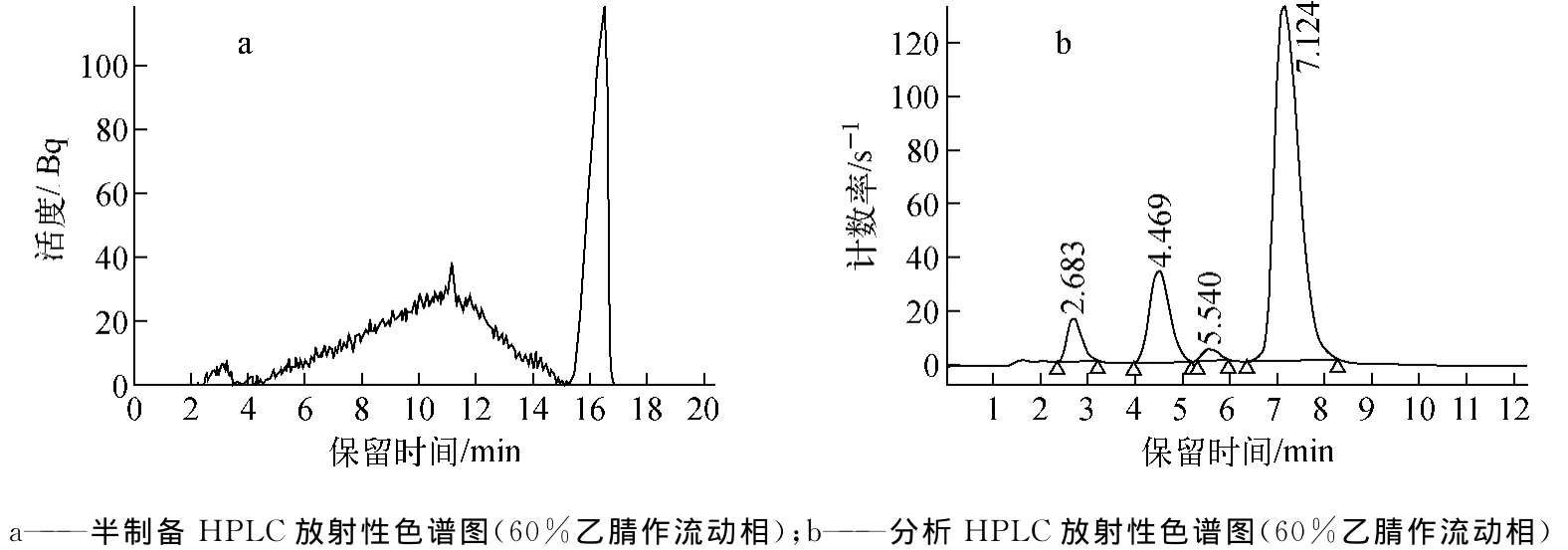
图3 11 C-CIC的HPLC放射性色谱图a——purification of Semi-HPLC(60%acetonitrile as mobile);b——analysis HPLC(60%acetonitrile as mobile)Fig.3 Radio-chromatogram of 11 C-CIC

图4 11 C-CIC的HPLC放射性色谱图a——purification of Semi-HPLC(80%acetonitrile and 10 g/L Vc as mobile);b——sanalysis HPLC(70%acetonitrile as mobile)Fig.4 Radio-chromatogram of 11 C-CIC
3.3 11 C-CIC的质量控制
分析HPLC放射性色谱图表明(图4b),11C-CIC的放化纯度大于99%,几乎无放射性杂质;紫外未见有前体存在。共进CIC标准品的UV保留时间表明,放射性峰与标准品在HPLC上有相同的保留时间,证实放射性物质为CIC。由于CIC中共轭的作用,产品呈淡绿色,紫外吸收峰较强(产品中吸光度达0.013 AU)。
3.4 11 C-CIC的自动化合成
采用全自动合成模块,从11CO2开始到产品合成全部耗时25 min,合成效率为55%~65%(n>10)。图4a为Semi-HPLC纯化11CCIC的放射性色谱图,可见,在2.5~4.5 min之间为未反应的Triflate-甲烷,产品峰在5~6 min之间。半制备的紫外检测前体在保留时间tR=3.5~4.5 min时出现,前体被分离,因此产品中没有检查到前体。采用HM-20回旋加速器加速器,束流为40μA,轰击12 min,最终得到3.3 GBq的11C-CIC,比活度为60 TBq/mol。
3.5 11 C-CIC在正常小鼠体内生物分布
11C-CIC在正常小鼠体内的生物分布结果列于表1。经尾静脉注射11C-CIC后,血液清除很快,到5 min时,为(1.86±0.66)%ID/g,到10 min 时 下 降 到 (0.43±0.21)%ID/g,5 min与30 min放射性摄取比为10.9;放射性主要分布在肝、脾和肾内,30 min在肝内放射性仍较高,清除较慢,可能与其脂溶性高有关,全脑摄取较高,在5 min时达(2.78±0.02)ID%/g,到30 min时为(0.52±0.05)%ID/g,5 min与30 min放射性摄取比为5.3,脑内有较好的滞留。
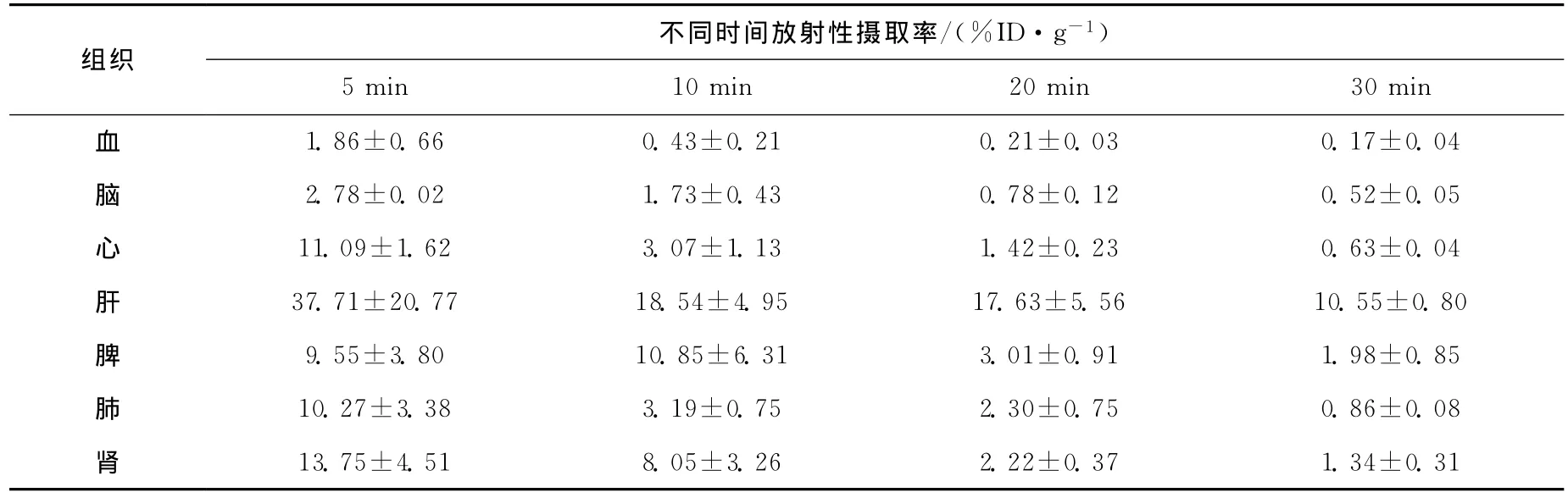
表1 11 C-CIC在正常小鼠体内的生物分布Table 1 The biodistribution of 11 C-CIC in the nor mal NH mice
3.6 Micro PET显像
11C-CIC在正常NH小鼠的PET显像见图5a,放射性主要集中于肝内,双肺区放射性较高,肌肉及大脑内有放射性摄取,该显像与生物学分布一致。大鼠的脑PET显像见图5b,可见30 min时大脑内有明显的放射性摄取,摄取区域为鼠脑白质区(图5b中白色箭头),该摄取即为11C-CIC与CNS白质区髓磷脂结合。

图5 11 C-CIC在正常NH鼠和SD大鼠显像a——Whole body PET i maging of NH mice;b——Brain PET i maging of SD ratFig.5 The PET i maging of 11 C-CIC in NH mice and SD rat
4 结论
本研究自动化合成了11C-CIC,研究了其体外稳定性并进行Micro PET显像。在半制备HPLC流动相及终产品加入10 g/L的抗坏血酸,能有效防止11C-CIC的体外分解。11C-CIC能进入鼠大脑,并被正常的脑白质摄取,提示11C-CIC有可能成为髓鞘斑潜在显像剂。
[1] Bakshi R,Miletich R S,Kinkel P R,et al.High-resolution fluorodeoxyglucose positron emission tomography shows both global and regional cerebral hypometabolis m in multiple sclerosis[J].J Neuroi maging,1998,8(4):228-234.
[2] Stankoff B,Freeman L,Aigrot M S,et al.Ima-ging Central Ner vous System Myelin by Positr on Emission To mography in Multiple Sclerosis Using[Methyl-11C]-2-(40-Methylaminophenyl)-6-Hydroxybenzothiazole[J].Ann Neurol,2011,69:673-680.
[3] Faria Dde P,Copray S,Sijbes ma J W,Willemsen AT,Buchpiguel CA,Dierckx RA,de Vries EF.PET i maging of focal demyelination and remyelination in a rat model of multiple sclerosis:comparison of [11C]Me DAS,[11C]CIC and[11C]PIB[J].Eur J Nucl Med Mol Imaging,2014,41(5):995-1 003.
[4] Wu C,Tian D,Feng Y,et al.A Novel Myelin Probe that Readily Enter the Brain and Selectively Binds to Meylin Sheaths[J].J Histochem Cytochem,2006,54:997-1 004.
[5] Wu C,Zhu J,Baeslack J,et al.Longitudinal positron emission to mography i maging for monitoring myelin repair in the spinal cord[J].Ann Neurol,2013,74(5):688-698.
[6] de Paula Faria D,de Vries E F,Sijbes ma J W,et al.Copray Simaging of demyelination and remyelination in t he cuprizone mouse model for multiple sclerosis:a co mparison bet ween [11C]CIC and [11C]Me DAS[J].Neuroi mage,2014,15(87):395-402.
[7] Wang Y M,Wu C Y,Caprariello AV,et al.In Vivo Quantification of Myelin Changes in the Vertebrate Nervous System [J].J Neurosci,2009,29(46):14 663-14 669.
[8] 张锦明,田嘉禾,王武尚,等.在线制备11CH3-Triflate[J].同位素,2006,19(2):124-128.Zhang J M,Tian J H,Wang W S,et al.ON-line production of11CH3-Triflate[J].Isotopes,2006,19(2):124-128(in Chinese).
[9] Ono M,Wilson A,Nobrega J,et al.11C-labeled stilbene derivatives as Abeta-aggregate-specific-PET i maging agents for Alzhei mer’s disease[J].Nucl Med Biol,2003,30:565-571.
[10]张晓军,富丽萍,张锦明,等.新型Aβ斑块显像剂18F-W372[J].核化学与放射化学,2013,35(1):40-45.Zhang X J,Fu L P,Zhang J M,et al.A Novel Aβ-Amyloid Imaging Agent18F-W372 f or Alzheimer’s Disease[J].J Nucl Radiochem,2013,35(1):40-45(in Chinese).
