诊断黑色素瘤的放射性药物研究进展
2015-05-16黄占文
尤 强,陈 跃,黄占文,王 力
(1.四川医科大学附属第一医院 核 医学科,四川 泸 州 646000;2.四川医科大学 药 学院,四川 泸 州 646000)
黑色素瘤(Melano ma)致死率高,发生率在所有皮肤肿瘤中约占5%,主要发生在皮肤的浅表层[1-2]。恶性黑色素瘤对人体具有极强的侵袭性,容易发生全身性转移,传统的放化疗很难从根本上对转移后的恶性黑色素瘤起作用,通常转移后患者的生存时间仅6个月[3-4]。据统计,恶性黑色素瘤已成为20至39年龄段的第二大致死因素[5-6]。然而,未转移前的早期恶性黑色素瘤却能够通过外科手术治愈。因此,恶性黑色素瘤的早期临床诊断,对提高患者的生存率至关重要。
在过去的几十年,对黑色素瘤的非侵袭性分子显像已取得了很大的发展,包括正电子发射计算机断层扫描(positron emission co mputed to mography,PET),单光子发射计算机断层扫描(single photon emission computerized tomography,SPECT),磁共振(nuclear magnetic resonanc,MRI),X射线断层影像(X-ray equip ment for computed tomography,CT),超声影像(ultrasound,US)在内的多种现象技术得到长足发展。相比于 MRI、CT、US等影像技术,核医学影像(PET/CT和SEPCT)可以提前六个月或者更早探测到黑色素瘤病灶,组织选择性和特异性高,吸引了越来越多的研究者对该类显像剂的关注[7]。特别是有“世纪分子”之称的正电子药物18F-脱氧葡萄糖(18F-Fluor odeoxygl ucose,18F-FDG)的出现,把核医学影像技术推向了新的高度。但18F-FDG在临床诊断上也遇到一些问题,如本底摄取率较高、肿瘤组织摄取率有限、特异选择性低等。如何将诊断药物靶向性的导入肿瘤组织,并在诊断过程中降低对正常组织细胞的损害,增加药物的选择性是核医学影像诊断药物研究重点思考的问题,其关键是通过放射性标记的化合物去识别病灶组织上的离子通道、受体等靶点。通过对恶性黑色素瘤具有特异性识别的分子进行放射性标记,可以用于黑色素瘤的诊断。而如何提高放射性药物在黑色素瘤组织中的摄取,增加其滞留时间,降低本底摄取率以及重要脏器摄取率低,成为黑色素瘤放射性分子探针的重要研究目标。目前用于黑色瘤显像的分子探针主要有两类:基于PET的正电子类和基于SPECT的单光子类,本文针对这两类诊断药物的研究进展进行综述。
1 单光子类分子探针
黑色素瘤细胞中有常见的两种受体,黑素皮质激素受体-1(MC1 R)以及整合素受体(Integrinαvβ3)。其中 MC1R属于G蛋白偶联受体(G pr otein-coupled receptor,GPCR)超家族中的A类。现共发现有五种黑素皮质激素受体(MC1 R~MC5R),激动剂主要是α-黑素细胞刺激素(α-melanocyte sti mulating hor mone,α-MSH),其中 MC1R与α-MSH亲和力最高。MC1R在人类正常黑色素细胞和黑色素瘤细胞中均有表达,其过度表达与黑色素瘤的发生与生长密切相关。而αvβ3的表达与特异性基质配体如精氨酸甘氨酸天冬氨酸 (Ar g-Gly-Asp,RGD)等三肽的相互作用以及肿瘤血管新生和转移中起着关键作用。αvβ3在活化的内皮细胞和肿瘤细胞中高度表达,但在正常的内皮细胞和多数正常组织中不表达,这为黑色素瘤的诊断与治疗提供了一个重要的靶点。因此,MC1R和αvβ3的显像大多采用的是放射性金属核素与 RGD、l,4,7,10-四氮杂环十二烷-N,N′,N″,N‴-四乙酸(1,4,7,10-Tetraazacyclododecane-N, N′, N″, N‴-tetraacetic acid,DOTA)、1,4,7-三氮杂壬烷-N,N′,N″-三乙酸(1,4,7-triazacyclononane-N,N′,N″-triacetic acid,NOTA)、氨基酸、多肽以及黑色素刺激激素(Melanocyte sti mulating hor mone,MSH)进行螯合得到的螯合物。
1.1 MC1R单光子放射性核素显像剂
MC1 R显像剂大多采用的是99mTc、111In、67Ga、203Pb等单光子金属离子与DOTA-MSH或NOTA-MSH的螯合物,其中99mTc标记的药物临床上最常用,具有标记时间短、标记简单、操作方便、价格相对便宜等优点。Miao课题组在这方面做了大量的研究工作。早期的研究,主要用111In标记了五个新的DOTA/氨基酸复合物[8],分别是111In-DOTA-ReCCMSH、111In-Ac-Lys(DOTA)-ReCCMSH、111In-DOTA-ReCCMSH(Arg11)、111In-DOTA-ReCCMSH-OH、111In-DOTAReCCMSH-Asp-OH,其 中,111In-DOTA-ReCCMSH(Arg11)的肿瘤摄取率最高(17.41±5.61)%ID/g、肾脏清除率最快(7.37±1.13%)ID/g。接下来,通过对111In-DOTA-ReCCMSH[9-10]进行简单的结构改造,分子中引入-Gly-Gl u-和Ac-Gly-Glu-基团,标记了两个新的分子探针。由于-Gly-Gl u-的引入,在不减少肿瘤组织摄取率的情况下,肾脏摄取率降低了44%,全身2 h清除率大于90%。在此基础上,Miao还考察[11]了-Gly-Gl u-或-Gly-Gly-基团 的引入 对受体MC1R的亲和力的影响,标记了三个新化合物。 其 中111In-DOTA-GENle-Cyc MSHhex与MC1R的亲和力高达873.4 n M,在黑色素瘤的显像诊断中表现出了潜在的临床开发价值。Eberle同样用111In离子与DOTA螯合,再与内源性的α-MSH链接,得到两个新的 MC1R受体 显 像 剂111In-DOTA-MSHoct和111In-DOTANDP-MSH[12-13]。在B16F10小鼠黑色素瘤显像研究 中 发 现,111In-DOTA-MSHoct和111In-DOTANDP-MSH都表显出了高的肿瘤摄取率,111In-DOTA-MSHoct与 MC1R有更高的亲和力(IC50=9.21 n mol/L),而111In-DOTA-NDP-MSH 只有0.25 n mol/L,小鼠尾静脉注射4 h后,111In-DOTA-MSHoct的肿瘤/非靶向组织比高达53.9,具有更优良的显像效果。在此基础上,作者将111In-DOTA-MSHoct分子中的 MSHoct用NAPamide取代后分别用111In和67Ga标记。得到111In-DOTA-NAPamide and67Ga-DOTA-NAPamide两个显像剂。与111In-DOTA-MSHoct相比,111In-DOTA-NAPamide和67Ga-DOTA-NAPamide与受体MC1R的亲和力提高了7倍左右;其中,肿瘤/肾脏放射性摄取比111In-DOTA-NAPamide提高了4.6倍,67Ga-DOTA-NAPamide提高了7.5倍。Miao还报道了67Ga标记的67Ga-DOTA-Gly Glu-Cyc MSH、67Ga-NOTA-GGNle-Cyc MSHhex和67Ga-DOTA-GGNle-Cyc MSHhex用于转移性黑色素瘤的显像[14-15],其中,67Ga-DOTA-GGNle-Cyc MSHhex具有更高肿瘤摄取率和更低的肾脏摄取率。相比111In、67Ga离子,99mTc更容易获得,临床上更常用。Miao[16]用99mTc标记了四个多肽用于MC1 R受体的显像,分别是99mTc-Ac-GGNle-CCEHd FRWCNH2,99mTc-Ac-GGNle-CCEHd FRWCRP-NH2,99mTc-Ac-CCEHd FRWC-Nle GG-NH2和99mTc-Ac-CCE-Hd FRWCRP-Nle GG-NH2。研究发现,-Arg-Pr o-(RP)基团的存在,会增加显像剂与MC1 R受体亲和力,而-NH2-做为缩氨酸的末端要比-Nle GG-NH2作为末端更能降低肾脏和肝脏的摄取率。因此,四个显像剂中99mTc-Ac-GGNle-CCEHd FRWCRP-NH2显 像效果最好。
1.2 αvβ3的单光子放射性核素显像剂
αvβ3类单光子显像剂多采用99mTc、111In等金属离子与分子中链接有RGD类多肽形成的螯合物。Decristof oro[17]报道了显像剂111In-DOTA-RGD用于αvβ3受体的显像,在小鼠黑色素瘤的诊断中,肿瘤摄取率仅有(1.9±0.3)%ID/g。Mittal[18]报道了 RGD的二聚体显像剂99mTc N-[G3-c(RGDf K)]2的合成与标记,与99Tcm标记的RGD单体相比,二聚体显像剂99TcmN-[G3-c(RGDf K)]2提高了与αvβ3受体的亲和力和肿瘤摄取率。在C57/BL6小鼠黑色素显像研究中,注射30 min后,肿瘤摄取率(4.61±0.04%)ID/g。Bianchini[19]还报道了两个模拟RGD的非肽类αvβ3受体显像剂:125I-3和125I-4(图 1)。在小鼠黑色瘤显像中,125I-4的肿瘤摄取率要高于125I-3。
1.3 MC1R和αvβ3的双靶点单光子显像剂

图1 具有三唑结构的非肽类αvβ3受体显像剂Fig.1 Triazole-based non-peptide molecular i maging pr obes
黑皮质素受体(MC1R)和整合素受体(αvβ3)双靶点单光子显像剂是由αvβ3的配体RGD与MC1R的配体α-MSH结合形成的多氨酸交联复合物,同时对MC1 R与αvβ3都具有识别作用。Miao报道了多个双靶点黑色素瘤显像剂[20-21]。其中99mTc标记的显像剂99mTc-RGD-Lys-(Arg11)CCMSH 即为 MC1R与αvβ3的双靶点显像剂。静脉注射分子探针后,99mTc-RGD-Lys-(Arg11)CCMSH 快速浓聚于肿瘤组织,0.5 h肿瘤中的摄取率为2.67%ID/g,肿瘤/肌肉比为3.7。2 h肿瘤摄取率有2.69%ID/g,肿瘤/肌肉高达19.21,对人类黑色瘤表现出了较好的显像效果。在此基础上,将99mTc-RGD-Lys-(Ar g11)CCMSH 中的甘氨酸(Gly)用丝氨酸(Ser)取代,得到一个新的分子探针99mTc-RSD-Lys-(Arg11)CCMSH(图2),该分子探针增加了对黑皮质受体(MC1R)的亲和力,在小鼠B16/F1黑色素瘤上具有良好的摄取率和肝肾清除率,肿瘤摄取率高达18.01±4.22%ID/g。在其最新的一项研究 中,将99mTc-RGD-Lys-(Arg11)CCMSH 分子中的赖氨酸(Lys)用β-丙氨酸(β-Ala)取代,合成了99mTc-RSD-β-Ala-(Arg11)CCMSH,99mTc-RTD-β-Ala-(Arg11)CCMSH,99mTc-RVD-β-Ala-(Arg11)CCMSH,99mTc-RAD-β-Ala-(Arg11)CCMSH,99mTc-NAD-β-Ala-(Arg11)CCMSH,以及99mTc -EAD-β-Ala-(Arg11)CCMSH等六个显像剂[22]。其中99mTc标记的99mTc-RAD-β-Ala-(Ar g11)CCMSH 效果最好,肿瘤摄取率(15.66±6.19)%ID/g和肾脏摄取率(20.18±3.86)%ID/g。该结果表明:β-丙氨酸(β-Ala)的引入,降低了肾脏摄取率。

图2 分子探针99 m Tc-RSD-Lys-(Arg11)CCMSHFig.2 The chemical str ucture of molecular i maging probe 99 mTc-RSD-Lys-(Arg11)CCMSH
1.4 IBP类似物单光子显像剂
黑色素瘤细胞中最大的特点是沉积了大量黑色素,碘苯甲酰类化合物由于与黑色素瘤细胞中内源性化合物IBP结构类似,因此表现出良好的选择性摄取,而细胞的摄取量与其黑色素的量成正比,这使得细胞中的黑色素成为很好的显像与治疗的靶点[23]。目前已报道了多个碘苯甲酰类化合物对黑色素瘤细胞具有特异性靶向作用[24]。因此,标记合成黑色素所需的一些中间体相似化合物可以用于黑色素瘤的显像,Andrew[25]用123I标记了多个苯甲酰胺类分子探针,最后筛选出123IBZA(图3)用于黑色素瘤单光子显像。肿瘤组织1 h的摄取率为8%ID/g。

图3 123I-BZA和IBP核素显像剂Fig.3 Chemical str uctures of 123IBZA and IBP
2014年Emmanuel[26]等合成了一个新的喹啉衍生物,并用125I进行放射性标记,得到分子探针125ICF01012(图4)。给小鼠尾静脉注射125I-CF01012后,1 h肿瘤组织放射性摄取率(2.43~5.68)%ID/g,在黑色素瘤显像中特异性良好,3 h肿瘤/肌肉摄取率比高达20.74。

图4 基于喹啉结构的新型黑色素瘤分子探针Fig.4 The quinoxaline derivatives as melanoma-targeting probes

表1 单光子类黑色素瘤显像剂Table 1 The melanoma i maging with single photon radionuclide agents
2 正电子类分子探针
2.1 MC1R正电子放射性核素显像剂
MC1R正电子类放射性核素显像剂主要是用螯合64Cu、86Y、68Ga等金属正电子核素的DOTA与多肽或缩氨酸的缩合物,其原理与常用的99mTc螯合物相似。Lewis[40]报道了用64Cu和86Y标记的α-MSH 相似物64Cu-DOTA-ReCCMSH(Arg11)和86Y-DOTA-ReCCMSH(Ar g11)用于黑色素瘤的显像。生物分布和小动物PET显像研究表明:小鼠尾静脉分别注射显像剂后,显像剂迅速浓聚于肿瘤灶,30 min达到高峰,肿瘤摄取率分别高达(9.68±1.51)%ID/g和(11.87±3.31)%ID/g,明显高于18F-FDG(5.08±0.02)%ID/g,对黑色素瘤表现出了较好的特异选择性与良好的显像效果。研究发现,将64Cu-DOTA-ReCCMSH(Arg11)和20μg未标记的DOTA-Re CCMSH(Ar g11)同时注入小鼠体内,肿瘤摄取率明显减少,这表明该显像剂对黑色素瘤的特异选择性主要是基于MC1R原理。在Lewis工作的基础上,Miao[41]将64Cu-DOTA-Re CCMSH(Ar g11)分子中的DOTA内酰胺环用NOTA进行取代,所获得的标记物分子对肿瘤组织显示出了更高的摄取率(12.39±1.61%ID/g),而非靶向器官摄取率低于1.02%ID/g。
2.2 αvβ3正电子放射性核素显像剂
Wei[42]报道了两个用64Cu络合的αvβ3类黑色素瘤显像剂:64Cu-CB-TE2 A-c(RGDy K)和64Cu-diamsar-c(RGDf D)。显像结果发现,两个显像剂与αvβ3受体都表现出了相似的亲和力,但64Cu-CB-TE2 A-c(RGDy K)在肝脏和血浆中的清除速率更快,更适合于αvβ3显像。最近,Knetsch[43]合成了两 个68Ga-RGD 的显像剂,68Ga-FSC-(RGD)3和68Ga-NODAGA-RGD,其中68Ga-FSC-(RGD)3为RGD的三聚体,注射1 h后,肿瘤摄取率4.3%ID/g,为单体RGD显像剂68Ga-NODAGA-RGD的三倍。
2.3 mGlu1的正电子放射性核素显像剂
作用于代谢型谷氨酸受体(metabotr opic glutamate receptors,mGl u1R)受体的过度表达会导致黑色素细胞的癌变,因此,mGl u1受体成为黑色素瘤显像的一个重要靶点。Masayuki报道了两个11C标记的mGl u1受体显像剂:[11C]4和[11C]6(图5)。体外研究发现,[11C]4和[11C]6与mGl u 1受 体 的 结 合 力 在(Ki,22-143 n M)范围。而在小鼠黑色素瘤显像中,显像剂[11C]6具有更高的肿瘤摄取率以及更低的血液、皮肤、肌肉摄取率[44]。

图5 11 C标记的mGlu1受体显像剂Fig.5 11 C-labeled PET probes
2.4 18F-IBP类似物正电子放射性核素显像剂
18F类显像剂是目前应用广泛的正电子核素,其半衰期比较适中(110 min),与单光子显像剂相比空间分辨率更高。18F-FDG是目前常用的非特异性正电子显像剂,临床上也用作黑色素瘤不同临床阶段变化的分子显像,但由于其特异选择性低,损伤、炎症常常对其显像效果造成干扰,临床应用受到一定的限制。

图6 18 F标记IBP类似物作为正电子类放射性核素显像剂Fig.6 18 F-labeled IBP derivative as PET probe
Gar g[45]在123I单光子标记的苯甲酰胺的基础上,用18F取代123I,获得了一个新的PET黑色素显像剂18F-DAFBA(图6)。18F与123I属同族元素,化学性质相似,且不影响苯甲酰胺的化学结构,因此,对黑色素瘤同样表现出了特异选择性和清除率。注射后1 h肿瘤放射性摄取率为 (7.00±2.76)%ID/g。Greguric[46]等对18F-DAFBA进行了进一步结构改造,将分子中的苯环用吡啶环替代,合成了四个新的黑色素瘤分子探针18F2、18F4、18F6、18F8(图 6)。与18F-DAFBA相比,其制备只需一步反应就可完成,具有反应条件温和、产率高的优点,且在小鼠黑色素瘤显像中同样表现出了高的肿瘤摄取率。在此基础上,Liu[47]小组通过改变18F与甲酰胺在吡啶环上的位置,合成了两个新的正电子药物18F-1和18F-2(图6),并对小鼠B16F10的PET显像做了比较,结果发现,肿瘤灶对18F-2表现出了更好的特异性摄取,2 h的摄取率高达(36.79±5.21)%ID/g。作者将吡啶酰胺的芳环部分去掉,首次合成了脂肪酰胺类分子探针18F-FPDA用于黑色素瘤显像[48]。通过和无色素的人恶性胶质母细胞瘤细胞(U87 MG)进行对比,注射18F-FPDA显像剂后,黑色素瘤2 h的摄取率为(2.65±0.48)%ID/g,而无色素的 U87 MG 肿瘤模型2 h的摄取率仅为(0.37±0.07)%ID/g。该结果表明,芳香环并非黑色素瘤细胞摄取的必要官能团,18F标记的脂肪酰胺类示踪剂对黑色素瘤同样具有特异选择性。
最近,Wu小组[49]报道了在IBP类似物分子上连接亲脂性长链的显像剂18F-FPBZA(图7)。该类显像剂在苯甲酰胺对位上引入烃基链,增加了显像分子的脂溶性,使其更易透过细胞膜进入肿瘤细胞。结果显示,由于烃基链的引入,显像剂在肿瘤2 h的摄取率高达(7.81±0.82)%ID/g。
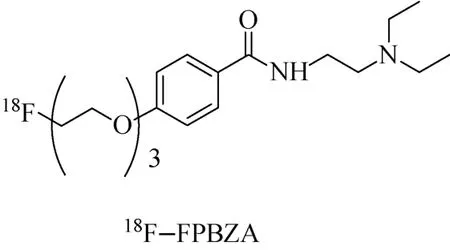
图7 烃基修饰的18 F-IBP类似物分子探针Fig.7 Alkyl modified 18 F-IBP derivative as PET probe

表2 正电子类黑色素瘤显像剂Table 2 The melanoma i maging with positron radionuclide agents
3 小结
99Tcm和64Cu等金属络合的单光子以及正电子多肽类显像剂在黑色素瘤的显像中都表现出了高的肿瘤放射性摄取率以及较好的显像效果,但多肽类分子化学结构复杂、合成难度大、成本高,一定程度上限制了其临床开发应用;而苯甲酰胺和烟酰胺酰类有机小分子化合物,化学结构简单、合成相对容易、易进行结构修饰、对黑色素瘤同样具有较好的靶向性,且用放射性核素标记后,不影响标记配体的化学性质以及在体内外与黑色素瘤细胞的亲和力,使得这类小分子在黑色素瘤靶向显像中显示出较好的临床开发应用价值,且为进一步的黑色素瘤靶向核素治疗研究奠定了基础,在黑色素瘤的早期诊断与靶向核素治疗方面有广阔的开发应用前景。
[1] Rigel D S,Russak J,Fried man R.The evolution of melano ma diagnosis:25 years beyond the ABCDs[J].CA-A Cancer Journal for Clinicians,2010,60(5):301-316.
[2] Jemal A,Siegel R,Xu J,et al.Cancer statistics[J].2010.CA-A Cancer Jour nal f or Clinicians,2010,60(5):277-300.
[3] Gar be C,Eigentler T K.Diagnosis and treatment of cutaneous melano ma:state of the art 2006[J].Melanoma Research,2007,17(2):117-127.
[4] Jennings L,Murphy G M.Predicting outcome in melano ma:where are we now?[J].British Journal of Der matology,2009,161(3):496-503.
[5] Balch C M,Soong S J,Gershen wald J E,et al.Prognostic factors analysis of 17 600 melanoma patients:validation oft he American Joint Co mmittee on Cancer melanoma staging system[J].Jour nal of Clinical Oncology,2001,19(16):3 622-3 634.
[6] Miller A J,Mih m MC J r.Melano ma[J].New England Jour nal of Medicine,2006,355(1):51-65.
[7] Massoud TF,Gambhir SS.Molecular i maging in living subjects:Seeing f undamental biological pr ocesses in a new light[J].Genes & Development,2003,17(5):545-580.
[8] Cheng Z,Chen J Q,Miao Y B,et al.Modification of the structure of a metallopeptide:Synthesis and biological evaluation of111In-labeled DOTA-conjugated r heniu m-cyclizedα-MSH analogues[J].Journal of Medicinal Chemistry,2002,45(14):3 048-3 056.
[9] Miao Y B,Gallazzi F,Guo H X,et al.111In-labeled lactam bridge-cyclizedα-melanocyte sti mulating hor mone peptide analogues f or melanoma i maging[J].Bioconjugate Chemistr y,2008,19(2):539-547.
[10]Guo H X,Yang J Q,Gallazzi F,et al.Effect of DOTA position on melano ma tar geting and pharmacokinetic properties of111In-labeled lactam bridge-cyclizedα-melanocyte sti mulating hor mone peptide[J].Bioconjugate Chemistr y,2009,20(11):2 162-2 168.
[11]Guo H,Yang J,Gallazzi F,et al.Effects of the a mino acid linkers on melano ma-targeting and phar macokinetic properties of Indiu m-111-labeled lactam bridge-cyclizedα-MSH peptides[J].Journal of Nuclear Medicine,2011,52(4):608-616.
[12]Froidevaux S,Calame-Christe M,Tanner H,et al.A novel DOTA-alpha-melanocyte-stimulating hormone analog for metastatic melanoma diagnosis[J].Journal of Nuclear Medicine,2002,43(3):1 699-1 706.
[13]Froidevaux S,Calame-Christe M,Schuh macher J,et al.A galliu m-labeled DOTA-α-melanocytesti mulating hor mone analog for PET i maging of melanoma metastases[J].Journal of Nuclear Medicine,2004,45(1):116-123.
[14]Guo H X,Yang J Q,Shenoy N,et al.Gallium-67-labeled lactam bridge-cyclized α-melanocyte sti mulating hor mone peptide for pri mary and metastatic melano ma i maging[J].Bioconjugate Chemistry,2009,20(12):2 356-2 363.
[15]Guo H X,Gallazzi F,Miao Y B.Galliu m-67-labeled lactam bridge-cyclized alpha-MSH peptides with enhanced melano ma uptake and reduced renal uptake[J].Bioconjugate Chemistr y,2012,23(6):1 341-1 348.
[16]Yang J Q,Liu L Q,Miao Y B.Effects of the Arg-Pro and Gly-Gly-Nle moieties on melanocortin-1 receptor binding affinities ofα-MSH peptides[J].ACS Medicinal Chemistr y Letters,2013,4(10):1 000-1 004.
[17]Decristoforo C,Hernandez Gonzalez I,Carlsen J,et al.68Ga-and111In-labelled DOTA-RGD peptides for imaging of alphavbeta 3 integrin expression[J].European jour nal of nuclear medicine and molecular i maging,2008,35(8):1 507-1 515.
[18]Mittal S,Bhad wal M,Chakraborty S,et al.A novel concept of radiosynthesis of a(99 m)Tc-labeled di meric RGD peptide as a potential radiotracer for tu mor i maging[J].Bioorganic & Medicinal Chemistry Letters,2013,23(6):1 808-1 812.
[19]Bianchini F,Fabbrizzi P,Menchi G,et al.Radiosynthesis and micro-SPECT analysis of triazolebased RGD integrin ligands as non-peptide molec-ular i maging probes f or angiogenesis[J].Bioorganic & Medicinal Chemistry,2015,23(5):1 112-1 122.
[20]Yang J Q,Guo H X,Miao Y B.Technetiu m-99 m-labeled Ar g-Gly-Asp-conjugated alpha-melanocyte sti mulating hor mone hybrid peptides f or hu man melano ma i maging[J].Nuclear Medicine and Biology,2010,37(8):873-883.
[21]Flook A M,Yang J Q,Miao Y B.Effects of amino acids on melano ma tar geting and clearance pr operties of Tc-99 m-labeled Arg-X-Asp-conjugatedαmelanocyte sti mulating hor mone peptides[J].Journal of Medicinal Chemistry,2013,56(21):8 793-8 802.
[22]Flook A M,Yang J Q,Miao Y B.Substitution of the Lys linker with theβ-Ala linker dramatically decreased the renal uptake of99mTc-labeled Ar g-X-Asp-conjugated and X-Ala-Asp-conjugatedα-melanocyte stimulating hor mone peptides[J].Jour nal of Medicinal Chemistr y,2014,57(21),9 010-9 018.
[23]Ditt mann H,Coenen H H,Zolzer F,et al.In vitro studies on t he cellular uptake of melano ma i maging aminoalkyl-iodobenzamide derivatives(ABA)[J].Nuclear Medicine and Biology,1999,26(1):51-56.
[24]Michelot J M,Moreau M F,Labarre P G,et al.Synt hesis and evaluation of new iodine-125 radiophar maceuticals as potential tracers for malignant melanoma[J].Journal of Nuclear Medicine,1991,32(8):1 573-1 580.
[25]Pham T Q,Greguric I,Liu X,et al.Synthesis and evaluation of novel radio iodinated benzamides for malignant melano ma[J].Jour nal of Medicinal Chemistry,2007,50(15):3 561-3 572.
[26]Aissi R E,Liu J R,Besse S,et al.Synthesis and biological evaluation of new quinoxaline derivatives of ICF01012 as melanoma-targeting probes[J].ACS Medicinal Chemistry Letters,2014,5(5):468-473.
[27]Chen J,Cheng Z,Hoff man T J,et al.Melanoma-targeting properties of 99 m Technetiu m-labeled cyclic alpha-melano-cyte-sti mulating hormone peptide analogues[J].Cancer Research,2000,60(20):5 649-5 658.
[28]Guo H,Shenoy N,Gersh man B M,et al.Meta-static melano ma i maging with an111In-labeled lactam bridge-cyclized alpha-melanocyte stimulating hor mone peptide[J].Nuclear Medicine and Biology,2009,36(3):267-276.
[29]Miao Y B,Figueroa S D,Fisher D R,et al.203Pb-labeled alpha-melanocyte-sti mulating hormone peptide as an i maging probe for melano ma detection[J]. Jour nal of Nuclear Medicine,2008,49(5):823-829.
[30]Guo H,Gallazzi F,Miao Y.Galliu m-67-labeled lactam bridge-cyclized alpha-MSH peptides with enhanced melano ma uptake and reduced renal uptake[J].Bioconjugate chemistry,2012,23(6):1 341-1 348.
[31]Guo H,Yang J,Gallazzi F,et al.Reduction of the ring size of radiolabeled lactam bridge-cyclized alpha-MSH peptide resulting in enhanced melanoma uptake[J].Journal of Nuclear Medicine,2010,51(3):418-426.
[32]Baishya R,Nayak D K,Kar makar S,et al.Synthesis and evaluation of technetiu m-99 m-labeled bioreductive phar macophores conjugated with a mino acids and peptides f or tu mor i maging[J].Chemical Biology &Dr ug Design,2015,85(4):504-517.
[33]Haubner R,Br uchertseifer F,Bock M,et al.Synthesis and biological evaluation of a(99 m)Tclabelled cyclic RGD peptide for i maging the alphavbeta3 expression[J]. Nuklear medizin,2004,43(1):26-32.
[34]Li C,Wang W,Wu Q,et al.Dual optical and nuclear i maging in human melanoma xenografts using a single targeted imaging probe[J].Nuclear Medicine and Biology,2006,33(3):349-358.
[35]Decristoforo C,Faintuch-Linkowski B,Rey A,et al.[99mTc]HYNIC-RGD f or i maging integrin alphavbeta3 expression[J].Nuclear Medicine and Biology,2006,33(8):945-952.
[36]Xu J,Yang J,Miao Y B.Dual receptor-targetingmTc-labeled Ar g-Gly-Asp-conjugated alpha-melanocyte sti mulating hor mone hybrid peptides for hu man melano ma i maging[J].Nuclear Medicine and Biology,2015,42(4):369-874.
[37]Yang J,Hu C A,Miao Y.Tc-99 m-labeled RGD-conjugated alpha-melanocyte stimulating hor mone hybrid peptides with reduced renal uptake[J].Amino Acids,2015,47(4):813-823.
[38]Liu X,Pham T Q,Ber ghofer P,et al.Synthesis and evaluation of novel radio iodinated nicotinamides f or malignant melanoma[J].Nuclear Medicine and Biology,2008,35(7):769-781.
[39]Pham T Q,Berghofer P,Liu X,et al.Preparation and biologic evaluation of a novel radio iodinated benzylpiperazine,123I-MEL037,for malignant melano ma[J].Jour nal of Nuclear Medicine,2007,48(8):1 348-1 356.
[40]Mc Quade P,Miao Y B,Yoo J S,et al.Imaging of melano ma using 64Cu-and 86 Y-DOTA-ReCCMSH(Arg11),a cyclized peptide analogue of r-MSH[J].Jour nal of Medicinal Chemistr y,2005,48(8):2 985-2 992.
[41]Guo H X, Miao Y B.Cu-64-labeled lactam bridge-cyclizedαMSH peptides f or PET i maging of melanoma[J]. Molecular Phar maceutics,2012,9(8):2 322-2 330.
[42]Wei L,Ye Y,Wadas T J,et al.64Cu-labeled CB-TE2 A and diamsar-conjugated RGD peptide analogs for targeting angiogenesis:comparison of the ir biological activity[J].Nuclear Medicine and Biology,2009,36(3):277-285.
[43]Knetsch P A,Zhai C,Rangger C,et al.[(68)Ga]FSC-(RGD)3a tri meric RGD peptide f or i maging αvβ3 integrin expression based on a novel siderophore derived chelating scaffold-synthesis and evaluation[J].Nuclear Medicine and Biology,2015,42(2):115-122.
[44]Fujinaga M,Xie L,Yamasaki T,et al.Synthesis and evaluation 4-halogeno-N-[4-[6-(isopropylamino)pyri midin-4-yl]-1,3-thiazol-2-yl]-N-[11C]methylbenzamide f or i maging of metabotr opic glutamate 1 receptor in melano ma[J].Journal of Medicinal Chemistry,2015,58(3):1 513-1 523.
[45]Garg S,Kothari K,Thopate S R,et al.Design,synthesis,and preliminary in vitro and in vivo evaluation of N-(2-diethylaminoethyl)-4-[18F]fluorobenzamide([18F]-DAFBA):A novel potential PET probe to image melanoma tumors[J].Bioconjugate Chemistry,2009,20(3):583-590.
[46]Greguric I,Taylor S R,Denoyer D,et al.Discovery of[18F]N-(2-(diethylamino)ethyl)-6-fluoronicotinamide:A melanoma positron emission tomography i maging radiotracer with high tu mor to body contrast ratio and rapid renal clearance[J].Jour nal of Medicinal Chemistry,2009,52(17):5 299-5 302.
[47]Liu H,Liu S,Miao Z,et al.Develop ment of18F-labeled picolinamide probes f or PET i maging of malignant melanoma[J].Journal of Medicinal Chemistr y,2013,56(3):895-901.
[48]Liu H,Liu S,Miao Z,et al.A novel aliphatic F-labeled probe f or PET i maging of melano ma[J].Molecular phar maceutics,2013,10(9):3 384-3 391.
[49]Wu S Y,Huang S P,Lo Y C,et al.Synthesis and preclinical characterization of[18F]FPBZA:A novel PET pr obe f or melano ma[J].Bio med Research International,2014,2014:912498.
[50]Maisonial A,Kuhnast B,Papon J,et al.Single photon emission computed tomography/positron emission tomography imaging and targeted radionuclide therapy of melanoma:new multimodal fluorinated and iodinated radiotracers[J].Journal of Medicinal Chemistry,2011,54(8):2 745-2 766.
[51]Denoyer D,Greguric I,Roselt P,et al.Highcontrast PET of melano ma using18F-MEL050,a selective probe for melanin with predo minantly renal clearance[J].Jour nal of Nuclear Medicine,2010,51(3):441-447.
[52]Wei L,Butcher C,Miao Y,et al.Synthesis and biologic evaluation of64Cu-labeledr heniu m-cyclized alpha-MSH peptide analog using a crossbridged cyclam chelator[J].Jour nal of Nuclear Medicine,2007,48(1):64-72.
[53]Cheng Z,Xiong Z,Subbarayan M,et al.64Culabeled alpha-melanocyte-sti mulating hor mone analog for Micro-PET i maging of melanocortin1 receptor expression[J].Bioconjugate Chemistry,2007,18(3):765-772.
[54]Prasanphanich A F,Nanda P K,Rold T L,et al.[64Cu-NOTA-8-Aoc-BBN(7-14)NH2]targeting vector for positron-emission tomography i maging of gastrin-releasing peptide receptor-expressing tissues[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(30):12 462-1 2467.
[55]Beaino W,Nedr ow J R,Anderson C J.Evaluation of (68)Ga-and (177)Lu-DOTA-PEG4-LLP2 A for VLA-4-targeted PET i maging and treat ment of metastatic melanoma[J].Molecular Phar maceutics,2015,12(6):1 929-1 938.
