大肠杆菌表达几丁质酶对不同底物的酶学性质及其降解产物分析*
2015-05-05吕梦圆石佳仙夏祥林建国蔡俊胡瑛
吕梦圆,石佳仙,夏祥,林建国,蔡俊,胡瑛
(湖北工业大学轻工学部生物工程学院,发酵工程教育部重点实验室/工业发酵湖北省协同创新中心,湖北武汉,430068)
几丁质(chitin)是自然界仅次于纤维素的第二大生物质资源[1],每年生物合成量约为100多亿吨[2],其中虾、蟹等甲壳类的甲壳富含1/4~1/3的几丁质。壳聚糖是几丁质的N-脱乙酰基的衍生物,也是自然界唯一大量存在的天然碱性多糖[3]。几丁质和壳聚糖是由β(1→4)连接的2-乙酰氨基-2-脱氧-D-吡喃葡萄糖(GlcNAc)和2-氨基-2-脱氧-D-吡喃葡萄糖(GlcN)二元线性共聚物所组成的,脱乙酰化和乙酰化之间的平衡程度用脱乙酰度(DD)来表征。几丁质由于分子内和分子间强烈的氢键作用而不溶于大多数溶剂,从而大大限制其应用。而甲壳寡糖溶解性增加,且具有提高免疫力,抑制癌肿细胞生长,促进肝脾抗体形成,促进钙及矿物质的吸收,增加双歧杆菌、乳酸菌等人体有益菌群,降血脂,降血压,降血糖,调节胆固醇,减肥,预防成人疾病等功能,可用于医药、功能性食品等领域[4]。所以,酶法降解几丁质来制备甲壳寡糖是几丁质研究和开发利用的热点之一。
几丁质酶(Chitinase,Ec.3.2.1.14)是一类能特异性和选择性催化降解几丁质β-1,4-糖苷键的水解酶[5]。且几丁质酶还具有多种潜在用途,如抗真菌,防治病虫害,制备功能性甲壳寡糖,处理几丁质废物,制备真菌原生质体等[6-7]。几丁质酶根据其氨基酸序列主要分为18、19和20三个家族[8-9]。18族水解主要采用双替换构型保持机制,即底物的N-乙酰基团的邻助作用和底物发生变形成船形构型协助催化。根据几丁质酶切割底物的位点不同,又可分为β-N-乙酰氨基葡萄糖、外切酶和内切酶。几丁质外切酶能从几丁质的非还原端以二糖为单位进行切割,产物为甲壳二糖。N-乙酰氨基葡萄糖酶能把二糖酶切为单糖,也就是乙酰氨基葡萄糖。几丁质内切酶可以随意酶切几丁质之间的糖苷键来得到甲壳寡糖[10]。产几丁质酶的微生物种类很多,包括细菌、放线菌和真菌等。Vaaje-Kolstad从Lactococcus lactis ssp.lactis IL1403中得到的几丁质水解体系,含有几丁质酶18族和几丁质结合蛋白33族,可水解α-和β-几丁质,但约85% α-几丁质未被水解[11]。以4-甲基伞形酮人工合成的各种荧光底物由于反应灵敏而常常作为底物检测酶活和研究酶学性质,但天然底物和荧光底物之间存在较大差异。天然几丁质结晶度高而溶解性差,但水溶性壳聚糖可溶于水,DD和几丁质较接近。几丁质酶是一类差异较大的水解酶类,已有不同来源的几丁质酶的分离纯化及性质研究的报道[4-9]。
本文将来源于Lactococus lactis ssp.lactis IL1403菌株的几丁质酶BL21(DE3)基因的重组质粒转化到E.coli BL21 DE3中进行大量表达,纯化后得到几丁质酶,采用SDS-PAGE分析其分子量,采用还原糖法和荧光法来研究几丁质酶对不同底物的酶学性质,研究了pH、温度、不同金属离子和表面活性剂对酶活的影响,采用Lineweaver-Burk双倒数作图法测定米氏方程,并采用薄层层析(TLC)和高效液相色谱(HPLC)对酶解产物进行分析比较,为几丁质酶降解不同底物提供科学依据。
1 材料与方法
1.1 主要试剂及仪器
考马氏亮蓝G-250、N-乙酰氨基葡萄糖和4MU-(GlcNAc)3购于 Sigma公司;系列几丁寡糖(Glc-NAc)2、(GlcNAc)3、(GlcNAc)4、(GlcNAc)5和(Glc-NAc)6,青岛博智汇力生物科技有限公司;几丁质,上海源叶生物有限公司;低分子量标准蛋白,Takara公司产品;其余试剂均为国产分析纯。E.coli BL21(DE3),Invitrogen公司;Ni-NTA 柱(3 cm ×5 cm),上海生工生物工程有限公司;TLC玻璃硅胶板,青岛海洋化工;JY92-11超声波细胞粉碎机,宁波新芝生物科技股份有限公司;蛋白电泳仪,北京六一仪器;LS-45/55荧光分光光度计,美国Perkin Elme公司;LC-20AD,日本SHIMADZU公司。
1.2 不同底物的制备
1.2.1 胶体几丁质的制备
按照参考文献[12]制备。
1.2.2 N-乙酰化壳聚糖的制备
按照文献[13]进行N-乙酰化反应,采用酸碱滴定法测定合成产物的脱乙酰度,水溶性壳聚糖的DD为50%左右;N-乙酰化壳聚糖的DD为70%左右。
1.3 克隆几丁质酶基因的表达纯化
重组质粒pETM11-LlChi18A由加拿大Alberta大学提供,并采用化学法转化到表达载体E.coli BL21(DE3)中[11]。通过优化产酶条件后,接种隔夜培养的E.coli到含有50 μg/mL卡那霉素的150 mL Luria-Bertani培养基,在37℃和250 r/min下培养至OD600达到 0.6 时,添加异丙基硫代-β-D-半乳糖苷(IPTG)最终浓度为0.05 mmol/L,在20℃继续培养12 h,4℃离心10 min(8 000r/min)收集菌体,用PBS缓冲溶液(pH7.5)洗涤菌体。以10倍体积浓缩加入PBS,进行超声波破碎。功率40 W,超声4 s,间歇6 s,超声时间15 min。破碎后的菌液于4℃离心10 min(10 000 r/min),取上清液采用Ni-NTA进行亲和层析纯化。用流动相缓冲液平衡柱子,收集甲壳酶的峰的流出液,用10 kDa超滤膜去除收集液中的咪唑并浓缩酶液,得到纯化后的几丁质酶液。
1.4 蛋白质性质
1.4.1 SDS-PAGE
采用垂直板状电泳,SDS-PAGE按标准方法进行[14]。
1.4.2 考马斯亮蓝法测定蛋白质的含量[15]
以牛血清白蛋白(BSA)作为标准品测定其蛋白质浓度的标准曲线(Y=0.753 7X-0.038 12,R2=0.993;X为蛋白质浓度,Y为吸光度)。根据标准曲线和A595吸光度值换算几丁质酶液的蛋白质含量。
1.5 几丁质酶的酶学性质
1.5.1 酶的底物特异性
分别以胶体几丁质、N-乙酰化壳聚糖、水溶性壳聚糖和4MU-(GlcNAc)3为底物,比较几丁质酶的底物特异性。
1.5.1.1 胶体几丁质、N-乙酰化壳聚糖、水溶性壳聚糖为底物
底物浓度分别为 0.1%,参照 Nawani法[16],取一定量几丁质酶(酶底比为0.3%)于50℃下水浴反应10 min,采用改良 Schales法[17]测定还原糖。1个酶活力单位是指在50℃下,每分钟释放1 μmol还原糖的酶量,而比酶活为1mg几丁质酶所具有的酶活力单位[18]。3次平行的结果取平均值。
1.5.1.2 荧光底物
以荧光物质4-甲基伞形酮(4-MU)为标准物质,采用荧光分光光度计得到标准曲线Y=0.639 8X+2.448 4(R2=0.991;X 为4-MU 浓度,Y 为荧光值)。以不同浓度的4-MU-(GlcNAc)3(Sigma)为底物,反应液还包含2.0 nmol/L几丁质酶,2.0 mg/mL牛血清白蛋白和200 μL 50 mmol/L柠檬酸-磷酸缓冲液。37℃下反应不同时间,取50 μL样液,加入1.95 mL Na2CO3(0.2 mol/L)停止反应,采用荧光分光光度计(激发波长380 nm、发射波长460 nm)测定荧光强度,根据标准曲线计算酶活和比酶活,4次平行的结果取平均值。1个酶活力单位是指在37℃下,1 min释放1 μmol荧光物质的酶量。比酶活为1 mg几丁质酶所具有的酶活力单位。
1.5.2 动力学方程
将酶液与不同底物的胶体几丁质和水溶性壳聚糖反应后测定其酶活力。用Lineweaver-Burk双倒数作图法求出该酶在不同底物下的Km及Vmax值[19]。
1.5.3 几丁质酶对不同底物的酶学性质
分别以胶体几丁质、水溶性壳聚糖为底物,研究几丁质酶的最适反应pH范围、最适反应温度、不同金属离子和不同表面活性剂对酶活力的影响。
1.5.3.1 反应pH对酶活的影响
将酶液分别加入不同pH值的缓冲溶液(柠檬酸-磷酸缓冲液 pH 3.0 ~4.0,HAc-NaAc缓冲液 pH 5.0 ~ 6.0,磷酸缓冲液 pH 7.0 ~ 8.0,Na2CO3-NaHCO3缓冲液 pH 9.0 ~10.0,硼砂-Na2CO3pH 11.0 ~12.0缓冲液)中,40℃下反应相同时间,测定几丁质酶降解胶体几丁质和水溶性壳聚糖的酶活,以酶活力最高者为100%。
1.5.3.2 反应温度对酶活的影响
最适 pH 条件下,在不同温度(30、40、50、60、70、80℃)下反应相同时间,分别测定几丁质酶降解胶体几丁质和水溶性壳聚糖的酶活,以酶活最高者为100%。
1.5.3.3 不同金属离子对酶活的影响
在最适pH和温度条件下,用50 mmol/L HAc-NaAc缓冲液配置浓度为10 mmol/L的不同金属离子(K+、Mg2+、Ca2+、Li+、Ba2+、Ni2+、Zn2+、Na+)缓冲液,采用几丁质酶分别降解胶体几丁质和水溶性壳聚糖,测定酶活,以不含金属离子的反应液为100%。
1.5.3.2 不同表面活性剂对酶活的影响
用50mmol/L HAc-NaAc缓冲液配置不同浓度的表面活性剂(Trition-100、Tween-80和SDS)溶液,采用几丁质酶分别降解胶体几丁质和水溶性壳聚糖测定酶活,以不含表面活性剂的反应液为100%。
1.6 几丁质酶降解产物的分析
1.6.1 TLC 分析
将10 mg/mL的不同底物及几丁寡糖溶解于50 mmol/L HAc-NaAc缓冲液(pH6.5),取 0.2 mL 该溶液加30 μg几丁质酶于40℃下酶解5 min(胶体几丁质酶解1 h),然后用玻璃硅胶板检测酶解产物,展开剂的组成是 V(正丁醇)∶V(甲醇)∶V(氨水)∶V(水)=5∶4∶2∶1。待硅胶板自然风干后喷显色剂(含0.5%二苯胺、0.5%苯胺的95%乙醇溶液,现配现用),于80℃下烘烤30 min,单糖和各寡糖呈现可见斑点[20]。
1.6.2 HPLC 分析
Prominence LC-20AD(岛津,日本),4.6 mm ×250 mm氨基液相色谱柱(依利特,中国),流动相为V(乙腈)∶V(水)=7∶3,紫外检测器(波长 195 nm),流速0.5 mL/min,柱温30 ℃,进样10 μL。
2 结果与分析
2.1 SDS-PAGE
用重组质粒pETM11-LiChi18A转化大肠杆菌BL21(DE3)获得重组菌株,由该菌株所合成的几丁质酶蛋白经超声和Ni-NTA柱亲和层析纯化后在SDS-PAGE上呈现一条谱带,纯度较高,相对分子质量约为54 kDa(见图1)。从图1中还可以看出,重组大肠杆菌表达的几丁质酶经细胞破碎后,存在于上清液中,还有一部分以包涵体的形式存在于沉淀中,但包涵体形式的几丁质酶不具有酶活。通过前期优化产酶条件,在IPTG浓度为0.05 mmol/L,20℃培养12 h,可使上清液中目的基因的量增加,而包涵体中的含量相对减少,但并不能完全消除包涵体的形成。
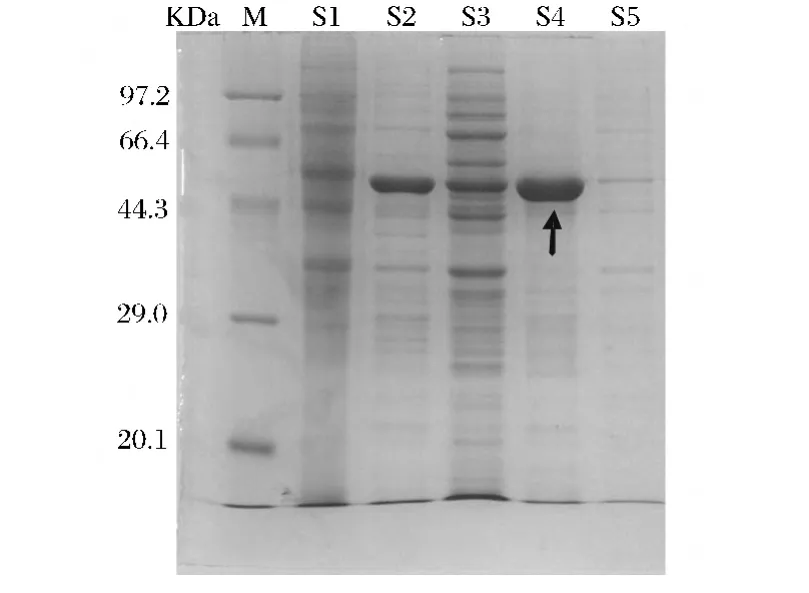
图1 几丁质酶Ni-NTA柱亲和层析前后的SDS-PAGE图Fig.1 SDS-PAGE analysis of chitinase before and after Ni-NTA column
2.2 几丁质酶的酶学特性
2.2.1 酶的底物特异性
采用纯化后的几丁质酶分别降解胶体几丁质、N-乙酰化壳聚糖(DD 30%)、水溶性壳聚糖(DD 50%)和4MU-(GlcNAc)3,结果如表1所示,说明该酶可以降解这些底物,特别是对水溶性壳聚糖(DD 50%),虽然和荧光底物相比,其比酶活低很多,但明显高于胶体几丁质和N-酰化壳聚糖,说明几丁质酶对水溶性壳聚糖降解能力较高。这和Masaru等的研究结果相一致,说明几丁质酶能水解部分N-乙酰化壳聚糖,随着乙酰化度的增加,酶反应速率增加,酶切位点相应增加[21]。而对 4MU-(GlcNAc)3的比酶活为1 060.18 U/mg,比其他反应底物的高很多,这可能是由于荧光底物溶解性好且灵敏度高的原因。

表1 几丁质酶对不同底物的比酶活Table 1 Specific enzyme activity of chitinase indifferent substrates
2.2.2 动力学方程
如图2所示,采用Lineweaver-Burk作图法测定米氏常数,结果表明该酶对胶体几丁质的Km和Vmax值分别为 2.913 mg/mL 和 2.836 μmol/(min·mg)(Y=1.027 2X+0.352 6,R2=0.998 8),对于水溶性壳聚糖的 Km和 Vmax值分别为 4.04 mg/mL和222.2 μmol/(min·mg)(Y=0.018 2X+0.004 5,R2=0.990 4)。胶体几丁质的Km值较小,说明该几丁质酶与胶体几丁质的亲和力较高。但对水溶性壳聚糖,虽然Km值比胶体几丁质大1.4倍,但其Vmax值大78倍,说明其与几丁质酶的亲和力较低一点,但其降解速率大大提高,这与其较高的酰化度而较好的水溶性相关。

图2 甲壳素酶的动力学方程Fig.2 Kinetic equations of chitinase
2.2.3 反应pH值对酶活的影响
通过不同底物测定几丁质酶在不同pH值的缓冲液体系中的酶活力,结果如图3(A),说明不同底物对几丁质酶的最适pH不同。当反应底物为水溶性壳聚糖时,pH 5~8时,相对酶活力在80%以上,在pH 7左右时酶活力最高,且随着pH的酸碱性增强酶活力逐渐下降。几丁质酶在不同的氢离子浓度下的解离程度不同,其高级结构中S-S键、疏水键及氢键受到影响,从而影响几丁质酶构象的变化而表现出不同的活性。微生物几丁质酶一般在pH 3~11范围内有不同程度的酶活,最适pH值大都在6~7[22]。当反应底物为胶体几丁质时,pH 5左右时酶活力最高,在pH 8左右时,相对酶活力在60%以上,这可能是胶体表面电荷的一定程度地增加有利于胶体的分散,但随着pH的酸碱性增强酶活力逐渐下降。
2.2.4 反应温度对酶活的影响
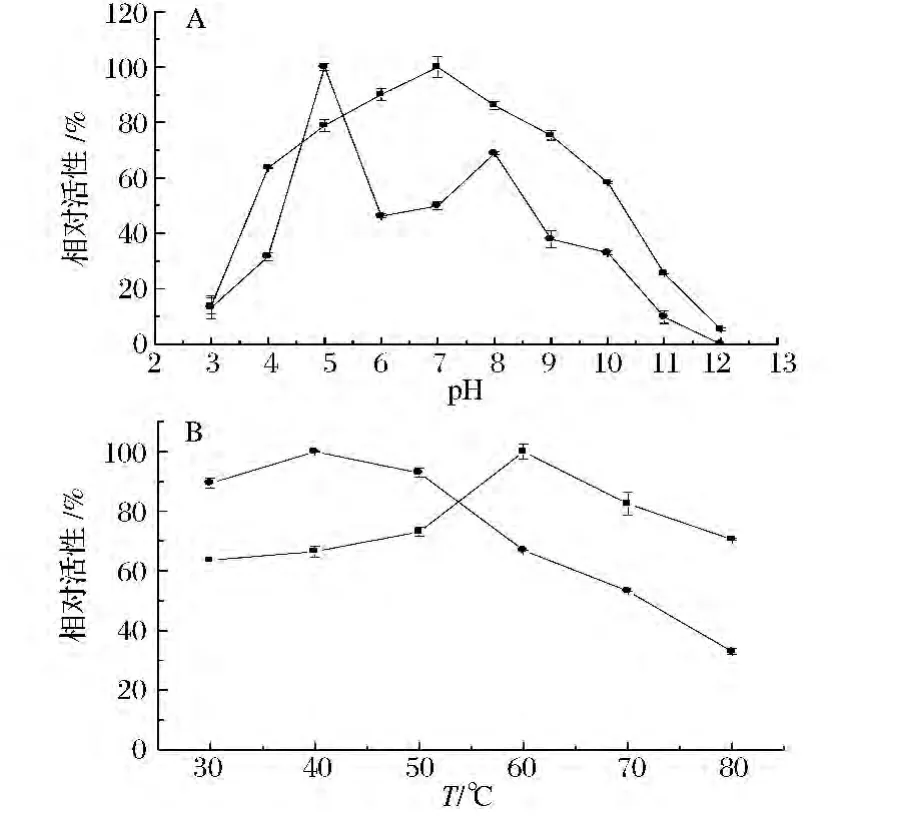
图3 不同pH(A)和不同温度(B)对几丁质酶降解水溶性壳聚糖(■)和胶体几丁质(●)的影响(n=3)Fig.3 Effects of pH(A)and temperature(B)on chitinase with water-soluble chitosan(■)or colloidal chitin(●)(n=3)
通过不同的底物测定几丁质酶在不同温度下酶的活力,结果如图3(B)所示。Vaaje-Kolstad等以4MU-(GlcNAc)3为底物研究该几丁质酶的最适温度为37℃,由于该酶来源于Lactococcus lactis ssp.lactis IL1403,其最适生长温度为30℃。当反应底物为水溶性壳聚糖时,反应温度在30~80℃之间,酶活力均在60%以上,说明该几丁质酶对温度的变化不是很敏感,60℃为酶反应最佳温度,可以认为该酶为耐热性酶[11]。但同时温度的变化对反应底物也会产生一定的影响,因此随着底物的改变,酶的最适温度也会发生改变。当反应底物为胶体几丁质时,在30~50℃酶活力均在80%以上,40℃为酶反应最佳温度,当反应温度在60℃以上时酶活力逐渐下降,这可能是温度的升高不利于胶体的分散。
2.2.5 金属离子对酶活的影响
在反应体系中加入10 mmol/L的不同金属离子,比较几丁质酶对水溶性壳聚糖和胶体几丁质的酶活的影响,如表2所示。一价金属离子K+、Li+、Na+对几丁质酶降解两种底物的活性均有不同程度的抑制作用(Li+>K+>Na+)。而二价金属离子 Ni2+、Mg2+、Ca2+、Zn2+对胶体几丁质的降解有明显的促进作用,但对水溶性壳聚糖的降解没有促进作用,且Ni2+和Zn2+有一定的抑制作用。说明金属离子对几丁质酶降解不同底物的影响存在一定差异。

表2 不同金属离子对不同底物的酶活影响(n=3)Table 2 Effect of different metal ions on chitinase with different substrates(n=3)
2.2.6 表面活性剂对酶活的影响
在以胶体几丁质和水溶性壳聚糖为底物的反应体系中加入不同浓度的表面活性剂,测定几丁质酶活力,如表3所示。结果表明,0.5%Trition-100对几丁质酶的酶活力影响不大,但增加Trition-100浓度到1%时,其对几丁质酶活力有抑制作用。而Tween-80在其浓度为0.5%和1%时,对降解水溶性壳聚糖无明显影响,但对降解胶体几丁质有促进作用,这可能是Tween-80有利于胶体的分散。Tween-80对降解胶体几丁质起一定的促进作用,而不同浓度的SDS有明显的抑制酶活作用,特别是对胶体几丁质。但对两种底物都表现出随着反应体系SDS浓度的增加,抑制作用显著增加,这说明SDS可能破坏该几丁质酶的高级结构。
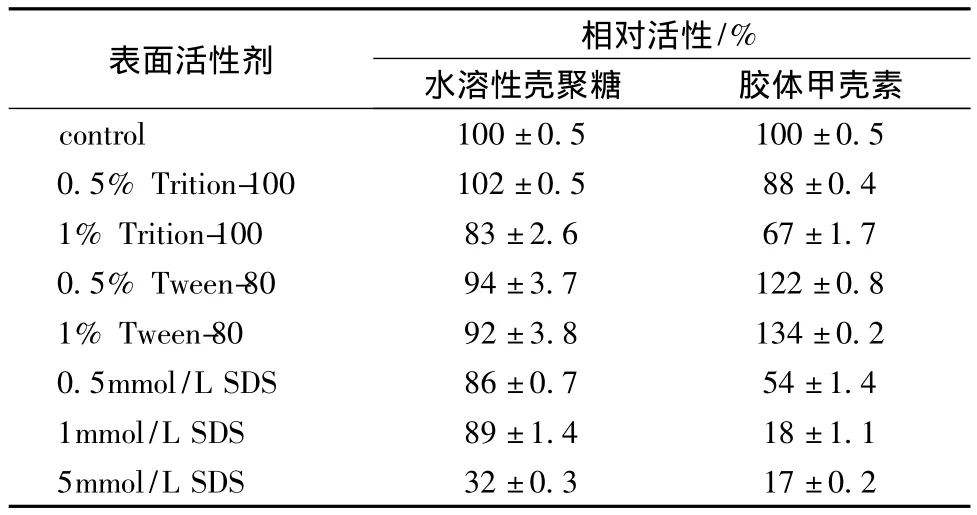
表3 不同浓度表面活性剂对酶活影响(n=3)Table 3 Effect of surfactants on chitinase with different substrates(n=3)
2.3 几丁质酶降解产物的分析
该几丁质酶对各种几丁寡糖和胶体几丁质的酶解产物的TLC分析结果如图4所示。结果表明,几丁质酶能完全降解几丁四糖和几丁六糖(GlcNAc)6,其产物为几丁二糖(GlcNAc)2;但不能完全降解几丁三糖(GlcNAc)3和几丁五糖(GlcNAc)5,其产物存在单糖(GlcNAc)和几丁二糖(GlcNAc)2,而从图中可以知道几丁质酶不能降解几丁二糖(GlcNAc)2,说明该几丁质酶是内切几丁质酶,以内切方式作用于甲壳聚糖主链内部的β-1,4糖苷键。几丁质酶对胶体几丁质的降解产物的TLC图谱可以看出,其降解产物主要为几丁二糖和乙酰氨基葡萄糖。而对水溶性壳聚糖因其脱乙酰度为50%,结构较复杂,降解图谱较为复杂。所以,采用HPLC对几丁质酶降解胶体几丁质和水溶性壳聚糖的产物进行进一步分析,如图5所示。胶体几丁质酶解产物不仅存在几丁二糖,而且存在乙酰氨基葡萄和氨基葡萄糖,因为天然几丁质并不是完全乙酰化的,而是乙酰氨基葡萄糖和小部分氨基葡萄糖的二元共聚物。水溶性壳聚糖的乙酰度更低,所以,其酶解产物主要有单糖和几丁二糖,另外,还存在接近几丁四糖的峰和较小的接近几丁五糖和六糖的峰,应该是不同聚合度和不同结构单元的甲壳寡糖,说明该内切几丁质酶水解时只需要糖苷键一侧至少含有1个GlcNAc基团,即可作用于甲壳素和水溶性壳聚糖主链上(GlcNAc)-(GlcNAc)、(GlcNAc)-(GlcN)或者(GlcN)-(GlcNAc)的 β-1,4 糖苷键。
3 讨论
本文以重组大肠杆菌大量表达并经过亲和层析纯化获得几丁质酶,比较其对不同底物的酶学性质。郝之奎等从Chitinolyticbacter meiyuanensis SYBC-H1纯化后的几丁质酶分子量约为42 kDa;几丁质酶的最适温度为40℃;最适pH为6.5;几丁质酶在45℃下比较稳定,55℃以上稳定性迅速下降;Zn2+、Cu2+、Mn2+、Fe2+、Fe3+(10 mmol/L)对丁质酶有不同程度的抑制作用,Na+、K+对几丁质酶有激活作用;该几丁质酶的Km 和 Vmax分别为22.96 mmol/L和9.066 U/mg[22]。张中等从粉棒束孢(Isaria farinosa)菌株中筛选出高产几丁质酶菌株RCEF0622纯化后的几丁质酶分子量是38.5 kDa;该几丁质酶对胶体几丁质的Km为0.73 mg/mL;酶的最适反应温度是40℃;最适反应 pH 值为 4.6;Mg2+,Mn2+,Al3+,K+,Ca2+,Ba2+等金属离子对酶活力有明显的激活作用,尤其是Mn2+对几丁质酶的激活作用非常明显;而Zn2+,Cu2+等对该酶有明显的抑制作用;Cu2+对该酶活有较大程度的抑制作用[23]。Wang等筛选的菌株Pseudomonas sp.TKU015纯化所得几丁质酶对胶体几丁质降解的最适pH值为5,pH值5~7时相对酶活力均在80%以上;最适温度为50℃,70℃时基本失活;5 mmol/L Mg2+、Zn2+对酶活力有促进作用;0.5 mmol/L SDS可促进该酶活性,但2 mmol/L SDS抑制该酶活性[24]。而结果表明,经SDS-PAGE测得几丁质酶LIChi18A分子量约为54 kDa,该几丁质酶对不同底物的酶学性质存在差异。在参考文献中大多是对胶体几丁质为底物来讨论几丁质酶的酶学性质,而胶体几丁质的降解费事且差异小,本实验对水溶性壳聚糖和胶体几丁质的最适pH和温度以及金属离子和表面活性剂的影响都分别进行了分析,两者作为反应底物酶的最适条件存在较大差异。实验证明该几丁质酶对胶体几丁质的最适温度为40℃;最适pH为 5,Km 和 Vmax分别为 2.913 mg/mL 和 2.836 μmol/(min·mg),稳定性与张中等结果较为一致。对水溶性壳聚糖的最适温度为60℃;最适pH为7,Km和Vmax值分别为 4.04 mg/mL 和 222.2 μmol/(min·mg),降解作用较强,降解速率较快,温度稳定性较好。Ni2+、Mg2+、Ca2+、Zn2+对胶体几丁质的降解有明显的促进作用。但对水溶性壳聚糖的降解没有促进作用,且Ni2+和Zn2+有一定的抑制作用。Tween-80对降解胶体几丁质起一定的促进作用,而不同浓度SDS有抑制酶活作用,且浓度越高抑制作用越强。
此外,本文还对几丁质酶对不同底物的降解产物进行分析,TLC和HPLC图谱结果表明,通过不同底物的比较发现,该酶降解的主要产物为几丁二糖。对胶体几丁质的亲和力较好,该酶降解胶体几丁质的产物主要为几丁二糖和单糖,而对水溶性壳聚糖的降解效果较好,Vmax值比胶体几丁质增大78倍,比酶活约是胶体几丁质的12倍,降解产物较为复杂,主要有单糖、几丁二糖和甲壳寡糖,所以,通过该几丁质酶降解水溶性壳聚糖可制备多种甲壳寡糖。甲壳低聚糖的溶解性和生理功能与其聚合度有密切关系,通过控制酰化度和水解反应过程来获得高质量的不同聚合度的甲壳低聚糖,在医药、食品、化工和环保等诸多领域得到广泛的应用或具有巨大的潜在应用价值。
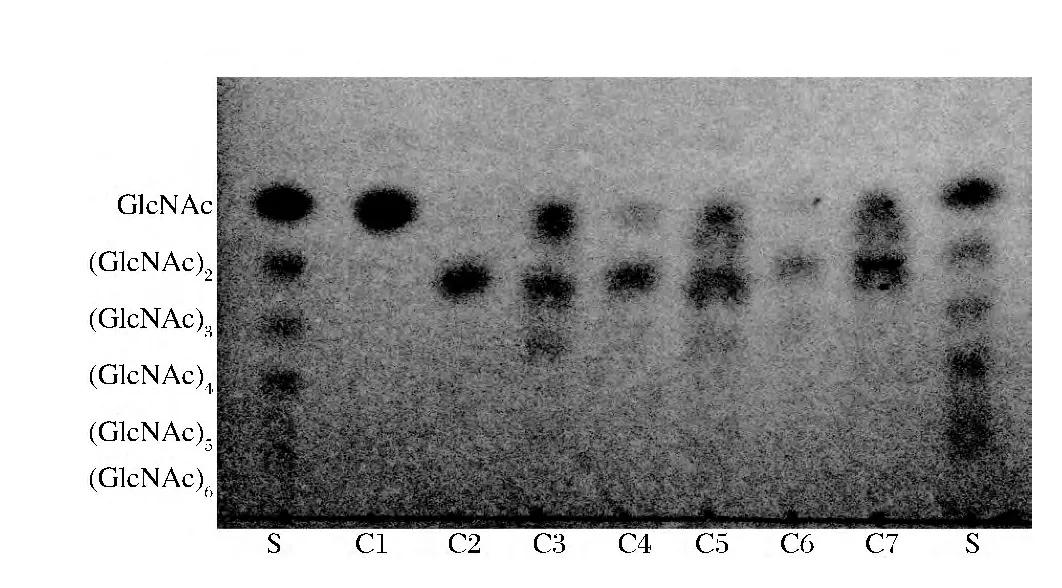
图4 (GlcNAc)n标样(S)、(GlcNAc)n的降解产物(Cn)和胶体几丁质的降解产物(C7)的TLC谱图Fig.4 TLC spectra of(GlcNAc)n standards and different hydrolysates from(GlcNAc)n and colloidal chitin

图5 (GlcNAc)1-6标样(A)和胶体几丁质(B)和水溶性壳聚糖(C)的酶解产物的HPLC谱图Fig.5 HPLC spectra of(GlcNAc)1-6 standards(A)and different hydrolysates from colloidal chitin(B)and water-soluble chitosan(C)
致谢:感谢加拿大Alberta大学Gänzle教授提供含甲壳素酶基因的质粒。
[1] 吴清基,吴鸿昌.几丁质-21世纪的绿色材料[J].东华学报(自然科学版),2004,30(1):133-138.
[2] 庞景贵,郭金龙.几丁质的应用范围及开发前景[J].饲料研究,2008,18(5):9-11.
[3] 张文博,陈盛.几丁质/壳聚糖的提取及其应用研究新进展[J].福建师范大学福清分校学报,2008(1):18-25.
[4] 程仕伟,孙爱友.酶法制备甲壳低聚糖研究的进展[J].生物加工过程,2011,9(5):65-70.
[5] 陈鲁生.完全水溶性壳聚糖制备条件的研究[J].化学通报,1998(8):48-50.
[6] 李春霞,佟永薇,候世洁.微生物几丁质酶的研究进展[J].食品研究与开发,2008,29(8):155-157.
[7] 李君,曾中文,欧阳石文.微生物几丁质酶的特性、基因表达调控及应用[J].微生物学通报,2004,28(4):85-87.
[8] 蒋红彬,蒋千里.几丁质酶的研究概况[J].山东科学,2000,13(4):41-45.
[9] 孙胜利,喻子牛,贾新成.微生物产几丁质酶的研究和应用进展[J].微生物学杂志,2002,2(5):47-50.
[10] 夏其昌.蛋白质化学研究技术与进展[M].北京:科学出版社,1997:102-107.
[11] Vaaje-Kolstad G,Bunaes AC,Mathiesen G,et al.The chitinolytic system of Lactococcus lactis ssp.lactis comprises a nonprocessive chitinase and a chitin-binding protein that promotes the degradation of α-and β-chitin[J].FEBS J,2009,276:2 402-2 415.
[12] Saima MK,Roohi IZA.Isolation of novel chitinolytic bacteria and production optimization of extracellular chitinase[J].J Genet Eng Biotechnol,2013,11(1):39-46.
[13] HU Y,DU YM,WANG X,et al.Self-aggregation of watersoluble chitosan and solubilization of thymol as an antimicrobial agent[J].J Biomed Mater Res A,2009,90(3):874-881.
[14] Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[15] Bradford MM.A Rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binging[J].Anal Biochem,1976,72:248-254.
[16] Nawani NN,Kapadnis BP,Das AD,et al.Purification and characterization of a thermophilic and acidophilic chitinase from Microbispora sp.V2[J].J Appl Micro,2002,93(6):965-975.
[17] Imoto T,Yagishita K.A simple activity measurement of Lysozyme[J],Agric Biol Chem,1971,35:1 154-1 156.
[18] LEE Y,Park I,Ahn S,et al.Cloning,purification,and characterization of chitinase from Bacillus sp.DAU101[J].Biores Technol,2007,98(14):2 734-2 741.
[19] 张龙翔,张庭芳,李令媛.生化实验技术[M].北京:高等教育出版社,1997:111-116;165-171.
[20] Morimoto K,Karita S,Kimura T,et al.Characterization of Clostridium paraputrificum chitinase A from a recombinant E coli[J].J Biosci Bioeng,2001,92(5):466-468.
[21] 万云祥,杜予民,杨建红,肖玲.甲壳酶特性与应用研究[J].天然产物研究与开发,2003,15(6):572-579.
[22] 郝之奎.Chitinolyticbacter meiyuanensis的筛选鉴定及其发酵产几丁质酶研究[D].无锡:江南大学,2011.
[23] 张中.粉棒束孢几丁质酶的分离纯化,酶学性质和基因克隆的研究[D].合肥:安徽农业大学,2006.
[24] WANG S,CHEN S,WANG C.Purification and characterization of chitinases and chitosanases from a new species strain Pseudomonas sp.TKU015 using shrimp shells as a substrate[J].Carbohydr Res,2008,343(7):1 171-1 179.
