赫赛汀诱导子宫内膜癌Ishikawa细胞凋亡并增强其对化疗的敏感性*
2015-04-27王晓玉暨南大学附属第一医院妇产科广东广州5063南方医科大学附属南方医院妇产科广东广州5055
沈 媛,陆 琳,王晓玉(暨南大学附属第一医院妇产科,广东广州5063;南方医科大学附属南方医院妇产科,广东广州5055)
赫赛汀诱导子宫内膜癌Ishikawa细胞凋亡并增强其对化疗的敏感性*
沈媛1▲,陆琳2▲,王晓玉1△
(1暨南大学附属第一医院妇产科,广东广州510632;2南方医科大学附属南方医院妇产科,广东广州510515)
[摘要]目的:研究赫赛汀单独或联合阿霉素(adriamycin,ADR)、顺铂(cisplatin,DDP)及紫杉醇(paclitaxel,PTX)对子宫内膜癌细胞凋亡和化疗敏感性的影响,为临床应用赫赛汀治疗子宫内膜癌提供理论依据。方法: MTT法检测赫赛汀、ADR、DDP及PTX处理子宫内膜癌Ishikawa细胞的IC(50)。进一步应用1/2 IC(50)量的赫赛汀与各1/2 IC(50)量的ADR、DDP及PTX药物联合,流式细胞术检测细胞周期与凋亡变化。结果:赫赛汀抑制子宫内膜癌Ishikawa细胞生长,引起细胞G1期阻滞,诱导细胞凋亡。子宫内膜癌Ishikawa细胞应用赫赛汀、ADR、DDP及PTX 的IC(50)分别为57.12 mg/L、0.572 μmol/L、67.4 μmol/L和719.5 nmol/L,赫赛汀联合化疗后显著提高各组化疗药的杀伤效果,诱导细胞凋亡,与单纯化疗组相比差异有统计学意义(P<0.05)。结论:赫赛汀诱导子宫内膜癌细胞凋亡,并提高子宫内膜癌细胞株对化疗的敏感性。
[关键词]赫赛汀;子宫内膜癌;化疗敏感性;细胞凋亡
▲并列第1作者
近年来子宫内膜癌发病率呈明显上升和年轻化趋势,早期患者预后良好,晚期以及复发性耐药性患者预后差,术后需行进一步的辅助治疗。对晚期和复发性耐药性子宫内膜癌患者,术后辅助化疗可明显提高患者的5年生存率。有关化疗方案的选择,联合用药与单药化疗相比,可明显提高化疗有效率。但目前晚期和复发耐药性子宫内膜癌的化疗缺乏有效的药物。赫赛汀是一种人源化单克隆抗体,目前已成为治疗肿瘤的重要分子靶向药物,其抗肿瘤作用是通过与肿瘤细胞膜上人类表皮生长因子受体2 (human epidermal growth factor receptor 2,HER-2)癌基因高表达产物P185蛋白的结合而实现的[1]。HER-2是一种原癌基因,在调节肿瘤细胞生长、分化及存活起着重要的作用,与肿瘤的发生、转移、预后、治疗等密切相关。已有多篇文献报道HER-2基因在子宫内膜癌组织中的表达,这些研究结果明确显示子宫内膜癌有HER-2基因过表达[2-3]。目前已有不少研究探讨赫赛汀抗瘤谱,但在子宫内膜癌治疗上却鲜有报道。肿瘤的药物研究发展方向是寻找特异性更强、疗效更显著、毒副作用更低的药物,本文旨在探讨赫赛汀对子宫内膜癌细胞周期和凋亡变化,及子宫内膜癌细胞对化疗敏感性的影响,为其在子宫内膜癌临床应用中提供理论依据。
材料和方法
1主要试剂和细胞株
磷酸盐缓冲液(phosphate buffered saline,PBS)和胎牛血清(杭州四季青公司) ; RPMI-1640培养基和双氢二氯荧光黄(Gibco) ; MTT(威佳公司) ; TRIzol (Invitrogen) ; Annexin V试剂盒(上海申能博彩公司)。人高分化子宫内膜癌细胞株Ishikawa由中山医科大学附属第三医院李小毛教授惠赠,常规冻存,为超二倍体细胞,雌激素受体(estrogen receptor,ER)α、ERβ及孕激素受体(progesterone receptor,PR)表达均阳性。Ishikawa细胞用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基,于37℃、5% CO2条件下培养。
2方法
2.1PI染色流式细胞术检测Ishikawa细胞周期取对数生长期Ishikawa细胞以2.0×108/L浓度接种于96孔板,赫赛汀设定20、40、60、80 nmol/L浓度。在培养24 h后离心收集细胞,弃上清,用预冷PBS洗细胞2次,加入预冷70%乙醇,于4℃固定过夜。离心收集细胞,以1 mL的PBS洗细胞1次,加入500 μL PBS含50 μg/L溴化乙锭(PI),100 mg/L RNase A,0.2% Triton X-100,4℃避光孵育30。以标准程序用流式细胞仪检测,结果用细胞周期拟和软件ModFit分析。
2.2MTT法检测赫赛汀联合化疗药物处理Ishikawa细胞的活力取对数生长期Ishikawa细胞以2.0× 108/L浓度接种于96孔板,实验分5组,无药物处理的对照组和赫赛汀、ADR、DDP及PTX 4个实验组,每组化疗药物设定5个浓度,每个浓度设3个复孔。赫赛汀设定20、40、60、80及100 nmol/L浓度,ADR设定0.1 μmol/L、0.25 μmol/L、0.5 μmol/L、0.75 μmol/L及1 μmol/L浓度,DDP设定10 μmol/L、25 μmol/L、50 μmol/L和100 μmol/L浓度,PTX设定10、100、500、750和1 000 nmol/L浓度,在培养24、48、72 h后加入四氮唑蓝,4 h后离心弃上清,加入150 μL的DMSO溶解,492 nm滤光片检测吸光度(A),细胞抑制率(%)=(对照组A-实验组A)/(对照组A-空白组A)×100%,筛选出各药物的IC50值。实验进一步将1/2 IC50赫赛汀和1/2 IC50的ADR、DDP及PTX药物联合应用。于培养24、48、72 h后,按上述方法检测细胞抑制率。
2.3流式细胞术检测赫赛汀联合化疗药物诱导Ishikawa细胞凋亡率和胞内活性氧(reactive oxygen species,ROS)水平应用1/2的IC50量赫赛汀与各1/2的IC50量的ADR、DDP及PTX药联合处理细胞,培养12 h后收集细胞PBS洗涤2次后,标本等分为2份,其一,PE标记Annexin V检测细胞凋亡率;其二,双氢二氯荧光黄染色测定细胞内ROS。
3统计学处理
计量资料的描述用均数±标准差(mean±SD)表示,用SPSS 16.0统计软件进行分析。以析因设计资料方差分析比较各组化疗药物间瘤细胞杀伤的差异,两独立样本均数的比较用t检验,化疗药物与化疗药联合赫赛汀间比较用配对t检验,以P<0.05为差异有统计学意义。
结果
1赫赛汀对子宫内膜癌细胞周期的影响
不同浓度赫赛汀抑制子宫内膜癌细胞Ishikawa增殖,引起细胞G1期阻滞,差异有统计学意义(P<0.01),见表1。
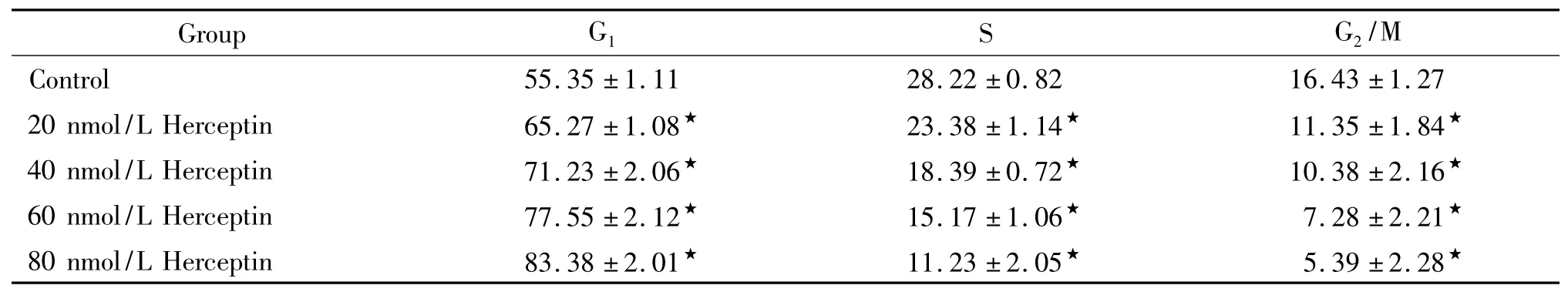
表1 赫赛汀诱导细胞G1期阻滞Table 1.Effect of Herceptin on cell cycle in Ishikawa cells (%.Mean±SD.n=6)
2赫赛汀联合化疗对子宫内膜癌细胞活力的影响
MTT结果显示,赫赛汀、ADR、DDP及PTX作用子宫内膜癌Ishikawa细胞的IC50分别为57.12 mg/L、0.572 μmol/L、67.4 μmol/L和719.5 nmol/L。赫赛汀(28.56 mg/L)联合ADR(0.29 μmol/L)、DDP (34 μmol/L)及PTX (360 nmol/L)应用后,细胞生长抑制率明显高于单药应用,见表2。
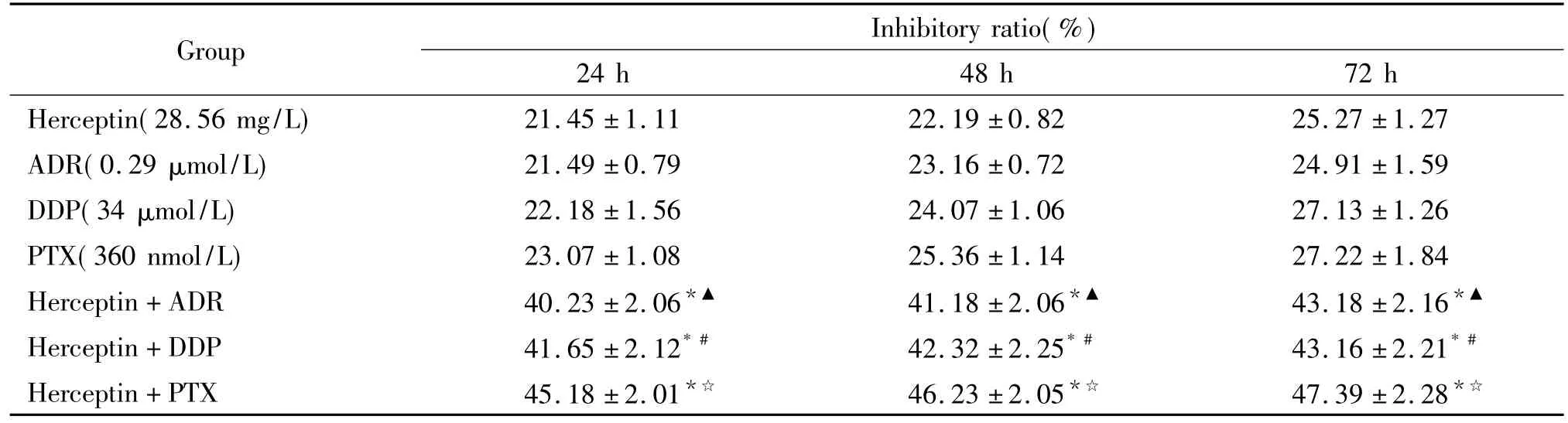
表2 赫赛汀单药及联合化疗对Ishikawa细胞生长的影响Table 2.The effects of Herceptin in combination with chemotherapeutic drug on the growth of Ishikawa cells (Mean±SD.n=6)
3赫赛汀联合化疗用药24 h后流式细胞术检测子宫内膜癌细胞凋亡及细胞内ROS生成
流式检测赫赛汀单用或联合化疗24 h后,联合用药组Ishikawa细胞凋亡及ROS水平明显增加,见表3。
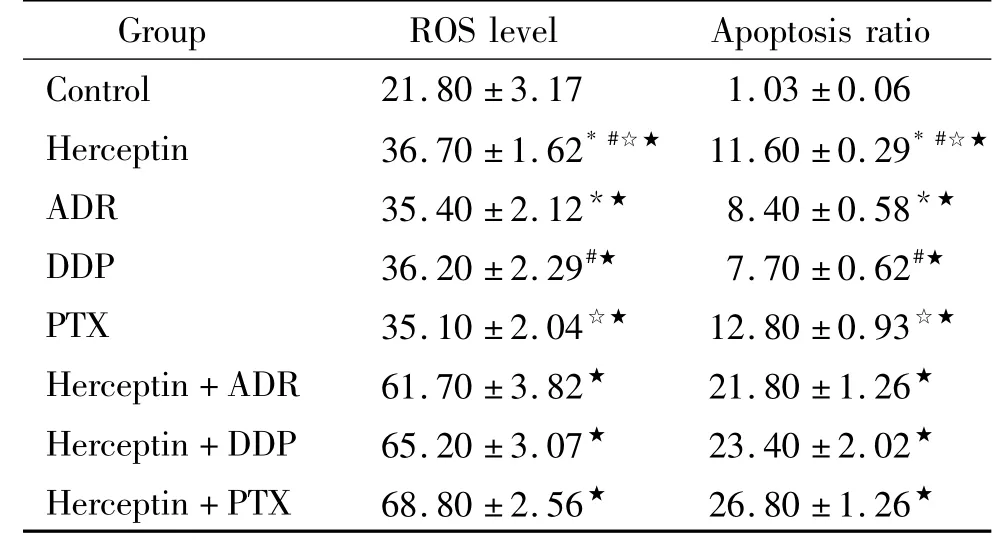
表3 流式细胞仪检测各组凋亡率和胞内ROS水平Table 3.The apoptosis rate and ROS levels in Ishikawa cells(%.Mean±SD.n=6)
讨论
子宫内膜癌是严重威胁我国女性健康的生殖道恶性肿瘤之一。对晚期及复发性患者,中位生存期不足1年,其治疗后复发率为15%~20%[4-5]。子宫内膜癌的化疗始于20世纪60年代,随着新药的不断出现和多中心临床药物研究,化疗在子宫内膜癌的治疗中具有越来越重要的价值,尤其对于晚期和复发性耐药性子宫内膜癌,复发耐药性患者的综合治疗和分子靶向化疗在子宫内膜癌治疗中的研究日益重要。子宫内膜癌的发病机制至今尚未阐明,随着肿瘤生物学研究的深入,人们逐渐了解到恶性肿瘤的形成是一个多步骤、多因素过程,涉及到多个癌基因的活化和抑癌基因功能的紊乱,不仅与细胞增殖和分化异常有关,同时也和细胞凋亡异常密切相关。凋亡异常参与了子宫内膜恶性肿瘤发生、发展、转移及化疗耐药等诸多环节[6-7]。在众多与子宫内膜癌密切相关的基因中,HER-2基因与肿瘤的发生、发展及预后有密切的关系。人HER-2基因于20世纪80年代发现,HER-2癌基因是一种促癌基因,又称为C-erbB-2或neu或HER-2/neu密码,位于第17号染色体q21带上,编码一分子量为185~190 kD细胞膜上的磷脂蛋白,是肿瘤细胞常发生异常改变的一个基因。其具有酪氨酸激酶活性,结构非常类似于表皮生长因子受体EGFR,二者氨基酸序列有50%的同源性[1-3]。HER-2增强肿瘤细胞的增殖、抑制凋亡、促进肿瘤细胞的迁移;增加肿瘤细胞的侵袭力,破坏机体组织抗侵袭屏障等,其过度表达的肿瘤细胞对普通化疗不敏感,但可以和特异性的HER-2单克隆抗体Herceptin结合,加速HER-2蛋白的降解,从而抑制HER-2对肿瘤细胞向恶性表型的转导。目前研究已证实,HER-2基因在子宫内膜癌表达高于非癌子宫内膜,与子宫内膜癌的发生、发展及生物学行为相关[8-10]。
2002年美国FDA批准了一种全新的药物赫赛汀是一种人源化的针对HER-2受体的单克隆抗体。赫赛汀是第1个用于治疗肿瘤的分子靶向药物,其作用靶点为肿瘤细胞膜上HER-2基因过表达的产物。赫赛汀治疗疗效与肿瘤组织的HER-2基因表达状况密切相关,即HER-2基因表达强度越高,效果越好。国内外研究报道,HER-2在子宫内膜癌组织中的过度表达不仅与子宫内膜癌的发生、发展、转移相关,还与化疗耐药、对激素治疗不敏感和预后也密切相关[11-12]。赫赛汀开创了肿瘤靶向性治疗的新时代,赫赛汀作为肿瘤靶向性治疗应用于子宫内膜癌的治疗上却少有研究。本研究应用赫赛汀处理子宫内膜癌Ishikawa细胞发现,不同药物浓度赫赛汀抑制细胞生长,引起细胞G1期阻滞,诱导子宫内膜癌Ishikawa细胞凋亡。本实验结果还表明赫赛汀对化疗有增敏作用,当赫赛汀联合ADR、DDP及PTX化疗药物作用子宫内膜癌Ishikawa细胞后,癌细胞的凋亡显著提高。应用1/2 IC50的赫赛汀和化疗药物均未达到28%的生长抑制率,1/2 IC50的赫赛汀联合1/2的IC50化疗药物处理细胞显示,瘤细胞生长抑制率均达到40%以上,证实赫赛汀有化疗的增敏作用。肿瘤细胞耐药性与抗凋亡蛋白表达升高有关,使DNA损伤修复能力增强,对于各种化疗药物的细胞毒作用产生抵抗,也是化疗抵抗的机制之一,赫赛汀除抑制HER-2之外还阻断细胞毒药物诱导的凋亡,增强化疗敏感性。
通过本实验,我们用赫赛汀体外处理子宫内膜癌Ishikawa细胞株,发现赫赛汀不但可以诱导细胞凋亡,同时还可以提高化疗药物的敏感性,为子宫内膜癌提供新的治疗方法。
[参考文献]
[1]李小平,王建六.化疗在晚期和复发性耐药性子宫内膜癌治疗中的作用[J].中国实用妇科与产科杂志,2015,31(3) : 216-220.
[2]Growdon WB,Groeneweg J,Byron V,et al.HER2 overexpressing high grade endometrial cancer expresses high levels of p95HER2 variant[J].Gynecol Oncol,2015,137(1) : 160-166.
[3]郎博娟,马金阳,胡余昌,等.子宫内膜癌组织her-2/neu过表达临床及病理意义的Meta分析[J].数理医药学杂志,2015,28(1) : 49-52.
[4]Groeneweg JW,Hernandez SF,Byron VF,et al.Dual HER2 targeting impedes growth of HER2 gene-amplified uterine serous carcinoma xenografts[J].Clin Cancer Res,2014,20(24) : 6517-6528.
[5]Teplinsky E,Muggia F.Targeting HER2 in ovarian and uterine cancers: challenges and future directions[J].Gynecol Oncol,2014,135(2) : 364-370.
[6]Obeidat BR,Matalka II,Mohtaseb AA,et al.Selected immunohistochemical markers in curettage specimens and their correlation with final pathologic findings in endometrial cancer patients[J].Pathol Oncol Res,2013,19 (2) : 229-235.
[7]Steffen AC,Orlova A,Wikman M,et al.Affibody-mediated tumour targeting of HER-2 expressing xenografts in mice[J].Eur J Nucl Med Mol Imaging,2006,33(6) : 631-638.
[8]Chaudhry P,Asselin E.Resistance to chemotherapy and hormone therapy in endometrial cancer[J].Endocr Relat Cancer,2009,16(2) : 363-380.
[9]刘淼,魏敏杰,赵福杰.HER-2/neu基因沉默对子宫内膜癌细胞株Ishikawa细胞增殖及其对孕激素敏感性的影响[J].沈阳药科大学学报,2008,25(S1) : 64.
[10]Odicino FE,Bignotti E,Rossi E,et al.HER-2/neu overexpression and amplification in uterine serous papillary carcinoma: comparative analysis of immunohistochemistry,real-time reverse transcription-polymerase chain reaction,and fluorescence in situ hybridization[J].Int J Gynecol Cancer,2008,18(1) : 14-21.
[11]Santin AD,Bellone S,Roman JJ,et al.Trastuzumab treatment in patients with advanced or recurrent endometrial carcinoma overexpressing HER2/neu[J].Int J Gynaecol Obstet,2008,102(2) : 128-131.
[12]Jewell E,Secord AA,Brotherton T,et al.Use of trastuzumab in the treatment of metastatic endometrial cancer [J].Int J Gynecol Cancer,2006,16(3) : 1370-1373.
(责任编辑:林白霜,罗森)
Mechanism of Herceptin enhancing apoptosis and improving sensitivity to chemotherapy in Ishikawa cells
SHEN Yuan1,LU Lin2,WANG Xiao-yu1
(1Department of Obstetrics and Gynecology,The First Affiliated Hospital of Jinan University,Guangzhou 510632,China;2Obstetrics&Gynecology Department,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China.E-mail: twxy@jnu.edu.cn)
[ABSTRACT]AIM: To investigate the role of Herceptin in the apoptosis and drug sensitivity of endometrial cancer Ishikawa cells.METHODS: The IC(50)values of Herceptin,adriamycin (ADR),cisplatin (DDP) and paclitaxel (PTX) for Ishikawa cells were detected by MTT method.Ishikawa cells were treated with single drug and combined chemotherapy for 24 h,the cell cycle and the apoptosis ratio were determined by flow cytometry.RESULTS: The IC(50)values of Herceptin,ADR,DDP and PTX were 57.12 mg/L,0.572 μmol/L,67.4 μmol/L and 719.5 nmol/L,respectively.Herceptin significantly enhanced the cytotoxicity of the chemotherapeutic drugs,and increased apoptosis ratio statistically.CONCLUSION: Herceptin enhances the apoptosis-inducing ability of the chemotherapeutic drugs and improves the chemotherapeutic sensitivity in Ishikawa cells.
[KEY WORDS]Herceptin; Endometrial cancer; Chemotherapeutic sensitivity; Apoptosis
通讯作者△Tel: 020-38688646; E-mail: twxy@jnu.edu.cn
*[基金项目]广东省科技计划(No.2013B021800163) ;暨南大学第一临床医学院科研培育专项基金资助项目(No.2014102)
[收稿日期]2015-05-21[修回日期]2015-07-10
[文章编号]1000-4718(2015)09-1568-04
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.006
