不可分型流感嗜血杆菌诱导NCI-H292细胞产生MUC5AC的分子机制*
2015-04-27周丽丽曹艳华杨志英张园园湘南学院基础医学部郴州市第一人民医院儿童医院湖南郴州4000清远市狮子湖医院广东清远550
阳 帆,周丽丽,曹艳华,杨志英,邝 婧,张园园,李 坚△(湘南学院基础医学部,郴州市第一人民医院儿童医院,湖南郴州4000;清远市狮子湖医院,广东清远550)
不可分型流感嗜血杆菌诱导NCI-H292细胞产生MUC5AC的分子机制*
阳帆1,周丽丽2,曹艳华1,杨志英1,邝婧2,张园园3,李坚1△
(1湘南学院基础医学部,2郴州市第一人民医院儿童医院,湖南郴州423000;3清远市狮子湖医院,广东清远511520)
[摘要]目的:探讨不可分型流感嗜血杆菌(nontypeable Haemophilus influenzae,NTHi)诱导气道上皮细胞表达黏蛋白MUC5AC的影响,并探讨其可能的分子机制。方法:体外培养NCI-H292细胞,用NTHi感染后,采用ELISA检测MUC5AC和基质金属蛋白酶9(MMP-9)的水平;明胶酶谱实验分析MMP-9的酶活性;同时分别采用表皮生长因子受体(EGFR)、磷脂酰肌醇3-激酶(PI3K)、NADPH氧化酶、活性氧簇(ROS)、和MMP-9特异性抑制剂AG1478、LY294002、DPI、NAC和GM6001预处理NCI-H292细胞,检测MUC5AC以及MMP-9的水平。结果: NTHi能以时间依赖性方式诱导NCI-H292细胞产生MMP-9,并上调其酶活性,同时增加Rac1的活性并诱导ROS生成;采用AG1478和LY294002处理后,Rac1活性显著降低;采用DPI或Rac1抑制剂NSC23766处理后,ROS含量明显减少;当NCI-H292细胞用NAC或NSC23766预处理后,可显著下调MMP-9的表达与活性。此外,采用GM6001处理后,MUC5AC的分泌明显降低。结论: NTHi经EGFR/PI3K/Rac1/NADPH氧化酶/ROS/MMP-9通路诱导NCIH292细胞产生MUC5AC。
[关键词]不可分型流感嗜血杆菌;基质金属蛋白酶9; MUC5AC
[修回日期]2015-07-08
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是世界上第4位主要死亡原因[1]。呼吸道黏液过度分泌是导致COPD急性发作的重要因素[2]。作为机体抵御外来病原体感染的重要保护屏障,呼吸道黏膜分泌的黏液在固有免疫系统中发挥重要作用[2-3]。黏蛋白是黏液的重要组成成分,但病理条件下黏蛋白过度表达往往会导致呼吸受限或换气不足[2,4]。在已经明确的20多种黏蛋白中,以凝胶黏蛋白MUC5AC研究最多[5]。研究表明,MUC5AC在肺部表达较高,多种细菌感染均可促进其分泌,如不可分型流感嗜血杆菌(nontypeable Haemophilus influenzae,NTHi)和铜绿假单胞菌等[6-8]。研究显示,NTHi能通过表皮生长因子受体(epidermal growth factor receptor,EGFR)途径诱导气道上皮细胞产生MUC5AC,其机制依赖于基质金属蛋白酶9 (matrix metalloproteinase 9,MMP-9)的活性[9-10]。但其上游的分子机制目前仍不清楚。本研究旨在进一步探讨NTHi诱导人气道上皮细胞产生MMP-9的分子机制,并探讨其在介导MUC5AC分泌中的作用。
材料和方法
1试剂与菌株
鼠抗人MUC5AC单克隆抗体、AG1478(EGFR抑制剂)、LY294002(PI3K抑制剂)、DPI (NADPH氧化酶抑制剂)、NAC (ROS抑制剂)和GM6001 (MMP-9特异性抑制剂)购自Sigma; HRP标记羊抗鼠多克隆抗体购自Santa Cruz; CM-H2DCFDA荧光探针为Molecular Probes产品; NSC23766购自Tocris; NTHi和NCI-H292细胞株购自ATCC;胎牛血清和RPMI-1640培养基为Gibco产品。MMP-9 ELISA检测试剂盒购自R&D。
2实验方法
2.1NTHi培养与提取NTHi菌株用巧克力琼脂于37℃、5% CO2下培养24 h,PBS洗脱平板上细菌并收集到Eppendorf管中,随后加入30 mL含3.5 mg/L NAD的脑-心浸液继续培养24 h。4℃10 000 r/min离心10 min,PBS洗涤沉淀2次后用0.22 μm滤膜(Millipore)过滤并保存于-80℃备用。
2.2NCI-H292细胞培养人气道上皮细胞系NCIH292细胞用含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素的RPMI-1640培养基中于5% CO2、37℃的环境下生长。实验前,将细胞按密度为5×105/well接种于6孔板中,无血清条件下培养24 h,随后加入培养的NTHi共感染9 h。在研究抑制剂效应时,NCI-H292细胞预先与相应的抑制剂孵育1 h,随后再用NTHi感染。本研究当中所用的抑制剂浓度分别为10 μmol/L (AG1478 )、20 μmol/L (GM6001 )、50 μmol/L (NSC23766 )、50 μmol/L (LY294002)、15 μmol/L(DPI)和30 mmol/L(NAC)。
2.3细胞存活率观察采用MTT实验观察NTHi感染或药物作用后细胞的存活率。当细胞处理结束前4 h各孔加入MTT溶液20 μL后,随后弃上清,并加入DMSO,充分混匀,用酶标仪测定各孔570 nm处的吸光度值(A570),并计算细胞的存活率。存活率=实验组A值/对照组A值×100%。
2.4明胶酶谱实验细胞用无血清培养基培养24 h后,收集上清,加入Laemmli样品缓冲液并经含1 g/L明胶的SDS-PAGE(分离胶10%)分离。电泳结束后,加入含2.5% Triton X-100复性液孵育30 min以去除SDS。随后将凝胶用50 mmol/L HCl (pH 7.4)、5 mmol/L CaCl2和1 μmol/L ZnCl2于37℃下孵育过夜。加入0.05%考马斯亮蓝R-250室温染色30 min,去离子水脱色,拍照,灰度扫描。MMP-9活性以相对值表示,计算公式为:处理组灰度值/对照组灰度值×100%。
2.5MMP-9蛋白含量分析细胞处理结束后,通过反复冻融以裂解细胞。经1 000 r/min离心5 min后,弃沉淀,采用双抗体夹心ELISA法检测上清中MMP-9的含量。操作方法按照商家提供的试剂盒操作步骤进行。结果以相对含量表示(处理组MMP-9浓度/对照组MMP-9浓度×100%)。
2.6Rac1活性检测裂解处理后的NCI-H292细胞,根据Cytoskeleton生产的G-LISATM Activation Assay试剂盒的操作说明测量Rac1的活性。本试剂盒采用ELISA原理测量小G蛋白中结合GTP(活性形式)的含量而加以确定。测量组荧光强度/对照组强度的比值即为Rac1的相对活性。
2.7活性氧簇(reactive oxygen species,ROS)含量的检测NCI-H292细胞刺激结束后,加入10 μmol/L CM-H2DCFDA用于检测自由基的活性。荧光强度采用荧光分光光度计(Hitachi F-2000)进行分析,其中激发波长为488 nm,发射波长为530 nm。ROS含量根据标本荧光强度/对照品荧光强度的比值表示。
2.8ELISA检测MUC5AC的含量采用酶联免疫分析测量MUC5AC蛋白的含量。细胞处理结束后,弃上清,随后用4℃PBS洗涤细胞。并加入裂解缓冲液(20 mmol/L Tris-HCl、133 mmol/L NaCl、1% NP-40及10%甘油)裂解细胞。离心获取裂解上清液并测定其浓度后置于-80℃。检测MUC5AC时,取裂解上清液置于96孔板中,40℃下烘干。加入2%胎牛血清于37℃封闭1 h,随后加入含0.05% Tween-20的MUC5AC抗体(PBS稀释)孵育1 h,结束后加入Ⅱ抗,37℃1 h。TMB法显色后,再加入2 N H2SO4终止反应。酶标仪下读取450 nm下的吸光度。
3统计学处理
所有数据用均数±标准差(mean±SD)表示。计量资料采用t检验。组间比较采用单因素方差分析后行SNK-q检验。以P<0.05为差异有统计学意义。
结果
1 NTHi经EGFR诱导NCI-H292细胞分泌并激活MMP-9
NCI-H292细胞静息状态下,MMP-9表达量较低。当经NTHi感染后,能以时间依赖性方式诱导产生MMP-9,当感染时间为9 h时,MMP-9含量为对照组的3.7倍。此外,MMP-9的酶活性也随感染时间的延长而增高。9 h后酶活性为对照组的3.1倍。此外,NCI-H292细胞经EGFR抑制剂AG1478处理后,MMP-9蛋白分泌水平减少52.2%,活性降低61.2%,见图1。在所有处理组中,细胞的存活率无明显变化(结果未显示)。

Figure 1.NTHi induced the secretion and activation of MMP-9 in NCI-H292 cells.Mean±SD.n=3.*P<0.05 vs control;#P<0.05 vs NTHi(9 h).图1 NTHi对NCI-H292表达MMP-9及其活性的影响
2 NTHi经EGFR和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)通路激活Rac1
NTHi感染NCI-H292细胞后,Rac1活性增加了3.8倍。有研究表明,NTHi感染能激活EGFR和PI3K[11]。为了进一步探讨Rac1的激活与EGFR和PI3K的关系,NCI-H292细胞分别与EGFR和PI3K特异性抑制剂AG1478及LY294002处理。结果显示,AG1478处理后Rac1活性降低了54.5%,LY294002能将其活性降低49.2%,见图2。上述浓度抑制剂处理后对细胞的存活率无明显影响(结果未显示)。

Figure 2.NTHi induced Rac1 activation through EGFR and PI3K.Mean±SD.n=3.*P<0.05 vs control;#P<0.05 vs NTHi.图2 NTHi经EGFR和PI3K激活Rac1
3 NTHi诱导的MMP-9含量与活性受Rac1和ROS调控
NCI-H292细胞静息状态下,ROS含量较低。经NTHi感染后,ROS含量为对照组的2.3倍。NADPH氧化酶和Rac1抑制剂DPI和HSC23766处理后,ROS水平显著降低。当NCI-H292细胞感染前用ROS特异性抑制剂NAC预处理后,MMP-9含量减少了56.7%,活性降低了71.4%。此外,NCI-H292细胞用Rac1特异性抑制剂NSC23766预处理后,MMP-9的含量降低了60.3%,活性降低至68.5%,见图3。此外,本实验所用的DPI、HSC23766或NAC处理后对细胞存活率无明显影响(结果未显示)。
4 NTHi诱导的MUC5AC受MMP-9调控
NTHi感染NCI-H292细胞后,MUC5AC分泌增加了3.8倍。NSC23766、DPI或NAC处理后,MUC5AC分泌降低了65.6%、57.9%和50.0%。MMP-9抑制剂GM6001在不影响细胞存活率的情况下(结果未显示),能明显减少MUC5AC产生,见图4。

Figure 3.Rac1 mediated NTHi-stimulated MMP-9 secretion and activation through generation of ROS.Mean±SD.n=3.*P<0.05 vs control;#P<0.05 vs NTHi.图3 NTHi经Rac1/ROS诱导MMP-9分泌并上调其酶活性
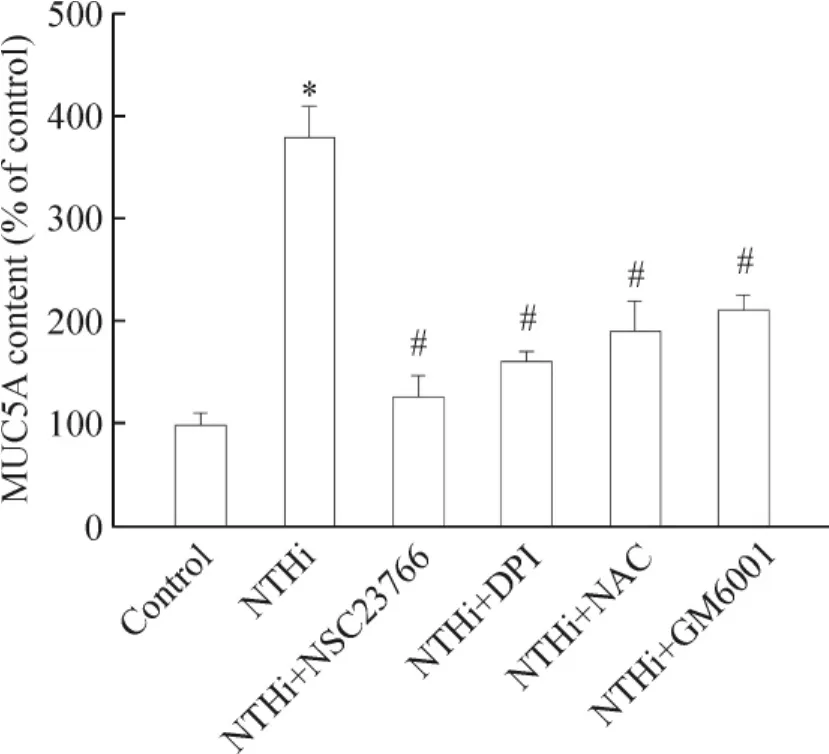
Figure 4.NTHi-stimulated MUC5AC production was regulated by Rac1/ROS-induced MMP-9 activity.Mean±SD.n=3.*P<0.05 vs control;#P<0.05 vs NTHi.图4 NTHi经Rac1/ROS/MMP-9诱导MUC5AC产生
讨论
尽管有研究显示NTHi能通过诱导MMP-9调控MUC5AC生成,但其确切的分子机制目前尚不完全清楚[12-13]。在本研究当中,我们对其信号通路进行了探讨。首先体外培养NTHi和NCI-H292细胞,通过建立感染模型后发现,NTHi能以时间依赖性方式诱导MMP-9的表达,并能上调其酶活性。由于在多种因素所诱导的MMP-9表达受EGFR信号通路的调节,因此本研究通过采用EGFR特异性抑制剂AG1478处理后发现,NTHi诱导MMP-9表达及酶活性作用显著降低,这表明NTHi诱导MMP-9的产生有赖于EGFR。EGFR激活后可磷酸化下游信号通路PI3K。Rac1是小G蛋白Rho家族成员,其通过GTP结合的有活性形式和GDP结合的无活性形式循环调节多种信号转导途径,在免疫应答、肌动蛋白细胞骨架重组和细胞迁移中发挥重要作用。研究表明,PI3K与Rac1密切相关。为了进一步探讨NTHi感染后EGFR和PI3K对Rac1活化的影响,我们采用AG1478和PI3K抑制剂LY294002处理后,结果显示Rac1活性明显降低,提示PI3K在介导EGFR激活Rac1中发挥重要作用。而随后通过抑制Rac1活性后,MMP-9的产生及酶活性也明显降低。以上结果表明EGFR下游的信号通路如PI3K依赖性Rac1介导了MMP-9的分泌与激活。
Rac1激活后,可激活下游NADPH氧化酶并诱导ROS产生[14]。ROS是细胞内一种重要的生理物质,但在病理条件下ROS的异常增多可导致严重的组织损伤。ROS的分泌受NADPH氧化酶调控。NADPH氧化酶是一个多组分活化的酶复合体,主要由质膜结合成分(包括gp91phox、p22phox和小GTP酶结合蛋白Rap1A)及胞浆成分组成(p47phox、p67phox、p40phox、小GTP酶结合蛋白Rac2、Cdc42等)组成。外源性因素刺激下可诱导NADPH氧化酶胞浆亚基p47phox磷酸化,随后转位到质膜或颗粒体膜,从而组装成有功能的NADPH氧化酶。NADPH氧化酶随后通过一系列电子传递催化ROS生成[14]。本研究通过采用NADPH氧化酶抑制剂DPI以及Rac1抑制剂处理后,细胞内ROS含量明显减少。这表明NAPDH氧化酶和Rac1参与了NTHi诱导的ROS产生。研究表明Rac1和ROS两者共同调控MMP-9的分泌与激活[15-17],为了进一步证明ROS是否也参与了NTHi诱导MMP-9的表达,随后我们采用ROS抑制剂NAC处理后发现,MMP-9的分泌及活性明显受到抑制。最后通过抑制MMP-9的活性后,MUC5AC的分泌显著降低。以上结果表明NTHi诱导MUC5AC的表达是通过激活EGFR/PI3K/Rac1/NAPDH氧化酶/ROS/MMP-9通路而实现的。
总之,本研究证实MUC5AC的产生受MMP-9调控,Rac1在该过程中发挥重要调控作用,这为COPD等疾病的治疗提供新的作用靶点。但Rac1是机体正常生理功能所必需的分子,尤其是参与了巨噬细胞的吞噬功能[18-19],因此以Rac1为作用靶点的药物开发用于治疗COPD等呼吸系统疾病时,必须考虑细胞特异性和可控性问题,以减少其副作用。
[参考文献]
[1]Tanabe N,Muro S,Hirai T,et al.Impact of exacerbations on emphysema progression in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2011,183(12) : 1653-1659.
[2]Evans CM,Koo JS.Airway mucus: the good,the bad,the sticky[J].Pharmacol Ther,2009,121(3) : 332-348.
[3]Rogers DF.The role of airway secretions in COPD: pathophysiology,epidemiology and pharmacotherapeutic options [J].COPD,2005,2(3) : 341-353.
[4]Rogers DF,Barnes PJ.Treatment of airway mucus hypersecretion[J].Ann Med,2006,38(2) : 116-125.
[5]Rose MC,Voynow JA.Respiratory tract mucin genes and mucin glycoproteins in health and disease[J].Physiol Rev,2006,86(1) : 245-278.
[6]Lai H,Rogers DF.New pharmacotherapy for airway mucus hypersecretion in asthma and COPD: targeting intracellular signaling pathways[J].J Aerosol Med Pulm Drug Deliv,2010,23(4) : 219-231.
[7]Leikauf GD,Borchers MT,Prows DR,et al.Mucin apoprotein expression in COPD[J].Chest,2002,121 (5 Suppl) : 166S-182S.
[8]Dohrman A,Miyata S,Gallup M,et al.Mucin gene (MUC 2 and MUC 5AC) upregulation by Gram-positive and Gram-negative bacteria[J].Biochim Biophys Acta,1998,1406(3) : 251-259.
[9]Kohri K,Ueki IF,Shim JJ,et al.Pseudomonas aeruginosa induces MUC5AC production via epidermal growth factor receptor[J].Eur Respir J,2002,20(5) : 1263-1270.
[10]Chen R,Lim JH,Jono H,et al.Nontypeable Haemophilus influenzae lipoprotein P6 induces MUC5AC mucin transcription via TLR2-TAK1 dependent p38 MAPK-AP1 and IKKβ-IκBα-NF-κB signaling pathways[J].Biochem Biophys Res Commun,2004,324(3) : 1087-1094.
[11]Xu X,Steere RR,Fedorchuk CA,et al.Activation of epidermal growth factor receptor is required for NTHi-induced NF-κB-dependent inflammation[J].PLoS One,2011,6(11) : e28216.
[12]Jono H,Xu H,Kai H,et al.Transforming growth factorbeta-Smad signaling pathway negatively regulates nontypeable Haemophilus influenzae-induced MUC5AC mucin transcriptionviamitogen-activatedproteinkinase (MAPK ) phosphatase-1-dependent inhibition of p38 MAPK[J].J Biol Chem,2003,278(30) : 27811-27819.
[13]Shen H,Yoshida H,Yan F,et al.Synergistic induction of MUC5AC mucin by nontypeable Haemophilus influenzae and Streptococcus pneumoniae[J].Biochem Biophys Res Commun,2008,365(4) : 795-800.
[14]Byeon SE,Yi YS,Oh J,et al.The role of Src kinase in macrophage-mediated inflammatory responses[J].Mediators Inflamm,2012,2012: 512926.
[15]Sadowska AM.N-Acetylcysteine mucolysis in the management of chronic obstructive pulmonary disease[J].Ther Adv Respir Dis,2012,6(3) : 127-135.
[16]洪华,曾进胜,王莹,等.阿托伐他汀对大鼠缺血再灌注脑组织中NADPH氧化酶源性超氧阴离子的抑制作用[J].中国病理生理杂志,2008,24(7) : 1345-1350.
[17]曾慧兰,卜欠欠,陈慧中,等.尼古丁对人脐带间充质干细胞增殖和迁移的影响[J].中国病理生理杂志,2013,29(5) : 778-783.
[18]Bokoch GM.Regulation of innate immunity by Rho GTPases[J].Trends Cell Biol,2005,15(3) : 163-171.
[19]Zhang P,Summer WR,Bagby GJ,et al.Innate immunity and pulmonary host defense[J].Immunol Rev,2000,173: 39-51.
(责任编辑:卢萍,余小慧)
Molecular mechanism of nontypeable Haemophilus influenzae stimulated MUC5AC production in NCI-H292 cells
YANG Fan1,ZHOU Li-li2,CAO Yan-hua1,YANG Zhi-ying1,KUANG Jing2,ZHANG Yuan-yuan3,LI Jian1
(1Department of Basic Medicine,Xiangnan College of Medicine,2Children's Hospital,The First People’s Hospital of Chenzhou,Chenzhou 423000,China;3Lionlake Hospital of Qingyuan,Qingyuan 511520,China.E-mail: okleonlj@163.com)
[ABSTRACT]AIM: To investigate the molecular mechanism of nontypeable Haemophilus influenzae (NTHi) -induced MUC5AC expression in the human airway NCI-H292 cells.METHODS: Bronchial epithelial NCI-H292 cells were cultured in vitro.The production of MUC5AC and matrix metalloproteinase 9 (MMP-9) after stimulation with NTHi was analyzed by enzyme-linked immunosorbent assay (ELISA).The enzymatic activity of MMP-9 was detected by gelatin zymography.In addition,the cells were pretreated with different inhibitors such as AG1478,LY294002,DPI,NAC and GM6001 before stimulation,which specifically inhibit epidermal growth factor receptor(EGFR),phosphatiadylinositol 3-kinase (PI3K),NADPH oxidase,reactive oxygen species (ROS) and MMP-9,respectively,and then the production of MUC5AC or MMP-9 was determined.RESULTS: NTHi-stimulated NCI-H292 cells exhibited a time-dependent increase in MMP-9 secretion and activity.NTHi also increased the activity of Rac1 and the production of ROS.Pretreatment of AG1478 and LY294002 decreased the Rac1 activity,and preincubation of DPI or Rac1 inhibitor significantly abrogated ROS production.In addition,secretion of MMP-9 and the enzymatic activity was decreased by treatment of NAC and NSC23766.Furthermore,inhibition of the MMP-9 activity by GM6001 significantly inhibited MUC5AC production.CONCLUSION: EGFR/PI3K/Rac1/NADPH oxidase/ROS/MMP-9 regulates MUC5AC production in NTHi-challenged NCIH292 cells.
[KEY WORDS]Nontypeable Haemophilus influenzae; Matrix metalloproteinase 9; MUC5AC
通讯作者△Tel: 0735-2653161; E-mail: okleonlj@163.com
*[基金项目]国家自然科学基金资助项目(No.31300156) ;湖南省教育厅计划项目(No.09C912) ;湘南学院“十二五”重点学科(No.xnu125kd019)
[收稿日期]2015-04-13
[文章编号]1000-4718(2015)09-1642-05
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.020
