HPLC法测定陈皮水提物中三种活性成分含量
2015-04-26叶勇树王国才李药兰
吴 霞,叶勇树,王国才,李药兰*
(1.广东药学院 中心实验室,广东 广州 510006;2.暨南大学 中药及天然药物研究所,广东 广州 510632)
HPLC法测定陈皮水提物中三种活性成分含量
吴 霞1,叶勇树2,王国才2,李药兰2*
(1.广东药学院 中心实验室,广东 广州 510006;2.暨南大学 中药及天然药物研究所,广东 广州 510632)
目的:采用高效液相色谱(HPLC)法测定陈皮水提物中橙皮苷、川陈皮素和橘皮素含量。方法:采用HPLC法,以橙皮苷、川陈皮素和橘皮素为化学对照品,固定相:Agilent Zorbax SB-C18色谱柱(4.6mm×250mm, 5μm),流动相:乙腈和0.5%的醋酸水溶液,流速:1.0mL/min,检测波长:283nm和330nm,柱温:25℃。结果:橙皮苷、川陈皮素和橘皮素的保留时间在20.46~35.55min之间,平均回收率为97.5%~98.6%,RSD为2.1%~3.3%,精密度为0.97%~1.0%;同时测定了收集自不同产地和年份的10种陈皮的活性成分含量。结论:HPLC法适合陈皮中橙皮苷、川陈皮素和橘皮素含量的测定,该方法操作简便,具有较高的灵敏度和精密度。
HPLC法;陈皮水提物;活性成分
陈皮为芸香科植物橘(CitrusreticulataBlanco)及其栽培变种的干燥成熟果皮,主要分布于我国广东、四川、福建、江西等地[1]。陈皮性温,味苦、辛,具有燥湿化痰、理气健脾的功效[2],作为药用和食用的历史悠久,其保健功效早已被国内外所认同。现代药理研究发现,陈皮水提物具有较好的药理活性作用[3-5],其中橙皮苷和多甲氧基黄酮川陈皮素及橘皮素为其有效成分[6-9]。陈皮中所含黄酮类成分以橙皮苷的含量最高,其次是多甲氧黄酮类成分,该类成分又以川陈皮素和橘皮素的含量居高[10-11]。因此,本实验建立了HPLC法测定广陈皮水提物中橙皮苷、川陈皮素和橘皮素三种有效成分含量的分析方法,同时测定了不同产地来源陈皮的有效成分含量。该方法可为陈皮在食品和药品中的进一步开发利用提供科学依据。
1 仪器与试剂
仪器:Agilent-1200 高效液相色谱系统;二极管阵列检测器(DAD);对照品:橙皮苷、川陈皮素、橘皮素(自制,经1H-NMR、13C-NMR和MS等技术和理化性质鉴定,用HPLC峰面积归一法测定其纯度在98%以上);试剂:乙腈(色谱纯,科密欧公司),水为纯净水(怡宝食品饮料有限公司),醋酸(分析纯,广州化学试剂厂)。药材:广陈皮(S1)购于江门市新会区,经暨南大学药学院周光雄教授鉴定为茶枝柑Citrusreticulate'Chachi'的干燥成熟果皮;收集不同储存时间、不同产地的陈皮样品10批,经暨南大学药学院周光雄教授鉴定为陈皮。样品保存于暨南大学药学院。具体见表1。

表1 陈皮药材(无限极有限公司提供)
2 实验方法
2.1 检测波长选择
由紫外吸收色谱图可以看出,橙皮苷在283nm处、川陈皮素和橘皮素在 330nm 处有较强吸收且基线平稳,因此选择283nm 作为橙皮苷的检测波长,330nm作为川陈皮素和橘皮素的检测波长,结果见图1。
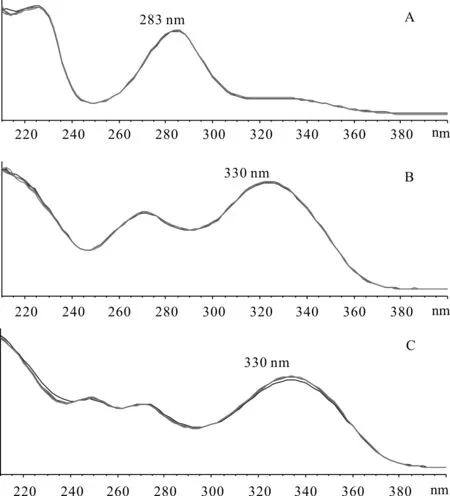
图1 供试品溶液中橙皮苷(A)、川陈皮素(B)和橘皮素(C)紫外吸收色谱
2.2 流动相选择与优化
本实验考察了甲醇-水、乙腈-水及在流动相中添加不同浓度的乙酸对样品分离的影响。结果表明,采用乙腈-0.5%乙酸水系统对橙皮苷、川陈皮素和橘皮素的分离效果与甲醇-水系统相比有明显改善,而乙酸浓度对样品分离影响不大;同时,采用梯度洗脱能满足样品基线分离且保留时间适宜。因此,实验采用乙腈-0.5%乙酸水系统作为流动相,洗脱方式为梯度洗脱。
2.3 提取方法考察
本实验主要考察广陈皮水提物中有效成分橙皮苷、川陈皮素和橘皮素的含量。实验采用水加热回流提取法,分别考察20倍量和30倍量水、提取次数对结果的影响。结果表明,30倍量水加热回流提取三次,已接近提取完全。见表2。
2.4 色谱条件
优化后色谱条件为:色谱柱:Agilent Zorbax SB-C18柱(4.6mm×250mm, 5μm);流动相:乙腈(B)-0.5%醋酸水(A)进行梯度洗脱;流速:1.0mL/min;检测波长:283nm(橙皮苷),330nm(川陈皮素和橘皮素);柱温:25℃;进样量:10μL,见表3。

表2 水(30倍量) 加热回流提取次数考察(峰面积)

表3 梯度洗脱条件
在上述色谱条件下,广陈皮水提物中供试品及橙皮苷、川陈皮素和橘皮素色谱峰分离度良好,结果见图2。
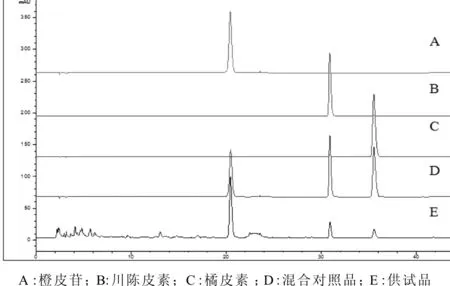
图2 各样品色谱
2.5 对照品溶液制备
精密称取川陈皮素1.7mg、橘皮素1.5mg,加甲醇溶解,定容,得川陈皮素(0.34mg/mL)、橘皮素(0.30mg/mL)混合液。精密称取橙皮苷2.0mg置于5mL容量瓶中,精密加入混合液1.0mL,加甲醇稀释至刻度,摇匀制成每1mL含川陈皮素0.068mg、橘皮素0.06mg和橙皮苷0.4mg的混合对照品溶液。
2.6 供试品溶液制备
取广陈皮药材(S1)粉碎,过80目筛,混合均匀后,精密称定约4.0g,置于500mL 圆底烧瓶中,加120mL水,直火加热回流提取1h,放冷至约40~50℃,抽滤,重复提取3次,过滤,合并过滤液,浓缩,加水定容至250mL容量瓶中,摇匀即得。取1mL溶液过0.45μm微孔滤膜,取续滤液作为供试品溶液。
2.7 标准曲线建立
分别精密吸取上述混合对照品溶液1、4、6、10、16、20μL注入液相色谱仪,按“2.4”项下色谱条件测定。以峰面积为纵坐标,进样量(μg)为横坐标进行线性回归,分别得到橙皮苷标准曲线为y=1668.4x+1.061,r=0.999 9(n=6),川陈皮素标准曲线为y=3494.5x+16.712,r=0.999 8(n=6),橘皮素标准曲线为y=3661.2x-0.3414,r=0.999 9(n=6)。结果表明橙皮苷、川陈皮素和橘皮素分别在0.8~8.0μg、0.136~1.36μg、0.12~1.2μg范围内质量与峰面积线性关系良好。
2.8 精密度考察
精密吸取混合对照品溶液10μL,按“2.4”项下色谱条件连续进样5次,记录峰面积值,结果橙皮苷、川陈皮素和橘皮素的峰面积RSD值分别为1.0%、0.96%和0.97%,表明仪器精密度良好。
2.9 稳定性考察
取广陈皮(S1)供试品溶液于制备后0、2、8、16、24h,按“2.4”项下色谱条件进样,橙皮苷、川陈皮素、橘皮素的峰面积RSD值分别为2.80%、0.66%和0.80%,表明供试品溶液在24h内稳定性良好。
2.10 重复性试验
精密称定广陈皮粉末(S1)约4.0 g,平行5份,分别按“2.6”项下方法制备供试品溶液,并按照“2.4”项下色谱条件进行测定,记录峰面积值,结果橙皮苷、川陈皮素和橘皮素的峰面积RSD分别为0.7%、1.1%和3.6%(n=5),表明测定方法重现性良好。
2.11 加样回收率考察
精密称取广陈皮(S1)粉末4.0g,平行操作5份,分别加入一定量的对照品,按“2.6”项下方法制备供试品溶液,并按照“2.4”项下色谱条件进行测定,记录峰面积值,并计算各测得含量值。结果表明,橙皮苷、川陈皮素和橘皮素的平均回收率分别为97.5%、98.9%和98.6%,RSD分别为2.4%、2.1%和3.3%(n=5),表明该方法准确度良好。结果见表4。
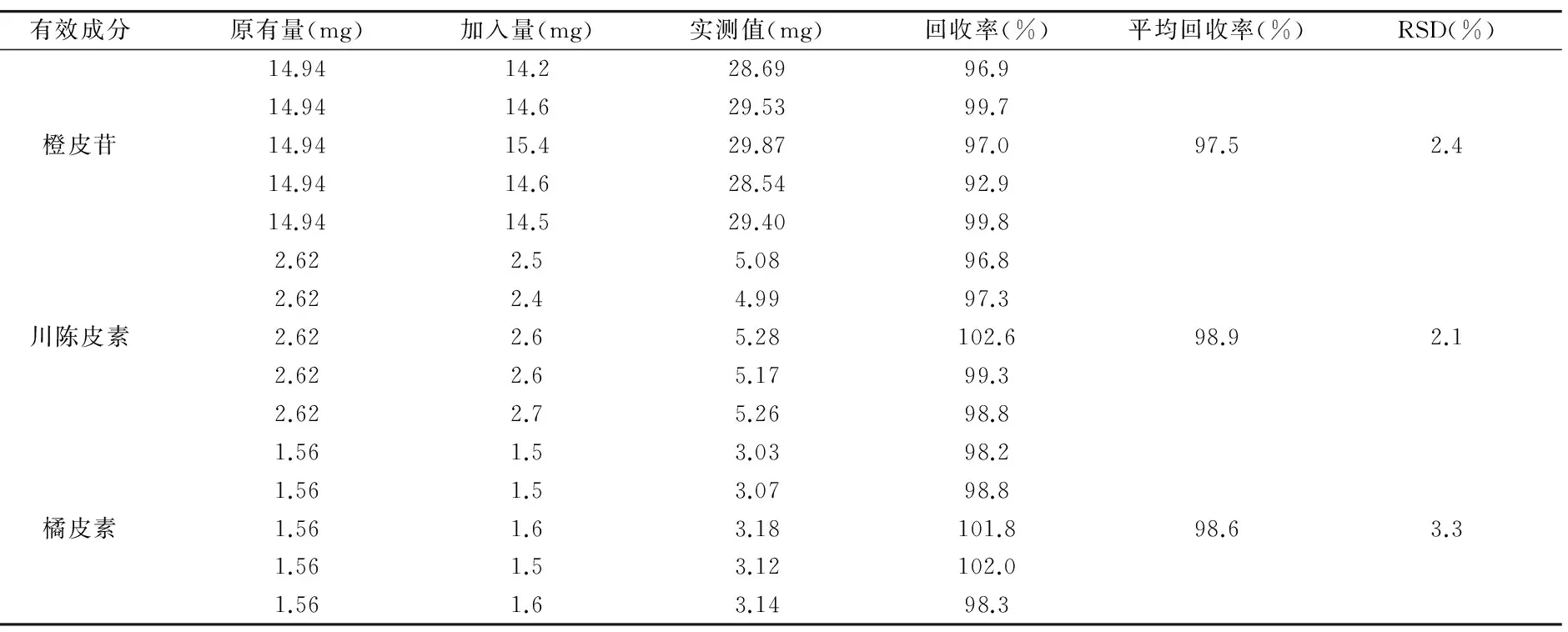
表4 广陈皮水提物加样回收率试验结果 (n=5)
3 含量测定
分别精密称取不同产地陈皮粉末4.0g,按照“2.6”项下方法制备供试品溶液,并按照“2.4”项下色谱条件进行测定,记录峰面积值,按照线性回归方程,以1g广陈皮中所含有效成分含量(mg)计算广陈皮有效成分含量。结果见表5。
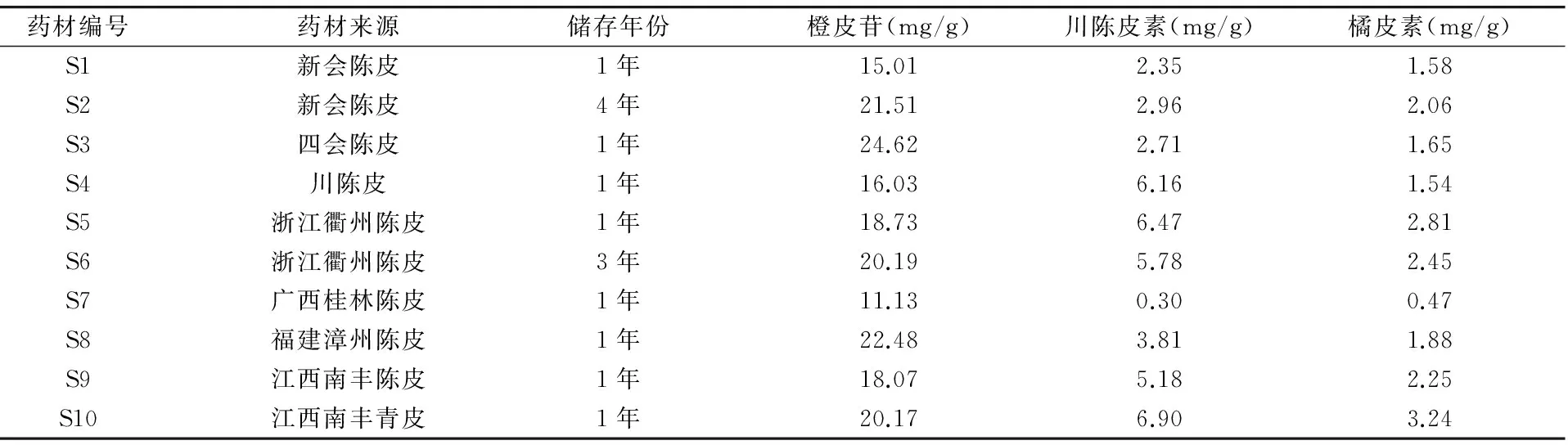
表5 不同产地不同年份陈皮有效成分含量测定结果
4 结果与讨论
本实验主要测定了陈皮水提物中三种有效成分的含量。供试品制备采用水加热回流提取的方法,能较好地将有效成分提取出来,由于橙皮苷易溶于热水,过滤时将提取液冷却置40~50℃过滤,可减少损失。提取方法具有对环境无污染,操作简便,适用于食品及药品的生产利用。
实验中考察了甲醇-水、乙腈-水及在流动相中添加不同浓度的乙酸对样品分离的影响。结果表明,采用乙腈-0.5%乙酸水系统对橙皮苷、川陈皮素和橘皮素的分离效果与甲醇-水系统相比有明显改善且乙酸浓度对样品分离影响不大,同时,采用梯度洗脱能满足样品基线分离且保留时间适宜。
本实验建立了HPLC法测定广陈皮水提物中橙皮苷、川陈皮素和橘皮素的含量,同时,还对不同产地不同年份陈皮进行分析测定,该方法简便、准确高效、稳定性好,为陈皮的质量控制提供科学依据。
[1] 陈有根,范崔生.陈皮类的生药学研究[J].江西中医学院学报, 1995(S1):26.
[2] 中国国家药典委员会.中华人民共和国药典[S].一部.北京:化学工业出版社,2005:1321.
[3] 李伟,郑天珍,瞿颂义,等.陈皮对大鼠胃平滑肌条收缩活动的作用及机制的探讨[J].中国中西医结合杂志, 2000(S1):49-50.
[4] 敬璞,丁晓雯,苏晔.柑桔皮水提液在小鼠体内的抗氧化作用研究[J].西南农业大学学报, 2003, 25 (3): 265-267.
[5] 方玉复,魏玉平,丁香安,等.陈皮对浅部真菌的试管内抑菌实验及临床疗效观察[J].中国皮肤性病学杂志, 1997, 11 (5): 275.
[6] YI ZB, YU Y,LIANG YZ.In vitro antioxidant and antimicrobial activities of the extract of Pericarpium Citri Reticulatae of a new Citrus cultivar and its main flavonoids[J].Food Science and Technology, 2008, 41 (4): 597-603.
[7] KUROWSKA EM,MANTHEY JA.Hypolipidemic effects and absorption of citrus polymethoxylated flavones in hamsters with diet-induced hypercholesterolemia[J].Journal of Agricultural and Food Chemistry, 2004, 52 (10): 2879-2886.
[8] HENG Q,HIROSE Y,YOSHIMI N,et al.Further investigation of the modifying effect of various chemopreventive agents on apop tosisand cell proliferation in human colon cancer cells[J].Journal of Cancer Research and Clinical Oncology, 2002, 128 (10): 539-546.
[9] 欧仕益.桔皮苷的药理作用[J].中药材, 2002, 25 (7): 531-533.
[10] WANG FM,SIMON JE,AVILES IF,et al. Analysis of antioxidative phenolic compounds in artichoke[J].Journal of Agricultural and Food Chemistry, 2003, 51: 601-608.
[11] 吴宏伟, 雷海民, 李强, 等.高效液相色谱法测定陈皮多甲氧基黄酮部位中3种黄酮的含量[J].药物分析杂志, 2007, 27 (12): 1895-1897.
(责任编辑:魏 晓)
Determination of Three Active Constituents in the Aqueous Extract of Citrus reticulata 'Chachi' by HPLC
Wu Xia1, Ye Yongshu2, Wang Guocai2, Li Yaolan2*
(1.Central Laboratory, Guangdong Pharmaceutical University, Guangzhou 510006, China;2.Institute of Traditional Chinese Medicine & Natural Products, College of Pharmacy, Jinan University, Guangzhou 510632, China)
Objective:To establish a HPLC method for determination of hesperidin, nobiletin and tangeretin in the aqueous extract of Citrus reticulata 'Chachi'.Methods:The HPLC analysis was conducted on Agilent-1200 with C18reversed-phase column (Agilent Zorbax SB, 4.6mm×250mm, 5μm). The gradient mobile phase consisted of 0.5% acetic acid and acetonitrile, and the flow rate is 1.0mL/min. The monitoring wavelengths were 283 nm and 330 nm, respectively. The column temperature was selected to be 25℃. Results:The retention times of hesperidin, nobiletin and tangeretin were ranged from 20.46~35.55 min, the average recoveries were 97.5%~98.6%, the relative standard deviations were 2.1%~3.3%, and the precision reached 0.97%~1.0%. Besides, the contents of hesperidin, nobiletin and tangeretin in the aqueous extract of Citrus reticulata 'Chachi' collected from differents places and different storage years were measured.Conclusion:The established method in the present study was simple, convenient and practicable.
HPLC; Aqueous Extract of Citrus Reticulata 'Chachi'; Active Constituents
2014-09-11
国家自然科学基金项目(81202429)
吴霞(1980-),女,广东药学院助理研究员,研究方向为天然药物活性成分研究与药物分析。
李药兰(1963-),女,暨南大学教授,研究方向为天然药物化学和生物活性研究。E-mail: tliyl@jun.edu.cn
R284
A
1673-2197(2015)03-0024-04
10.11954/ytctyy.201503010
