川陈皮素调节AMPK/NLRP3 信号通路对脂多糖诱导的肾小球系膜细胞炎性损伤的影响
2024-03-05罗丹王燕丁旭胡耀成都大学附属医院血液净化中心四川成都6008成都大学附属医院肾病内科四川成都6008
罗丹,王燕,丁旭,胡耀(.成都大学附属医院血液净化中心,四川成都 6008;.成都大学附属医院肾病内科,四川成都 6008)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的常见并发症,包括I 型和II 型,是世界各地终末期肾病的主要原因[1]。糖尿病肾病的特征是系膜细胞增殖、系膜细胞外基质(extracellular matrix,ECM)增厚、肾肥大和随后的肾小球硬化。除ECM 蛋白积累外,炎症也是糖尿病肾病的标志,在该疾病的发生和发展中起着重要作用[2]。已有研究[3]报道称,抑制脂多糖(lipopolysaccharide,LPS)诱导的大鼠肾小球系膜细胞(mesangium cells,MC)ECM 积累和炎症对于防治糖尿病肾病起到积极效果。
川陈皮素(Nobiletin)是柑橘类水果皮中的一种生物活性物质,据报道其是一种有效的抗炎和抗菌剂[4]。有报道[5]称,川陈皮素可以改善链脲佐菌素-镉诱导的大鼠糖尿病肾病。川陈皮素可以抑制高葡萄糖诱导的炎症和ECM 在肾小球系膜细胞的积累[6]。肾小球系膜细胞约占肾小球细胞的1/3,在维持细胞平衡中发挥重要作用,肾小球系膜细胞是体外研究糖尿病肾病的常见细胞[7]。AMP 激活的蛋白激酶(AMPactivated protein kinase,AMPK)/NOD 样受体蛋白3(NOD-like receptor protein 3,NLRP3)信号通路是研究糖尿病肾病的常见通路,有报道[8]称,通过促进AMPK 表达来抑制NLRP3 炎症小体活化可以改善糖尿病肾病造成的肾损伤。近期还发现,川陈皮素可以通过调控AMPK 途径促进自噬来改善NLRP3 炎症小体介导的炎症,进而对LPS处理的大鼠小胶质细胞起到保护作用[9],故推测川陈皮素可能通过调节AMPK/NLRP3通路对LPS诱导的肾小球系膜细胞损伤起到改善效果。
本研究拟探索川陈皮素是否可以通过调节AMPK/NLRP3通路来缓解LPS诱导的肾小球系膜细胞炎性损伤,以期为糖尿病肾病的治疗提供参考。
1 材料与方法
1.1 药物及试剂 川陈皮素(Nobiletin),纯度≥97%,购自美国Sigma-Aldrich 公司,批号:N1538;AMPK/NLRP3 信号通路抑制剂雷帕霉素、LPS、MTT 细胞毒性以及细胞增殖检测试剂盒、二甲基亚砜(DMSO),购自北京索莱宝生物科技有限公司,批号分别为:R8140、 L8880、 M1020、 D8370; 白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、过氧化氢酶(catalase,CAT)试剂盒,购自伊艾博(武汉)科技股份有限公司,批号分别为:E0563h、U0079h、E0133h、E0242h;谷胱甘肽(glutataione,GSH)试剂盒,购自上海齐源生物科技有限公司,批号:QYS-231068;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、细胞凋亡检测试剂盒,购自北京百奥莱博科技有限公司,批号分别为:SNM203、YT131;兔源一抗AMPK、NLRP3 抗体,购自美国Abcam 公司,批号分别为:ab32047、ab263899。
1.2 主要仪器 Multiskan FC 酶标仪,美国Thermo Fisher 公司;FACSCalibur 流式细胞仪,美国Becton-Dickinson公司。
1.3 细胞培养及分组 大鼠肾小球系膜细胞HBZY-1,购自上海烜雅生物科技有限公司。将购买的HBZY-1细胞接种于DMEM 培养基(10%胎牛血清),置于37 ℃细胞培养箱中培养,分为5组:正常组,DMEM培养基(10%胎牛血清)培养HBZY-1细胞,未做其他任何处理;LPS 组,用100 ng·mL-1的LPS 处理HBZY-1 细胞24 h 后加入DMEM 培养基(10%胎牛血清)24 h[3];川陈皮素组,HBZY-1 细胞在经过100 ng·mL-1的LPS 处理24 h 后加入40 μmol·L-1的川陈皮素24 h[10];雷帕霉素组,HBZY-1 细胞在经过100 ng·mL-1的LPS 处理24 h 后加入0.5 μmol·L-1雷帕霉素24 h[11];川陈皮素+雷帕霉素组,细胞在经过LPS 处理24 h 后,同时加入40 μmol·L-1的川陈皮素和0.5 μmol·L-1雷帕霉素,孵育24 h 后用于后续实验。
1.4 MTT 法检测细胞毒性检测 将HBZY-1 细胞以每孔5×104个细胞的密度接种在96孔板中。培养24 h后,分别用不同浓度的川陈皮素(0、10、20、30、40、50 和60 μmol·L-1)处理HBZY-1 细胞24 h。然后在每个孔中加入25 μL MTT(5 mg·mL-1)溶液,37 ℃培养4 h,再在每孔加入100 μL二甲基亚砜。轻微震荡后,用酶标仪在570 nm处检测吸光度值。
1.5 MTT 法检测细胞增殖 将HBZY-1 细胞以每孔5×104个细胞的密度接种在96 孔板中培养24 h,按“1.3”项下方法处理各组细胞后,向每孔加入20 μL MTT(5 mg·mL-1),并在37 ℃下再孵育4 h。然后小心去除培养基并加入150 μL 二甲基亚砜以溶解结晶颗粒,使用酶标仪在570 nm处测量吸光度值。
1.6 细胞炎性指标、氧化应激检测 按酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书,测定各组细胞IL-1β、IL-6、TNF-α、CAT、SOD、GSH含量。
1.7 流式细胞术检测细胞凋亡 将各组HBZY-1 细胞以800 r·min-1(离心半径10 cm)、4 ℃离心5 min,并用预冷的磷酸盐缓冲液洗涤2 次。用1 mL 1×Binding Buffer 重悬细胞,按照试剂盒说明各组细胞分别加入5 μL Annexin V-FITC 和PI,孵育15 min(室温避光),利用流式细胞仪测定各组细胞凋亡率。
1.8 Western Blot 法检测AMPK/NLRP3 信号通路蛋白水平在RIPA 裂解缓冲液中裂解HBZY-1 细胞。使用蛋白质测定试剂盒进行总蛋白定量。将等体积的蛋白质加载到10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上进行分离,并转移到聚偏二氟乙烯膜,封闭1 h 后,在4 ℃下用AMPK(1∶1 000)、NLRP3(1∶2 000)和GAPDH 抗体(1∶1 000)的一抗处理过夜。然后加入二抗(1∶2 000)室温放置1 h,最后用ECL显色剂使目的条带显色,以ImageJ软件分析目的条带的灰度值。
1.9 统计学处理方法 采用Graphpad Prism 8.0 软件分析,计量资料呈正态分布,以均数±标准差(±s)表示,单因素方差分析和SNK-q检验用于比较多组间差异。P<0.05为差异有统计学意义。
2 结果
2.1 川陈皮素对HBZY-1 细胞的影响 见表1。MTT检测结果显示,0、10、20、30、40、50和60 μmol·L-1的川陈皮素对HBZY-1 细胞OD 值无明显影响(P>0.05),表明0~60 μmol·L-1的川陈皮素对HBZY-1细胞无明显毒性。故选用40 μmol·L-1的川陈皮素进行下一步实验。
表1 川陈皮素对HBZY-1 细胞的影响(±s,n=6)Table 1 Effects of nobiletin on HBZY-1 cells(±s,n=6)

表1 川陈皮素对HBZY-1 细胞的影响(±s,n=6)Table 1 Effects of nobiletin on HBZY-1 cells(±s,n=6)
浓度/(μmol·L-1)0 10 20 30 OD值0.44±0.04 0.45±0.05 0.47±0.06 0.48±0.05浓度/(μmol·L-1)40 50 60 OD值0.46±0.04 0.49±0.07 0.43±0.04
2.2 川陈皮素对LPS 诱导的HBZY-1 细胞增殖的影响见表2。与正常组比较,LPS 组细胞OD 值明显下降(P<0.05);与LPS组比较,川陈皮素组细胞OD 值明显升高(P<0.05),而雷帕霉素组细胞OD值明显下降(P<0.05);与川陈皮素组比较,川陈皮素+雷帕霉素组细胞OD值明显下降(P<0.05)。
表2 川陈皮素对脂多糖(LPS)诱导细胞增殖能力的影响(±s,n=6)Table 2 Effects of nobiletin on LPS-induced cell proliferation(±s,n=6)
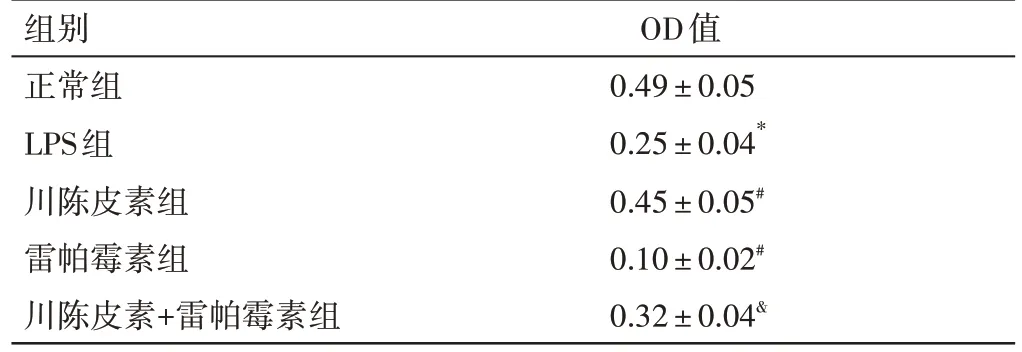
表2 川陈皮素对脂多糖(LPS)诱导细胞增殖能力的影响(±s,n=6)Table 2 Effects of nobiletin on LPS-induced cell proliferation(±s,n=6)
注:与正常组比较,*P<0.05;与LPS 组比较,#P<0.05;与川陈皮素组比较,&P<0.05
组别正常组LPS组川陈皮素组雷帕霉素组川陈皮素+雷帕霉素组OD值0.49±0.05 0.25±0.04*0.45±0.05#0.10±0.02#0.32±0.04&
2.3 川陈皮素对LPS 诱导的HBZY-1 细胞炎性因子的影响见表3。与正常组比较,LPS组IL-1β、IL-6、TNF-α 含量明显增加(P<0.05);与LPS 组比较,川陈皮素组IL-1β、IL-6、TNF-α 含量明显降低(P<0.05),而雷帕霉素组IL-1β、IL-6、TNF-α含量明显升高(P<0.05);与川陈皮素组比较,川陈皮素+雷帕霉素组IL-1β、IL-6、TNF-α含量明显增加(P<0.05)。
表3 川陈皮素对脂多糖(LPS)诱导HBZY-1 细胞炎性因子的影响(±s,n=6)Table 3 Effects of nobiletin on LPS-induced inflammatory factors in HBZY-1 cells(±s,n=6)

表3 川陈皮素对脂多糖(LPS)诱导HBZY-1 细胞炎性因子的影响(±s,n=6)Table 3 Effects of nobiletin on LPS-induced inflammatory factors in HBZY-1 cells(±s,n=6)
注:与正常组比较,*P<0.05;与LPS 组比较,#P<0.05;与川陈皮素组比较,&P<0.05
组别正常组LPS组川陈皮素组雷帕霉素组川陈皮素+雷帕霉素组IL-1β/(pg·mL-1)100.52±13.56 185.63±21.25*119.46±14.46#334.58±41.26#168.34±18.25&IL-6/(pg·mL-1)20.52±2.08 41.71±4.66*24.45±2.79#62.68±6.74#38.41±4.13&TNF-α/(pg·mL-1)40.45±4.05 120.08±13.52*57.78±6.81#239.45±27.91#104.24±11.34&
2.4 川陈皮素对LPS 诱导的HBZY-1 细胞氧化应激的影响见表4。与正常组比较,LPS 组SOD、GSH、CAT 水平明显降低(P<0.05);与LPS 组比较,川陈皮素组SOD、GSH、CAT 水平明显升高(P<0.05),而雷帕霉素组SOD、GSH、CAT 水平明显降低(P<0.05);与川陈皮素组比较,川陈皮素+雷帕霉素组SOD、GSH、CAT水平明显降低(P<0.05)。
表4 川陈皮素对脂多糖(LPS)诱导HBZY-1 细胞氧化应激的影响(±s,n=6)Table 4 Effects of nobiletin on LPS-induced oxidative stress in HBZY-1 cells(±s,n=6)

表4 川陈皮素对脂多糖(LPS)诱导HBZY-1 细胞氧化应激的影响(±s,n=6)Table 4 Effects of nobiletin on LPS-induced oxidative stress in HBZY-1 cells(±s,n=6)
注:与正常组比较,*P<0.05;与LPS 组比较,#P<0.05;与川陈皮素组比较,&P<0.05
组别正常组LPS组川陈皮素组雷帕霉素组川陈皮素+雷帕霉素组SOD/(U·mL-1)345.24±34.65 278.76±28.76*340.97±33.65#215.43±22.45#279.98±27.92&GSH/(mg·mL-1)15.34±1.52 12.76±1.34*15.08±1.50#9.32±1.32#12.93±1.39&CAT/(μmol·L-1)5.71±0.53 3.70±0.36*5.35±0.54#1.64±0.16#3.85±0.38&
2.5 川陈皮素对LPS 诱导的HBZY-1 细胞凋亡的影响见表5。与正常组比较,LPS 组细胞凋亡率明显升高(P<0.05);与LPS 组比较,川陈皮素组凋亡率明显下降(P<0.05),而雷帕霉素组凋亡率明显升高(P<0.05);与川陈皮素组比较,川陈皮素+雷帕霉素组凋亡率明显上升(P<0.05)。
表5 川陈皮素对脂多糖(LPS)诱导细胞凋亡的影响(±s,n=6)Table 5 Effects of nobiletin on LPS-induced apoptosis(± s,n=6)
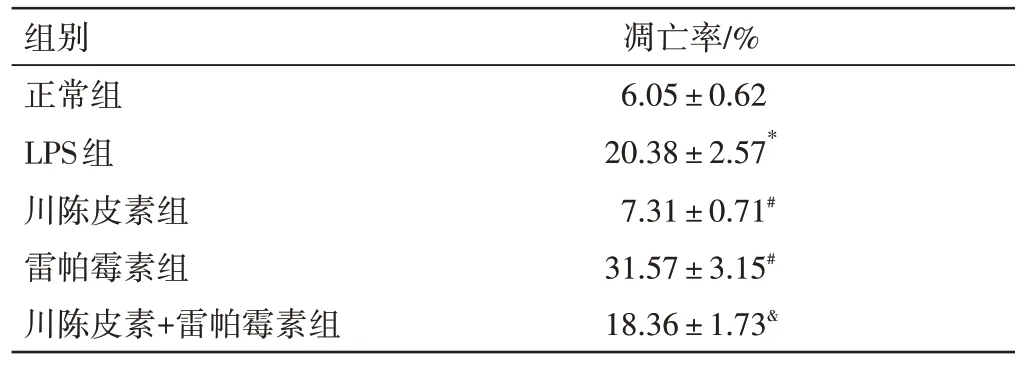
表5 川陈皮素对脂多糖(LPS)诱导细胞凋亡的影响(±s,n=6)Table 5 Effects of nobiletin on LPS-induced apoptosis(± s,n=6)
注:与正常组比较,*P<0.05;与LPS 组比较,#P<0.05;与川陈皮素组比较,&P<0.05
组别正常组LPS组川陈皮素组雷帕霉素组川陈皮素+雷帕霉素组凋亡率/%6.05±0.62 20.38±2.57*7.31±0.71#31.57±3.15#18.36±1.73&
2.6 川陈皮素对LPS 诱导的HBZY-1 细胞AMPK/NLRP3 通路的影响 见图1、表6。与正常组比较,LPS 组AMPK 蛋白水平明显下调(P<0.05),NLRP3蛋白水平明显上调(P<0.05)。与LPS 组比较,川陈皮素组AMPK 蛋白水平明显上调(P<0.05),NLRP3蛋白水平明显下调(P<0.05);而雷帕霉素组AMPK蛋白水平明显下调(P<0.05),NLRP3 蛋白水平明显上调(P<0.05)。与川陈皮素组比较,川陈皮素+雷帕霉素组AMPK 蛋白水平明显下调(P<0.05),NLRP3蛋白水平明显上调(P<0.05)。
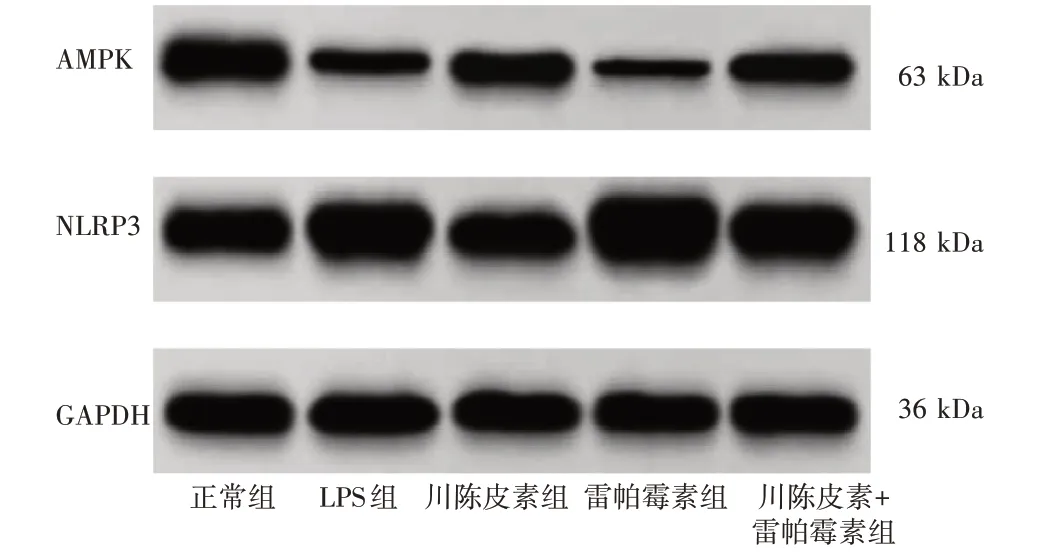
图1 Western Blot 法检测AMPK/NLRP3 通路相关蛋白表达Figure 1 Western Blot analysis of AMPK / NLRP3 pathway related protein expression
表6 川陈皮素对脂多糖(LPS)诱导HBZY-1 细胞AMPK/NLRP3 通路的影响(±s,n=6)Table 6 Effect of nobiletin on AMPK/NLRP3 pathway in LPSinduced HBZY-1 cells(±s,n=6)
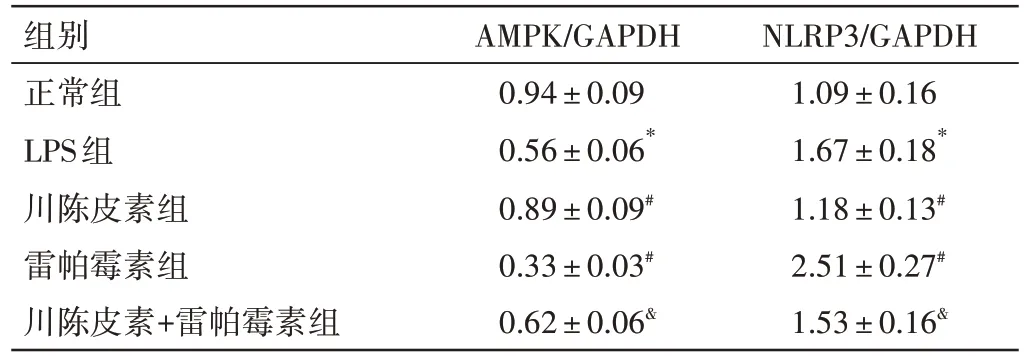
表6 川陈皮素对脂多糖(LPS)诱导HBZY-1 细胞AMPK/NLRP3 通路的影响(±s,n=6)Table 6 Effect of nobiletin on AMPK/NLRP3 pathway in LPSinduced HBZY-1 cells(±s,n=6)
注:与正常组比较,*P<0.05;与LPS 组比较,#P<0.05;与川陈皮素组比较,&P<0.05
组别正常组LPS组川陈皮素组雷帕霉素组川陈皮素+雷帕霉素组AMPK/GAPDH 0.94±0.09 0.56±0.06*0.89±0.09#0.33±0.03#0.62±0.06&NLRP3/GAPDH 1.09±0.16 1.67±0.18*1.18±0.13#2.51±0.27#1.53±0.16&
3 讨论
糖尿病因其发病率迅速上升和巨大的经济负担,已成为世界范围内公认的严重公共卫生问题。2019 年,全球糖尿病患病率约为9.3%(4.63 亿成年人),预计到2030 年上升至10.2%(5.78 亿)[12]。约30%~40%的糖尿病患者患有糖尿病肾病,糖尿病肾病是糖尿病最严重的微血管并发症之一。糖尿病肾病还是终末期肾脏疾病的主要原因,并被认为是一种慢性炎症性疾病[13]。尽管关于糖尿病肾病的研究已有大量报道,但糖尿病肾病的确切发病机制尚未得到充分解释。由于LPS诱导的肾小球系膜细胞病理变化与糖尿病肾病的病理特征相似,因此,LPS诱导的肾小球系膜细胞常用于体外模拟糖尿病肾病。川陈皮素是从柑橘类植物中分离出来的多甲氧基类黄酮,有抗炎和抗糖尿病的作用[14]。有报道[15]称,川陈皮素可改善葡萄糖代谢并减少与妊娠糖尿病相关的炎症,并且可能是预防妊娠糖尿病的新型疗法。有报道[5]称,川陈皮素可能抑制炎症反应以及氧化应激改善链脲佐菌素-镉诱导的大鼠糖尿病肾病。以上研究提示川陈皮素可能通过抑制炎症反应对糖尿病以及糖尿病并发症(例如糖尿病肾病)起到积极影响。本研究用不同浓度0~60 μmol·L-1的川陈皮素处理HBZY-1细胞,结果发现,0~60 μmol·L-1的川陈皮素对HBZY-1 细胞无明显毒性。我们参考有关研究[3]用100 ng·mL-1的LPS 处理HBZY-1 细胞,结果发现,HBZY-1 细胞的OD 值明显降低,而川陈皮素处理LPS诱导的HBZY-1细胞后,HBZY-1细胞OD值明显升高,说明川陈皮素可能对LPS 诱导的HBZY-1细胞生长起到促进作用。
氧化应激和炎症在糖尿病肾病的发展中起着至关重要的作用,可以通过缓解氧化应激和炎症来治疗糖尿病肾病[16]。有研究报道称,高血糖会引起ROS的过量产生,导致氧化应激,氧化应激引起一系列代谢和细胞紊乱,包括脂质过氧化、蛋白质氧化和DNA损伤,最终导致肾细胞凋亡[17];此外,氧化应激还可以通过刺激相关生长因子、细胞因子和转录因子的产生来促进炎症反应,加重肾损伤[18]。SOD 催化O2-转化为H2O2,H2O2可以在CAT 或GPX 催化的反应中进一步还原为H2O 从而抑制ROS 的产生[19],而涉及GPX 的反应需要GSH 的氧化[20]。因此,SOD、CAT、GSH 可以直接或间接地反映机体抗氧化水平。炎症反应通常由氧化应激和ROS 介导,炎症介质参与或诱导炎症反应发生,IL-6、IL-1β和TNF-α是糖尿病肾病发生的关键促炎因子,抑制IL-1β、IL-6、TNF-α的释放可以抑制糖尿病肾病进展[21]。本研究发现,LPS 处理后HBZY-1 细胞CAT、SOD、GSH 水平明显降低,细胞凋亡率、IL-1β、IL-6、TNF-α 含量明显升高,表明LPS 处理HBZY-1细胞诱导其发生氧化应激,进而促进其细胞凋亡以及炎症的发生。川陈皮素处理LPS 诱导的HBZY-1 细胞后,HBZY-1 细胞CAT、SOD、GSH水平明显升高,细胞凋亡率、IL-1β、IL-6、TNF-α 含量明显降低,表明川陈皮素可抑制LPS 诱导的HBZY-1 细胞氧化应激、炎症以及细胞凋亡。
AMPK/NLRP3 信号通路是广泛研究的炎症通路,上调AMPK/NLRP3 信号传导可以减轻糖基化终产物诱导的人脐静脉内皮细胞炎症和氧化应激损伤[22]。Hou等[23]也发现,增加AMPK活性,同时抑制NLRP3蛋白水平可以减轻糖尿病肾小管上皮细胞氧化应激损伤,进而改善小鼠糖尿病肾病。本研究结果显示,LPS 处理后,HBZY-1 细胞AMPK 蛋白低表达,NLRP3 蛋白高表达;而川陈皮素处理LPS 诱导的HBZY-1 细胞后,HBZY-1 细胞AMPK 蛋白水平明显升高,NLRP3 蛋白水平明显降低,提示川陈皮素可能是通过激活AMPK/NLRP3 信号通路减轻氧化应激和炎性损伤,进而对LPS 诱导的HBZY-1细胞起到改善作用。为了进一步证实川陈皮素可能是通过激活AMPK/NLRP3 信号通路来发挥作用,我们在HBZY-1细胞经过LPS 处理后,同时加入川陈皮素和AMPK/NLRP3 信号通路抑制剂雷帕霉素,结果发现,雷帕霉素与川陈皮素的作用效果相反,雷帕霉素消除了川陈皮素对LPS诱导的HBZY-1细胞的保护作用。
综上所述,川陈皮素可能通过促进AMPK 的表达来抑制NLRP3表达,从而改善LPS诱导的HBZY-1细胞氧化应激损伤、炎性损伤以及细胞凋亡,今后可通过体内实验进行进一步研究。另外,川陈皮素是否可以通过上调AMPK/NLRP3 信号通路缓解其他肾病,仍需进一步探究。
