24孔板法诱变选育高产红曲黄色素菌株
2015-04-24岳建明王成涛文雁君
杨 强,岳建明,王成涛,*,文雁君
(1.北京工商大学,北京市食品添加剂工程技术研究中心,北京100048;2.北京工商大学,食品质量与安全北京实验室,北京100048;3.河南中大生物工程有限公司,河南郑州451162)
生物工程
24孔板法诱变选育高产红曲黄色素菌株
杨 强1,2,岳建明1,王成涛1,2,*,文雁君3
(1.北京工商大学,北京市食品添加剂工程技术研究中心,北京100048;2.北京工商大学,食品质量与安全北京实验室,北京100048;3.河南中大生物工程有限公司,河南郑州451162)
以红曲霉F9-2为出发菌株,24孔板培养法结合紫外线-氯化锂复合诱变处理选育高产红曲黄色素菌株。实验结果表明:在紫外照射130 s、氯化锂添加浓度为0.1%的复合诱变条件下得到的菌株Y16,经液态发酵后产黄色素高达488 U/mL,与出发菌相比,黄色素色价提高了37.1%。经10次传代培养,色价稳定,可作为生产红曲黄色素的优良菌株。
红曲霉,24孔板,复合诱变,红曲黄色素
红曲作为我国传统的药食两用产品,尤其是红曲色素作为天然食品着色剂其应用历史已达数千年之久。如今,食品安全问题日益受到人们的关注,对于红曲色素的研究也更加具有意义和实际价值[1]。红曲色素主要包括三类复合色素:红曲红色素、红曲黄色素和红曲橙色素[2-4]。目前的红曲色素产品中以红色素居多,黄色素在红曲混合色素中的含量较低。黄色素作为一类主要的食用色素品种,其色泽鲜亮,容易引起人的食欲与购买欲,通常占市场需求量的50%以上,因此研究及开发红曲黄色素具有很高的实际应用价值与商业推广价值[5]。
通过理化诱变选育高产红曲黄色素菌株,是我国红曲色素生产企业提升色素产量的重要途径之一。理化诱变选育菌种操作简便,且选育出的红曲霉遗传性状稳定[6]。目前理化诱变选育高产红曲色素的方法很多,国内外选育高产红曲色素菌株主要利用紫外、超声、微波、60Co-γ、氯化锂、双氧水、亚硝基胍、硫酸二乙酯等方法,而我国采用上述诱变方法得到的红曲霉液态发酵产红曲黄色素色价均处于偏低水平[7-11]。泰国的Yongsmith等[12]一直致力于选育高产红曲黄色素菌株,液态发酵色价不高,但固态发酵红曲米中黄色素色价可达2224 U/g。虽然诱变育种存在许多优势,但是其随机性、盲目性问题突出,且存在耗时、劳动强度大等缺点[13]。由于红曲霉产黄色素色价普遍偏低,很难实现工业化,为提高红曲黄色素的液态发酵色价,选育优良菌株尤为重要。本文采用24孔板高通量法辅助诱变筛选红曲黄色素高产菌株,与传统摇瓶筛选方法比较,24孔板法减少了仪器的使用、降低了工作量且提升了筛选速度,对今后其他菌株的诱变选育具有重要参考意义。以实验室筛得的紫红红曲霉菌株F9-2作为出发菌,利用紫外-氯化锂复合诱变选育高产红曲黄色素菌株,以期为红曲黄色素的工业化生产提供优良菌株。
1 材料与方法
1.1 材料与仪器
紫红红曲霉(Monacus purpureus) 编号F9-2,本实验室筛得并保存;无水氯化锂、乳酸、无水乙醇、麦芽浸粉、琼脂、葡萄糖、蛋白胨、酵母提取物、磷酸二氢钾、硝酸钠、硫酸镁、豆粕粉、玉米浆 国药集团化学试剂有限公司,分析纯;大米粉 中粮米业有限公司,食用级;基础培养基 麦芽浸粉2%,琼脂2%,葡萄糖0.5%,蛋白胨0.1%,pH自然(诱变培养基为在此配方基础上添加LiCl),121℃下灭菌20 min;扩大培养基 葡萄糖2%,蛋白胨0.3%,酵母提取物0.4%,麦芽浸粉2%,琼脂2%,KH2PO40.2%,NaNO30.2%,MgSO40.1%,pH自然,121℃下灭菌20 min;种子培养基 大米粉4%,蛋白胨0.8%,豆粕粉0.5%,KH2PO40.2%,NaNO30.2%,MgSO40.1%,乳酸调节pH4.0,装液量50 mL/250 mL,121℃下灭菌20 min;发酵培养基 大米粉7.7%,葡萄糖7.5%,豆粕粉0.2%,KH2PO40.05%,NaNO30.18%,MgSO40.1%,玉米浆0.35%,乳酸调节pH4.0,装液量50 mL/250 mL,121℃下灭菌20 min。
DL-CJ-1NDII型单人单面洁净工作台 北京东联哈尔仪器制造有限公司;BSA224S型电子天平 塞多利斯科学仪器(北京)有限公司;HZQ-F160型全温振荡培养箱 太仓市实验设备厂;TGL-10C型高速台式离心机 上海安亭科学仪器厂;PHS-3D型pH计 上海三信仪表厂;UV-2450型紫外可见分光光度计 日本岛津公司;DHG-9145型电热恒温鼓风干燥箱 上海一恒科技有限公司;HJ-1型磁力加热搅拌器 国华仪器厂;24方形深孔板 北京半夏科技发展有限公司;Synergy H1型全功能酶标仪 美国伯腾公司。
1.2 实验方法
1.2.1 出发菌株的活化 将红曲霉菌株F9-2接种于扩大培养基试管斜面,30℃培养7 d进行活化。
1.2.2 孢子悬液的制备 菌株斜面30℃培养7 d后,用10 mL 0.85%的无菌生理盐水冲洗斜面孢子,孢子液倒入含玻璃珠的三角瓶中200 r/min振荡1 h,待孢子充分散开,用无菌擦镜纸滤除菌丝,制成孢子悬液,最后将孢子浓度稀释为1×106个/mL左右。
1.2.3 红曲色价的测定 取3 mL发酵液加入27 mL 70%乙醇溶液中,恒温水浴锅60℃浸提2 h,4000 r/min离心10 min后取上清液稀释2000倍后,用分光光度计测定410 nm处吸光值[14]。
红曲色素的色价(U/mL)=吸光值×稀释倍数
1.2.4 紫外线诱变 将带有转子的玻璃平皿置于磁力搅拌器上,调整玻璃平皿距离紫外灯20 cm左右,倒入10 mL浓度为1×106个/mL左右的孢子悬液。于黑暗环境下照射10、30、50、70、90、110、130、150 s后,分别吸取0.1 mL孢子悬液涂布于平板培养基中,每一个梯度处理3个重复,30℃恒温培养箱倒置培养5 d,以未经紫外线照射的原始孢子液为空白对照,读取菌落个数,计算致死率,确定最优紫外照射时间。
致死率(%)=(空白平板上的菌落数-诱变培养基上的菌落数)/空白平板上的菌落数×100
1.2.5 氯化锂诱变 分别配制氯化锂浓度为0.05%、0.075%、0.1%、0.125%、0.15%、0.175%、0.2%的基础培养基,孢子悬液经紫外照射130 s后接种于不同浓度氯化锂的培养基中,每一个梯度处理做3个重复,30℃恒温培养箱倒置培养5 d,以紫外照射孢子为空白对照,读取菌落个数,计算致死率,确定最优氯化锂诱变浓度。
致死率(%)=(空白平板上的菌落数-诱变培养基上的菌落数)/空白平板上的菌落数×100
1.2.6 紫外-氯化锂复合诱变 首先按1.2.4实验中得到的紫外线诱变最佳照射时间诱变照射孢子悬液,然后在1.2.5实验结果确定的最佳氯化锂浓度培养基平板上涂布培养。
1.2.7 初筛 经过紫外-氯化锂复合诱变后的菌种于30℃恒温培养箱中倒置培养5 d,选取菌落直径大且颜色较深的单菌落,挑取菌丝后接入装有1 mL/孔种子培养基的24孔板中(每孔放一个灭菌的玻璃珠),33℃、220 r/min培养42 h。将培养好的种子按9%接种量接入装有1 mL/孔发酵培养基的24孔板中(每孔放一个灭菌的玻璃珠),33℃、220 r/min培养60 h。
培养完成后,用移液枪从24孔板中吸取0.1 mL发酵液,加入装有0.9 mL 70%乙醇溶液的离心管中,混匀,静置15~20 min后,于3000 r/min离心5 min;取上清液,加到96孔板中,每孔200 μL。用酶标仪测定全波长下的吸光度,计算色价值后,选取色价高的菌株进行液体摇瓶复筛。
1.2.8 复筛 从扩培后的初筛菌种平板培养基中挑取2~3环,接种于种子培养基中(装液量50 mL/250 mL),于33℃、200 r/min条件下振荡培养2 d。再按照6%的接种量接种于发酵培养基中(装液量50 mL/250 mL),于33℃、200 r/min条件下振荡培养7 d。发酵完成后按照1.2.3的方法测定410 nm吸光值,换算成色价值。与出发菌株的产黄色价值进行比较,选取色价高于出发菌株的诱变菌斜面低温保存。
1.2.9 诱变株的稳定性实验 将经1.2.8复筛所得的红曲霉菌株在平板基础培养基上传代10次,分别测定每代发酵产红曲黄色素色价值,观察其产色素能力是否稳定。
1.2.10 数据处理 采用软件SPSS 17.0对复筛数据进行统计分析。
2 结果与讨论
2.1 紫外线诱变剂量的确定
出发菌红曲霉F9-2的孢子悬液经紫外灯照射不同时间的致死率曲线如图1所示。通常紫外灯照射诱变的致死率在20%~90%之间的正突变几率较高,且突变后菌种遗传物质稳定[15]。由图1可知随着紫外照射时间的延长,致死率逐渐增加。当紫外照射时间为130 s时,致死率达到80.4%。照射150 s,致死率已达到95.4%。因此本实验选用致死率为80%左右的130 s为紫外最佳诱变剂量。
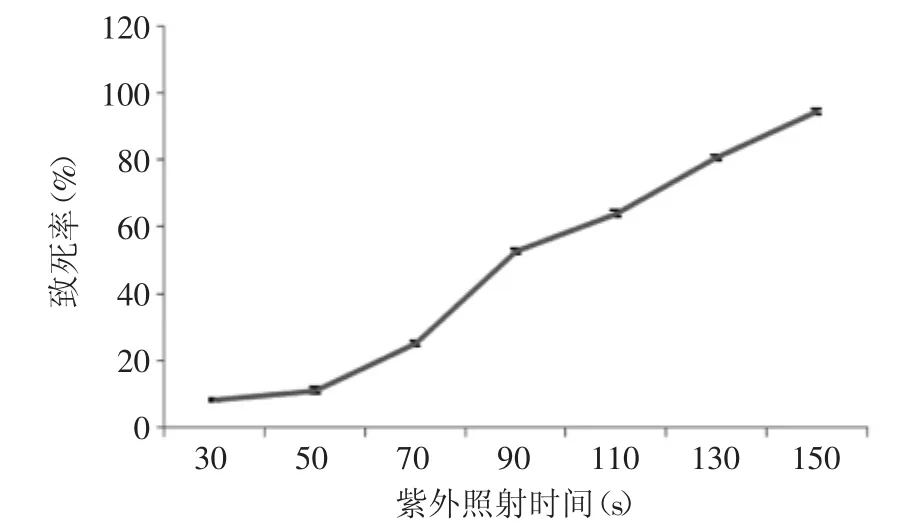
图1 紫外致死曲线Fig.1 The lethality curve of UV
2.2 氯化锂诱变剂量的确定
出发菌红曲霉F9-2的孢子悬液经最佳紫外照射剂量处理后,于不同浓度氯化锂培养基中涂布后黑暗倒置培养,得到氯化锂浓度诱变致死率曲线如图2所示。随着氯化锂浓度的增加,致死率逐渐增加。当氯化锂浓度为0.1%时,致死率为80.6%;当氯化锂浓度为0.125%~0.175%时,致死率为87.8%~97.6%;当氯化锂浓度为0.2%时,致死率已达到100%。因此本实验采用致死率为80%左右的氯化锂浓度0.1%为最佳诱变剂量。

图2 氯化锂致死曲线Fig.2 Lethality curve of LiCl
2.3 紫外、氯化锂复合诱变处理
孢子悬液经紫外线照射130 s后涂布于含0.1%氯化锂的平板培养基上复合诱变培养,共诱变处理20批次,得到突变子419株。选取直径大且颜色较深的菌株,按照1.2.8的方法培养后测定诱变株的色价。其中148孔无生长,199孔吸光值过低,其余72株与出发菌株F9-2的产黄色素能力进行比较,结果如图3所示。
由图3可知,72个突变株中有12株的黄色素色价高于出发菌株F9-2(横向直线所示),其中Y16的孔板发酵液色价值最高,达到了44.8 U/mL,比出发菌高出了27.1%。这12株产黄色素高的菌株进行液体摇瓶复筛,按照1.2.3的红曲色素色价测定方法计算,最终所得结果如图4所示。

图3 复合诱变突变菌产色素情况Fig.3 Monascus pigment production of compound mutagenesis mutant

图4 复合诱变结果Fig.4 Results of combined mutagenesis
由图4可知,紫外诱变和氯化锂诱变复合使用,其诱变效果非常明显。与图4中出发菌株红曲霉F9-2的产黄色价相比,复合诱变得到的12株突变菌株有8株菌的产黄色能力高于原始菌株。其中突变株Y1、Y16、Y31的产红曲黄色素能力经t检验显著性分析结果均为极显著(p<0.01),Y1、Y31较出发菌的产黄色素能力分别提高了30.6%和29.5%。Y16的产黄色素能力提高最多,与出发菌红曲霉F9-2相比,其所产黄色素色价提高了37.1%。周波等[16]利用物理化学法诱变选育的高产红曲黄色素菌株虽然黄色素色调高达3.5左右,但红曲黄色素的最高色价仅为140 U/mL左右。

表1 突变株遗传稳定性实验Table 1 Genetic stability of mutants
2.4 突变株的遗传稳定性
对本实验获得的产黄色素较高的3株突变株Y1、Y16、Y31进行传代稳定性考察。将突变菌株分别在基础培养基平板上连续传10代后,摇瓶发酵考察产红曲黄色素的稳定性,结果见表1。
由表1结果可知,突变菌株Y31产黄色素的能力在传代过程中出现比较明显的衰退,菌株Y1和Y16在传代过程中,产黄色素能力则基本稳定,这表明复合诱变得到的突变菌株Y1和Y16菌株具有较好的遗传稳定性。比较Y1和Y16可知,Y16的产红曲黄色素能力最强且最为稳定,经过10代的传代培养,其产黄色素色价值基本稳定在486 U/mL左右。相较于传代3次~6次的稳定性实验,本实验所得突变菌经过10次传代培养,其产红曲黄色素色价稳定性得到很好的验证。
3 结论
本文采用24孔板法辅助紫外-氯化锂复合诱变筛选高产红曲黄色素菌株。确定了最佳紫外照射时间为130 s,最佳氯化锂添加浓度为0.1%。紫外-氯化锂复合诱变得到的诱变效果非常明显,证明复合诱变对于红曲霉产黄色素的提高有显著的作用。复合诱变筛选出一株高产红曲黄色素菌株Y16,产红曲黄色素色价高达488 U/mL,较原始菌株提高了37.1%。经10次传代培养,证明其传代稳定性良好,属于高产菌。本实验得到高产红曲黄色素为理化诱变突变菌,还需对该菌进行培养基及发酵工艺的进一步优化研究,以便为今后的工业化生产所用。
[1]殷军帅.红曲色素和功能性红曲的菌种选育和生产工艺的优化[D].泰安:山东农业大学,2012.
[2]Kang B,Zhang X H,Wu Z Q,et al.Production of citrininfree Monascus pigments by submerged culture at low pH[J]. Enzyme and Microbial Technology,2014(55):50-57.
[3]万里.红色红曲菌M-7紫外诱变突变子特征分析[D].武汉:华中农业大学,2008.
[4]朱雷.红曲色素合成机理及红曲霉混合培养的初步研究[D].合肥:安徽农业大学,2006.
[5]程哲灏.红曲黄色素固态发酵的研究[D].广州:华南理工大学,2010.
[6]石文娟,谭俊,储炬,等.红曲色素高产菌株的高通量选育[J].中国酿造,2012,31(7):25-28.
[7]Hu W X,Wei Y F,Jiang X L,et al.Mutagenic breeding of high-yield monacolin k strains of Monascus sp.and process optimization itssubmerged fermentation[J].Food and Feed Chemistry,2013,34(24):296-301.
[8]Xu W,Fan Z C,Liu Y H.Mutation breeding of Monascus purpureus with high productivity of orange pigments by microwave irradiation[J].Food and Feed Chemistry,2010,31(23):224-227.
[9]陈义光,张晓蓉,张丽,等.高产红曲色素菌株的复合诱变选育[J].长江大学学报,2005,2(8):69-71.
[10]Jing W W,Zhou L H,Chen C L.Mutation breeding of high red pigment producing Monascus strains[J].Fermentation and Bioindustrial Chemistry,2008,(23):32-34.
[11]方春玉,周健,邓静,等.高产红曲色素的紫红红曲霉诱变育种技术研究[J].中国酿造,2008,(23):19-21,31.
[12]Yongsmith B,Thongpadis P,Klinsupa W,et al.Fermentation and quality of yellow pigments from golden brown rice solid culture by a selected Monascus mutant[J].ApplMicrobiol Biotechnol,2013(97):8895-8902.
[13]石文娟.红曲色素高产菌株的高通量选育[D].上海:华东理工大学,2012.
[14]张婵,杨强,张桦林,等.超声辅助法优化提取红曲红、红曲黄色素[J].食品与生物技术学报,2014(8):805-813.
[15]刘芳宁,梁琪,乔海军,等.紫外线与氯化锂诱变选育高产乳糖酶米曲霉[J].食品工业科技,2013(1):155-159.
[16]周波,王菊芳,吴振强,等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,35(12):1901-1914.
Breeding of Monascus with high-yield yellow pigment by 24 well-plate assay combining with mutation
YANG Qiang1,2,YUE Jian-ming1,WANG Cheng-tao1,2,*,WEN Yan-jun3
(1.Beijing Engineering and Technology Research Center of Food Additives,Beijing Technology and Business University,Beijing 100048,China;2.Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China;3.Henan Zhongda Biological Engineering Co.,Ltd.,Zhengzhou 451162,China)
Monascus F9-2 was used as the original strain;then the high-yield yellow pigment of Monascus Y16 strain was obtained by UV(130 s)and LiCl(0.1%)complex mutation combining with the 24 well-plate assay. The results showed that the yellow pigment value of Monascus Y16 could reach 488 U/mL and the value was 37.1%higher than the starting strain.The stable genotype was verified through ten times of transferring of culture and was hence a fine strain for producing high-yield yellow pigment.
Monascus;24 well-plate;complex mutation;Monascus yellow pigment
TS201.3
A
1002-0306(2015)22-0156-04
10.13386/j.issn1002-0306.2015.22.024
2015-03-19
杨强(1990-),女,硕士,助理实验师,研究方向:食品微生物与发酵技术,E-mail:yq_0314@126.com。
*通讯作者:王成涛(1969-),男,博士,教授,研究方向:食品生物技术,E-mail:wct5566@163.com。
国家自然科学基金青年基金项目(31401669,31301411);北京市科技计划项目(Z151100001215008);北京市科技计划项目和北京市属高等学校食品科学创新团队项目(IDHT20130506)。
