CCK-8对足底电击诱导的吗啡CPP重燃的影响
2015-04-21孙东磊臧国庆闫玉仙马春玲
贾 慧,刘 涛,文 迪,孙东磊,臧国庆,于 峰,闫玉仙,马春玲
(1.武警后勤学院,天津 300309;2.河北医科大学基础医学院法医学系,河北省法医学重点实验室,河北石家庄 050017;3.云南省第二人民医院急诊内科,云南昆明 650021)
CCK-8对足底电击诱导的吗啡CPP重燃的影响
贾慧1,2,刘涛3,文迪2,孙东磊2,臧国庆2,于峰2,闫玉仙1,马春玲2
(1.武警后勤学院,天津300309;2.河北医科大学基础医学院法医学系,河北省法医学重点实验室,河北石家庄050017;3.云南省第二人民医院急诊内科,云南昆明650021)
摘要:目的建立吗啡条件性位置偏爱(CPP)模型,观察不同剂量的外源性CCK-8对足底电击诱导的吗啡CPP重燃的影响,并探讨其相关机制。方法建立足底电击诱导的吗啡CPP重燃模型,在CPP重燃前给予侧脑室注射CCK-8(0.1、1 μg),以观察外源性CCK-8对足底电击诱导吗啡CPP重燃的影响。另外,CPP重燃前共同给予侧脑室注射CCK-8和CCK受体拮抗剂(CCK1受体拮抗剂L-364,718、CCK2受体拮抗剂L-365,260)、CCK-8和阿片受体拮抗剂(非选择性阿片受体拮抗剂纳洛酮、高选择性μ阿片受体拮抗剂CTAP),以探讨CCK-8抑制足底电击诱导吗啡CPP重燃的相关机制。结果①足底电击成功重燃CPP的表达,并且0.1和1 μg CCK-8有效抑制了CPP重燃过程。②CCK1受体拮抗剂L-364,718和阿片受体拮抗剂纳洛酮、CTAP均可阻断CCK-8对足底电击诱导吗啡CPP重燃的抑制作用。结论CCK-8可以通过CCK1受体抑制足底电击诱导的吗啡CPP重燃,并且这种作用与阿片受体相关。
关键词:吗啡;八肽胆囊收缩素;胆囊收缩素受体;复吸;条件性位置偏爱;内源性阿片肽
阿片依赖是一种慢性复发性脑病,以强迫用药、停药后出现戒断综合症和复吸等为主要特征[1]。最近研究认为,许多非阿片受体作用系统可能是阿片依赖防治中的重要靶点。胆囊收缩素(cholecystokinin,CCK)是一种典型的神经肽,广泛存在于中枢和周围神经系统,发挥多种生物学功能[2]。本室以往研究发现,侧脑室给予不同剂量的CCK-8干预可减轻纳洛酮引起的急性催促戒断症状[3]、抑制吗啡诱导大鼠条件性位置偏爱(conditoned place preference,CPP)的形成[4],但是其对应激等因素诱导CPP重燃过程的作用尚不明确。本研究将建立足底电击诱导的吗啡CPP重燃实验模型,观察不同剂量CCK-8对足底电击诱导吗啡CPP重燃的作用,并探讨其相关机制。
1 材料与方法
1.1药品和试剂盐酸吗啡(morphine hydrochloride)为沈阳第一制药厂产品;八肽胆囊收缩素(cholecystokinin,CCK-8)、纳洛酮(naloxone)和CTAP (D-Phe-Cys-Tyr-D-Trp-Arg-Thr-Pen-Thr-NH2)均购自美国Sigma公司,CCK1受体拮抗剂组L-364,718和CCK2受体拮抗剂组L-365,260购自英国Tocris公司。
1.2动物清洁级健康♂Wistar大鼠,体质量190~210 g,由河北省实验动物中心提供。实验前适应性饲养1周,室温(22±1)℃,湿度50%,自然昼夜循环非直接光照条件生活,自由摄食、饮水。
1.3大鼠脑立体定位及脑室注射首先用40 mg ·kg-1戊巴比妥钠腹腔注射麻醉大鼠,而后将其固定在大鼠脑立体定位仪上,核团定位以前囟为参照零点,确定一侧核团的位置后,用微型牙科钻打孔,将微量注射套管(外径0.6 mm,内径0.4 mm)插入脑内(AP-1.67; ML+ 0.92; DV-3.10),并用牙科水泥将其固定于颅骨表面。手术完毕后预防性给予抗生素3 d。注射时插入内注射管(外径0.4 mm,内径0.25 mm),连接PE管和微量注射器进行注射。手术后大鼠单笼饲养7 d后开始实验,侧脑室注射体积2 μL,注射速度0.5 μL·min-1,注射完后留针5 min。实验完毕后通过套管注射1 μL 0.1%台盼蓝,观察脑室是否蓝染,剔除定位不准确动物的数据。
1.4大鼠条件性位置偏爱
1.4.1大鼠条件性位置偏爱测试系统大鼠条件性位置偏爱测试系统为上海吉量科技有限公司产品,包括条件位置偏爱测试箱、视频接收系统及计算机数据采集系统。测试箱由大小相同的两个箱体(内径:长×宽×高,30 cm×30 cm×40 cm)和一个中间箱(内径:长×宽×高,8 cm×30 cm×40 cm)组成。实验环境要求隔音、隔光,充分排除外界因素对实验动物的干扰。
1.4.2条件位置偏爱分(CPP score)记录15 min内动物在两箱的活动时间,条件位置偏爱分为两箱活动时间之差。
1.4.3吗啡诱导CPP的建立(无偏设计,见Fig 1A)第1阶段(d 1) :预适应期。使动物适应偏爱箱两次(8:00和16:00),每次15 min,剔除偏爱分大于150 s的动物。将符合条件的动物按随机对照及对等平衡的原则进行分组,保证每组10~12只动物,平均分配至左、右两箱作为偏爱侧进行训练。第2阶段(d 2~8) :形成期,共7 d。动物每天接受两次训练任务,间隔6 h。给予皮下注射10 mg·kg-1吗啡后放入偏爱箱,关闭偏爱箱的隔门,每次训练45 min。具体程序: d 1上午为伴药训练,下午为非伴药训练; d 2上午非伴药训练,下午为伴药训练,依此类推。第3阶段(d 9) :表达期。训练结束后d 2 8:00进行CPP测试,记录并计算CPP得分。第4阶段(d 10~20) :消退期。大鼠不给任何药物处理(自然熄灭),每5天进行1次测试观察位置偏爱是否消失,约需10d。第5阶段(d 21) :重燃期(复吸)。各组大鼠均给予足底电击(强度:0.5 mA,每次0.5 s,间隔40 s) 15min后,再次记录15 min内大鼠在左右两箱的停留时间,观察CPP效应是否重建。
1.5实验设计及分组
1.5.1足底电击诱导的CPP重燃模型的建立实验分为盐水对照组和吗啡组。大鼠均按“1.4.3”中程序给药及训练,在条件性训练期,吗啡组给予皮下注射10 mg·kg-1吗啡后进行条件化训练,盐水组注射等体积生理盐水。重燃期给予足底电击后进行CPP测试,记录并计算CPP得分。
1.5.2外源性CCK-8对足底电击诱导吗啡CPP重燃的影响按“1.4.3”第1~4阶段程序给药及训练,在条件性训练期所有大鼠均给予皮下注射10 mg·kg-1吗啡后训练。表达测试时不给予任何药物放入偏爱箱,打开隔门,测试15 min内在左、右两箱的停留时间,按照CPP得分随机分组分为吗啡+盐水组、吗啡+不同剂量(0.1、1 μg) CCK-8组。第5阶段重燃前各组大鼠分别侧脑室注射盐水(2 μL) 或CCK-8(0.1、1 μg) 15 min之后,立即给予足底电击,完成后立即放入偏爱箱,记录并计算CPP得分。

Fig 1 Model establishment of morphine-induced conditioned place preference (CPP)
1.5.3CCK-8抑制足底电击诱导的吗啡CPP重燃的受体机制实验分为吗啡+ CCK-8(1 μg)+ DMSO组、吗啡+ CCK-8+ CCK1受体拮抗剂(L-364,718,10 μg)组、吗啡+ CCK-8+ CCK2受体拮抗剂(L-365,260,10 μg)组,在CPP复燃测试前15 min侧脑室共同给予CCK-8及CCK受体拮抗剂,以探讨CCK-8抑制足底电击诱导的吗啡CPP重燃的受体机制;同时设置吗啡+ CCK1受体拮抗剂组、吗啡+ CCK2受体拮抗剂组,测试前15 min单独给予CCK受体拮抗剂,以观察CCK受体拮抗剂本身对足底电击诱导的吗啡CPP重燃的影响。
1.5.4CCK-8通过上调内源性阿片肽抑制足底电击诱导的CPP重燃实验分为吗啡+ CCK-8(1 μg)+盐水组、吗啡+ CCK-8+纳洛酮(5 μg)组、吗啡+ CCK-8+ CTAP (10 μg)组,在CPP复燃测试前15min侧脑室共同给予CCK-8及非选择性阿片受体拮抗剂纳洛酮或高选择性μ阿片受体拮抗剂CTAP进行干预,以探讨CCK-8是否可以通过上调内源性阿片肽系统抑制足底电击诱导的CPP重燃;并同时设置吗啡+纳洛酮组、吗啡+ CTAP组,测试前15min单独给予纳洛酮或CTAP,以观察纳洛酮或CTAP本身的作用。
2 结果
2.1足底电击诱导的CPP重燃模型的建立按照本实验中的方法成功建立了条件位置偏爱模型(F1,7=97.81,P<0.01,Fig 1B),给予10 mg·kg-1吗啡皮下注射后进行条件位置偏爱训练,CPP得分与训练前相比明显增加(P<0.01) ;不给予任何药物处理及训练自然熄灭后,条件位置偏爱成功消退,CPP得分明显下降(P<0.01),恢复至训练前水平;给予足底电击15 min后,重新建立条件位置偏爱(P<0.01)。
2.2外源性CCK-8对足底电击诱导吗啡CPP重燃的影响建立大鼠条件位置偏爱模型,并自然熄灭10 d,给予足底电击进行重燃前分别侧脑室注射生理盐水或CCK-8(0.1、1 μg),再次进行CPP测试。结果发现(Fig 2),足底电击成功重燃CPP的表达,并且CCK-8有效抑制了吗啡CPP重燃过程(F2,26=16.411,P<0.01),采用Bonferroni法进行组间比较后发现,与盐水对照组(0 μg CCK-8组)相比,0.1 μg和1 μg CCK-8明显降低了足底电击重燃后的CPP得分(P<0.01)。

Fig 2 CCK-8 (0.1,1 μg) significantly inhibited the foot shock-primed reinstatement of morphine-induced CPP.
2.3CCK-8抑制足底电击诱导吗啡CPP重燃的相关机制
2.3.1CCK1受体拮抗剂阻断CCK-8对足底电击诱导CPP重燃的抑制作用分别用CCK1受体拮抗剂L-364,718或CCK2受体拮抗剂L-365,260与CCK-8共同干预,以探讨CCK-8抑制足底电击诱导吗啡CPP重燃的受体机制(Fig 3)。结果显示,Mor+ CCK-8+ L-364,718组与Mor+ CCK-8+ DMSO组相比,L-364,718能够明显阻断CCK-8的作用(P<0.01),而Mor+ CCK-8+ L-365,260组与Mor+ CCK-8+ DMSO组相比差异无显著性(P>0.05)。但是,与CPP重燃后水平相比,CCK2受体拮抗剂L-365,260单独作用,也可以抑制足底电击诱导的CPP重燃(P<0.01)。结果表明,外源性CCK-8是通过CCK1受体抑制足底电击诱导的CPP重燃,而内源性CCK可能通过CCK2受体促进足底电击诱导的吗啡CPP重燃。
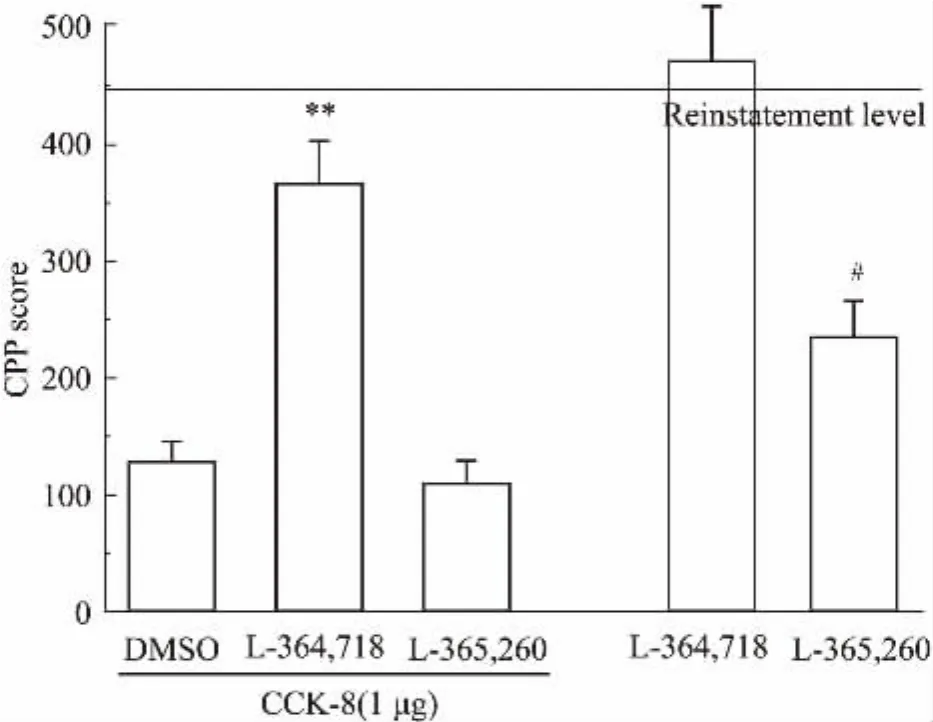
Fig 3 CCK1 receptor antagonist L-364,718 blocked the inhibitory effect of CCK-8 on foot shock-primedreinstatement of morphine-induced CPP
2.3.2阿片受体拮抗剂阻断CCK-8对足底电击诱导CPP重燃的抑制作用为探讨CCK-8是否可以通过上调内源性阿片肽系统抑制足底电击诱导吗啡CPP重燃,我们在CPP重燃测试前15 min侧脑室共同给予CCK-8及非选择性阿片受体拮抗剂纳洛酮或高选择性μ阿片受体拮抗剂CTAP进行干预。结果发现,纳洛酮或CTAP和CCK-8共同作用,均能阻断CCK-8的作用(P<0.01),纳洛酮和CTAP本身对足底电击诱导吗啡CPP重燃无明显影响(P>0.05),表明外源性CCK-8抑制足底电击诱导吗啡CPP重燃的作用可能与内源性阿片系统相关。
3 讨论
药物依赖是一种主要以中枢神经系统适应性或者可塑性改变为基础的慢性复发性脑病。随着反复用药,用药者对药物的行为反应一方面表现为耐受,另一方面又表现为增强,即敏化;敏化使机体形成对药物的病理性渴求,促进强迫性觅药及复吸行为。复吸是指吸毒者在完成脱毒治疗以后,由于种种原因重新开始滥用毒品的行为,是目前成瘾研究的重点和难点[5]。
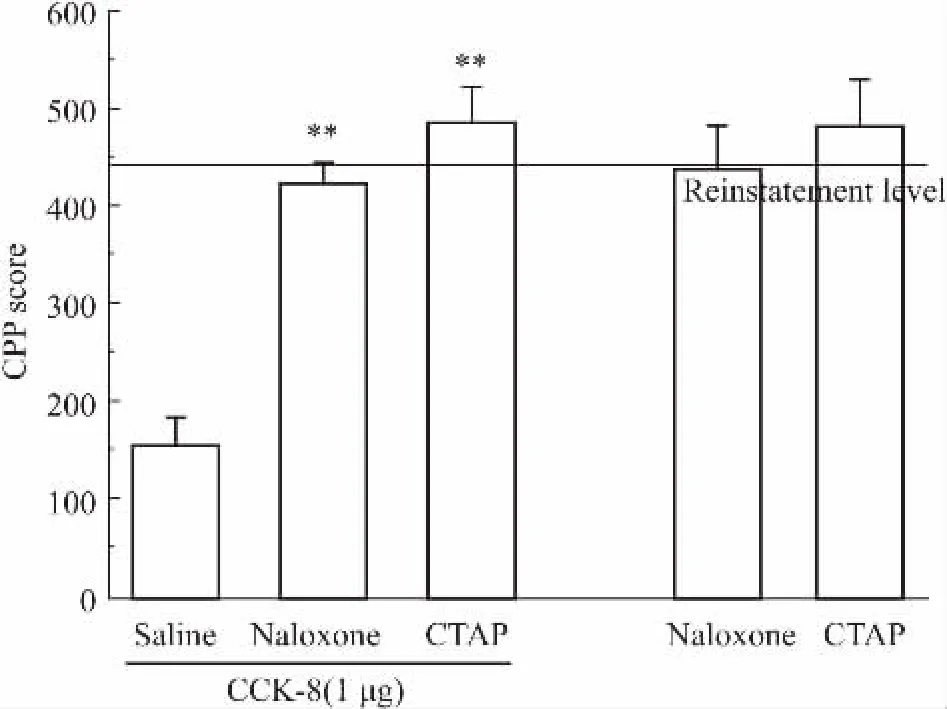
Fig 4 Opioid receptor antagonists naloxone and CTAP block the inhibitory effect of CCK-8 on foot shock-primedreinstatement of morphine-induced CPP
CCK-8是目前已知作用最强的内源性“抗阿片肽”,可通过CCK1和CCK2两种受体亚型发挥多种生物学功能。大量研究表明,当体内阿片物质过多时将引起抗阿片肽CCK的生成释放增多,起到负反馈调节作用,内源性阿片系统与CCK系统之间的相对平衡在抗伤害性感受、疼痛调控及阿片依赖过程中起重要作用[6]。但是,CCK-8作为一种最强效CCK受体激动剂,其相关研究并未得到与CCK受体拮抗剂完全相反的结论。在Itoh等[7]报道CCK-8能抗阿片镇痛的同时,Doi等[8]却报道CCK-8本身有镇痛作用,Rezayat等[9]还发现CCK可以降低纳洛酮诱导吗啡戒断小鼠模型的跳跃反应。在脊髓薄片的离体实验中,大剂量CCK-8可以引起脊髓甲硫脑啡肽免疫活性物质的释放,因此推测CCK-8还可引起阿片肽的释放。我们的前期研究系统考察了外源性CCK-8对吗啡依赖的影响,并发现外源性CCK-8可明显抑制吗啡诱导的CPP表达过程[4]。在本研究中,足底电击进行重燃前侧脑室注射不同剂量的CCK-8,发现CCK-8可明显抑制足底电击诱导的吗啡CPP重燃,与本室以往研究结果一致[5]。药物产生的欣快感与正性强化相关联,而戒断症状与负性强化有关,二者均参与了复吸过程。一些实验证据表明,CCK可以通过CCK2受体调节谷氨酸-GABA能系统,使杏仁核失去抑制,产生了焦虑和恐慌样行为,这种负性情绪强化了对药物的寻求[10]。但是,我们发现CCK-8可以通过CCK1受体上调SH-SY5Y细胞前脑啡肽原(PENK)的表达[11],抑制吗啡戒断诱导条件性位置厌恶的表达[12],并通过CCK1受体上调内源性阿片肽缓解戒断过程中的焦虑症状[13]。本研究中,CCK1受体拮抗剂和阿片受体拮抗剂均可阻断CCK-8对足底电击诱导吗啡CPP重燃的抑制作用。因此,我们考虑CCK-8可以通过CCK1受体缓解戒断过程中的负性情绪,从而抑制复吸过程,且CCK受体的不同亚型可能在吗啡成瘾过程中发挥不同作用。
另外,复吸的某些主要特征被认为是记忆的另一种形式,是大脑特定神经系统中由不良适应所介导的异常方式的学习和记忆。例如:长期慢性给予阿片类物质,可通过正常的学习记忆系统产生病理反应,并使用药者形成强迫性用药行为;当成瘾者停止用药或者脱毒后,再次遇到与以往用药相关的环境或其他线索,通过刺激中枢部分记忆环路即可诱发复吸。以往研究已证实CCK-8参与动物学习、记忆过程[14],我们还发现外源性CCK-8可以抑制药物相关性记忆,并一定程度上降低长期给予药物对正常空间学习记忆的损害作用[15]。因此,CCK-8还可能通过学习及记忆机制干预吗啡依赖的过程。
综上所述,我们通过在体动物水平的实验证明了CCK-8可明显抑制足底电击诱导的吗啡CPP重燃过程。CCK-8可能从正性和负性两方面干预吗啡依赖过程,使其具有成为治疗吗啡成瘾用药的可能。但CCK-8具有明显的浓度效应及特殊的量效曲线,还需我们进一步研究CCK受体不同亚型的作用模式,完善和明确CCK-8在吗啡成瘾过程中作用及其生物学机制。
(致谢:本研究在河北医科大学基础医学院法医学系,河北省法医学重点实验室完成,感谢对本研究的指导和支持)
参考文献:
[1]Leshner A I.Addiction is a brain disease,and it matters[J].Science,1997,278(5335) : 45-7
[2]陈大庆,倪宏.缩胆囊素生物学作用的多样性[J].国外医学儿科学分册,2002,29(3) : 164-6.
[2]Chen D Q,Ni H.The diversity of cholecystokinin biology function [J].Foreign Med Sci (Sect Pediat),2002,29(3) :164-6.
[3]文迪,马春玲,丛斌,等.侧脑室注射八肽胆囊收缩素及其受体拮抗剂对吗啡依赖大鼠戒断症状的影响[J].中国药理学通报,2011,27(10) :1363-8.
[3]Wen D,Ma C L,Cong B,et al.Effects of CCK-8 and its receptor antagonists given intracerebroventricularly on withdrawal symptomof morphine dependent rats[J].Chin Pharmacol Bull,2011,27 (10) :1363-8.
[4]Wen D,Cong B,Ma C,et al.The effects of exogenous CCK-8 on the acquisition and expression of morphine-induced CPP[J].Neurosci Lett,2012,510: 24-8.
[5]Koob G F.Hedonic homeostatic dysregulation as a driver of drugseeking behavior[J].Drug Discov Today Dis Models,2008,5 (4) :207-5.
[6]Hebb A L,Poulin J F,Roach S P,et al.Cholecystokinin and endogenous opioid peptides: Interactive influence on pain,cognition and emotion[J].Prog Neuro psychopharmacol Biol Psychiatry,2005,29(8) : 1225-38.
[7]Itoh S,Katsuura G,Maeda Y.Caerulein and cholecystokinin suppress beta-endorphin-induced analgesia in the rat[J].Eur J Pharmacol,1982,80(4) : 421-5.
[8]Doi T,Jurna I.Analgesic effect of intrathecal morphine demonstrated in ascending nociceptive activity in the rat spinal cord an in effectiveness of caerulein and CCK-8[J].Brain Res,1982,234 (2) : 399-407.
[9]Rezayat M,Azizi N,Zarrindast M R,et al.On the mechanism (s) of cholecystokinin (CCK) : Receptor stimulation attenuates morphine dependence in mice[J].Pharmacol Toxicol,1997,81 (3) :124-9.
[10]Perez de la Mora M,Hernandez-Gomez A,Arizmendi-Garcia Y, et al.Role of the amygdaloid cholecystokinin (CCK)/gastrin-2 receptors and terminal networks in the modulation of anxiety in the rat.Effects of CCK-4 and CCK-8S on anxiety-like behaviour and [3H]GABA release[J].Eur J Neurosci,2007,26(12) : 3614-30.
[11]文迪,马春玲,丛斌,等.CCK-8与内源性阿片系统在吗啡依赖中的相互作用[J].中国药理学通报,2010,26(11) : 1445-50.
[11]Wen D,Ma C L,Cong B,et al.Interaction of CCK-8 and endogenous opioid system in the opioid dependence[J].Chin Pharmacol Bull,2010,26(11) :1445-50
[12]Yu H,Wen D,Ma C,et al.Effects of exogenous cholecystokinin octapeptide on acquisition of naloxone-precipitated withdrawal-induce conditioned place aversion in rats[J].PLOS One,2012,7 (7) : e41860.
[13]Wen D,Sun D,Zang G,et al.Cholecystokinin octapeptide induces endogenous opioid-dependent anxiolytic effects in morphinewithdrawal rats[J].Neuroscience,2014,277: 14-25
[14]Hadjiivanova C,Belcheva S,Belcheva I.Cholecystokinin and learning and memory processes[J].Acta Physiol Pharmacol Bulg,2003,27(2-3) : 83-8.
[15]Yang S,Wen D,Dong M,et al.Effects of cholecystokinin-8 on morphine-induced spatial reference memory impairment in mice [J].Behavioral Brain Res,2013,256: 346-53.
Effects of CCK-8 on foot shock primed reinstatement of morphine-induced CPP
JIA Hui1,2,LIU Tao3,WEN Di2,SUN Dong-lei2,ZANG Guo-qing2,YU Feng,YAN Yu-xian1,MA Chun-ling2
(1.Logistics University of People’s Armed Police Torce,Tianjin 300309,China; 2.Dept of Forensic Medicine,Basic Medical College,Hebei Medical University; Hebei Key Laboratory of Forensic Medicine,Shijiazhuang 050017,China; 3.Dept of Emergency Internal Medicine,the Second People's Hospital of Yunnan Province,Kunming 650021,China)
Abstract:AimTo explore the effects of exogenous CCK-8 on foot shock primed reinstatement of morphineinduced CPP and its mechanism.Methods The model of morphine induced conditioned place preference was established.Doses of CCK-8 (0.1,1 μg) were given intracerebroventricularly before CPP reinstatement,and the effects of exogenous CCK-8 on foot shock primed reinstatement of morphine-induced CPP were examined.Furthermore,CCK receptor antagonists (CCK1 receptor antagonist L-364,718 and CCK2 receptor antagonist L-365,260) and opioid receptor antagonists (opioid receptor antagonist naloxone and μopioid receptor antagonists CTAP) were co-administrated with CCK-8 before CPP reinstatement to explore the mechanisms of CCK-8 inhibiting foot shock primed reinstatement of morphine-induced CPP.Results①Foot shock successfully provoked the reinstatement of CPP,and CCK-8 (0.1,1 μg) effectively inhibited the reinstatement of morphine-induced CPP.②CCK1 receptor antagonist L-364,718,opioid receptor antagonists naloxone and CTAP could block the inhibitory effects of CCK-8 on foot shock primed reinstatement of morphine-induced CPP.③CCK-8 itself had no effect on sensitivity threshold of rats to foot shock.ConclusionCCK-8 can inhibit foot shock primed reinstatement of morphine-induced CPP via CCK1 receptor.This function of CCK-8 is related to opioid receptor.
Key words:morphine; CCK-8; CCK receptor; relapse; conditioned place preference; endogenous opioid peptide
作者简介:贾慧(1981-),女,硕士生,研究方向:药物成瘾机制,E-mail: wdl998@ sohu.com;闫玉仙(1968-),女,博士,硕士生导师,研究方向:药物成瘾机制,通讯作者,E-mail: yyx19683@126.com;马春玲(1964-),女,博士,博士生导师,研究方向:法医毒理学,E-mail: chunlingma@126.com
基金项目:国家自然科学基金资助项目(No 81273337) ;河北省自然科学基金资助项目(No H2013206157)
收稿日期:2015-01-18,修回日期:2015-02-26
文献标志码:A
文章编号:1001-1978(2015) 06-0848-05中国图书分类号: R341.6; R749.61; R971.2; R977.6
doi:10.3969/j.issn.1001-1978.2015.06.022
