肺癌患者淋巴结内培养CIK细胞的抑瘤实验和临床前期研究
2015-04-19滕家俊刘显勋韩宝惠
滕家俊,周 严,刘显勋,韩宝惠,钟 华
上海市胸科医院呼吸内科,上海 200030
肺癌患者淋巴结内培养CIK细胞的抑瘤实验和临床前期研究
滕家俊,周 严,刘显勋,韩宝惠,钟 华
上海市胸科医院呼吸内科,上海 200030
背景与目的:细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK)兼具T淋巴细胞强大的杀瘤活性与自然杀伤细胞(natural killer cell,NK)杀瘤的非MHC限制性。CIK细胞可直接杀伤肿瘤细胞,调节并增强免疫功能,同时不损害机体免疫环境,其在治疗恶性肿瘤中的作用已得到广泛认可。本研究旨在观察肺癌手术患者淋巴结培养获得的CIK细胞的杀瘤活性及其临床应用的安全性。方法:获取上海市胸科医院6例经手术治疗的非小细胞肺癌患者的淋巴结及外周血,体外培养分别获得CIK细胞。通过倒置显微镜观察两组CIK细胞的形态,检测淋巴结组及外周血组CIK细胞表型,应用CCK8显色法检测两组CIK细胞对A549细胞株的抗增殖作用,观察回输后血液中癌胚抗原(carcino-embryonic antigen,CEA)的变化及其临床应用中的不良反应。结果:淋巴结组和外周血组CIK细胞CD3+CD56+T细胞的比例均>30%。不同效靶比淋巴结组CIK细胞对A549细胞的抑制率均高于外周血组(P<0.05)。回输淋巴结内CIK细胞后肺癌患者有不同程度CEA下降。不良反应轻微,主要表现为皮疹和发热。结论:肺癌手术患者的淋巴结可用于培养CIK细胞,其活性优于外周血来源的CIK细胞,临床前期实验证实安全性高。
肺癌;淋巴结;免疫治疗
肺癌的发病率高,死亡率居所有恶性肿瘤的首位。传统的手术治疗、放疗和化疗虽在不断地改进,但肺癌患者的总生存率并无明显改善,5年生存率不足15%[1]。人们在不断探索新的肺癌治疗手段。Schmidt-Wolf等[2]1991年首次报道的细胞因子诱导的杀伤细胞(cytokineinduced killer cells,CIK)因其在体内外展现出来的强大抗肿瘤活性而备受关注, 迅速成为肿瘤免疫治疗的前沿和热点。到目前为止,CIK细胞用于治疗肝癌、食管癌、乳腺癌、胃癌、结肠癌、肾细胞癌及各类白血病等都取得良好效果[3-6]。在肺癌治疗方面,Kim等[7]、Lin等[8]和Wang等[9]的研究均表明,外周血培养的CIK细胞自体回输是治疗晚期肺癌良好的过继免疫疗法,可延长患者生存期,改善患者的生活状况,且未见明显的不良反应。肺癌手术患者淋巴结组织是否可以培养CIK并用作过继性免疫治疗,国内外目前尚无相关研究报道。本实验将对外科手术患者术中所取得的淋巴结组织进行分离培养得到CIK细胞,将其与外周血CIK进行比较,观察其生物学特性及对肺腺癌细胞的抗增殖作用,观察淋巴结中培养的CIK细胞回输肺癌患者的安全性。
1 材料和方法
1.1 细胞、试剂和仪器
肺腺癌A549细胞购自中国科学院上海生命科学研究院细胞资源中心。试剂和仪器包括无血清培养液X-VIVOTM15(美国Lonza公司)、一次性细胞滤网(上海前尘生物科技有限公司)、鼠抗人CD3单克隆抗体(法国Immunotech公司)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD3(鼠抗人CD3单克隆抗体)、多甲藻叶绿素蛋白(PerCP)标记的CD4(鼠抗人CD4单克隆抗体)、多甲藻叶绿素蛋白(PerCP)标记的CD45(鼠抗人CD45单克隆抗体)、藻红蛋白(P-phycoerythrin,PE)标记的CD16CD56(鼠抗人CD56单克隆抗体)(美国BD公司)、上皮细胞黏附分子(epithelial cell adhesion molecule, Ep-CAM)抗体(C-10)(Santa Cruz公司)、重组人白细胞介素-2(recombinant human interleukin-2,rhIL-2)、干扰素γ(interferon γ,IFNγ)和CCK-8试剂盒(上海博谷生物科技有限公司)、FACS Calibur流式细胞仪(美国BD公司)。
1.2 患者资料
选取2012年10月—2014年10月在上海市胸科医院手术的非小细胞肺癌的患者6例。根据国际肺癌研究学会(International Association for the Study of Lung Cancer,IASLC)第7版分类:ⅡB期2例和Ⅲ期4例;病理类型为肺腺癌5例,鳞癌1例。男性5例,女性1例,入组患者中位年龄为(63.00±3.08)岁。手术肿瘤切除加淋巴结清扫,满足常规病理诊断要求后,淋巴结体外培养CIK细胞(表1),回输给患者。术后化疗方案均为长春瑞宾联合卡铂方案(NC:长春瑞滨25 mg/m2,第1、8天+卡铂AUC=5,第1天)。入选患者均签署知情同意书。体力评价采用美国东部协作肿瘤组(Eastern Cooperative Oncology Group,ECOG)评分标准均≤1。
1.3 方法
1.3.1 外周血及淋巴结内CIK前体细胞的培养
外周血采集,术前30 min抽取患者静脉血50 mL,16~20 ℃条件下保存。采用Ficoll密度梯度离心法,分离离心(670×g,20 min)。取中间层薄雾状的外周血单个核细胞层静置于培养箱中2 h,悬浮细胞制备CIK。
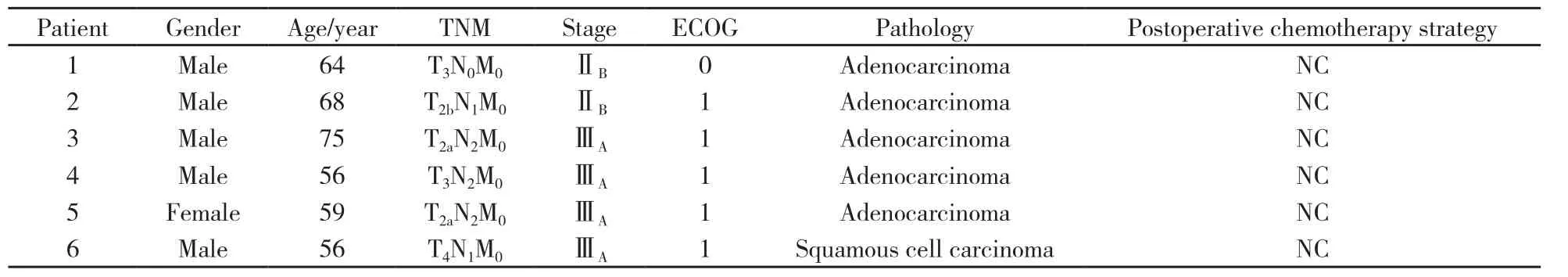
表 1 入组患者一般资料Tab. 1 Characterisitics of patients
淋巴结的采集:在手术中取纵隔淋巴结组织,约10 g(石蜡切片染色病理证实无转移)。16~20 ℃保存,将其剪碎,剔除脂肪组织及各种纤维成分,再经过碾磨、0.9%氯化钠溶液洗涤重悬后采用细胞滤网过滤后收集细胞。细胞静置于细胞培养箱中培养2 h后,收集悬浮细胞并制备CIK细胞。
1.3.2 CIK细胞的诱导与扩增
CIK的诱导扩增:将从外周血中收集获得的外周血单个核细胞和淋巴组织中收集获得的CIK前体细胞,用含INF-γ(1 000 μ/mL)和2%患者自体血清的X-VIVOTM15培养液,在温度为37 ℃、CO2体积分数为5%的培养箱中培养24 h。将CD3单克隆抗体(500 ng/mL)、rhIL-2 (1 000 U/mL)加入培养液中,隔天补充营养因子(INF-γ和rhIL-2),共培养10 d。继续培养细胞至第14天时,开始收集CIK细胞,使细胞悬浮于50 mL的0.9%氯化钠溶液中,储存在输液袋中(16~20 ℃下保存);并取两组细胞标记CD3、CD4、CD8、CD16CD56、Ep-CAM和内毒素的流式抗体,采用流式细胞仪上样分析。
1.3.3 CCK8法细胞活性测定
取培养14 d后的外周血和淋巴结CIK细胞作为效应细胞,靶细胞为A549肺腺癌细胞,其细胞密度为1×105个/mL(1×104个/孔),分别以效靶比为12.5∶1、25∶1、50∶1和100∶1的比例加入96孔板(实验组),另设单独靶细胞孔(单独靶细胞组)和单独效应细胞孔(单独效应细胞组)。每组设3个复孔,置于37 ℃、CO2体积分数为5%的培养箱中培养48 h,用CCK8显色法检测波长450 nm处吸光度(D)值。抑制率(%)=(D单独效应细胞组-D实验组/D单独靶细胞组)×100%。实验重复3次。
1.3.4 CIK细胞形态的观察及表型的检测
取培养14 d后的外周血组及淋巴结组CIK细胞在倒置显微镜下观察细胞形态。培养第14天时,用流式细胞仪检测外周血组及淋巴结组CIK细胞表面分子,检测方法同1.3.2节。
1.3.5 CIK回输及回输后评估
手术当日获取患者淋巴结,按1.3.1和1.3.2节方法培养14 d获得CIK细胞并常规进行病毒学、病原学检测。每例患者淋巴结培养的CIK细胞从第15天开始分两次回输(1次/天),计算每例患者回输细胞总量。回输方法为CIK细胞混悬于250 mL的0.9%氯化钠溶液,静脉回输,回输前0.5 h用吲哚美辛栓剂半枚纳肛,异丙嗉(非那更)半支肌内注射。术后化疗于手术后第4周进行,每4周1个疗程,共4个疗程。分别在手术后和化疗4个疗程结束后抽取外周血检测癌胚抗原(carcino-embryonic antigen,CEA),行血常规(评估骨髓抑制发生率),观察皮疹、发热、过敏性事件的发生率。
1.4 统计学处理
2 结 果
2.1 来源淋巴结及来源外周血培养的CIK细胞表型分析
本实验所选取的淋巴结均为术中病理提示无转移的淋巴结,且术后石蜡切片免疫组织化学染色再次证实。试验中Ep-CAM经流式细胞术检测表达阴性证实无肿瘤细胞。以上三项充分提示肿瘤未累及肺癌引流区域的淋巴结。来源于外周血与来源于淋巴结组的CD3+CD56+细胞所占的比例分别为(32.9±0.1)%和(31.8±3.0)%。差异无统计学意义(P=0.556,表2)。1例患有典型的来源于淋巴结和同时来源于外周血中培养的CD3+CD56+细胞(图1)。
表 2 培养14 d外周血组及淋巴结组CIK表型情况Tab. 2 CIK phenotype of two groups after cultivation for 14 d(n=6)
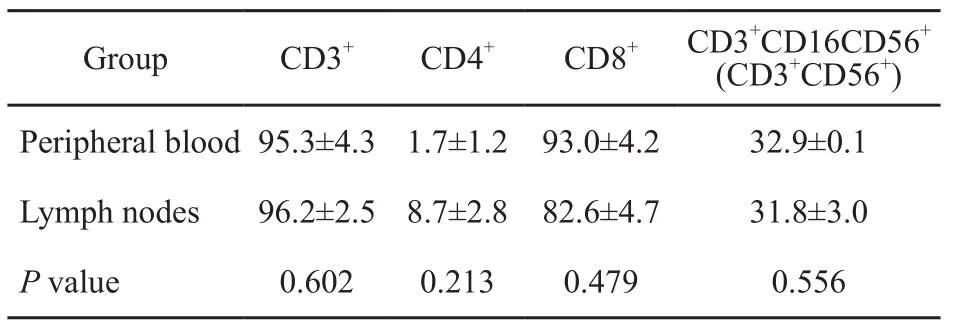
表 2 培养14 d外周血组及淋巴结组CIK表型情况Tab. 2 CIK phenotype of two groups after cultivation for 14 d(n=6)
Group CD3+ CD4+ CD8+ CD3+CD16CD56+(CD3+CD56+) Peripheral blood95.3±4.3 1.7±1.2 93.0±4.2 32.9±0.1 Lymph nodes 96.2±2.5 8.7±2.8 82.6±4.7 31.8±3.0 P value 0.602 0.213 0.479 0.556
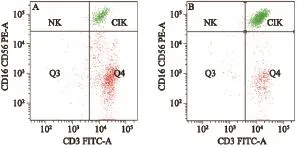
图 1 流式细胞术检测1例肺癌患者外周血及淋巴结内培养的CIK表型表达Fig. 1 Proportion of CIK cells from 1 patient’s peripheral blood and lymph nodes assayed by flow cytometry
2.2 培养14 d后外周血组及淋巴结组细胞形态
刚分离出的单个核细胞悬浮于培养基中,细胞体积较小,大小及折光性较一致。培养第5~6天时,细胞体积增大,可成团生长;培养第14天,倒置显微镜下淋巴结组和外周血组CIK细胞均呈圆形或椭圆形,体积增大,有细胞集落,细胞膜光滑,细胞质增多、饱满、透亮、折光性好。
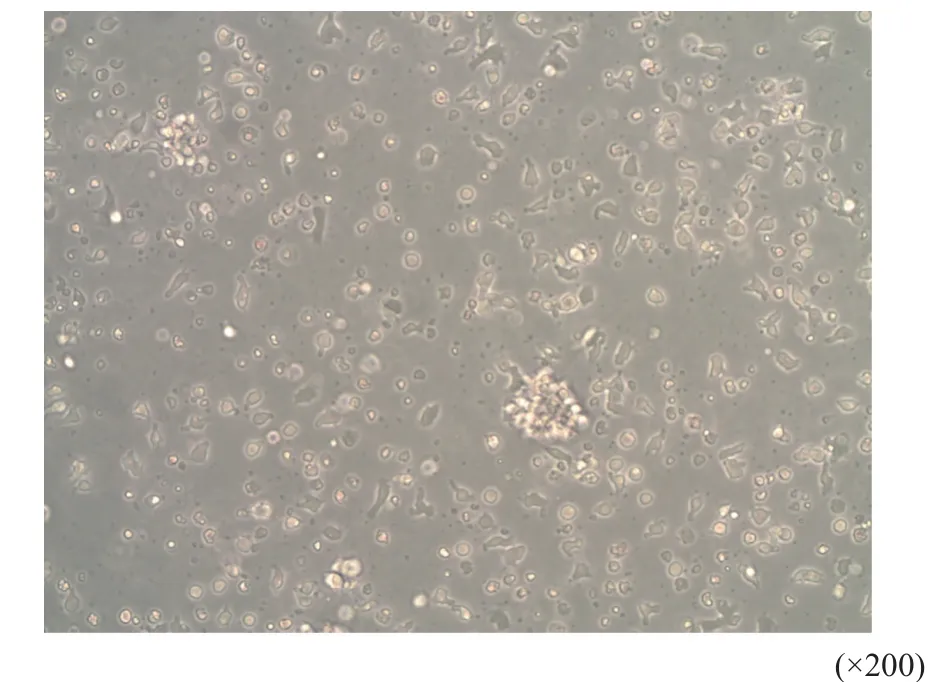
图 2 来源于淋巴结中培养14 d的CIK细胞形态Fig. 2 The morphology of CIK cells after cultivation for 14 d
2.3 淋巴结CIK细胞对比外周血CIK细胞对A549细胞抗增殖作用
入组患者外周血及淋巴结分别培养CIK细胞,检测其对A549细胞的抗增殖作用。当A549细胞取1×105个/mL时,检测CIK细胞对A549细胞不同效靶比的抑制率。随着效靶比的增高,对CIK细胞抑制率呈上升趋势;不同效靶比淋巴结组CIK细胞对A549肺腺癌细胞的抑制能力均高于外周血组(P<0.05,图3)。
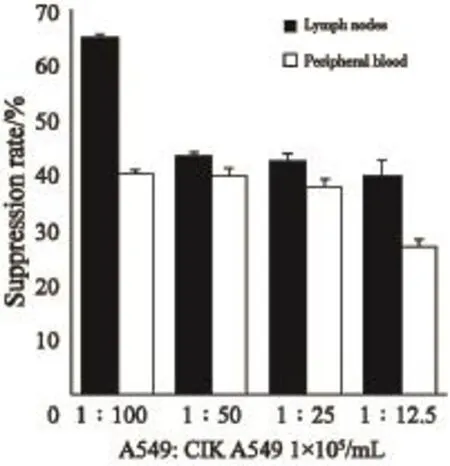
图 3 CCK8法检测CIK细胞对A549的抑制率Fig. 3 The suppression rate of CIK on A549 cells detected by CCK8 assay
2.4 回输后评估
淋巴结培养扩增所得CIK细胞符合质控要求。按1.3.5节方法,每例患者分两次回输,回输细胞总量为2.38×109个/例。分别在手术后和化疗4个疗程结束后抽取外周血检测CEA,结果表明4例患者CEA出现不同程度下降(下降幅度超过25%定义为CEA下降)。安全性观察结果显示:淋巴结培养获得的CIK细胞回输安全性高,不良反应少,仅出现皮疹和发热,并且都可以耐受,2名患者出现回输CIK后的Ⅰ度皮疹(包括红疹、痤疮和瘙痒症),3例患者出现发热(Ⅰ度2例,Ⅱ度1例),临床上不需要特殊处理。这6例患者在后续的4次术后辅助化疗中,没有出现超过Ⅰ度化疗相关的骨髓移植不良反应。截止至最后一次随访日(2015年6月1日),1例患者出现疾病进展(无进展生存期为11个月),其余5例均未发现疾病进展(表3)。

表 3 肺癌患者淋巴结中培养CIK细胞回输后CEA变化及不良反应Tab. 3 The variation of CEA and side effects of transfusion with the CIK cells derived from lymph nodes in patients suffering from lung cancer
3 讨 论
肺癌的发病率和死亡率居恶性肿瘤首位,其中非小细胞肺癌占80%,其表现为高发生率、高死亡率、低生存率[10]。标准的化疗及放疗虽然可以在一定程度上杀死肿瘤细胞,但其毒性严重,易引起肿瘤患者免疫力低下状态持续存在;而肺癌细胞的免疫原性差,这又进一步增加了肿瘤的免疫逃逸,导致肺癌患者的进一步治疗严重受阻[10-12]。因此,提高机体免疫力,建立有效的免疫应答可能是肺癌治疗的一种有效途径。近年来,癌症的免疫疗法获得重大的突破。免疫疗法毫无疑问将成为主流的抗癌疗法。
免疫疗法中,过继性免疫治疗占据重要的位置。过继性免疫治疗可以在没有损伤机体免疫系统结构和功能的前提下,直接杀伤肿瘤细胞,并且调节和增强机体的免疫功能。CIK细胞又称做NK细胞样T淋巴细胞,拥有T-NK细胞表型及MHC非限制性杀瘤能力。这是一群以CD3+CD8+CTL和 CD3+CD56+(CD3+CD16CD56+)为主的异质细胞群,其活化标志如CD25、CD69、CD95和记忆T细胞标志物CD45RO的表达明显增加,这些标志与其杀伤肿瘤细胞活性有关。大量的CIK细胞输入体内可以通过直接的靶向肿瘤细胞进行杀伤或导致其凋亡,也可通过分泌的细胞因子来增强机体已减退的免疫功能[13]。众多研究表明,CIK细胞对于各种实体肿瘤,包括一些耐药细胞的细胞毒作用主要来源于CD3+CD56+T细胞群[14-16]。CD3+CD56+T细胞比例越高,其杀瘤能力越强。
淋巴结的主要功能是滤过淋巴液,产生淋巴细胞和浆细胞,参与机体的免疫反应。淋巴结内的T细胞约占淋巴细胞总数的75%,其他为B细胞及其他免疫细胞[17]。
本研究表明,肺癌手术患者的淋巴结组织在体外经细胞因子的诱导同样可以获得大量的扩增,培养第14天,CD3+CD56+T细胞比例上升至30%,平均水平不低于同期培养外周血来源的CIK细胞(P>0.05)。取淋巴结组与外周血组培养14 d所得CIK细胞进行活性实验,发现均可有效杀伤A549肺腺癌细胞,并且淋巴结组CIK细胞对A549肺腺癌细胞的抑制率高于外周血组(P<0.05)。这说明手术患者的淋巴结组织完全可以用于CIK培养,其体外抑瘤活性强大。
肺癌患者免疫防御能力低下,对于刚术后的患者,抽取外周血培养CIK的过继性免疫疗法可能会影响患者术后恢复。因此通过对肺癌手术患者术中取得淋巴结组织培养CIK细胞,再回输患者体内的方法,一定程度上减少患者的痛苦,依从性更高。
本实验所选取的淋巴结均为术中病理明确无转移的淋巴结,且术后石蜡切片免疫组织化学染色再次证实的没有癌细胞转移的淋巴结。培养前,应用上皮细胞黏附分子[18](epithelial cell adhesion molecule,EpCAM)流式检测淋巴结单细胞悬液。检测阴性的淋巴结才能用于CIK的培养。因此,来源于手术中肺癌患者的淋巴结培养的CIK细胞,在安全性和无肿瘤细胞污染方面是可控的。
综上所述,本实验证实了肺癌手术患者术中取得的淋巴结组织可用作体外CIK细胞培养,增殖速度不低于外周血培养的CIK,并且对肺腺癌细胞株A549有更高效的抗增殖活性。淋巴结中培养的CIK细胞回输后患者耐受良好,不良反应轻微。
本实验探索性地应用肺癌手术患者淋巴结分离培养诱导CIK细胞用于过继性免疫治疗,证实了这种创新方法的安全性。未来将设计大规模的前瞻性对照临床试验分析比较此种方法在提高肺癌患者生存期上的作用和价值。
[1] SWISHER S G, ROTH J A. Clinical update of Ad-p53 gene therapy for lung cancer[J]. Surg Oncol Clin N Am, 2002, 11(3): 521-535.
[2] SCHMIDT-WOLF I G, NEGRIN R S, KIEM H P, et al. Use of a SCID mouse/human lymphoma model to evaluate cytokineinduced killer cells with potent antitumor cell activity[J]. J Exp Med, 1991, 174(1): 139-149.
[3] WENG D S, ZHOU J, ZHOU Q M, et al. Minimally invasive treatment combined with cytokine-induced killer cells therapy lower the short-term recurrence rates of hepatocellular carcinomas[J]. J Immunother, 2008, 31(1): 63-71.
[4] HUANG X, CHEN Y T, SONG H Z, et al. Cisplatin pretreatment enhances anti-tumor activity of cytokineinduced killer cells[J]. World J Gastroenterol, 2011, 17(25): 3002-3011.
[5] SU X, ZHANG L, JIN L, et al. Immunotherapy with cytokineinduced killer cells in metastatic renal cell carcinoma[J]. Cancer Biother Radiopharm, 2010, 25(4): 465-470.
[6] INTRONA M, BORLERI G, CONTI E, et al. Repeated infusions of donor-derived cytokine-induced killer cells in patients relapsing after allogeneic stem cell transplantation: a phase Ⅰ study[J]. Haematologica, 2007, 92(7): 952-959.
[7] KIM H M, LIM J, PARK S K, et al. Antitumor activity of cytokine-induced killer cells against human lung cancer[J]. Int Immunopharmacol, 2007, 7(13): 1802-1807.
[8] LIN J, ZHU H, LU X, et al. Autologous cytokine-induced killer cells in the treatment of multiple myeloma concomitant with lung cancer and paraneoplastic dermatoses [J]. Intern Med, 2010, 49(21): 2341-2346.
[9] WANG S, ZHANG H, LIU C, et al. Human leukocyte antigenhaploidentical donor-derived cytokine-induced killer cells are safe and prolong the survival of patients with advanced non-small cell lung cancer[J]. Oncol Lett, 2014, 8(6): 2727-2733.
[10] LEVINA V, MARRANGONI A, WAN T, et al. Elimination of human lung cancer stem cells through targeting of the stem cell factor-c-kit autocrine signaling loop[J]. Cancer Res, 2010, 70(1): 338-346.
[11] BAAS P, BELDERBOS J S, VAN DEN HEUVEL M. Chemoradiation therapy in non-small cell lung cancer[J]. Curr Opin Oncol, 2011, 23(2): 140-149.
[12] HSU H S, HUANG P I, CHANG Y L, et al. CucurbitacinⅠ inhibits tumorigenic ability and enhances radiochemosensitivity in non-small cell lung cancer-derived CD133-positive cells[J]. Cancer, 2011, 117(13): 2970-2985.
[13] ROSENBERG S A. Cell transfer immunotherapy for metastatic solid cancer-what clinicians need to know[J]. Nat Rev Clin Oncol, 2011, 8(10): 577-585.
[14] WANG S, ZHANG H, LIU C, et al. Human leukocyte antigenhaploidentical donor-derived cytokine-induced killer cells are safe and prolong the survival of patients with advanced non-small cell lung cancer[J]. Oncol Lett, 2014, 8(6): 2727-2733.
[15] FRANCESCHETTI M, PIEVANI A, BORLERI G, et al. Cytokine-induced killer cells are terminally differentiated activated CD8 cytotoxic T-EMRA lymphocytes[J]. Exp Hematol, 2009, 37(5): 616-628.
[16] SANGIOLO D, MARTINUZZI E, TODOROVIC M, et al. Alloreactivity and anti-tumor activity segregate within two distinct subsets of cytokine-induced killer (CIK)cells: implications for their infusion across major HLA barriers[J]. Int Immunol, 2008, 20(7): 841-848.
[17] KATAKAI T, HARA T, LEE J H, et al. A novel reticular stromal structure in lymph node cortex: an immuno-platform for interactions among dendritic cells, T cells and B cells[J]. Int Immunol, 2004, 16(8): 1133-1142.
[18] MUNZ M, BAEUERLE P A, GIRES O, et al. The emerging role of EpCAM in cancer and stem cell signaling[J]. Cancer Res, 2009, 69(14): 5627-5629.(收稿日期:2015-06-09 修回日期:2015-08-20)
Anti-tumor activities of CIK cells derived from lymph nodes of lung cancer patients
TENG Jiajun, ZHOU Yan, LIU Xianxun, HAN Baohui, ZHONG Hua
(Department of Pulmonary Disease, Shanghai Chest Hospital, Shanghai, 200030, China)
ZHONG Hua E-mail: eddiedong8@hotmail.com
Background and purpose: Cytokine-induced killer (CIK) has both the advantages of T lymphocytes’ powerful anti-tumor activity and NK cells’ tumor killing capacity without MHC restriction. It could directly kill tumor cells, regulate and enhance immune function, without damaging the structure and functions of the immune system. Its effects on the treatment of malignant solid tumors has been widely recognized. This study aimed to evaluate the anti-proliferation effects of CIK cells obtained and cultivated from lung cancer patients’ lymph nodes. Meanwhile, the safety of clinical transfusion was observed. Methods: The peripheral blood and lymph nodes of 6 surgery patients with lung cancer from Shanghai Chest Hospital were used to cultivate CIK cells for 14 days. The phenotypes of CIK cells were detected by flow cytometry. The anti-proliferation activities of CIK cells on A549 lung cancer cells were detected by CCK8 assay. The morphological changes of CIK cells were observed by invert microscope. The expression of CEA level and adverse events were evaluated after CIK transfusion. Results: The proportion of CD3+CD56+T lymphocyte in two groups were both more than 30%. The CCK8 assay showed that the suppression rate of lymph nodes group was higher than that of peripheral blood group at each effect/target ratio(P<0.05). The adverse effect of CIK transfusion was mild and tolerable. The expression of CEA level decreased in patients. Conclusion: Lymph nodes of surgery patients with lung cancer can be used for cultivation of CIK cells. The anti-tumor activity of CIK isolated from lymph nodes is better than that of CIK cells cultivated from peripheral blood. Preclinical experiments showed high safety.
Lung cancer; Lymph nodes; Immunotherapy
10.3969/j.issn.1007-3969.2015.09.004
R734.2
A
1007-3639(2015)09-0665-06
上海市科委引导课题(124119a6300);上海市胸科医院重大重点项目(2014YZDC20700)。
钟华 E-mail:eddiedong8@hotmail.com
