长链非编码RNA HOTTIP 通过调控细胞凋亡水平促进非小细胞肺癌增殖
2015-04-19周发忱白宇新迟鑫明
周发忱,赵 磊,白宇新,迟鑫明,周 欣
1.大连医科大学附属第一医院胸外科,辽宁 大连 116011;2.大连医科大学组织胚胎学教研室,辽宁 大连 116044
长链非编码RNA HOTTIP 通过调控细胞凋亡水平促进非小细胞肺癌增殖
周发忱1,赵 磊1,白宇新2,迟鑫明2,周 欣2
1.大连医科大学附属第一医院胸外科,辽宁 大连 116011;2.大连医科大学组织胚胎学教研室,辽宁 大连 116044
背景与目的:探索非小细胞肺癌(non-small cell lung cancer,NSCLC)有效的早期诊断及预后标志物具有重要的科学意义和临床价值。长链非编码RNA(lncRNA)在肿瘤中的作用逐渐引起研究者的关注。本研究拟分析lncRNA HOTTIP在NSCLC中的表达情况及对NSCLC细胞增殖水平的影响和机制。方法:采用实时定量PCR(quantitative real-time PCR,qRT-PCR)检测方法检测54例NSCLC组织及其对应癌旁组织的HOTTIP表达情况,分析NSCLC组织HOTTIP表达与临床病理参数的相关性;MTT方法检测肺癌细胞增殖水平,流式细胞术检测凋亡率的改变;蛋白[质]印迹法(Western blot)检测目的基因的蛋白表达变化。结果:与癌旁组织比较,HOTTIP在肺癌组织中的表达率明显增加,差异有统计学意义(P<0.05)。HOTTIP表达与患者淋巴结转移和TNM分期相关。转染HOTTIP siRNA至A549肺癌细胞后,结果显示,与未转染组和阴性质粒转染组相比,转染siRNA-HOTTIP 的A549细胞HOTTIP 表达明显降低;HOTTIP表达下调后细胞增殖速度减慢,凋亡率增加,凋亡相关蛋白Bax的表达增加,Bcl-2表达减少。结论:HOTTIP是一种新的NSCLC生物标志物,可作为潜在的治疗新靶点。
长链非编码RNA;HOTTIP;非小细胞肺癌;增殖;细胞凋亡
肺癌是当今世界对人类健康危害最大的恶性肿瘤之一。在全世界范围内,由肺癌引起的死亡率在各种癌症类型中居首位[1]。在所有的肺癌中,非小细胞肺癌(non-small cell lung cancer,NSCLC)占75%~80%,尽管关于NSCLC的研究目前取得了很多新进展,但是其预后差仍是目前面临的严峻问题。因此,寻找NSCLC有效的早期诊断及预后标志物具有重要的科学意义和临床价值。将发现的特征性分子作为抗肿瘤靶点,可为肺癌的临床预防和治疗开辟新途径。
长链非编码RNA(lncRNA)是一类转录本长度超过200 nt的RNA,位于细胞核内或细胞质,不具有编码蛋白质的功能[2]。继microRNA之后,lncRNA的发现再次推动了非编码RNA领域的研究进展。近年的研究结果发现,lncRNA参与X染色体的基因沉默、基因组印迹、染色质修饰、转录激活、核内运输等多种方式调控基因的表达[3]。有研究发现,lncRNA参与细胞凋亡、细胞周期等生物学过程,在人类疾病发生、发展过程中发挥重要作用[4]。最近,关于lncRNA在肿瘤中的作用已引起人们关注[5]。
HOTTIP是2011年被科学家发现的一种新lncRNA[6],HOTTIP在前列腺癌和肝癌等肿瘤中的研究已经取得一定进展,提示其可能在调控肿瘤进展中发挥重要作用,但在NSCLC中的作用及机制如何,目前未见相关报道。本研究通过检测NSCLC组织及癌旁组织中HOTTIP表达,并比较表达差异,分析HOTTIP与NSCLC患者临床病理参数相关性,进一步通过体外细胞实验,干预NSCLC细胞中HOTTIP表达水平,分析细胞增殖和凋亡水平的改变。
1 材料和方法
1.1 材料
1.1.1 临床标本
收集大连医科大学附属第一医院胸外科2009—2014年手术切除的54例NSCLC患者的癌组织,并选取距离肿瘤边缘2 cm以上的癌旁组织(镜下未见癌细胞)作为对照。其中:男性34例,女性20例;年龄范围45~78岁,中位年龄59.8岁;鳞癌31例,腺癌23例;肿瘤直径≤3 cm 20例,>3 cm 34例;淋巴结转移19例,无淋巴结转移35例;Ⅰ~Ⅱ期31例,Ⅲ~Ⅳ期23例;组织学分级Ⅰ级29例,Ⅱ~Ⅲ级25例。所有患者术前均为经过放、化疗,标本术后取材后置于液氮中保存。
1.1.2 细胞系
正常支气管上皮细胞系16HBE、NSCLC腺癌细胞系A549、SPC-A1和鳞癌细胞系SKMES-1购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。
1.1.3 主要试剂
RPMI-1640培养基和胎牛血清购自美国Hyclone 公司;TRIzol 试剂、PrimeScript反转录试剂盒以及 SYBR PCR Master Mix 均购自宝生物工程(大连)有限公司;siRNA-HOTTIP和阴性对照siRNA以及转染试剂LipofecamineTM2000购自美国Invitrogen公司;MTT试剂购自美国Sigma公司;Bax、Bcl-2单克隆抗体均购自美国CST公司;PVDF膜购自美国Millipore公司;凋亡检测试剂盒购自晶美生物技术有限公司。
1.2 方法
1.2.1 细胞培养
上述细胞系传代培养于RPMI-1640完全培养基,其内含10%胎牛血清、100 U/mL青霉素以及100 mg/mL链霉素,置于37 ℃、CO2体积分数为5%的细胞培养箱内培养。每1~2 d更换新鲜培养基,当细胞融合达到80%~90%时进行传代培养。
1.2.2 定量实时PCR(quantitative real-time PCR,qRT-PCR)检测
应用TRIzol试剂提取细胞总RNA,根据反转录试剂盒说明书反转录获得 cDNA,进行相关指标的实时荧光定量实验,以ΔΔCt法进行定量分析,以 GAPDH作为内参,HOTTIP产物的荧光强度比GAPDH扩增产物荧光强度相对量代表HOTTIP相对表达水平。每个实验重复3次,以H2O为模板作为阴性对照。HOTTIP的上游引物5’-CCTAAAGCCACGCTTCTTTG-3’,下游引物5’-TGCAGGCTGGAGATCCTAGT-3’。
1.2.3 细胞转染
将NSCLC细胞接种到6孔板中培养24 h,待细胞融合至70%进行转染。分别设立HOTTIP干扰组(si-HOTTIP)、阴性转染组(si-NC)、空白对照组(blank control)。将LipofecamineTM2000与si-HOTTIP或si-NC混合(终浓度为100 nmol/L)后加入细胞中,温育6 h后,换完全RPMI-1640继续培养24 h,收集细胞进行后续实验。
1.2.4 MTT方法检测细胞增殖
取对数生长期细胞,按每孔5 000个细胞铺96孔板,接种培养24、48、72及96 h后终止培养。终止培养前4 h,加入MTT溶液(5 mg/mL),继续培养,除去孔中培养基,加入DMSO,振荡至结晶溶解。酶标仪检测490 nm波长时各孔吸光度(D)值。实验重复3次。
1.2.5 流式细胞仪检测细胞凋亡
取对数生长期细胞,消化后收集细胞,用预冷的PBC洗涤2次,以1 mL结合缓冲液重悬细胞,使其密度为1×106个/mL,将100 μL的细胞悬液加入5 mL流式管中,每管加入10 μL Annexin-Ⅴ-FITC染色,随后加入10 μL PI染色,室温下避光温育15 min,流式细胞仪检测凋亡率。实验重复3次。
1.2.6 蛋白[质]印迹法(Western blot)检测
将不同处理因素组的细胞培养48 h后,裂解并提取蛋白,用Western blot检测目的蛋白表达。将蛋白印迹显影图扫描,利用凝胶自动分析成像FluorChem V2.0软件(Alpha Innotech Corp., USA)对蛋白带进行灰度值(分别以目的蛋白的整合密度值比内参GAPDH的整合密度值)分析。
1.3 统计学处理
采用SPSS 16.0统计学软件对结果进行分析,数值用x±s 表示。实验最少重复3次。两组间比较采用配对t检验。多组间比较采用单因素方差分析方法统计。P<0.05为差异有统计学意义。
2 结 果
2.1 HOTTIP在NSCLC组织和细胞中的表达情况
本研究采用qRT-PCR方法检测54例肺癌组织及其对应癌旁组织中的HOTTIP表达情况。结果发现,HOTTIP在癌旁组织中呈低表达,在肺癌组织中表达明显增加(图1A)。这提示HOTTIP在NSCLC组织中持续高表达。
本研究分析了HOTTIP与患者临床病理参数相关性。结果发现,HOTTIP在分期较高(T3、T4)患者肿瘤组织中的表达水平明显高于低分期者(T1、T2)(图1B)。发生淋巴结转移的患者,其肿瘤组织中HOTTIP表达亦明显高于无淋巴结转移的患者(图1C)。
此外,本研究检测了不同NSCLC细胞中HOTTIP表达水平。结果发现,与正常支气管上皮细胞系16HBE相比,HOTTIP 在A549、SPC-A1和SK-MES-1细胞中的表达分别增高4.2倍、3.4倍和2.6倍(图1D)。
2.2 抑制NSCLC细胞中HOTTIP 表达后增殖减慢
本研究首先验证siRNA对细胞中HOTTIP 表达的干扰效率。通过qRT-PCR方法检测A549细胞中转染siRNA-HOTTIP后HOTTIP 的表达。结果发现,与未转染组和阴性质粒转染组相比,转染siRNA-HOTTIP的A549细胞,其HOTTIP表达明显降低,说明该siRNA可沉默A549细胞中HOTTIP的表达(图2A)。
此外,本研究采用MTT的方法检测转染siRNA-HOTTIP后细胞增殖水平的改变。结果发现,A549细胞中HOTTIP沉默后,细胞增殖活性明显降低,说明HOTTIP参与NSCLC细胞增殖活性的调控(图2B)。
2.3 抑制NSCLC细胞中HOTTIP 表达后细胞凋亡增加
采用流式细胞仪检测A549细胞中转染siRNA-HOTTIP后细胞凋亡率的改变。结果发现,与阴性转染组相比,转染siRNA-HOTTIP细胞的凋亡率明显增加(图3A),差异有统计学意义(P<0.05,图3);同时促凋亡蛋白Bax的表达增加,抗凋亡蛋白 Bcl-2表达减少。这提示HOTTIP可能通过影响Bax和Bcl-2蛋白表达调控细胞凋亡(图4)。
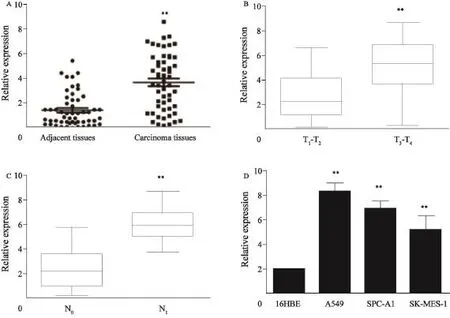
图 1 HOTTIP在NSCLC中的表达及临床意义Fig. 1 HOTTIP expression in NSCLC and its clinical significance
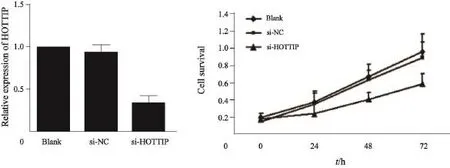
图 2 HOTTIP对A549细胞增殖的影响Fig. 2 The efffect of lncRNA HOTTIP on the cell proliferation in vitro
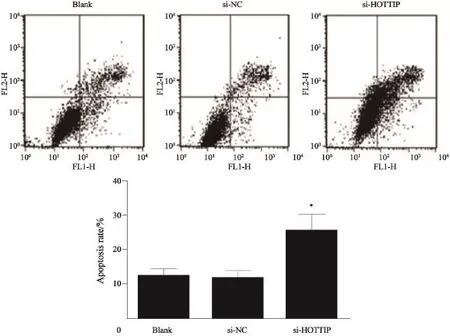
图 3 流式细胞仪检测抑制A549中HOTTIP 表达后细胞凋亡水平Fig. 3 Apoptosis of cells was measured by FACScan after HOTTIP silencing in A549 cell line
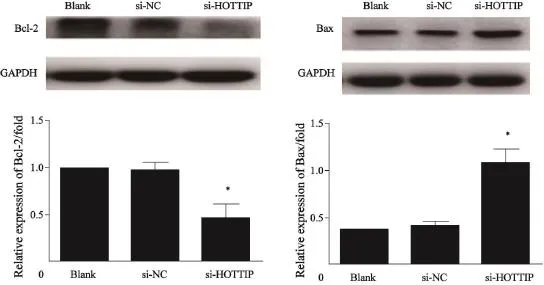
图 4 Western blot方法检测抑制A549中HOTTIP 表达后凋亡相关蛋白表达Fig. 4 Apoptosis–related proteins were measured by Western blot after HOTTIP silencing in A549 cell line
3 讨 论
lncRNA起初被认为是基因组转录的“噪声”,是RNA聚合酶Ⅱ转录的副产物,并不具有任何生物学功能。lncRNA异常表达与癌症发生关系密切,在肿瘤发生、发展中起重要作用。lncRNA异常表达可以存在于正常组织、不典型增生组织以及肿瘤组织中,而特异性表达的lncRNA还可作为肿瘤诊断的标志物[7]。目前基因组分析已发现了大量的lncRNAs,但是只有少部分lncRNA的功能被研究。其中较为突出的是HOTAIR、MALAT-1。目前已在多种肿瘤如胃癌、乳腺癌、前列腺癌、肺癌等组织中发现HOTAIR、MALAT-1的异常表达[8-9]。MALAT-1是第一个在肺癌中被研究的lncRNA,研究发现其可作为早期肺腺癌患者预后的独立标志物[10]。此外,有研究报道,HOTAIR高表达状态与NSCLC患者淋巴结转移和临床分级密切相关,并提示患者的不良预后[11]。本研究中发现了一种新的lncRNA,即HOTTIP,其可能参与了肺癌的发生、发展。
HOTTIP基因定位于染色体7p15.2,转录本含有4 665个核苷酸,在胚胎发育过程中可通过与WDR5/MLL复合物作用促进H3K4基因甲基化及临近的HOXA基因的转录激活。Li等[12]发现,HOTTIP可通过调控HOXA13的表达促进前列腺癌细胞的进展和对吉西他滨的耐药性。还有研究发现,肝癌细胞中HOTTIP过表达可促进肝癌的发生、侵袭力增加,可被miR-125b负性调控[13]。肝癌组织中的HOTTIP过表达与患者侵袭和不良预后相关,可能是预测肝癌预后的生物标志物[14]。Liu等[15]的研究结果发现,在胃癌细胞中人类同源异型盒(HOX)基因座的反义RNA(HOTAIR)作为ceRNA,通过竞争miR-331-3p,调节HER-2的表达,影响胃癌的发生、发展。
本研究结果发现,与正常组织相比,在NSCLC组织和细胞中HOTTIP的表达均显著上调,提示HOTTIP基因可能在NSCLC 的发生、发展中发挥类似癌基因的作用。进一步观察HOTTIP与NSCLC患者临床病理参数的相关性,发现HOTTIP与患者淋巴结转移数目、临床分期相关,提示HOTTIP高表达可能参与肺癌的恶性增殖过程。通过生存分析结果发现,HOTTIP高表达与患者预后不良有关。HOTTIP可能成为判断NSCLC预后的参考指标。
为进一步探讨HOTTIP在NSCLC中的生物学功能,本研究开展了体外细胞实验。结果发现,在NSCLC细胞中HOTTIP表达被抑制后,显著降低了肿瘤细胞的增殖能力,说明HOTTIP可能主要通过促进增殖参与肿瘤的形成。
肿瘤是细胞增殖和凋亡均异常的疾病。有学者指出细胞凋亡的异常比细胞过度增殖在肿瘤发生、发展过程中的作用更为重要[4]。对此,本研究检测了细胞凋亡的变化,结果发现HOTTIP表达下调后,细胞凋亡数增加。由于Bax/Bcl-2比率是启动细胞凋亡的分子开关,本研究还检测了凋亡蛋白的表达变化。结果发现,抑制HOTTIP表达后可增加促凋亡蛋白Bax的表达,抑制Bcl-2蛋白的表达,进一步证实了HOTTIP的抑制凋亡作用。
综上,本研究发现HOTTIP在NSCLC细胞及组织中高表达,其高表达与患者的不良预后相关;下调NSCLC细胞中HOTTIP的表达后可抑制肺癌细胞增殖并促进肿瘤细胞凋亡,提示HOTTIP可能通过影响细胞增殖与凋亡促进NSCLC的发生、发展。这些新的研究发现将为今后深入研究NSCLC分子机制及治疗新靶点提供新思路。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] OKAZAKI Y, FURUNO M, KASUKAWA T, et al. Analysis of the mouse transcriptome based on functional annotation of 60,770 full-length cDNAs[J]. Nature, 2002, 420(6915): 563-573.
[3] VILLEGAS V E, ZAPHIROPOULOS P G. Neighboring gene regulation by antisense long non-coding RNAs[J]. Int J Mol Sci, 2015, 16(2): 3251-3266.
[4] CHEN L L, ZHAO J C. Functional analysis of long noncoding RNAs in development and disease[J]. Adv Exp Med Biol,2014, 825: 129-158.
[5] YANG G, LU X, YUAN L. LncRNA: a link between RNA and cancer[J]. Biochim Biophys Acta, 2014, 1839(11): 1097-1109.
[6] WANG K C, YANG Y W, LIU B. A long noncoding RNA maintains active chromatin to coordinate homeotic gene expression[J]. Nature, 2011, 472(7341): 120-124.
[7] DENG G, SUI G. Noncoding RNA in oncogenesis: a new era of identifying key players[J]. Int J Mol Sci, 2013, 14(9): 18319-18349.
[8] WU Y, ZHANG L, WANG Y, et al. Long noncoding RNA HOTAIR involvement in cancer[J]. Tumour Biol, 2014, 35(10): 9531-9538.
[9] WANG F, REN S, CHEN R, et al. Development and prospective multicenter evaluation of the long noncoding RNA MALAT-1 as a diagnostic urinary biomarker for prostate cancer[J]. Oncotarget, 2014, 5(22): 11091-11102.
[10] SCHMIDT L H, SPIEKER T, KOSCHMIEDER S, et al. The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and induces migration and tumor growth[J]. J Thorac Oncol, 2011, 6(12): 1984-1992.
[11] LOEWEN G, JAYAWICKRAMARAJAH J, ZHUO Y. Functions of lncRNA HOTAIR in lung cancer[J]. J Hematol Oncol, 2014, 7(1): 90.
[12] LI Z, ZHAO X, ZHOU Y, et al. The long non-coding RNA HOTTIP promotes progression and gemcitabine resistance by regulating HOXA13 in pancreatic cancer[J]. J Transl Med, 2015, 13: 84.
[13] TSANG F H, AU S L, WEI L, et al. Long non-coding RNA HOTTIP is frequently up-regulated in hepatocellular carcinoma and is targeted by tumour suppressive miR-125b[J]. Liver Int, 2015, 35(5): 1597-1606.
[14] QUAGLIATA L, MATTER M S, PISCUOGLIO S, et al. Long noncoding RNA HOTTIP/HOXA13 expression is associated with disease progression and predicts outcome in hepatocellular carcinoma patients[J]. Hepatology, 2014, 59(3): 911-923.
[15] LIU X H, SUN M, NIE F Q, et al. LncRNA HOTAIR functions as a competing endogenous RNA to regulate HER2 expression by sponging miR-331-3p in gastric cancer[J]. Mol Cancer, 2014, 13: 92.
《中国癌症杂志》2016年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价15元,全年180元。国际标准连续出版物号1007-3639,国内统一连续出版物号CN 31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
主 编:沈镇宙
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×83574
网 址:www.china-oncology.com
电子邮件:zgazzz@163.com
The long non-coding RNA HOTTIP promotes the proliferation of non-small cell lung cancer cells through the regulation of apoptosis
ZHOU Fachen1, ZHAO Lei1, BAI Yuxin2, CHI Xinming2, ZHOU Xin2
(1. Department of Thoracic Surgery, the First Hospital Affiliated to Dalian Medical University, Dalian 116011, Liaoning, China; 2. Department of Histology and Embryology, Dalian Medical University, Dalian 116044, Liaoning, China)
Correspondence to: ZHOU Xin E-mail: dl_zhoufch@126.com
Background and purpose: Exploration of the effective early diagnostic and prognostic markers of non-small cell lung cancer (NSCLC) has important scientific significance and clinical value. Recently, the role of long chain non-coding RNA (lncRNA) in the tumor attracts widespread attention. This study intended to investigate the level of lncRNA HOTTIP in NSCLC, the effect of HOTTIP on cell proliferation and its mechanisms. Methods: Expression of lncRNA HOTTIP in tumor and their matched non-tumor tissues were determined by quantitative real-time PCR (qRT-PCR) in NSCLC patients. Then, we analyzed the potential correlation of lncRNA HOTTIP expression levels in tumor tissues with clinicopathological features of NSCLC and clinical outcome. The effects of HOTTIP on NSCLC cell proliferation and apoptosis were tested using in vitro MTT and flow cytometric assays. Western blot method was uesd to detect the expressions of proteins. Results: LncRNA HOTTIP expression level was significantly decreased in NSCLC tissues in comparison to adjacent non-tumor tissues (P<0.05). It was also proved that HOTTIP expression was associated with NSCLC histological grade and lymph node metastasis. Moreover, knockdown of HOTTIP expression in A549 cell line decreased proliferation and enhanced apoptosis compared with transfected negative control. Western blot assay showed that the level of Bax protein was significantly increased, whereas Bcl-2 was significantly decreased in HOTTIP-silencing A549 cell. Conclusion: HOTTIP is a novel prognostic biomarker and a potential therapeutic candidate forNSCLC.
lncRNA; HOTTIP; Non-small cell lung cancer; Proliferation; Apoptosis
10.3969/j.issn.1007-3969.2015.09.002
R734.2
A
1007-3639(2015)09-0652-07
2015-04-09
2015-07-20)
吴阶平基金(320675014037)。
周欣 E-mail:dl_zhoufch@126.com
