培美曲塞与多西他赛联合铂类一线治疗晚期肺腺癌的疗效比较
2015-04-19贲素琴
周 娟,贲素琴
1.南通大学附属医院呼吸科,江苏 南通 226001;
2.上海市第一人民医院呼吸科,上海200080
培美曲塞与多西他赛联合铂类一线治疗晚期肺腺癌的疗效比较
周 娟1,贲素琴2
1.南通大学附属医院呼吸科,江苏 南通 226001;
2.上海市第一人民医院呼吸科,上海200080
背景与目的:目前,晚期肺腺癌主要依靠以化疗为主的综合治疗。培美曲塞作为一种多靶点抗叶酸制剂,与铂类药物联合应用治疗晚期肺腺癌,因其疗效好、不良反应轻而受到推崇。本研究比较培美曲塞与多西他赛联合铂类一线治疗晚期肺腺癌的效果及不良反应。方法:将50例晚期肺腺癌患者随机分为培美曲塞+顺铂(PC)组和多西他赛+顺铂(TP)组。每组各25例患者。PC组:培美曲塞500 mg/m2静脉滴注,第1天;顺铂75 mg/m2静脉滴注,第1天。TP组:多西他赛75 mg/m2静脉滴注,第1天;顺铂75 mg/ m2静脉滴注,第1天。两组1个周期均为21 d。比较两组的有效率(response rate,RR)、疾病控制率(disease control rate,DCR)、无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。测定外周血T淋巴细胞亚群活性,评价两组患者免疫功能。结果:50例患者均可评价疗效及不良反应,两组均无完全缓解(complete remission,CR)病例,部分缓解(partial remission,PR)20例,疾病稳定(stable disease,SD)17例,疾病进展(progressive disease,PD)13例。PC组与TP组的RR、DCR、PFS和OS差异均无统计学意义(P>0.05)。PC组治疗后与TP组相比,CD3+、CD4+、CD4+/CD8+T细胞和NK细胞活性均升高,CD8+T细胞活性降低,但差异无统计学意义(P>0.05)。两组的不良反应主要为骨髓抑制和消化道反应,PC组Ⅲ~Ⅳ级不良反应白细胞减少、血小板减少、消化道症状和乏力的发生率低于TP组,差异有统计学意义(P<0.05)。结论:培美曲塞与多西他赛联合顺铂治疗晚期肺腺癌的临床疗效相当,但前者可降低不良反应发生率。
肺腺癌;培美曲塞;多西他赛;化疗
近年统计数据显示,在晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)新发病例中,鳞癌约占30%,腺癌比例增加迅猛,约占60%,而在女性NSCLC患者中,腺癌比例甚至接近90%[1]。目前晚期肺腺癌主要依靠以化疗为主的综合治疗[2],靶向治疗成为热点。但其中大部分患者仍需以化疗为主,含铂双药联合方案在治疗中的基石地位仍不可动摇。培美曲塞是一种新型的多靶点抗叶酸制剂,不良反应轻,与铂类药物联合应用治疗晚期肺腺癌目前受到推崇[3]。美国食品药品管理局(Food and Drug Administration,FDA)于2008年9月30日批准培美曲塞联合顺铂作为治疗晚期肺腺癌的一线治疗方案。
本研究对2012年5月—2014年10月在南通大学附属医院呼吸科和上海市第一人民医院呼吸科分别采用培美曲塞+顺铂(PC)和多西他赛+顺铂(TP)方案化疗的50例无手术指征的晚期肺腺癌患者进行对比研究,比较培美曲塞与多西他赛联合铂类一线治疗晚期肺腺癌的效果及不良反应。
1 资料和方法
1.1 临床资料
入选标准:① 2012年5月—2014年10月经病理学或细胞学证实的TNM分期为Ⅲb期、Ⅳ期腺癌的50例患者,其中男性29例,女性21例;Ⅲb期11例,Ⅳ期39例。② CT证实不能手术的腺癌,有可测量的或可评估的肿瘤病灶。③ 受试者无心、肝、肾、骨髓功能障碍。④ 近1个月内未作过其他抗肿瘤治疗。将患者随机分为PC组和TP组:PC组25例,采用培美曲塞+顺铂化疗;TP组25例,采用多西他赛+顺铂化疗。两组年龄、性别等差异均无统计学意义。两组患者各影响因素之间均衡性好(表1)。25名健康体检者作为对照组。
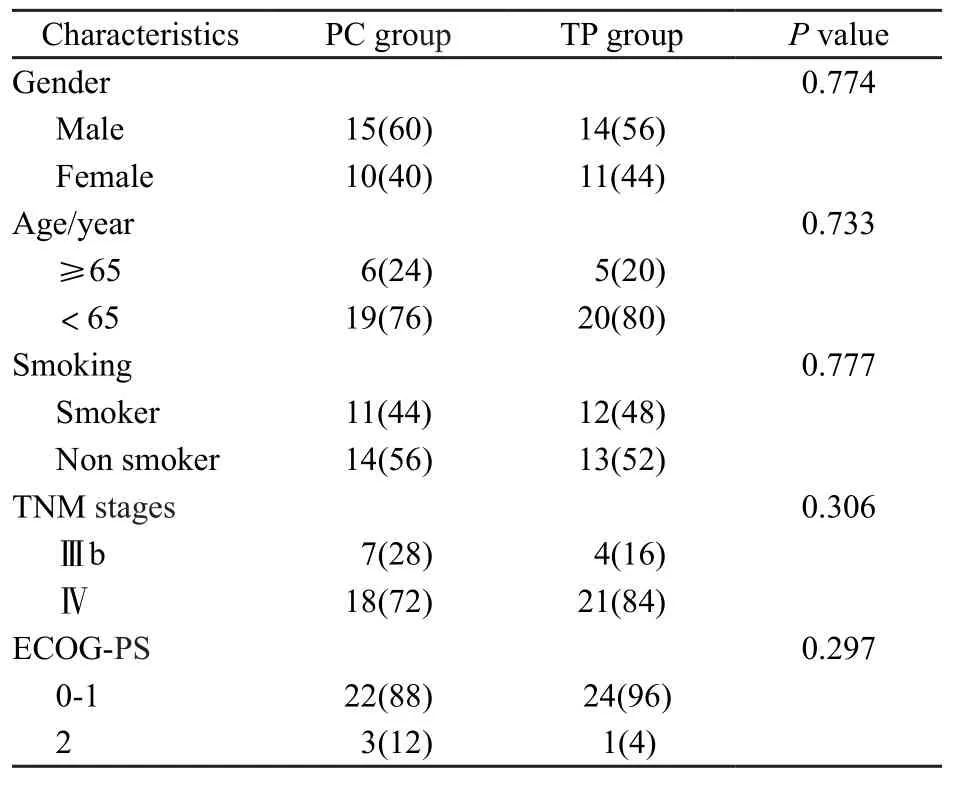
表 1 患者临床资料比较Tab. 1 Patients' characteristics [n(%)]
1.2 治疗方法
PC组:培美曲塞预处理,给药前1周肌肉注射维生素B121 000 μg/次,每3个周期重复1次,首次培美曲塞给药前1周口服叶酸400 μg/d,持续至培美曲塞末次给药后21 d,培美曲塞给药前1天、当天及给药后1天口服地塞米松8 mg/d,分2次服用。培美曲塞500 mg/m2,静脉滴注,第1天;顺铂75 mg/m2,静脉滴注,第1天。TP组:多西他赛预处理,给药前1天、当天及给药后1天口服地塞米松16 mg/d,分2次服用。多西他赛75 mg/m2静脉滴注,第1天;顺铂75 mg/m2静脉滴注,第1天。两组1个周期均为21 d。化疗2个周期以上作评价。
1.3 观察指标和疗效评价
① 治疗开始和结束后每两周检测血常规,每月监测肝肾功能。② 流式细胞术检测外周血T淋巴细胞亚群活性,正常对照组于治疗前,PC组和TP组于治疗前、第二次治疗结束后7天检测各指标并与正常对照组比较。③ 观察X线、CT诊断结果在治疗前后的变化。④ 比较两组的有效率(response rate,RR)、疾病控制率(disease control rate,DCR)、无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。按照WHO抗肿瘤药物疗效进行疗效评价,分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。RR=(CR+PR)/总例数×100%;DCR=(CR+PR+SD)/总例数×100%。PFS是指患者从首次用药到观察到疾病进展或因任何原因死亡的时间。⑤ 不良反应评定按照WHO标准分为0~Ⅳ度。
1.4 后续治疗及随访
随访日期截至2015年1月,1例患者失访。进行表皮生长因子受体(epithelial growth factor receptor,EGFR)基因检测的患者共24例,其中EGFR野生型11例,EGFR突变型13例。共有19例患者接受表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)二线或三线治疗,中位治疗时间为5个月。
1.5 统计学处理
结果采用SPSS 16.0软件进行分析,患者临床资料比较采用t检验,疗效分析采用χ2检验,生存期分析采用Kaplan-Merier曲线法和log-rank检验。对患者预后产生影响的因素采用Cox比例风险模型进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗后疗效比较
50例患者均按计划完成了2个周期以上化疗,中位化疗周期为4个周期,均能评定疗效。两组均无CR病例,PR 20例,SD 17例,PD 13例。PC组RR及DCR较TP组高,PFS及OS较TP组延长,但两组RR、DCR、PFS及OS差异均无统计学意义(P>0.05,表2,图1、2)。本研究所有患者均在疾病进展后接受二线治疗,无维持治疗者。其中接受EGFR-TKIs后续治疗的患者19例,中位生存期为21个月(95%CI:16.4~25.6);未接受EGFR-TKIs治疗者31例,中位生存期为18个月(95%CI:15.5~20.5)。二者比较差异无统计学意义(χ2=0.986,P=0.32)。
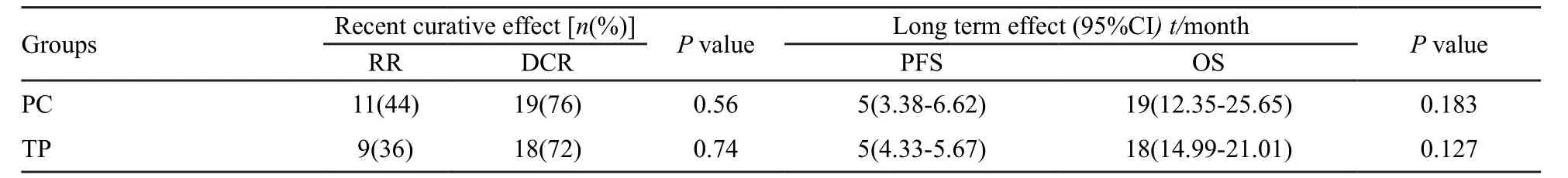
表 2 两组患者疗效比较(n=25)Tab. 2 Clinical efficacy of two groups(n=25)
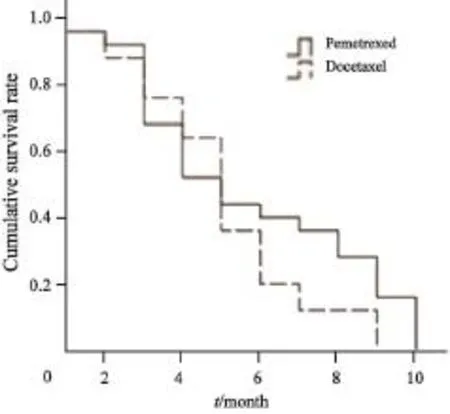
图 1 两种化疗方案患者的PFS曲线Fig. 1 PFS curve of two chemotherapy methods
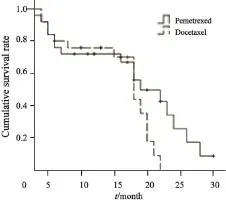
图 2 两种化疗方案患者的OS曲线Fig. 2 OS curve of two chemotherapy methods
2.2 Cox回归分析
结果显示,无论是PC还是TP方案,均不是影响PFS(P=0.403)和OS(P=0.294)的独立危险因素(图3)。
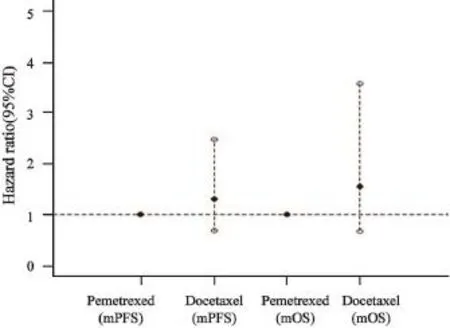
图 3 两种化疗方案与PFS及OS之间的Cox回归分析Fig. 3 Cox multivariate analysis of two chemotherapy methods with PFS and OS
2.3 T淋巴细胞亚群、NK细胞活性变化
与对照组相比,肺癌患者CD3+、CD4+、CD4+/CD8+T细胞和NK细胞活性均降低,CD8+T细胞活性升高,差异有统计学意义(P<0.05)。PC组与TP组治疗前比较各指标差异无统计学意义(P>0.05)。PC组和TP组治疗后CD3+、CD4+、CD4+/CD8+T细胞和NK细胞活性均较治疗前升高,CD8+T细胞活性较治疗前降低,但差异无统计学意义(P>0.05)。PC组治疗后与TP组相比,CD3+、CD4+、CD4+/CD8+T细胞和NK细胞活性均升高,CD8+T细胞活性降低,但差异无统计学意义(P>0.05,表3)。
2.4 不良反应
PC组Ⅲ~Ⅳ级不良反应白细胞减少、血小板减少、消化道症状、乏力的发生率低于TP组,差异有统计学意义(P<0.05,表4)。
表 3 治疗前后两组患者T细胞亚群活性比较Tab. 3 The changes in T lymphocyte subsets activity in patients before and after chemotherapy
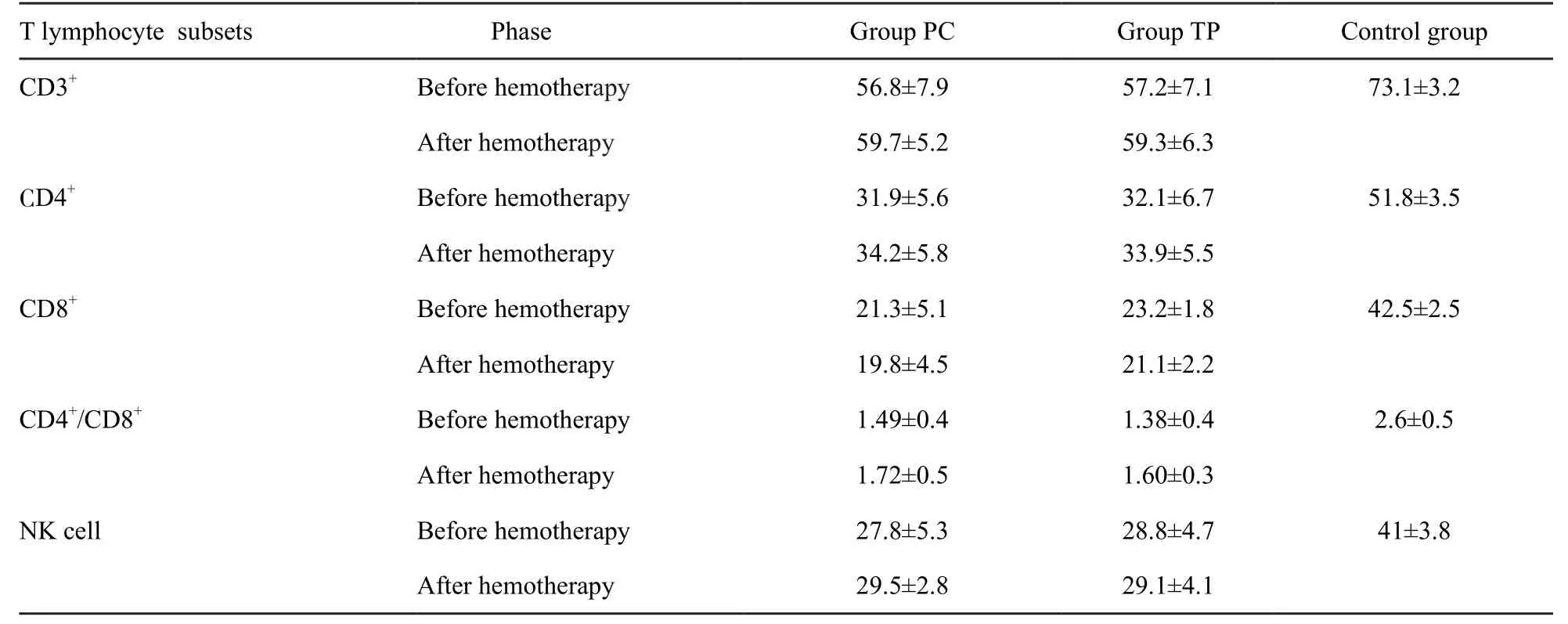
表 3 治疗前后两组患者T细胞亚群活性比较Tab. 3 The changes in T lymphocyte subsets activity in patients before and after chemotherapy
T lymphocyte subsets Phase Group PC Group TP Control group CD3+ Before hemotherapy 56.8±7.9 57.2±7.1 73.1±3.2 After hemotherapy 59.7±5.2 59.3±6.3 CD4+ Before hemotherapy 31.9±5.6 32.1±6.7 51.8±3.5 After hemotherapy 34.2±5.8 33.9±5.5 CD8+ Before hemotherapy 21.3±5.1 23.2±1.8 42.5±2.5 After hemotherapy 19.8±4.5 21.1±2.2 CD4+/CD8+ Before hemotherapy 1.49±0.4 1.38±0.4 2.6±0.5 After hemotherapy 1.72±0.5 1.60±0.3 NK cell Before hemotherapy 27.8±5.3 28.8±4.7 41±3.8 After hemotherapy 29.5±2.8 29.1±4.1
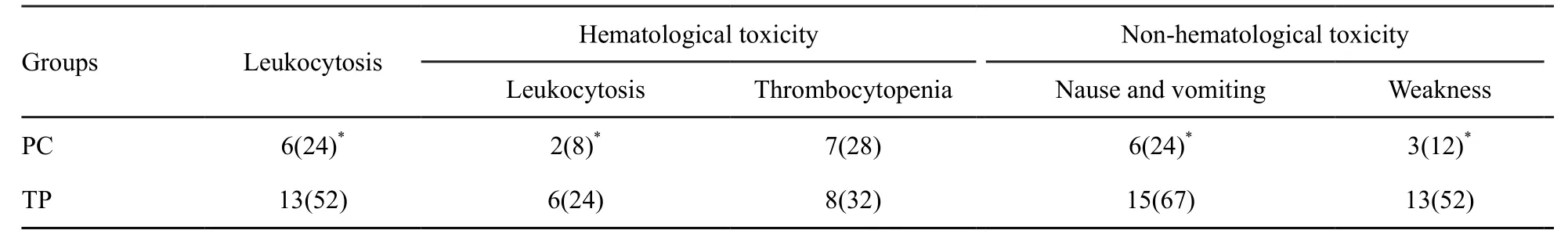
表 4 两组化疗后的Ⅲ~Ⅳ级不良反应比较Tab. 4 Ⅲ-Ⅳ toxicity of the chemotherapy [n(%)]
3 讨 论
近年来,医学界致力于探求针对晚期NSCLC可以延长患者生存期、提高缓解率的有效化疗方案。新一代的化疗药紫杉醇、多西他赛和吉西他滨等联合铂类延长了NSCLC患者特别是肺腺癌患者的生存期,改善了患者生存质量。其中多西他赛是半合成的紫杉类衍生物,通过促进细胞微管聚合,抑制其解聚从而使游离小管的数量显著减少,也可通过破坏微管的网状结构,从而抑制细胞分裂和增殖,达到抗肿瘤的目的,在晚期非小细胞肺癌一线、二线化疗方案中占据了重要的地位[4]。但多西他赛的血液不良反应,影响了患者的依从性。
培美曲塞是一种新的人工合成的多靶点抗代谢药物。它是核苷酸合酶/二氢叶酸还原酶双重抑制剂,对多个叶酸依赖酶有很强的抑制作用,可以从多个途径抑制嘧啶和嘌呤的合成,从而起到抗肿瘤作用,并且能降低肿瘤的耐药性[5]。无论作为一线治疗的JMDB研究,还是二线治疗的JMEI研究,以及维持治疗的JMEN研究[6-8],这些大规模、多中心随机对照的临床研究均显示培美曲塞对非鳞状NSCLC的良好疗效。周彩存等[9-10]研究结论提示,培美曲赛可作为中国晚期非鳞状NSCLC患者一线治疗后换药维持或二线治疗的标准化疗方案。其他多项临床研究也显示,培美曲塞在非鳞NSCLC,尤其是腺癌治疗中较其他常用的三代化疗药物如吉西他滨、多西他赛更具优势[11]。Langer等[12]的研究也表明,培美曲塞一线治疗对肺腺癌有效率更高。
Hanna等[6]的研究对比单药培美曲塞与多西他赛二线治疗晚期非鳞NSCLC,无论RR、中位生存期还是1年生存率差异均无统计学意义,而培美曲塞组的不良反应明显降低。正是基于这项研究,FDA批准培美曲塞作为晚期NSCLC二线治疗的标准药物,并批准培美曲塞与顺铂联用为治疗非鳞癌NSCLC的一线治疗方案。
本研究25例接受培美曲塞联合铂类方案一线治疗的患者,中位PFS为5个月,中位OS为19个月,显示出培美曲塞良好的疗效。与多西他赛联合顺铂一线治疗晚期肺腺癌比较结果提示,培美曲塞组RR、DCR较多西他赛组提高,中位PFS、OS较多西他赛组延长,虽然差异无统计学意义,但仍显示出培美曲塞的优势。多因素分析结果显示,无论是PC方案还是TP方案,均不是影响PFS和OS的独立危险因素,考虑是否与统计的样本过小有关,可扩大临床样本数进一步分析培美曲塞或多西他赛不同化疗药物对患者PFS和OS的影响。
肿瘤细胞能分泌多种免疫抑制因子,晚期肺癌患者在肿瘤进展过程中常出现免疫功能紊乱低下,T淋巴细胞免疫功能低下,以及NK细胞杀伤作用明显减弱[13]。本研究结果显示,50例肺癌患者化疗前CD3+、CD4+、CD4+/CD8+T细胞和NK细胞比例低于健康对照组,CD8+T细胞比例增高,与杨红[14]的报道一致。这提示患者免疫功能处于抑制状态,细胞免疫对肿瘤的控制能力有限,正可以解释肿瘤细胞的免疫逃避机制和诱发肿瘤的起因。而化疗后两组CD3+、CD4+、CD4+/ CD8+T细胞和NK细胞比例总体较化疗前有上升,CD8+T细胞比例下降,以培美曲塞组更为明显,虽然差异无统计学意义。但提示有效化疗对晚期肺癌患者免疫功能的改善发挥了作用,推测其可能通过化疗后的免疫重建使得肺癌患者的细胞免疫功能得到提高。
化疗药物引起的不良反应常使其应用受到了很大的限制。本研究比较两组均无致命性反应,其不良反应主要为骨髓抑制和消化道反应。培美曲塞组Ⅲ~Ⅳ级不良反应白细胞减少、血小板减少、消化道症状、乏力的发生率低于多西他赛组,差异有统计学意义。研究结果提示,培美曲塞与顺铂联合治疗晚期NSCLC可获较高疗效,与多西他赛联合顺铂相比,疗效相当且不良反应轻,耐受性好,是肺腺癌患者目前较为理想的方案;但尚需大样本的前瞻性随机研究进一步证实。
[参 考 文 献]
[1] SAKURAI H, ASAMURA H, GOYA T, et al. Survival differences by gender for resected non-small cell lung cancer: a retrospective analysis of 12,509 cases in a Japanese Lung Cancer Registry study[J]. J Thorac Oncol, 2010, 5(10): 1594-1601.
[2] PIRKER R, MINAR W. Chemotherapy of advanced non-small cell lung cancer[J]. Front Radiat Ther Oncol, 2010, 42: 157-163.
[3] KELLY K, CHANSKY K, MACK P C, et al. Chemotherapy outcomes by histologic subtypes of non-small-cell lung cancer: analysis of the southwest oncology group database for antimicrotubule-platinum therapy[J]. Clin Lung Cancer, 2013, 14(6): 627-635.
[4] BELANI C P. Optimizing chemotherapy for advanced nonsmall cell lung cancer:focus on docetaxel[J]. Lung Cancer, 2005, 50(Suppl 2): 3-8.
[5] KAWANO Y, OHYANAGI F, YANAGITANI N, et al. Pemetrexed and cisplatin for advanced non-squamous nonsmall cell lung cancer in Japanese patients: phase Ⅱ study[J]. Anticancer Res, 2013, 33(8): 3327-3333.
[6] HANNA N, SHEPHERD F A, FOSSELLA F V, et al. Randomized phase Ⅲ trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy[J]. J Clin Oncol, 2004, 22(9):1589-1597.
[7] CIULEANU T, BRODOWICZ T, ZIELINSKI C, et al. Maintenande pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer:a randomized, double-blind, phase 3 study[J]. Lancet, 2009, 374(9699): 1432-1440.
[8] SCAGLIOTTI G V, PARIKH P, VOL PAWEL J, et al. PhaseⅢ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21): 3543-3551.
[9] 周彩存, 吴一龙, 孙 燕, 等. 组织学类型对培美曲塞治疗中国晚期非小细胞肺癌二线及一线后维持治疗患者的综合分析[J]. 中华肿瘤杂志, 2014, 36(1): 29-33.
[10] SUN Y, WU Y L, ZHOU C C, et a1. Second-line pemetrexed versus docetaxel in Chinese patients with locally advanced or metastatic non-small cell lung cancer: a randomized, openlabel study[J]. Lung Cancer, 2013, 79(2): 143-150.
[11] ZINNER R G, NOVELLO S, PENG G, et al. Comparison of patient outcomes according to histology among pemetrexedtreated patients with stage ⅢB/Ⅳ non-small-cell lung cancer in two phase Ⅱtrials[J]. Clin Lung Cancer, 2010, 11(2): 126-131.
[12] LANGER C J, BESSE B, GUALBERTO A, et al. The evolving role of histology in the management of advanced non-smallcell lung cancer[J]. J Clin Oncol, 2010, 28(36): 5311-5320.
[13] 姚东平, 王祖蓉. 五分类血液分析仪对诊断白血病的价值[J]. 检验医学与临床, 2011, 8(5): 578, 580.
[14] 杨 红. 流式细胞术检测25例肺癌患者T淋巴细胞亚群表型分析[J]. 中国实用医药, 2009, 4(26): 36-37.
第二届中-欧个体化肿瘤免疫标志物专家学术论坛将于上海举行
“第二届中-欧个体化肿瘤免疫标志物专家学术论坛”将于2015年11月12日(周四),11月13日(周五)在复旦大学附属肿瘤医院举办。本次论坛由复旦大学附属肿瘤医院(欧盟第七框架协议计划——“免疫与癌症”国际合作项目组联合主席)、法国Transgene生物公司(梅里埃旗下)、德国汉诺威医学院、意大利国家癌症中心、丹麦哥本哈根大学联合主办,复旦大学附属肿瘤医院承办。该论坛是复旦大学附属肿瘤医院与欧盟合作的“癌症与免疫项目”(IMMUNOCAN)的一个重要组成部分,旨在促进中国和欧盟在癌症研究领域更深入、更广泛的交流与合作。
本届论坛我们邀请到了陈竺院士、法国梅里埃总裁Alain Merieux先生担任大会荣誉主席,曹雪涛院士、Laurence Zitvogel教授担任大会主席,邵志敏教授、Romain MICOL先生担任副主席。此外,我们还邀请到欧盟委员会国际合作项目处主任、法国领事馆参赞以及近20位国际国内著名专家出席并做精彩主题大会报告。
大会联系人:曹春梅
联系方式:sino_euro_conf@shca.org.cn
联系电话:18121299304
The clinical effects of pemetrexed or docetaxel combined with cisplatin as the first line treatment for advanced lung adenocarcinoma
ZHOU Juan1, BEN Suqin2
(1.Department of Respiratory Medicine, Affiliated Hospital of Nantong University, Nantong 226001, Jiangsu, China; 2.Department of Respiratory Medicine, Shanghai General People’s Hospital, Shanghai Jiao Tong University, Shanghai 200080, China)
BEN Suqin E-mail: bensuqin@163.com
Background and purpose: At present, the advanced lung adenocarcinoma is mainly treated by chemotherapy-oriented comprehensive therapy. Pemetrexed as a multi-target antifolate chemotherapeutic drug, combined with platinum, was approved for treatment of advanced lung adenocarcinoma because of its low toxicity and high efficacy. The purpose of this study was to compare the short-term clinical efficacy and toxicity of pemetrexed and docetaxel combined with cisplatin for advanced lung adenocarcinoma. Methods: Fifty patients with stage Ⅲ-Ⅳ lung adenocarcinoma were randomly divided into two groups. Group PC received pemetrexed (500 mg/m2, d1) combined with cisplatin (75 mg/m2, d1) and group TP received docetaxel (75mg/ m2, d1) combined with cisplatin (75 mg/m2, d1) treatment. One cycle was 21 days in both two groups. The response rate (RR), disease control rate (DCR), progressionfree survival (PFS) and overall survival (OS) of the two groups were compared. The peripheral blood T lymphocyte subsets and natural killer (NK) cell activity of patients in both groups were measured before and after the treatment, while compared with healthy controls (25 cases). Results: Among 50 patients, no one got complete remission (CR), 20 patients got partial remission (PR), 17 patients had stable disease (SD) and 13 patients had progressive disease (PD).It showed no significant difference in RR, DCR, PFS and OS (P>0.05) between two groups. Compared with group TP, the activity of CD3+, CD4+, CD4+/CD8+T cells and NK cells increased and CD8+T cells reduced in group PC after treatment, but the value had no obvious change (P>0.05). The common side effects were hematological toxicity and gastrointestinal response. The incidence of side effects in group PC was lower than that in group TP, and the degree was also slighter (P<0.05). Conclusion: The clinical efficacy of pemetrexed combined with cisplatin is equal to docetaxel combined with cisplatin in treatment of advanced lung adenocarcinoma, but the former could reduce the adverse reaction rate.
Lung adenocarcinoma; Pemetrexed; Docetaxel; Chemotherapy
10.3969/j.issn.1007-3969.2015.09.005
R734.2
A
1007-3639(2015)09-0671-06
2015-02-06
2015-04-15)
贲素琴 E-mail:bensuqin@163.com
