miR-1284过表达对人胃癌SGC-7901细胞基因表达谱及侵袭转移的影响
2015-04-19韦尉元稳珑詹泽栩谢玉波
韦尉元, 稳珑,詹泽栩,余 晗,谢玉波,肖 强
1. 广西医科大学第一附属医院胃肠腺体外科,广西 南宁530021;
2. 广西医科大学第一附属医院麻醉科,广西 南宁530021
miR-1284过表达对人胃癌SGC-7901细胞基因表达谱及侵袭转移的影响
韦尉元1, 稳珑1,詹泽栩1,余 晗1,谢玉波2,肖 强1
1. 广西医科大学第一附属医院胃肠腺体外科,广西 南宁530021;
2. 广西医科大学第一附属医院麻醉科,广西 南宁530021
背景与目的:人胃癌组织微小RNA表达谱芯片筛选研究报道miR-1284与胃癌淋巴结转移有关,但其在胃癌中的具体作用鲜见报道。该研究探讨miR-1284过表达对人胃癌SGC-7901细胞基因表达谱及侵袭转移的影响。方法:以慢病毒介导miR-1284过表达转染胃癌SGC-7901细胞为实验组(LV-miR-1284组),转染空载体慢病毒载体的细胞为阴性对照组(LV-NC-GFP组),未转染慢病毒载体的细胞为空白组(Control组)。采用荧光定量PCR检测各组细胞miR-1284的表达,芯片检测各组细胞差异表达基因,生物信息学预测miR-1284的靶基因,Transwell侵袭实验检测各组细胞侵袭能力,裸鼠皮下移植瘤模型检测各组细胞转移能力。结果:PCR结果显示,与LV-NC-GFP组和Control组比较,LV-miR-1284组细胞miR-1284表达明显增高;芯片结果显示,LV-miR-1284组有20个基因表达显著上调,17个基因表达显著下调;生物信息学预测miR-1284的靶基因有138个基因;Transwell侵袭实验结果显示,LV-miR-1284组侵袭细胞数为70.00±2.37,其细胞侵袭能力较LV-NCGFP组(168.67±4.55)和Control组(170.33±3.08)明显减弱;体内裸鼠实验结果显示,LV-miR-1284组肝脏转移率为14.29%,其细胞转移能力较LV-NC-GFP组(85.71%)和Control组(85.71%)明显减弱。结论:miR-1284过表达能抑制人胃癌SGC-7901细胞侵袭转移,其机制可能与调控SUMO1、JUN基因表达有关。
胃癌;miR-1284;侵袭;转移
胃癌是发生率和死亡率较高的恶性肿瘤之一,侵袭和转移是导致死亡的主要因素。因此,深入探讨胃癌侵袭和转移机制,寻找胃癌侵袭转移相关的分子,对胃癌的治疗及预后具有重要的意义。微小RNA(microRNA,miRNA)发挥作用主要在转录后水平负性调控蛋白编码基因,且与胃癌转移密切相关[1-2]。最近,胃癌miRNA表达谱芯片筛选研究报道了miR-1284在胃癌淋巴结转移阳性组织比原胃癌组织表达量少[3],提示其表达异常可能与胃癌发生转移相关。而miR-1284在胃癌中的具体作用及机制鲜见报道,因此,本研究拟探讨miR-1284对胃癌侵袭转移发生、发展的影响。
1 材料和方法
1.1 主要材料及试剂
人胃癌细胞株SGC-7901购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库;RPMI-1640培养基购自HyClone公司;胎牛血清(FBS)购自杭州四季青生物工程材料有限公司;Transwell小室购自美国Corning公司;Matrigel购自美国BD公司;miR-1284过表达慢病毒载体和质粒由上海吉凯基因化学技术有限公司构建合成;芯片检测由北京华联生物科技有限公司完成;miRNA反转录、定量PCR试剂盒、引物购自宝生物工程(大连)有限公司;21只4~5周龄雌性BALB/c裸鼠,体质量18~22 g,SPF级,购自广西医科大学动物实验中心。
1.2 细胞培养及转染
SGC-7901细胞使用RPMI-1640(含10%胎牛血清)培养液,在CO2体积分数为5%、37 ℃的培养箱中培养。细胞培养至对数生长期,常规胰酶消化细胞用于转染实验,以4×105个细胞/孔的密度接种于6 孔板,细胞长到50%~60%时,每孔更换为900 μL无血清RPMI-1640培养基中加入100 μL LipofectamineTM2000,实验组(LV-miR-1284组)和阴性对照组(LV-NCGFP组)每孔分别加入含miR-1284的病毒载体(5×108TU/mL)6.4 μL及阴性对照病毒(8× 108TU/mL)4 μL,转染24 h后,更换为RPMI-1640(含10%胎牛血清)培养液,72 h后用含5 μg/mL嘌呤霉素的培养液筛选稳定转染细胞株,稳定转染细胞株用于后续实验。
1.3 总RNA 提取及质检
取LV-miR-1284组、LV-NC-GFP组、空白组(control组,未转染病毒的SGC-7901细胞)的细胞,用PBS洗涤,按照TRIzol试剂说明提取总RNA。采用紫外分光光度计分别测定波长230、260和280 nm的吸光度(D)值,确定样品总RNA的纯度和浓度。以安捷伦RNA 6000 nano assay检测RIN评估RNA样本中18 s与28 s(真核生物)是否完整,以判定RNA的完整性(RIN值在0~10之间,以10 分为满分,RIN > 6表示样本的完整性良好可用于实验)。
1.4 荧光实时定量PCR 检测miR-1284的表达
采用反转录试剂盒合成cDNA,反转录反应条件为37 ℃,60 min。以合成的cDNA作为模板,U6作为内参,U6上游引物序列为5’-TTATGGGTCCTAGCCTGAC-3’,下游引物序列为5’-CACTATTGCGGGTCTGC-3’;miR-1284上游引物序列为5’-UCUAUACAG ACCCUGGCUUUUC-3’,下游引物序列为5’-CGTCTATACAGACCCTGGCTTTTC-3’。以SYBR Premix Ex TaqⅡ为扩增染料,进一步进行PCR扩增反应。反应条件为95 ℃预变性30 s,1个循环;PCR反应95 ℃变性5 s,60 ℃退火20 s,70 ℃延伸30 s,40个循环。采用2-△△Ct法计算miR-1284的相对表达量。
1.5 全基因表达谱芯片检测表达差异基因
以UniGene 最新数据库为筛选差异表达基因芯片基础。取LV-miR-1284组和LV-NC-GFP组的总RNA,随后反转录、标记,芯片杂交前须先进行前杂交处理,最后杂交、洗染,用激光共聚焦扫描仪对杂交结束后的芯片进行扫描,对杂交信号值进行扣本底、标准化,显著差异表达1.3倍以上的基因作为筛选纳入标准。
1.6 生物信息学分析芯片结果及预测miR-1284的靶基因
采用KEGG和GO进行通路及功能富集分析。用MiRanda、TargetScan和microRNA软件预测miR-1284的靶基因,网站分别为http://www. miranda.com、http://www.targetscan.org、http:// www.microrna.org。取芯片表达差异基因和生物信息学网站数据库预测靶基因的交集作为miR-1284的靶基因。
1.7 Transwell侵袭实验检测细胞侵袭能力
取Corning小室(孔径8 μm),在小室滤膜上铺一层Matrigel(用无血清培养液1∶4稀释,75 μL/孔,37 ℃温育30 min,形成胶状),在上室孔中加入未转染和转染后筛选稳定转染细胞(4×105个/孔,无血清培养基的单细胞悬液)。每组设4个复孔。下室中加入含10%血清的培养液600 μL,培养24 h后用冰预冷的甲醇固定30 min,用0.1%结晶紫染色15~20 min,用PBS洗3遍以上,显微镜100倍下拍照。随机选取10个视野进行细胞计数,计算平均每个视野侵袭细胞数。
1.8 裸鼠皮下移植瘤模型检测细胞转移能力
对LV-miR-1284组、LV-NC-GFP组、空白组的细胞,用PBS制备密度为2×107个/mL的单细胞悬液;取4~5周龄的裸鼠21只,每组7只,选取所有裸鼠左前肢腋窝作为种植部位,缓慢进针至皮下推注各组细胞0.25 mL(1×107个细胞)/只,正常喂养,监测裸鼠的生命及肿瘤生长情况;注射细胞后第38天脱颈椎法处死裸鼠,完整切取肿瘤组织和肝、肺组织。
1.9 统计学处理
采用SPSS 17.0统计软件进行统计分析。各组实验数据均用表示,各组间差异采用单因素方差分析,进一步组内比较采用t检验,计数资料采用χ2分析。P<0.05为差异有统计学意义。
2 结 果
2.1 样本总RNA质量鉴定结果
从LV-miR-1284组、LV-NC-GFP组和空白组细胞中提取总RNA,用紫外分光光度计测量D值。结果表明,D260/D280=1.95,D260、D230>1.72,提示提取总RNA 纯度高,蛋白质和DNA污染少。样本进一步以安捷伦RNA 6000 nano assay检测证实,RIN>6表示样本的完整性良好,可用于后续实验(表1)。
2.2 miR-1284在各组细胞中的表达情况
荧光定量PCR检测结果用2-△△Ct值表示,与LV-NC-GFP组(3.20±1.00)和空白组(1.00±0.00)比较,miR-1284的表达量在LV- miR-1284组(52.30±2.40)显著增高,差异有统计学意义(P<0.05);LV-NC-GFP组和空白组比较,差异无统计学意义(P>0.05)。
2.3 miR-1284过表达慢病毒转染SGC-7901细胞后差异表达的基因分析
对LV-miR-1284组和LV-NC-GFP组细胞中UniGene数据库人类基因表达谱数据进行分析表明,在检测到31 741个基因中,143个基因为差异性表达,其中显著表达上调20个,显著表达下调17个(表2)。

表 1 RNA质检结果Tab. 1 The results of RNA quality inspection
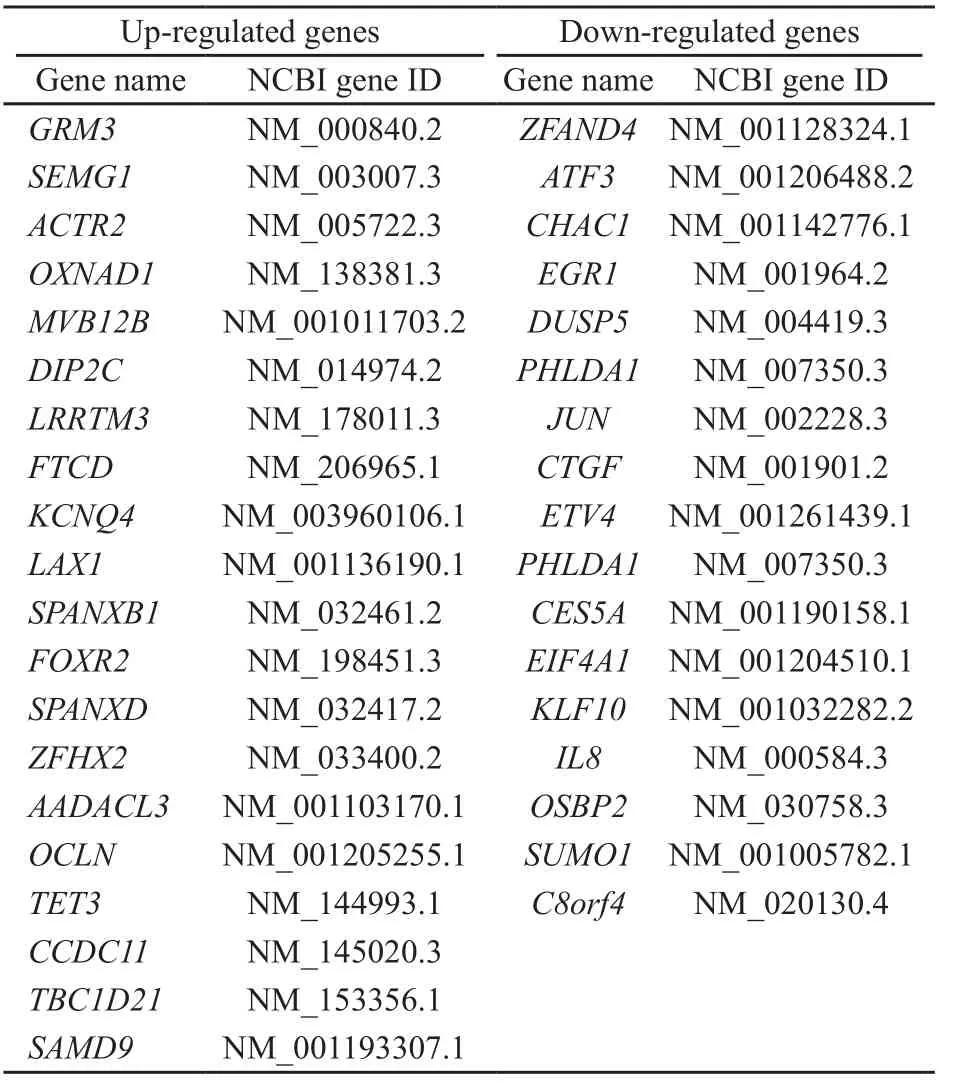
表 2 miR-1284过表达慢病毒转染SGC-7901细胞显著差异表达的基因Tab. 2 Significantly differential expression of genes in SGC-7901 cells infected with lentivirus containing over-expression of miR-1284
2.4 生物信息学分析芯片结果及预测miR-1284的靶基因
采用KEGG和GO进行通路及功能富集分析。结果显示,LV-miR-1284组中的显著差异表达基因TAOK2、NTF4、MAP3K13、JUN、GADD45A、DUSP1、DUSP4、DDIT3与MAPK信号通路相关,且JUN与肿瘤恶性转移密切相关(图1)。生物信息学网站软件预测miR-1284的靶基因为138个(表3)。取芯片表达差异基因和生物信息学网站数据库预测靶基因的交集,EIF4A1、KLF10、C8orf4、SUMO1基因为miR-1284的预测靶基因。
2.5 miR-1284对胃癌SGC-7901细胞侵袭能力的作用
Transwell侵袭实验结果提示,上调胃癌细胞miR-1284表达后,24 h时LV-miR-1284组侵袭细胞数为70.00±2.40,LV-NC-GFP组为168.70±4.60,空白组为170.30±3.10。与LVNC-GFP组和空白组比较,LV-miR-1284组侵袭细胞数均明显较少,差异均有统计学意义(P<0.05,图2)。
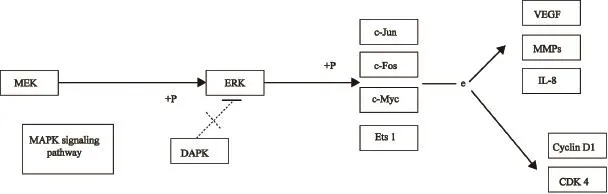
图 1 JUN基因参与MAPK信号通路调控Fig. 1 JUN gene involved in MAPK signaling pathway
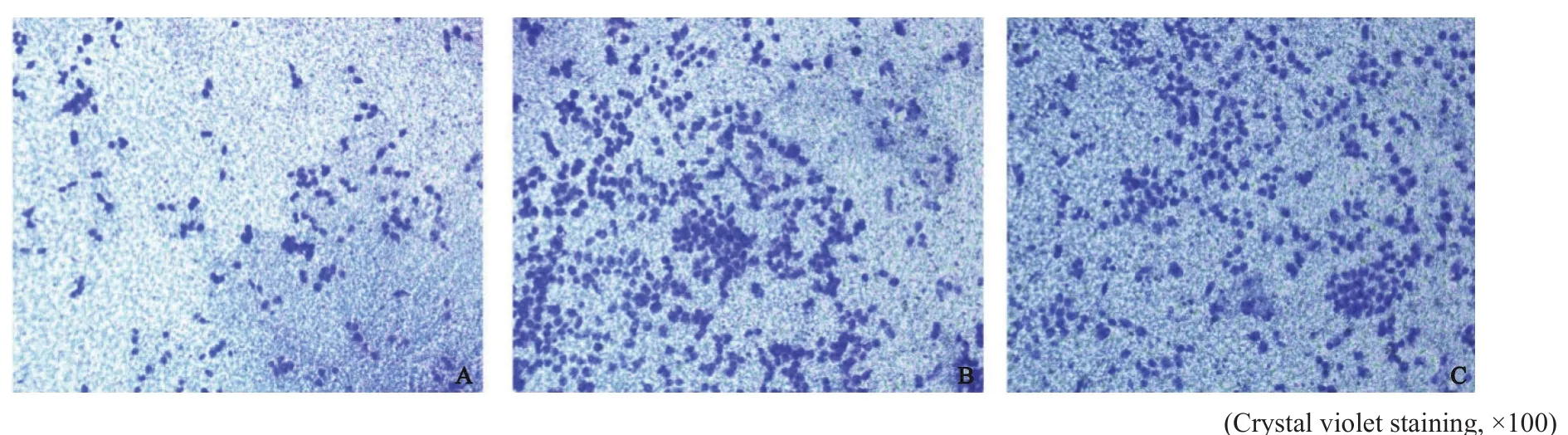
图 2 各组胃癌SGC-7901细胞的侵袭情况Fig. 2 Invasive situation of gastric cancer SGC-7901 cells in each group
2.6 裸鼠皮下移植瘤模型的细胞转移能力
肝肺组织病理检查显示:LV-miR-1284组肝脏转移率为14.29%,LV-NC-GFP组为85.71%,空白组为85.71%;LV-miR-1284组肺脏转移率为0.00%,LV-NC-GFP组为57.14%,空白组为42.86%。与LV-NC-GFP组和空白组比较,LV-miR-1284组细胞肝脏转移率明显较少,差异有统计学意义(P<0.05);LV-miR-1284组细胞肺脏转移率均较少,但差异无统计学意义(P>0.05,图3,表4)。
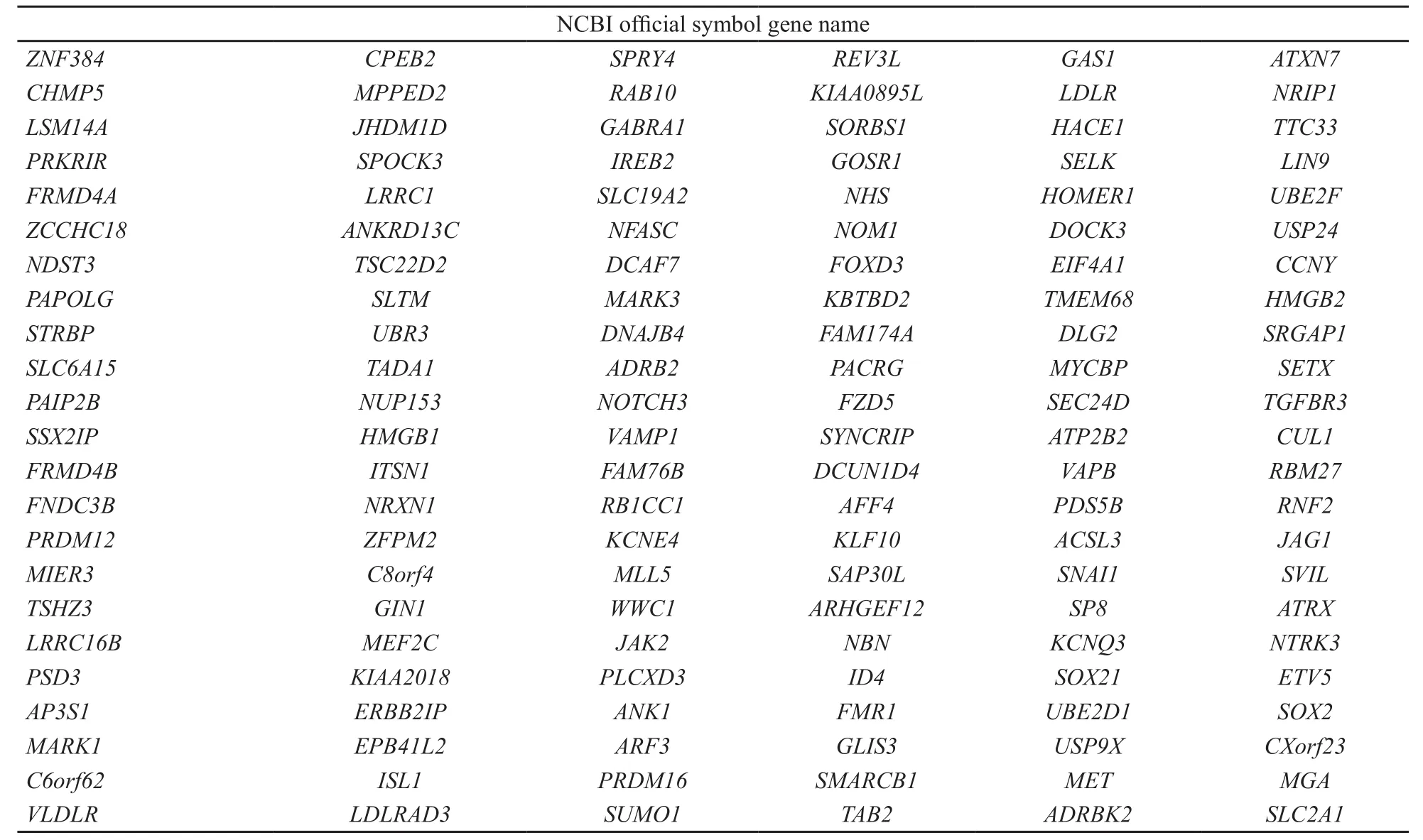
表 3 生物信息学网站预测miR-1284的靶基因Tab. 3 The target genes of miR-1284 predicted by bioinformatics website
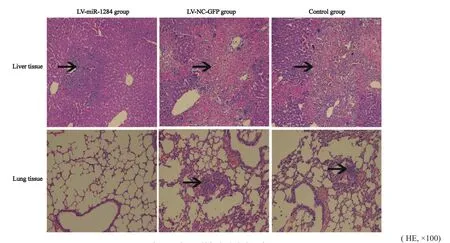
图 3 各组肝肺组织的裸鼠移植瘤细胞Fig. 3 HE staining of liver and lung tissues in cells transplanted tumor of nude mice in each group
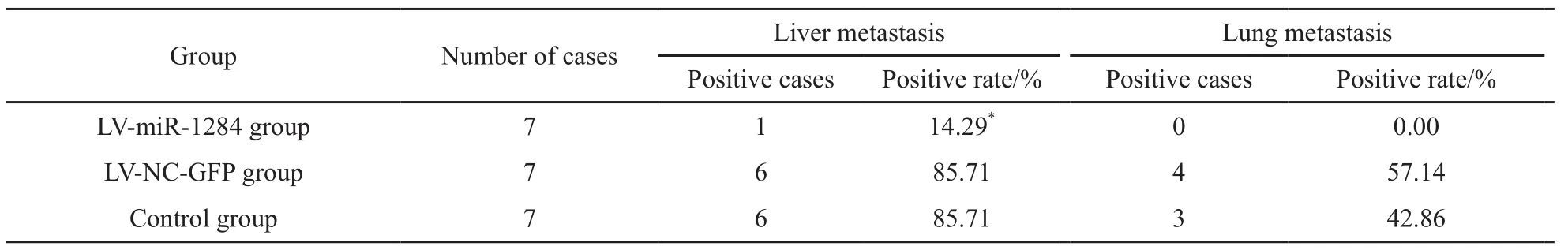
表 4 各组细胞裸鼠移植瘤肝肺转移情况Tab. 4 The metastasis cases of liver and lung tissues in cells transplanted tumor of nude mice in each group
3 讨 论
近年来,已证实微小miRNA是一类长约19~25个核普酸序列的内源性非编码单链小RNA,成熟的miRNA通过和靶基因mRNA碱基配对部分互补或完全互补结合,抑制其翻译或导致其降解而起到在转录后水平沉默基因表达的作用, miRNA的表达异常参与了细胞的多种生物学过程,比如细胞增殖、凋亡、迁移和侵袭等[4]。最近胃癌miRNA表达谱芯片筛选研究报道了miR-1284在胃癌淋巴结转移阳性组织比原胃癌组织表达量少[3]。而胃癌是常见的恶性肿瘤,且影响胃癌预后的主要因素就是胃癌的侵袭转移情况[5]。因此,研究与胃癌侵袭及转移可能密切相关的miR-1284具有重要意义。
本研究通过构建miR-1284过表达慢病毒载体,转染胃癌SGC-7901细胞,体外实验发现细胞侵袭能力下降,动物体内模型也显示能明显降低胃癌肝脏转移能力,且细胞芯片结果分析提示miR-1284与MAPK信号通路相关,且能显著降低JUN的表达,而JUN与肿瘤血管形成及恶性转移密切相关[6]。我们生物信息学预测发现SUMO1基因为miR-1284的预测靶基因,SUMO1蛋白的表达与癌组织的浸润深度和远处转移呈正相关[7],且SUMO1能调控JUN的表达[8],而在肿瘤中JUN表达降低可下调MMP蛋白的表达。MMP蛋白的活性降低,改变肿瘤细胞的侵袭能力,肿瘤细胞侵犯血管能力下降,进而抑制肿瘤的转移[9]。
综上所述,miR-1284过表达抑制胃癌的侵袭转移,可能与其靶向调控SUMO1基因有关,进而调控JUN基因信号通路,从而抑制胃癌的发生、发展,提示miR-1284可作为研究胃癌侵袭转移的重要靶点;而miR-1284是否直接调控SUMO1基因,将有待实验进一步验证。
[1] 李 明, 连海峰, 刘成霞, 等. miR-486-5p对胃癌细胞株SGC7901生物学行为的影响[J]. 中国癌症杂志, 2014, 24(4): 273-278.
[2] HUANG D, WANG H, LIU R, et al. miRNA27a is a biomarker for predicting chemosensitivity and prognosis in metastatic or recurrent gastric cancer[J]. J Cell Biochem, 2014, 115(3): 549-556.
[3] CHEN W, TANG Z, SUN Y, et al. miRNA expression profile in primary gastric cancers and paired lymph node metastases indicates that miR-10a plays a role in metastasis from primary gastric cancer to lymph nodes[J]. Exp Ther Med, 2012, 3(2): 351-356.
[4] BAER C, CLAUS R, PLASS C. Genome-wide epigenetic regulation of miRNAs in cancer[J]. Cancer Res, 2013, 73(2): 473-477.
[5] CHEHREI A, AMOUEIAN S, ANSARI J, et al. Comparison of five staging systems of lymph node metastasis in the gastric carcinoma[J]. J Res Med Sci, 2013, 18(10): 848-854.
[6] RANA A, RANA B, MISHRA R, et al. Mixed lineage kinasec-Jun N-terminal kinase axis: a potential therapeutic target in cancer[J]. Genes Cancer, 2013, 4(9-10): 334-341.
[7] 麦 蕾, 赖人旭, 林宇静, 等. 结直肠癌组织泛素样小分子修饰因子-1表达及其临床意义[J]. 中华肿瘤防治杂志, 2015, 22(2): 113-119.
[8] YANG P, ZHANG Y, XU J, et al. SUMO1 regulates endothelial function by modulating the overall signals in favor of angiogenesis and homeostatic responses[J]. Am J Transl Res, 2013, 5(4): 427-440.
[9] SUI H, CAI G X, PAN S F, et al. miR200c attenuates P-gpmediated MDR and metastasis by targeting JNK2/c-Jun signaling pathway in colorectal cancer[J]. Mol Cancer Ther, 2014, 13(12): 3137-3151.
The effect of miR-1284 over-expression on gene expression profiling and invasion/metastasis of human gastric cancer SGC-7901 cells
WEI Weiyuan1, CAO Wenlong1, ZHAN Zexu1, YU Han1, XIE Yubo2, XIAO Qiang1
(1. Department of Gastrointestine and Gland Surgery, First Affiliated Hospital of Guangxi Medical University, Nanning 530021, Guangxi, China; 2. Department of Anesthesiology, First Affiliated Hospital of Guangxi Medical University, Nanning 530021, Guangxi, China)
XIAO Qiang E-mail: xiaoqiang20050@aliyun.com
Background and purpose: It has been reported that miR-1284 is associated with gastric cancer lymph node metastasis in the research of microRNA microarray in human gastric cancer tissues. But the specific role of miR-1284 in gastric cancer has not been reported. The aim of this study was to investigate the effect of miR-1284 over-expression on the gene expression profiling and invasion/metastasis of human gastric cancer SGC-7901 cells. Methods: Gastric cancer SGC-7901 cells of LV-miR-1284 group were transfected with lentiviral vectors of miR-1284, cells of LV-NC-GFP group were transfected with lentiviral vectors without miR-1284, and cells of control group were not transfected with lentiviral vectors. The expression of miR-1284 was detected by the real-time fluorescent quantitative PCR. Differential expression genes were detected by the microRNA chip. Target genes of miR-1284 were predicted by the bioinformatics. Invasive ability was detected by the Transwell invasion assay. Metastasis ability was detected by subcutaneously transplanted tumor model of nude mice. Results: Compared with LV-NC-GFP and control groups, the expressions of miR-1284 and 20 genes were up-regulated, and the expression of 17 genes was down-regulated in LV-miR-1284 group. One hundred and thirty-eight target genes of miR-1284 were predicted by the bioinformatics website. Compared with invasive cell number of LV-NC-GFP group (168.67±4.55) and control group (170.33±3.08), the ability of invasion ofcells was weakened in LV-miR-1284 group (70.00±2.37). Compared with the liver metastasis rate of LV-NC-GFP group (85.71%) and control group (85.71%), the ability of metastasis of cells was weakened in LV-miR-1284 group (14.29%). Conclusion: The ability of invasion and metastasis of SGC-7901 cells is suppressed by over-expression of miR-1284. The mechanism may be related to regulating the expression of SUMO1 and JUN genes.
Gastric carcinoma; miR-1284; Invasion; Metastasis
10.3969/j.issn.1007-3969.2015.09.003
R73-37;R735.2
A
1007-3639(2015)09-0659-06
2015-03-24
2015-05-08)
广西科学技术攻关项目(桂科攻14124004-1-9);2015年广西研究生教育创新计划项目(YCBZ2015028)。
肖强 E-mail:xiaoqiang20050@aliyun.com
