宫颈癌细胞系中HPV16 E6、E7及E6/E7基因对STK31基因甲基化状态及表达的影响
2015-04-19殷复粉毕晓宁徐小惠王言奎
殷复粉,王 宁,于 啸 ,毕晓宁,徐小惠,王言奎
青岛大学医学院附属医院妇产科,山东 青岛 266003
宫颈癌细胞系中HPV16 E6、E7及E6/E7基因对STK31基因甲基化状态及表达的影响
殷复粉,王 宁,于 啸 ,毕晓宁,徐小惠,王言奎
青岛大学医学院附属医院妇产科,山东 青岛 266003
背景与目的:丝氨酸/苏氨酸蛋白激酶31(serine/threonine kinases 31,STK31)基因在人类多种癌症中扮演重要角色,且STK31基因的表达受其启动子及第一外显子区甲基化状态的影响;病毒感染与肿瘤组织中某些抑癌基因启动子区高甲基化有关。本研究旨在探讨宫颈癌细胞系中HPV16 E6、E7及E6/E7癌基因对STK31基因甲基化状态及表达的影响,以及不同种类甲基转移酶(DNA methyltransferases,DNMTs)基因在STK31基因甲基化中的潜在作用。方法:构建外源性HPV16 E6、E7以及E6/E7基因共表达慢病毒,分别感染人乳头瘤病毒(human papillomavirus,HPV)阴性宫颈癌细胞系HT-3及C33A,获得稳定转染的细胞系;采用亚硫酸氢盐基因组测序法(bisulfite genomic sequencing,BGS)和甲基化特异性PCR (methylation-specific PCR,MSP)检测3种HPV阳性宫颈癌细胞系HeLa、SiHa和CasKi以及HPV阴性宫颈癌细胞系HT-3和C33A转染前后STK31基因的甲基化状态;RT-PCR及蛋白[质]印迹法(Western blot)检测上述宫颈癌细胞系中STK31基因的表达以及DNMT1、DNMT2、DNMT3a、DNMT3b和DNMT3L基因在HPV16转染前后宫颈癌细胞系及HPV阳性、HPV阴性宫颈癌组织中的表达情况。结果:外源性HPV16 E6、E7以及E6/E7基因可在HPV阴性宫颈癌细胞系中稳定表达。3种HPV阳性细胞系HeLa、SiHa和CasKi中STK31基因呈低甲基化状态,STK31 mRNA及蛋白质表达阳性;2种HPV阴性细胞系HT-3、C33A中STK31基因则表现为高甲基化状态,STK31 mRNA及蛋白质表达缺失;与未感染慢病毒HT-3和C33A细胞系比较,外源性HPV16 E7以及E6/E7表达的HT-3和C33A细胞系STK31基因甲基化程度降低,其mRNA及蛋白质重新表达。DNMT1、DNMT3a和DNMT3b基因在HT-3E6/E7和C33AE6/E7细胞系中mRNA水平分别高于HT-3空载细胞系和C33A空载细胞系,差异有统计学意义(P<0.001)。DNMT1、DNMT3a和DNMT3b基因的mRNA水平在HPV16阳性宫颈癌组织中的表达高于其在HPV阴性宫颈癌组织中的表达,差异有统计学意义(t=5.997,P<0.001;t=6.743,P<0.001;t=7.926,P<0.001)。DNMT2在HT-3E6/E7和C33AE6/E7细胞系中mRNA表达水平分别低于HT-3空载细胞系和C33A空载细胞系,差异有统计学意义(t=7.451,P<0.001;t=2.451,P<0.05);DNMT2基因转录水平在HPV16阳性宫颈癌组织中低于HPV阴性宫颈癌组织(t=9.134,P<0.001)。DNMT3L mRNA表达水平在宫颈癌细胞系转染前后及HPV阴阳性宫颈癌组织中的差异无统计学意义(P>0.05)。结论:HPV感染可导致STK31基因启动子及第1外显子区甲基化状态降低,低甲基化状态促进该基因表达。STK31基因的表达受其启动子及第1外显子区甲基化状态的调控。HPV16 E7、E6/E7基因可能通过影响DNMT2的表达参与调控癌基因STK31基因启动子及第1外显子区甲基化状态。
丝氨酸/苏氨酸蛋白激酶31基因;甲基化;人乳头病毒16;宫颈癌;生物标志
[Abstract] Background and purpose: Studies have proved that the serine/threonine kinases 31 (STK31) gene plays important roles in human cancers. The STK31 gene expression was demonstrated to be regulated by the methylation status of its promoter/exon1 region. Viral infection was revealed to be associated with the hypermethylation of some tumor suppressor genes in some tumor samples. The purposes of this paper were to study the roles of HPV16 E6, E7, or E6/ E7 oncogenes in methylation status and expression of the STK31 gene, and potential effects of DNA methyltransferases (DNMTs) on STK31 gene methylation status. Methods: Ectopically-expressed HPV16 E6, E7, or E6/E7 cells were established by transfecting HPV16 E6, E7, or E6/E7 oncogenes with lentivirus vectors into HPV-negative cervical cancer cell lines HT-3 and C33A. Bisulfite genomic sequencing PCR (BGS) combined with TA clone and MSP (methylation-specific PCR) were used to analyze methylation status of the STK31 gene promoter/exon1 region in HPV-positive cervical cancer cell lines (HeLa, SiHa, CaSki), HPV-negative cervical carcinoma cell lines (C33A, HT-3) and the transfected cells. The mRNA and protein expression of STK31, DNMT1, DNMT2, DNMT3a, DNMT3b and DNMT3L were detected by RT-PCR and Western blot. Results: Transfection efficiency was tested by Western blot, which showed that the transfected cells successfully expressed E6, E7, or E6/E7 proteins, respectively. The STK31 gene promoter/exon1 was hypomethylated in HPV-positive cell lines HeLa, SiHa and CasKi resulting in detection of mRNA and protein expression. STK31 gene promoter/exon1 showed hypermethylation leading to silenced expression in the two HPV-negative cervical cancer cells HT-3 and C33A. Compared with primary HT-3 and C33A cells, the methylation status of STK31 promoter/exon1 was down-regulated that led to expression of STK31 in the ectopically-expressed HPV16 E7 and E6/E7 cells. Expressions of DNMT1, DNMT3a and DNMT3b genes at the level of transcription were higher in C33AE6/E7 and HT-3E6/E7 cells than those in C33A-vector and HT-3 vector cells, respectively (P<0.001). mRNA levels of DNMT1, DNMT3a and DNMT3b were higher in HPV16-positive cervical cancer tissues than those in HPV-negative cervical cancer tissues, respectively (t=5.997, P<0.001; t=6.743, P<0.001; t=7.926, P<0.001). DNMT2 mRNA level was lower in C33AE6/E7 and HT-3E6/E7 cells than those in C33A-vector and HT-3 vector cells, respectively (t=7.451, P<0.001; t=2.451, P<0.05). mRNA level of DNMT2 gene was lower in HPV16-positive cervical cancer tissues than in HPV-negative cervical cancer tissues (t=9.134, P<0.001). There was no statistically significant difference in expression levels of DNMT3L mRNA between cervical cancer cell lines before and after transfection, or HPV16-positive and HPV-negative cervical cancer tissues, respectively (P>0.05, data not shown). Conclusion: HPV infection leads to the down-regulated methylation status of STK31 promoter/exon1 that results in the expression of STK31. STK31 gene expression is regulated by methylation status of its promoter/exon1 region. HPV16 E7 and E6/E7 oncogenes may influence the methylation status of STK31 gene promoter/exon1 region by regulating the expression of DNMT2.
宫颈癌是女性死亡的主要原因之一,在发展中国家尤为显著[1-2]。持续性高危型人乳头瘤病毒(human papillomavirus,HPV)感染与90%宫颈癌相关,且HPV16型是最常见的高危型HPV,并与世界上60%的宫颈癌相关[3-4]。大量研究表明,病毒感染与肿瘤组织中抑癌基因启动子区高甲基化有关[5-6]。同样地,癌基因启动子区的异常甲基化与肿瘤的发生、发展亦密切相关[7-8]。丝氨酸/苏氨酸蛋白激酶31(serine/threonine kinases 31,STK31)基因是一种癌-睾丸基因,存在于人类多种肿瘤组织,而在正常情况下,仅存在于精细胞及睾丸[9-10]。Kuo等[11]研究发现,STK31可能与细胞周期调控有关,并且STK31表达可增加细胞迁移能力与侵袭能力。研究结果发现,在结肠癌中,STK31基因的表达受到其启动子区甲基化状态的调控,STK31基因有助于保持结肠癌细胞的未分化状态,并且敲除STK31基因后,通过加强结肠癌细胞的分化程度,抑制体内外肿瘤的发生[12]。目前有关STK31启动子及第1外显子区甲基化及表达与HPV感染的关系在宫颈癌中的研究鲜见报道。
本研究采用亚硫酸氢盐基因组测序法(bisulfite genomic sequencing,BGS)及甲基化特异性PCR (methylation-specific PCR, MSP)检测宫颈癌细胞系中STK31基因启动子及第1外显子甲基化状态,RT-PCR及蛋白[质]印迹法(Western blot)检测STK31基因及不同种类甲基转移酶(DNAmethyltransferases,DNMTs) DNMT1、DNMT2、DNMT3a、DNMT3b、DNMT3L等基因在宫颈癌细胞系及相关宫颈癌组织中的表达,旨在探讨HPV感染与STK31基因启动子及第1外显子区甲基化状态的关系以及不同种类DNMTs基因在STK31基因甲基化状态改变中的潜在作用;明确该基因表达是否受其启动子甲基化状态的调控;探究STK31基因在宫颈癌中的潜在作用,为HPV相关宫颈癌的诊断、治疗提供表观遗传学分子机制的实验依据。
1 材料和方法
1.1 细胞转染和培养
外源性HPV16E6、E7及E6/E7基因共表达慢病毒由生工生物工程(上海)股份有限公司合成,其克隆载体为LV5,克隆位点是NotⅠ/ BamHⅠ,合成的病毒滴度分别如下:E6为2×108TU/mL,E7为2×108TU/mL ,E6/E7为1×108TU/mL,慢病毒空载体为1×108TU/mL。将整合有外源性HPV16E6、E7及E6/E7基因的慢病毒及慢病毒空载体感染两种HPV阴性宫颈癌细胞系HT-3及C33A细胞,温育72 h后进行检测。用嘌呤霉素筛选感染后的细胞,建立稳定感染的细胞系,分别记为HT-3空载、HT-3E6、HT-3E7和HT-3E6/E7、C33A空载、C33AE6、C33AE7和C33AE6/E7。采用Western blot验证外源性HPV16E6、E7及E6/E7基因在转染后细胞中的表达。宫颈癌细胞系均用含有10%胎牛血清(购自美国Gibco公司)、100 U/mL青霉素和100 μg/mL链霉素的高糖DMEM培养基(购自美国Gibco公司),在37 ℃、饱和湿度、CO2体积分数为5%的培养箱中传代培养。
1.2 细胞DNA提取及 DNA亚硫酸盐修饰
采用饱和酚-氯仿抽提法提取宫颈癌细胞系DNA,1.5%琼脂糖电泳检查提取的基因组DNA的完整性,所有基因组DNA经紫外分光光度计检测波长260 nm处吸光度(D)值与波长280 nm处D值比值均在1.9~2.1。将所提取的基因组DNA进行亚硫酸氢盐修饰,采用德国QIAGEN公司的快速DNA亚硫酸盐修饰处理剂盒。操作严格按照试剂盒说明进行。
1.3 BGS及MSP检测
BGS及MSP引物采用Methy primer express v1.0软件设计,具体序列及反应条件见表1。BGS方法检测宫颈癌细胞系HeLa、SiHa、CasKi、HT-3、C33A、HT-3空载、HT-3E6、HT-3E7、HT-3E6/E7、C33A空载、C33AE6、C33AE7和C33AE6/E7中STK31基因启动子及第1外显子区的甲基化状态,其反应体系:TaqHS (5 U/μL) 0.3 μL、10×PCR缓冲液(含Mg2+) 3 μL、dNTPs (2.5 mmol/L) 3 μL、上游及下游引物各(10 μmol) 1.8 μL、0.05 μg亚硫酸盐修饰后细胞DNA作为模板、去离子水加至30 μL。PCR产物于2%琼脂糖凝胶电泳,鉴定扩增结果。PCR产物送上海迈浦生物科技有限公司进行TA克隆测序。MSP检测方法用来验证上述13种宫颈癌细胞系中STK31基因的甲基化状态,采用2%琼脂糖凝胶电泳鉴定PCR扩增结果。引物序列及产物大小见表1。
1.4 RNA提取及荧光定量PCR检测
TRIzol一步法提取宫颈癌细胞系及宫颈癌组织总RNA,采用瑞士Roche公司的反转录试剂盒合成cDNA。实时荧光定量PCR检测STK31基因及DNMT1、DNMT2、DNMT3a、DNMT3b、DNMT3L基因在宫颈癌细胞系及宫颈癌组织中mRNA转录表达水平,同时以管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参照,每一个样本均设3个重复。20 μL反应体系含Mix:10 μL、上下游引物各1 μL、PCR水8 μL、cDNA 1 μL。反应条件:95 ℃预变性10 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,共40个循环。引物序列及产物大小见表1。
1.5 Western blot检测
常规方法提取宫颈癌细胞系总蛋白,行SDS-PAGE。HPV16 E6/E7蛋白PVDF转膜10 V,15 min;STK31蛋白检测转膜10 V,30 min。用TBST配置5%脱脂奶粉封闭2 h。一抗为HPV16 E6、E7单克隆抗体(1∶1 000)以及STK31单克隆抗体(1∶1 000),二抗为辣根过氧化物标记的山羊抗兔抗体(1∶5 000),加DAB显色后分析目的蛋白表达情况。本实验中一抗购自美国Abcam公司,二抗及DAB显色液购自生工生物工程(上海)股份有限公司。
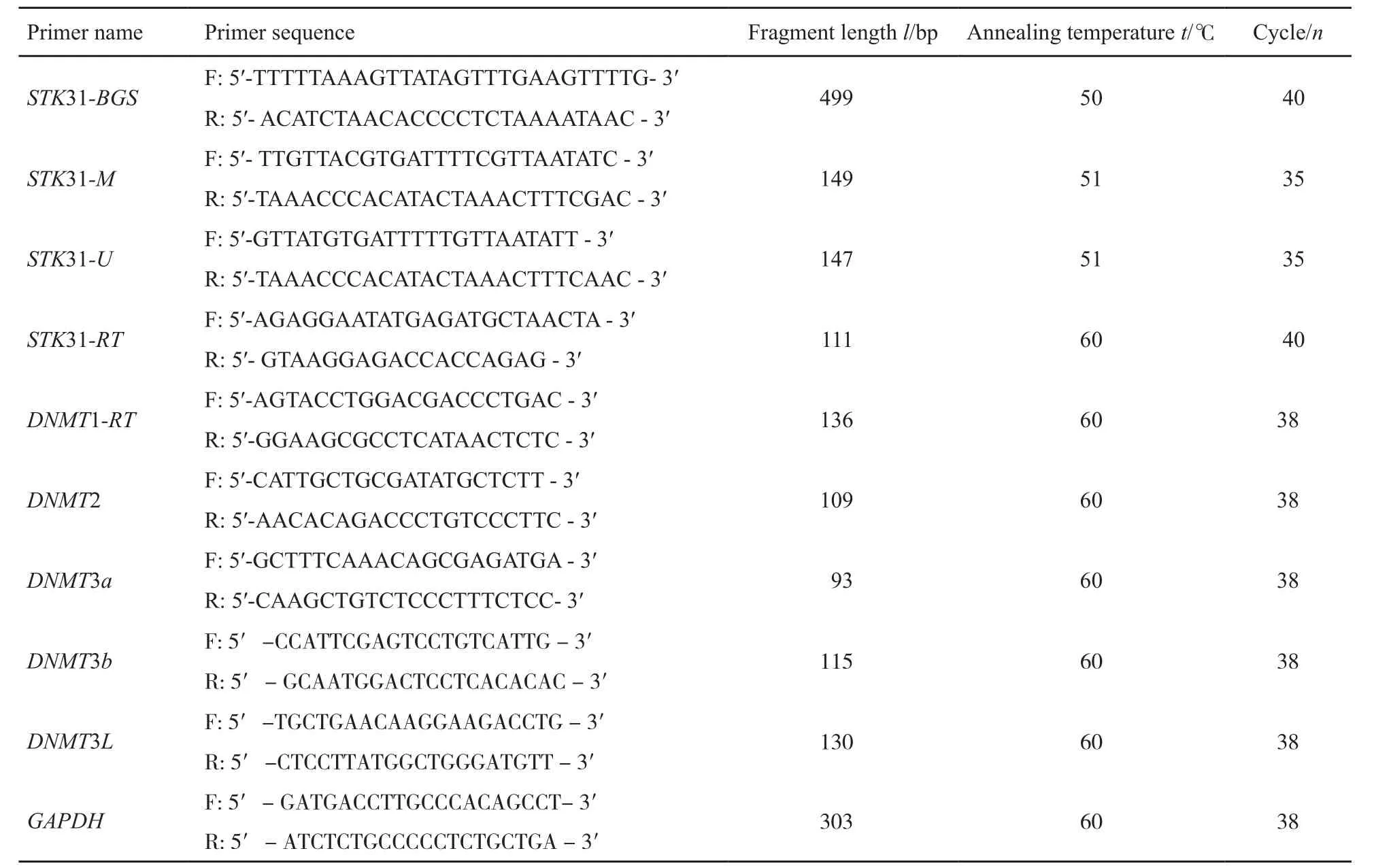
表 1 BGS、MSP及RT-PCR所用引物序列及反应条件Tab. 1 The primer sequences and reaction conditions of BGS, MSP and RT-PCR
1.6 统计学处理
采用SPSS 17.0统计软件对实验数据进行统计学分析。采用t检验比较转染后细胞系HT-3E7与HT-3E6/E7之间、C33AE67与C33AE6/E7之间的STK31 mRNA表达的差异,并比较HPV16E6、E7转染前后宫颈癌细胞系及HPV阴、阳性宫颈癌之间的DNMTs转录水平。P<0.05为差异有统计学意义。
2 结 果
2.1 外源性HPV16 E6、E7及E6/E7蛋白在HPV阴性宫颈癌细胞系HT-3及C33A中稳定表达
Western blot检测结果显示,转染后细胞系稳定表达HPV16 E6、E7及E6/E7蛋白,转染效率较高(图1)。
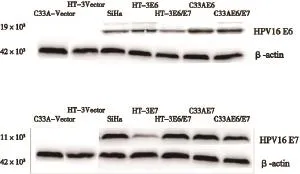
图 1 Western blot检测HPV16 E6、E7及E6/E7转染效率Fig. 1 The transfection efficiencies of HPV16 E6, E7 and E6/E7 were tested by Western blot
2.2 宫颈癌细胞系转染前后及HPV阴、阳性宫颈癌组织中STK31基因的甲基化状态的差异
BGS扩增PCR产物经2%琼脂糖凝胶电泳后可观察到499 bp的特异性目的片段。电泳结果见图2。TA克隆后,分别选取13种宫颈癌细胞系各6个阳性克隆进行测序,检测STK31基因启动子及第1外显子区CpG位点的甲基化状态。结果表明,其甲基化率在3种HPV阳性细胞系HeLa(46.4%)、SiHa(50.0%)和CasKi(49.1%)中低于2种HPV阴性宫颈癌细胞系HT-3(98.2%)和C33A(95.5%);HT-3空载及C33A空载分别与HT-3、C33A细胞系比较,STK31启动子及第1外显子区甲基化状态未见明显改变;HPV16 E6、E7及E6/E7异位表达细胞系中,HT-3E7、HT-3E6/E7、C33AE7和C33AE6/E7细胞系中STK31基因甲基化水平较转染前细胞系明显下降,而转染后细胞系HT-3E6、C33AE6中STK31基因甲基化状态较转染前细胞系则未见明显改变。具体结果见图3。图4为截取的HPV阴性宫颈癌细胞系C33A部分序列测序信号结果,未见套峰及杂峰现象,测序结果准确可靠。
宫颈癌细胞系中STK31基因启动子及第1外显子MSP检测结果与BGS一致,在HPV阳性宫颈癌细胞系HeLa、SiHa、Caski及转染后细胞系HT-3E6/E7、C33AE6/E7中只出现U条带;在2种HPV阴性细胞系HT-3、C-33A,及HT-3空载、HT-3E6、C33A空载和C33AE6细胞系中只检测到M条带;在转染后细胞系HT-3E7、C33AE7中出现M+U条带。MSP检测54例HPV16阳性宫颈癌组织及17例HPV阴性宫颈癌组织中STK31基因启动子及第1外显子区甲基化状态。结果显示,其在HPV16阳性宫颈癌组织中的甲基化率(15/54)明显低于HPV阴性宫颈癌组织(10/17)。差异有统计学意义(χ2=5.463,P=0.019,表2,图5)。
2.3 宫颈癌细胞系中HPV感染通过调节STK31基因启动子及第1外显子甲基化状态影响其基因的表达
RT-PCR电泳结果见图6A,Western blot检测结果见图6B。在3种HPV阳性宫颈癌细胞系HeLa、SiHa和CasKi中可检测到STK31基因的表达、STK31基因在2种HPV阴性宫颈癌细胞系HT-3和C-33A中表达缺失;整合有HPV16 E6、E7及E6/E7癌基因的慢病毒转染HPV阴性细胞系HT-3和C33A后,STK31基因在转染后细胞系HT-3E7、HT-3E6/E7、C33AE7和C33AE6/ E7中重新表达,而在转染后细胞系HT-3E6和C33AE6中未检测到STK31基因表达;STK31基因在HT-3E6/E7和C33AE6/E7细胞系中转录水平分别高于HT-3E7和C33AE7。差异有统计学意义(t=2.422,P=0.036;t=7.158,P<0.001,图7)。
2.4DNMT、DNMT2、DNMT3a、DNMT3b和DNMT3L基因mRNA在外源性HPV16E6/E7转染前后宫颈癌细胞系及HPV阴阳性宫颈癌标本中表达水平的比较
荧光定量PCR法检测结果显示,DNMT1、DNMT3a、DNMT3b在HT-3E6/E7和C33AE6/ E7细胞系中mRNA水平分别高于HT-3空载和C33A空载细胞系。差异有统计学意义(t=8.134,P<0.001;t=6.134,P<0.001;t=8.971,P<0.001;t=6.543,P<0.001;t=5.164,P<0.001;t=8.997,P<0.001);DNMT1、DNMT3a和DNMT3b基因的mRNA水平在HPV16阳性宫颈癌组织中的表达高于HPV阴性宫颈癌组织(t=5.997,P<0.001;t=6.743,P<0.001;t=7.926,P<0.001)。DNMT2基因在HT-3E6/ E7和C33AE6/E7细胞系中mRNA表达水平分别低于HT-3空载C33A空载。差异有统计学意义(t=7.451,P<0.001;t=2.451,P<0.05);DNMT2转录水平在HPV16阳性宫颈癌组织中低于HPV阴性宫颈癌组织(t=9.134,P<0.001)。DNMT3L mRNA表达水平在宫颈癌细胞系转染前后及HPV阴阳性宫颈癌组织中的表达差异无统计学意义(P>0.05,图8)。

图 2 BGS检测13种宫颈癌细胞系中STK31基因甲基化电泳结果Fig. 2 BGS results of STK31 gene promoter/exon1 methylation status in cervical cancer cell lines

图 3 宫颈癌细胞系转染前后STK31基因启动子及第1外显子区TA克隆测序结果Fig. 3 CpG methylation status of STK31 gene promoter/exon1 in cervical cancer cell lines before and after transfection with lentivirus vectors detected by TA clone.

图 4 HPV阴性细胞系C33A中STK31基因启动子区部分位点甲基化状态测序结果Fig. 4 Sequencing results of STK31 gene promoter/exon1 in C33A cells

表 2 宫颈癌组织标本中STK31基因甲基化状态与HPV感染之间的关系Tab. 2 Correlations between STK31 methylation and HPV infection in human cervical cancers
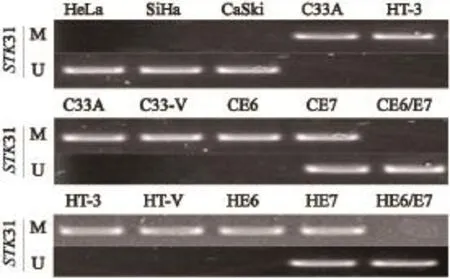
图 5 MSP检测13种宫颈癌细胞系中STK31基因启动子及第1外显子区甲基化电泳结果Fig. 5 MSP results of STK31 gene promoter/exon1 in 13 cervical cancer cell lines
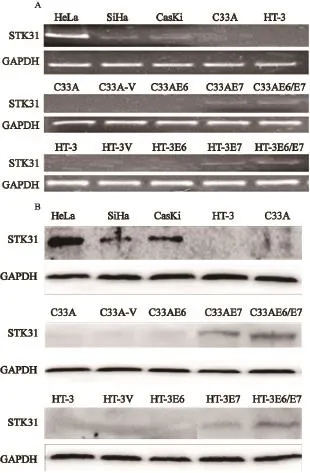
图 6 RT-PCR和Western blot检测13种宫颈癌细胞系中STK31基因转录和翻译Fig. 6 mRNA and protein expression of STK31 gene in 13 cervical cancer cell lines detected by RT-PCR and Western blot
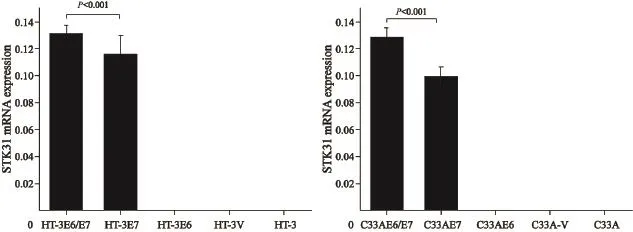
图 7 荧光定量PCR方法比较不同细胞系中STK31基因表达差异Fig. 7 Real-time fluorescent quantitative PCR (qPCR) was used to compare STK31 gene expression in different cell lines
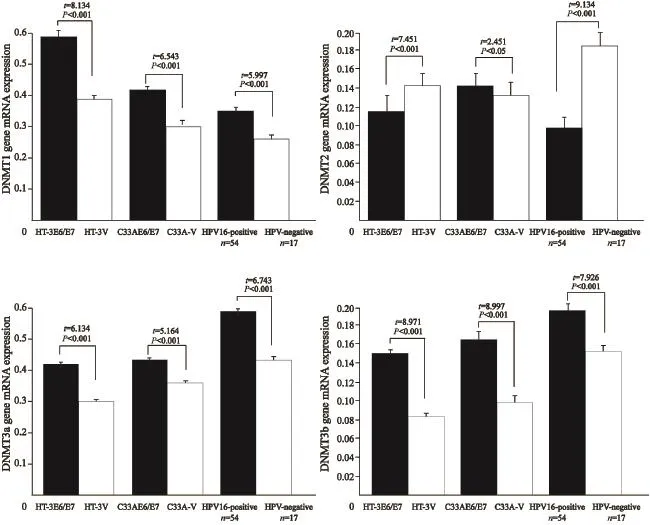
图 8 qPCR检测DNMT1、DNMT2、DNMT3a、DNMT3b和DNMT3L基因的mRNA在外源性HPV16 E6/E7转染前后宫颈癌细胞系及HPV阴阳性宫颈癌标本中表达水平Fig. 8 mRNA expression of DNMT1, DNMT2, DNMT3a, DNMT3b and DNMT3L genes in cervical cancer cell lines before and after HPV16 E6/E7-lentivirus transfection, and in HPV16-positive and HPV-negative cervical cancer samples
3 讨 论
高危型HPV感染是宫颈癌发生、发展的重要条件,虽然HPV感染在女性中十分常见,只有很小比例的HPV感染者发展为侵袭性宫颈癌。因此,宫颈涂片检测出HPV阳性的诊断及预后价值就有所减小。研究表明,HPV中两种致癌蛋白E6、E7可通过不同的途径,在宫颈癌的发生、发展中发挥重要的作用[4,13-14]。HPV感染与某些抑癌基因或癌基因的异常甲基化密切相关,因此,探索一组新的、肿瘤特异性的、具有更高敏感性及特异性的生物学标志,如甲基化相关的生物学标志,则有助于早期发现宫颈癌,提高没有条件定期做宫颈涂片筛查者的安全性,预测高危型HPV感染者的预后,指导HPV相关性肿瘤的治疗[15-16]。
本实验研究结果显示,HPV阳性宫颈癌细胞系中STK31基因甲基化水平低于HPV阴性宫颈癌细胞系,HPV16E7及E6/E7异位表达的HPV阴性细胞系中STK31基因甲基化程度降低,且STK31基因甲基化程度在HPV16阳性宫颈癌组织中低于HPV阴性宫颈癌组织,表明HPV感染可能影响STK31基因启动子及第1外显子区甲基化状态。由此推测,通过联合检测STK31基因的甲基化状态,可以提高HPV检测的特异性,为进一步HPV相关性肿瘤的诊断、预后及治疗等提供理论依据。
STK31基因表达受到其启动子及第1外显子区甲基化状态的调控,高甲基化水平抑制该基因表达。虽然转染后细胞系HT-3E6和C33AE6中STK31基因甲基化状态及其表达情况分别较转染前无明显改变,HT-3E6/E7和C33AE6/E7的表达分别高于HT-3E7和C33AE7细胞系,提示HPV16 E6可能对STK31的表达同样起一定的调控作用。
DNA甲基化过程是在DNMTs的催化作用下发生的。目前已研究报道的DNMTs主要有3 种,包括DNMT1、DNMT2和DNMT3,不同种类的DNMTs在DNA甲基化过程中起不同的作用。DNMT1在细胞分裂中起重要的、维持基因甲基化状态的作用,与一些肿瘤抑制基因的甲基化有关,在肿瘤的诊断与治疗中具有重要的潜在性作用[17-19]。DNMT2具有微弱的DNMT活性,其主要具有天门冬氨酸tRNA的甲基转移酶活性[20],虽然DNMT2在原生生物、植物、真菌和动物中具有高度同源性,是最保守的DNMT蛋白,令人感兴趣的是,DNMT2的功能至今研究报道较少[21]。DNMT3主要分为3类,即DNMT3a、DNMT3b和DNMT3L。DNMT3a与DNMT3b具有相似的结构,参与DNA从头甲基化,DNMT3L单独没有催化能力,但可以与DNMT3a、DNMT3b相互作用调节其活性。
本研究结果表明,DNMT1、DNMT3a和DNMT3b基因转录水平在异位性表达HPV16 E6/ E7的慢病毒转染后细胞系高于无编码HPV16 E6/ E7的慢病毒空载体转染后细胞系,且DNMT1、DNMT3a和DNMT3b基因的mRNA表达在HPV16阳性宫颈癌组织高于HPV阴性宫颈癌组织;而STK31基因启动子及第1外显子区甲基化率在异位性表达HPV16 E6/E7的慢病毒转染后细胞系低于慢病毒空载体转染后宫颈癌细胞系,STK31基因启动子及第1外显子区甲基化率在HPV阳性宫颈癌组织中低于HPV阴性宫颈癌组织,表明DNMT1、DNMT3a和DNMT3b可能不参与癌基因STK31基因启动子及第1外显子区甲基化状态的调控。研究报道表明,DNMT1主要参与一些抑癌基因的甲基化,且DNMT1高表达总是会伴有基因组和癌基因的低甲基化,或抑癌基因的高甲基化[20,22];STK31基因是一种癌基因,其甲基化率在DNMT1相对高表达的HPV16阳性的宫颈癌细胞系及宫颈癌组织中低于在DNMT1相对低表达的HPV阴性宫颈癌细胞系及宫颈癌组织。实验结果与上述研究报道结果相符。DNMT2 mRNA水平在异位性HPV16E6/E7表达的细胞系中低于HPV阴性宫颈癌细胞系,且DNMT2甲基转录水平在HPV16阳性宫颈癌组织中低于HPV阴性宫颈癌组织,STK31基因甲基化水平在HPV16E6/E7转染后细胞系及HPV16阳性宫颈癌组织中分别低于慢病毒空载体宫颈癌细胞系及宫颈癌组织,表明STK31基因启动子及第1外显子区甲基化转移酶可能是DNMT2分子,HPV16 E6、E7可能通过影响DNMT2的表达参与调控癌基因STK31基因启动子及第1外显子区甲基化状态;DNMT2具有微弱的DNMT活性,其表达差异与STK31基因启动子及第1外显子区甲基化状态相关。本研究推测,DNMT2可能参与某些癌基因甲基化状态的调控。
研究证实,STK31基因的表达受到其启动子区甲基化状态的调控,可通过抑制细胞凋亡,保持细胞的未分化状态等机制在肿瘤的发生、发展中起重要作用[11-12]。STK31是一种癌-睾丸基因,存在于多种肿瘤中,在正常组织仅存在于睾丸及精细胞。睾丸是一个免疫豁免器官,用特异性的T细胞靶向性的识别癌-睾丸抗原不会引起其他不良反应。因此,癌-睾丸抗原可能在人类肿瘤中是一个潜在的诊断性、治疗性、预后性的生物学标志[23]。我们推测,开展STK31抗原在宫颈癌中免疫学特性的研究,可以为STK31基因在宫颈癌免疫学治疗中的潜在作用提供线索与理论依据。
本研究初步证实了HPV感染,尤其是HPVE6、E7及E6/E7可能通过调控STK31基因启动子及第1外显子区甲基化状态来影响宫颈癌中STK31基因表达,清除HPV感染可能通过减弱对其靶基因STK31的表达促进作用,发挥肿瘤抑制作用;HPVE6、E7及E6/E7可能通过影响DNMT2的表达来调控STK31基因启动子及第1外显子区甲基化状态,当然还需要进一步的实验,如Western blot等;但仍有许多问题需要进一步深入研究,如STK31基因启动子及第1外显子异常甲基化与宫颈癌侵袭性及转移性的关系及相关具体机制,STK31抗原在宫颈癌中的免疫学特征等。总之,STK31基因异常甲基化可能是HPV感染相关宫颈癌发生、发展中的一个新的甲基化相关的分子生物学标志物,并有望用于肿瘤的早期诊断、预后分析和治疗指导。因而对STK31基因的进一步深入研究,有助于为宫颈癌的诊断和治疗提供新的思路及理论依据。
[1] ZUR HAUSEN H. Papillomaviruses and cancer: from basic studies to clinical application[J]. Nat Rev Cancer, 2002, 2(5): 342-350.
[2] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917.
[3] LI N, FRANCESCHI S, HOWELL-JONES R, et al. Human papillomavirus type distribution in 30,848 invasive cervical cancers worldwide: Variation by geographical region, histological type and year of publication[J]. Int J Cancer, 2011, 128(4): 927-935.
[4] AJIRO M, ZHENG Z M. E6^E7, a novel splice isoform protein of human papillomavirus 16, stabilizes viral E6 and E7 oncoproteins via HSP90 and GRP78[J]. MBio, 2015, 6(1): e02068-14.
[5] TAO Q, CHAN A T. Nasopharyngeal carcinoma: molecular pathogenesis and therapeutic developments[J]. Expert Rev Mol Med, 2007, 9(12): 1-24.
[6] FLANAGAN J M. Host epigenetic modifications by oncogenic viruses[J]. Br J Cancer, 2007, 96(2): 183-188.
[7] CORAL S, SIGALOTTI L, ALTOMONTE M, et al. 5-aza-2’-deoxycytidine-induced expression of functional cancer testis antigens in human renal cell carcinoma: immunotherapeutic implications[J]. Clin Cancer Res, 2002, 8(8): 2690-2695.
[8] FEINBERG A P, TYCKO B. The history of cancer epigenetics[J]. Nat Rev Cancer, 2004, 4(2): 143-153.
[9] SCANLAN M J, SIMPSON A J, OLD L J. The cancer/testis genes: review, standardization, and commentary[J]. Cancer Immun, 2004, 4: 1.
[10] HOFMANN O, CABALLERO O L, STEVENSON B J, et al. Genome-wide analysis of cancer/testis gene expression[J]. Proc Natl Acad Sci U S A, 2008, 105(51): 20422-20427.
[11] KUO P L, HUANG Y L, HSIEH C C, et al. STK31 is a cellcycle regulated protein that contributes to the tumorigenicity of epithelial cancer cells[J]. PloS One, 2014, 9(3): e93303.
[12] YOKOE T, TANAKA F, MIMORI K, et al. Efficient identification of a novel cancer/testis antigen for immunotherapy using three-step microarray analysis[J]. Cancer Res, 2008, 68(4): 1074-1082.
[13] NARISAWA-SAITO M, KIYONO T. Basic mechanisms of high-risk human papillomavirus-induced carcinogenesis: roles of E6 and E7 proteins[J]. Cancer Sci, 2007, 98(10): 1505-1511.
[14] FLATLEY J E, MCNEIR K, BALASUBRAMANI L, et al. Folate status and aberrant DNA methylation are associated with HPV infection and cervical pathogenesis[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(10): 2782-2789.
[15] HANSEL A, STEINBACH D, GREINKE C, et al. A promising DNA methylation signature for the triage of high-risk human papillomavirus DNA-positive women[J]. PloS One, 2014,9(3): e91905.
[16] LAIRD P W. The power and the promise of DNA methylation markers[J]. Nat Rev Cancer, 2003, 3(4): 253-266.
[17] LIN C H, HSIEH S Y, SHEEN I S, et al. Genome-wide hypomethylation in hepatocellular carcinogenesis[J]. Cancer Res, 2001, 61(10): 4238-4243.
[18] ZHANG Y, CHEN F Q, SUN Y H, et al. Effects of DNMT1 silencing on malignant phenotype and methylated gene expression in cervical cancer cells[J]. J Exp Clin Cancer Res, 2011, 30: 98.DOI:10.1186/1756-9966-30-98.
[19] ETOH T, KANAI Y, USHIJIMA S, et al. Increased DNA methyltransferase 1 (DNMT1) protein expression correlates significantly with poorer tumor differentiation and frequent DNA hypermethylation of multiple CpG islands in gastric cancers[J]. Am J Pathol, 2004, 164(2): 689-699.
[20] HERMANN A, GOWHER H, JELTSCH A. Biochemistry and biology of mammalian DNA methyltransferases[J]. Cell Mol Life Sci, 2004, 61(19-20): 2571-2587.
[21] SCHAEFER M, LYKO F. Solving the Dnmt2 enigma[J]. Chromosoma, 2010, 119(1): 35-40.
[22] ROBERT M F, MORIN S, BEAULIEU N, et al. DNMT1 is required to maintain CpG methylation and aberrant gene silencing in human cancer cells[J]. Nat Genet, 2003, 33(1): 61-65.
[23] MIRANDOLA L, J CANNON M, COBOS E, et al. Cancer testis antigens: novel biomarkers and targetable proteins for ovarian cancer[J]. Int Rev Immunol, 2011, 30(2-3): 127-137.
“惠尔血支持按时足剂量化疗”2015年度有奖征文通知
众所周知,按时足剂量化疗对于改善癌症(乳腺癌、淋巴瘤、卵巢癌、结直肠癌及非小细胞肺癌等)患者的预后具有重要意义。然而,大多数的化疗方案存在一定的血液毒性,极大程度地降低了患者完成按时足剂量、足疗程化疗的比例。惠尔血(重组人粒细胞刺激因子)从20世纪90年代面世至今,造福了数以百万计的癌症化疗患者。
为进一步探索并评估惠尔血支持按时、足剂量、足疗程化疗的临床效果,促进临床经验交流,《中国癌症杂志》特举办“惠尔血支持癌症患者按时足剂量化疗有奖征文”活动,现将征文活动事项通知如下:
征文内容:
⑴ 惠尔血应用于癌症患者,支持癌症患者完成按时足剂量化疗的多病例、分组研究等临床研究,其中患者类型及化疗方案不限。
⑵ 惠尔血支持按时足剂量化疗的个案报道(个案报道要求特异性与新颖性)。
⑶ 惠尔血在不同的化疗方案中的作用等。
征文要求及提交:
⑴ 为首次投稿,未公开发表过。
⑵ 征文格式参照《中国癌症杂志》稿约要求,撰写论文。
⑶ 请将论文电子文档,通过邮件发送至:kirin2015zwhd@163.com(注明“征文活动”)。
⑷ 请注明作者、单位、地址、职称、邮编和联系电话等信息。
征文截止日期:
截止日期为2015年12月31日(以E-mail发出时间为准)。
评选方法:
⑴ 由《中国癌症杂志》编辑部组织专家成立评审委员会,以公正、公平的方式评选,在征文截稿后评选2015年度获奖论文。设立一等奖2名,二等奖5名,三等奖15名,并颁发获奖证书。
⑵ 获奖论文经《中国癌症杂志》审稿通过后可优先在《中国癌症杂志》上发表。
⑶ 一等奖获得者可获资助参加欧美学术会议一次;二等奖获得者可获资助参加亚太学术会议一次;三等奖获得者可获资助参加国内学术会议一次。
⑷ 全部论文将以《中国癌症杂志》编辑部名义颁发证书,并编入《论文汇编》。
《中国癌症杂志》编辑部
协和发酵麒麟(中国)制药有限公司
The roles of HPV16 E6, E7 and E6/E7 genes in STK31 promoter/exon1 methylation and expression levels in cervical cancer cell lines
YIN Fufen, WANG Ning, YU Xiao, BI Xiaoning, XU Xiaohui, WANG Yankui
(Department of Obstetrics and Gynecology, Affiliated Hospital of Qingdao University, Qingdao 266003, Shandong, China)
Correspondence to: WANG Yankui E-mail: qdwykpro@163.com
Serine/threonine kinases 31 gene; Methylation; HPV16; Cervical cancer; Biomarker
10.3969/j.issn.1007-3969.2015.09.001
R737.33
A
1007-3639(2015)09-0641-11
2015-04-18
2015-08-10)
国家自然科学基金(81172480)。
王言奎 E-mail:qdwykpro@163.com
