西格列汀对肥胖大鼠代谢指标及脂肪因子chemerin 脂联素水平的影响
2015-04-18刘炯炯胡红琳王长江方朝晖
刘炯炯 胡红琳 夏 莉 王长江 方朝晖
西格列汀对肥胖大鼠代谢指标及脂肪因子chemerin 脂联素水平的影响
刘炯炯 胡红琳 夏 莉 王长江 方朝晖
目的 研究西格列汀对肥胖大鼠代谢指标及脂肪因子chemerin、脂联素(ADPN)水平的影响及其可能机制,并探讨chemerin及ADPN与肥胖的关系。方法 将30只大鼠随机分为正常对照组(NC组)、肥胖对照组(HF组)和肥胖西格列汀干预组(SP组),ELISA法分别测定干预前后各组大鼠生化指标,Western blot 法检测大鼠脂肪、肝脏、肌肉及肾脏组织chemerin及ADPN蛋白表达水平。结果 与NC组相比,HF组大鼠血清chemerin、体质量(BW),空腹血糖(FBG)、胰岛素(FINS)、总胆固醇(TG)、甘油三酯(TC)、低密度脂蛋白胆固醇(LDL-C),胰岛素抵抗指数(HOMO-IR)增高,血清ADPN及高密度脂蛋白胆固醇(HDL-C)降低(P<0.05),HF组大鼠脂肪、肝脏、肌肉及肾脏组织的chemerin蛋白表达量较NC组对应组织的表达量增加(P<0.05),脂肪、肝脏及肌肉组织的ADPN表达量减少(P<0.05)。与HF组相比,SP组大鼠FBG、FINS、TC、TG、LDL-C、HOMO-IR、血清chemerin水平降低, HDL-C及血清ADPN水平升高(P<0.05),脂肪、肝脏、肾脏及肌肉组织的chemerin蛋白表达量减少,脂肪、肌肉组织的ADPN表达增加(P<0.05)。干预前chemerin、ADPN与BW、FBG、TG、HDL-C、LDL-C、FINS、HOMO-IR有相关性,干预后chemerin、ADPN与BW、LDL-C、FINS、HOMO-IR有相关性,ADPN与HDL-C呈正相关。结论 chemerin及ADPN参与糖脂代谢过程,西格列汀可改善血清学各代谢指标,并通过影响chemerin及ADPN来改善肥胖大鼠胰岛素敏感性。
肥胖;西格列汀;chemerin;脂联素
肥胖是一种低度的慢性炎症过程,过度分化的脂肪细胞可产生大量的脂肪因子,如chemerin、脂联素(adiponectin,ADPN)及瘦素等,不仅可以在脂肪组织内部发挥作用,而且可以影响食物摄取、体质量、胰岛素敏感性、炎症、凝血和血管功能等[1],而西格列汀作为一种新型降糖药物对脂肪因子chemerin及ADPN的影响目前鲜有报道。本研究通过建立高脂肥胖大鼠模型来明确西格列汀是否通过对chemerin及ADPN水平的影响而影响糖脂代谢,并探讨其可能的机制。
1 材料与方法
1.1 仪器与试剂 Roche Modular全自动生化分析仪(瑞士罗氏公司),稳豪血糖仪(美国强生公司),胰岛素放免试剂盒(北京原子高科公司),ELISA试剂盒(上海源叶生物科技有限公司),10%水合氯醛(青岛宇龙海藻有限公司),羟甲基淀粉酶(上海蒙究实业有限公司),chemerin及ADPN小鼠抗大鼠单克隆抗体(英国Abcam公司),辣根酶标记的山羊抗小鼠二抗及兔抗小鼠二抗(英国Abcam公司),ECL化学发光显影剂(美国millipore公司)等。
1.2 实验动物 普通级SD大鼠30只,雄性6周龄,(160.0±30.5)g,购自安徽医科大学实验动物中心。饲养条件为室温(22±2)℃,湿度55%左右,自然昼夜节律,自由饮水摄食。适应性喂养1周后随机分为两组:正常对照组(NC组,n=10)和高脂饲料组(n=20)。NC组予以普通饲料(由安徽医科大学实验动物中心配制)喂养,直至实验结束;高脂组给予高脂饲料喂养。12周后,取高脂组中体质量高于NC组体质量均数20%的大鼠为肥胖模型造模成功(n=16)。
1.3 干预方式 16只高脂大鼠按体质量随机分为两组,两组均继续予以高脂饲料喂养。肥胖西格列汀干预组(SP组,n=8):灌胃给予磷酸西格列汀10 mg/(kg·d),溶于2 mL羟甲基淀粉酶中,每日灌胃时间于早9点,持续6周。肥胖对照组(HF组,n=8):灌胃给予2 mL生理盐水作为空白对照。
1.4 血标本收集与处理 高脂喂养12周后,所有大鼠禁食12 h,内眦静脉取血2 mL,第18周末,大鼠末次干预后,禁食12 h,称重,10%水合氯醛0.3 mL/100 g腹腔注射,麻醉状态下腹主动脉取血3 mL,血标本静止15 min后,3 000 r/min离心10 min,留取血清置于-80℃冰箱保存。
1.5 指标测定 通过测定体质量(body weight,BW),空腹血糖(fasting glucose,FBG)、胰岛素(fasting insulin,FINS)、总胆固醇(total cholesterol,TG)、甘油三酯(triglyceride,TC)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C),高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C),胰岛素抵抗指数(insulin resistance index,HOMO-IR)[HOMO-IR=FINS(mIU/L)×FBG(mmol/L)/22.5],血清chemerin与ADPN来明确西格列汀干预前后对血清各指标的影响。
1.6 western blot法检测组织中chemerin 及ADPN蛋白表达 提取脂肪中的总蛋白,使用BCA 法测定蛋白浓度,根据蛋白浓度决定上样量。依次进行电泳、转膜、封闭,chemerin小鼠抗大鼠单克隆抗体(1 ∶1 000) 4 ℃ 孵育过夜后,辣根酶标记的山羊抗小鼠二抗(1 ∶4 000) 室温下孵育2 h。ADPN小鼠抗大鼠单克隆抗体(1 ∶1 000) 4 ℃ 孵育过夜后,辣根酶标记的兔抗小鼠二抗(1 ∶2 000) 室温下孵育2 h。充分洗涤后ECL化学发光显影并进行胶片显影定影处理。采用上述相同方法,在相同条件下完成肝脏组织、肌肉及肾脏组织chemerin、ADPN及各对应的β-actin 蛋白检测。图像扫描并分析各条带的灰度值。
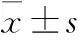
2 结果
2.1 干预前生化指标与血清chemerin、ADPN比较 与NC组相比,HF组大鼠的血清chemerin、BW、FBG、FINS、TC、TG、LDL及HOMO-IR升高,ADPN及HDL-C降低,差异有统计学意义(P<0.05);HF组与SP组比较差异无统计学意义(P>0.05)。见表1。
2.2 干预后生化指标与血清chemerin、ADPN比较 与HF组比较,SP组各血清chemerin、FBG、FINS、TC、TG、LDL及HOMO-IR显著降低,HDL-C及血清ADPN水平升高,差异有统计学意义(P<0.05);与NC组比较差异无统计学意义(P>0.05);SP组与HF组BW差异无统计学意义(P>0.05)。见表2。
2.3 各组织中chemerin与ADPN蛋白表达 HF组与SP组大鼠脂肪、肝脏、肌肉及肾脏组织的chemerin蛋白表达量较NC组对应组织的表达量增加(P<0.05);SP组大鼠脂肪、肝脏、肾脏、肌肉组织的chemerin蛋白表达量较HF组对应组织的表达量减少(P<0.05)。HF组及SP组脂肪、肝脏及肌肉组织的ADPN表达量较NC组对应组织表达量减少,SP组大鼠脂肪、肌肉组织ADPN表达较HF组增加,见图1、表3。
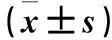
表1 西格列汀干预前生化指标与血清chemerin、ADPN比较
注:与NC组比较,*P<0.05

表2 西格列汀干预后生化指标与血清chemerin、ADPN比较
注:与NC组比较,*P<0.05;与HF组比较,#P<0.05
图1 脂肪、肝脏、肌肉、肾脏组织chemerin及ADPN蛋白表达水平比较(A:脂肪组织;B:肝脏组织;C:肌肉组织;D;肾脏组织;1:NC组;2:HF组;3:SP组)
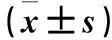
表3 西格列汀对各组织中chemerin蛋白表达的影响
注:与NC组比较:#P<0.05;与HF组比较:*P<0.05
2.4 血清chemerin、ADPN与生化指标相关性分析 干预前chemerin与BW、FBG、TG、HDL-C、LDL-C、FINS、HOMO-IR呈正相关,与ADPN呈负相关;干预后与BW、LDL-C、FINS、HOMO-IR呈正相关,与血清ADPN呈负相关。干预前ADPN与BW、FBG、TC、HLDL-C、FINS、HOMO-IR、血清chemerin呈负相关;干预后与HDL-C呈正相关,与BW、FBG、TG、TCH、LDL-C、FINS、HOMO-IR、血清chemerin呈负相关。见表4。

表4 西格列汀干预前后chemerin与各生化指标相关性
3 讨论
1995年Sherer等[2]首次报道了一种由脂肪组织分泌的血浆激素蛋白-ADPN,其分子量约为30 000, 可通过与其受体结合发挥生物学作,其受体广泛分布在脑、心、肾、肝、骨骼肌、胰腺等多种组织中。胡红琳等[3]利用糖尿病人群分析胰岛素抵抗程度与脂肪因子的研究中,发现脂联素与胰岛素抵抗有关。而Chemerin最初是在1997年使用差异显示法被识别的,作为维A酸反应基因出现在银屑病皮肤损伤中,人类Chemerin编码基因全长3 289 bp,位于染色体7q36.1,在白色脂肪组织、肝脏和胎盘中高表达[4],两者均与肥胖的发生发展密切相关。
本研究证实肥胖大鼠体内ADPN水平降低,chemerin水平升高,同时血脂、血糖代谢紊乱,胰岛素抵抗程度增加,这与Stejskal[5]、Jortay等[6]的研究结果相一致。相关性分析结果提示chemerin、ADPN均与BW、FBG、TG、HDL-C、LDL-C、FINS、HOMO-IR有相关性,且ADPN与血清chemerin呈负相关,说明ADPN及chemerin可能均参与了糖脂代谢过程、胰岛素抵抗的发生,而且两种脂肪因子间相互影响。根据本研究western blot分析,肥胖大鼠脂肪、肝脏、肌肉及肾脏组织的chemerin蛋白表达量较非肥胖大鼠增加,而ADPN表达量在肥胖大鼠脂肪、肝脏及肌肉组织的较非肥胖大鼠减少,说明在这种糖脂代谢紊乱的内环境下可刺激于脂肪、肝脏、肾脏及肌肉组织中chemerin的基因表达,而脂肪、肝脏及肌肉组织中ADPN的基因表达受抑制,具体是影响了蛋白的转录、翻译还是翻译后修饰过程有待于进一步研究。
西格列汀作为DPP-4抑制剂,可以选择性的抑制DPP-4的生物活性,延迟GLP-1的降解,发挥降低血糖、促进胰岛素分泌、抑制胰高血糖素分泌、保护胰岛β细胞功能、促进β细胞再生等作用[7]。
除上述作用外,本研究显示西格列汀干预6周后还可改善肥胖大鼠高血脂状态、炎症状态及胰岛素抵抗程度,并且不增加大鼠的体质量。相关性分析得出西格列汀干预后BW、LDL-C、FINS、HOMO-IR同时与chemerin及ADPN有相关性,ADPN与HDL-C呈正相关,说明西格列汀主要通过改善高胰岛素血症、胰岛素敏感性及高血脂状态来影响机体的炎症状态。另外干预后ADPN仍然与chemerin呈负相关,本实验进行过程中发现虽然西格列汀干预后总体趋势是chemerin降低,ADPN增高,但一些大鼠在干预6周后仅chemerin降低或仅ADPN增加,还有些大鼠是既有chemerin的降低也有ADPN的升高,最终发现chemerin与ADPN均有变化的大鼠胰岛素抵抗改善程度要大于前者,但由于样本量少,不能进行统计学分析,但仍可以说明西格列汀在调节炎症因子过程中是多向调节的,不仅使单一的因子产生变化,也可使炎症因子间相互作用。
通过western blot分析得出西格列汀可增加大鼠脂肪与肌肉细胞的ADPN表达量,说明西格列汀对ADPN的调节是通过脂肪与肌肉组织共同作用的,其有可能通过增强ADPN对肌肉中AMPK及PPARα通路的影响来增加肌肉组织对葡萄糖摄取和脂肪氧化,并且促进脂质向脂肪细胞聚积,减少异位脂肪沉积,从而增加机体胰岛素敏感性[8]。western blot分析还得出在肝脏、脂肪、肌肉及肾脏中chemerin的表达量均有所下降,提示这些组织均是西格列汀的作用靶点,已有研究证实在骨骼肌组织中chemerin是抑制葡萄糖摄取的[9],而在脂肪组织中chemerin对葡萄糖摄取的作用存在分歧,结合本实验上述chemerin的升高与胰岛素抵抗程度的增加存在相关性说明chemerin对脂肪组织葡萄糖摄取是起抑制作用的,西格列汀可能解除这种抑制作用来增加胰岛素敏感性。有研究显示Tomoyuki等[10]发现IR可促进脂质的降解使游离脂肪酸转运到肝脏,异位沉积的肝脏脂肪导致氧化应激,故推测西格列汀可通过改善肝脏、脂肪、肌肉及肾脏组织中高胰岛素状态及胰岛素敏感性影响机体脂肪因子的表达,进而影响血清中chemerin及ADPN的浓度。
综上所述,脂肪因子chemerin及ADPN在肥胖大鼠胰岛素抵抗的发生发展中有重要的作用,西格列汀作为新型抗糖尿病药物可影响大鼠糖脂代谢及脂肪因子的水平,是否有其他机制参与有待于进一步研究。
[1] Romacho T,Elsen M,Eckel J,et al.Adipose tissue and its role in organ crosstalk[J].Acta Physiol(Oxf),2014,210(4):733-753.
[2] Yamauchi T,Nio Y,Maki T,et al.Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions[J].Nat Med,2007,13(3):332-339.
[3] 胡红琳,王长江,王佑民,等.血清脂联素、抵抗素与2型糖尿病[J].安徽医学,2006,27(5):349-351.
[4] Roh S,Song SH,Choi KC,et al.Chemerin-A new adipokine that modulates adipogenesis via its own receptor[J].Biochem Biophys Res Commun,2007,362(4):1013-18.
[5] Stejskal D,Karpisek M,Hanulova Z,et al.Chemerin is an independent marker of the metabolic syndrome in a Caucasian population-a pilot study[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2008,152(2):217-221.
[6] Jortay J,Senou M,Abou-Samra M,et al.Adiponectin and skeletal muscle:pathophysiological implications in metabolic stress[J].Am J Pathol,2012,181(1):245-256.
[7] Gallwitz B.Review of sitagliptin phosphate a novel treatment for type 2 diabetes[J].Vasc Health Risk Manag,2007,3(2):203-210.
[8] Yamauchi T,Kamom J,Ito Y,et al.Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J].Nature,2003,423(6941):762-769.
[9] Sell H,Laurencikiene J,Taube A,et al.Chernerin is a novel adipocyte-derived factor inducing insulin resistance inprimary human skeletal muscle cells[J].Diabetes,2009,58(12):2731-2740.
[10]Tomoyuki I,Masato Y,Masahiko I.Sitagliptin as an novel treatment agent fornon-alcoholi Fatty liver disease patients with type 2 diabetesm ellitus[J].Hepato-gastroenterology,2011,58(112):2103-2105.
(2015-03-24 收稿 2015-05-29 修回)
Influence of sitagliptin on metabolic parameters and adipocytokines levels of obesity rats
LiuJiongjiong,HuHonglin,XiaLi,etal
DepartmentofEndocrinology,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022,China
Objective To investigate the effects of sitagliptin on metabolic parameters, chemerin and adiponectin levels of obesity rats, and to explore the relationship between the chemerin and adiponectin with obesity. Methods A total of 30 rats were randomly divided into normal diet group (NC), high-fat control group (HF) and sitagliptin intervention group (SP). The rats′ metabolic parameters were measured by ELISA.The chemerin and adiponectin protein expression levels in kidney adipose, liver and muscle tissue were detected by western blot. Results Compared with NC group, the serum chemerin, BW, FBG, FINS, TC, TG, LDL-C, HOMO-IR levels of high-fat model group were increased, HDL-C and adiponectin were decreased. Chemerin expression levels of high-fat control group in adipose, liver and kidney tissues increased compared with NC group, the expression of adiponectin in adipose, liver and muscle tissues was decreased. Compared with HF group, sitagliptin could down-regulate the levels of FBG, FINS, TC, TG, LDL, HOMO-IR, serum chemerin. The HDL-C and adiponectin were up-regulated. After sitagliptin treatment, chemerin expression levels in adipose, liver, kidney and muscle were reduced, and the expression of adiponectin in adipose and muscle tissue was increased. Correlation analysis showed that before intervention, chemerin and adiponectin were correlated with FBG, TG, HDL, LDL-C, FINS, HOMO-IR and BW. After intervention, chemerin and adiponectin had correlation with BW, LDL-C, FINS, HOMO-IR at the same time, adiponectin has positive correlation with HDL-C. Conclusion Chemerin and adiponectin may be a key participate element in the development of obesity. Sitagliptin can improve the metabolic indexes remarkably in serum, and improve insulin sensitivity in obesity rats by influencing the levels of chemerin and adiponectin.
Obesity;Sitagliptin;Chemerin;Adiponectin
安徽中医学院中医药管理局重点学科-中医内分泌学科开放基金(项目编号:2011nfmxk004);安徽医科大学第一附属医院2011年度国家自然科学基金青年科学基金培养计划(项目编号:2011KJ11)
230022 合肥 安徽医科大学第一附属医院内分泌科(刘炯炯,胡红琳,夏莉,王长江) 230022 合肥 安徽中医药大学第一附属医院内分泌科(方朝晖)
夏莉, xiali0205@163.com
10.3969/j.issn.1000-0399.2015.09.002
