肺腺癌巨噬细胞M2表型边缘极化效应观察及预后分析*
2015-04-17肖维华赵灵灵应丽丽马海芬陈国荣
肖维华, 赵灵灵, 应丽丽, 马海芬, 吴 亮, 陈国荣△
(1宁波市北仑区人民医院病理科,浙江 宁波 315800; 2温州医科大学附属第一医院病理科,浙江 温州 325000)
肺腺癌巨噬细胞M2表型边缘极化效应观察及预后分析*
肖维华1, 赵灵灵2, 应丽丽2, 马海芬1, 吴 亮2, 陈国荣2△
(1宁波市北仑区人民医院病理科,浙江 宁波 315800;2温州医科大学附属第一医院病理科,浙江 温州 325000)
目的: 探讨肺腺癌边缘区巨噬细胞M2表型的极化效应、边缘/中心比值及对预后的影响。方法: 采用双重免疫组化技术,观察巨噬细胞CD163+/CD68+表型(M2表型)在49例原位肺腺癌(AIS)、11例微小浸润性腺癌(MIA)、57例浸润性腺癌(IA)边缘区及中心区的分布规律和差异,探讨巨噬细胞边缘极化效应及边缘/中心比值在肺腺癌进程中的作用及机制。采用单因素Kaplan-Meier 生存曲线分析及多变量Cox生存分析探讨M2表型边缘极化状态与预后的关系。结果: 肺腺癌边缘区M2型巨噬细胞较中心区域呈现极性聚集,具有显著差异(P<0.01)。根据中位数分高、低极化组,低极化组AIS中M2型巨噬细胞计数值与MIA及IA比较未见明显差别,但其在高、极化组AIS中的计数值依次低于MIA和IA,差异有统计学意义(均P<0.01)。单因素Kaplan-Meier 生存曲线分析及log-rank检验结果显示边缘区巨噬细胞M2表型数量及边缘/中心比值与生存时间呈负相关(2=44.71,P<0.01;2=21.75,P<0.01)。多变量Cox生存分析表明M2表型边缘高极化状态和边缘/中心比值是独立的预后危险因素(P<0.01)。结论: 巨噬细胞M2表型在肺腺癌边缘区存在边缘极化效应,其边缘极化状态和边缘/中心比值是独立的预后危险因素,因此术前穿刺判断边缘极化状态或术后活检检测M2型巨噬细胞型边缘/中心比值可能是评估预后的一种有效方法。
肺肿瘤; 巨噬细胞; 极化; 预后
巨噬细胞是具有异质性的细胞群,具有多种功能,其在复杂的肿瘤微环境下可极向分化为替代激活的M2型巨噬细胞[1]。CD163可作为M2型巨噬细胞活化的重要标记[2],与CD68共表达能更准确地识别该亚型细胞,后者激活状态与肺腺癌[3]、胰腺癌[4]和卵巢癌[5]等多种肿瘤预后有关。以往研究侧重的是M2型巨噬细胞在肿瘤实质中心区浸润的临床意义。本研究着重观察其在人肺原位、微小浸润性和浸润性肺腺癌中不同解剖区域分布差别,评估边缘区/中心区比值变化,同时分析这些参数对肺腺癌预后的影响。
材 料 和 方 法
1 材料
回顾性研究117例温州医科大学第一附属医院病理科存档肺腺癌根治标本,时间范围为2002年3月至2008年10月。所有标本经4%中性甲醛固定,石蜡包埋。参考肺腺癌2011年新分类[6]进行诊断及分类。筛选合适的肺腺癌边缘区存档蜡块及对应数量的癌中心蜡块作为组织样本,其中男性42例,女性75例,年龄25~76岁。肺腺癌样本分3组,包括原位肺腺癌(adenocarcinomainsitu,AIS)49例、微小浸润性腺癌(minimally invasive adenocarcinoma, MIA)11例和浸润性腺癌(invasive adenocarcinoma, IA)57例。术后采用电话、信件及上门等方式进行随访,共3人失访。随访截止日期为2011年4月,随访时间为8~125个月(平均53.60个月)。随访期内因肺癌死亡34例,生存期8~95个月(平均47.71个月)。
2 主要试剂
PBS(磷酸盐缓冲液粉剂,0.01 mol/L,pH 7.2~7.4)、柠檬酸盐抗原修复液(pH 6.0)和3%H2O2购自北京中杉金桥生物技术有限公司,主要抗体包括CD68(克隆号KP,鼠抗人单克隆,胰酶消化,MAB-0041)、HLA-DR(克隆号LN3,鼠抗人单克隆,无需修复,MAB-0093) 和CD163(克隆号10D6,鼠抗人单克隆,高温修复,MAB-0206),均购自福州迈新生物技术开发有限公司。试剂盒PV-6000(规格:通用型 Polymer Kit 18 mL×2)购自北京中杉金桥生物技术有限公司,其组成包括内源性过氧化物酶阻断剂,Ⅱ抗-HRP多聚体以及PV-6000 辣根酶标记羊抗兔/小鼠IgG多聚体。DouSPTM免疫组化双染试剂盒(KIT-9999)。
3 主要方法
3.1 准备步骤 组织常规切片,厚度4 μm,放入65 ℃烘箱中烘烤45 min,脱蜡过程为二甲苯10 min×3次、100%乙醇×2次、95%乙醇×1次、80%乙醇×1次、75%乙醇×1次,每次5 min,蒸馏水冲洗5 min ×1次。
3.2 双重免疫组化染色步骤 石蜡白片经脱蜡及水化后,用PBS(pH 7.4)冲洗3次,每次3~5 min。根据Ⅰ抗的要求,对组织抗原进行相应的修复。每张切片加50 μL过氧化酶阻断溶液,室温下孵育10 min,每张切片加50 μL正常非免疫动物血清,室温下孵育后除去,加50 μL CD163抗体,室温下孵育60 min。加50 μL生物素标记的Ⅱ抗,孵育完毕后加50 μL链霉菌抗生物素-碱性磷酸酶溶液,除去PBS液后加入100 μL BCIP/NBT显色液,显微镜下观察并控制显色强度。加50 μL双染增强液,室温下孵育10 min。进行胰酶修复,加入50 μL正常非免疫动物血清。除去血清,加50 μL CD68抗体,室温下孵育60 min。加50 μL生物素标记的Ⅱ抗,加50 μL链霉菌抗生物素-过氧化物酶溶液,加100 μL新鲜配制的AEC溶液,室温下显色。自来水冲洗,苏木素复染,自来水冲洗返蓝。直接用水性封片剂封片,显微镜下观察结果。
3.3 细胞识别 利用双重免疫组化染色技术识别巨噬细胞M2表型,CD163+/CD68+双重阳性细胞为M2型巨噬细胞。双重染色第1种抗体着色为棕褐色颗粒状或呈蓝黑色,第2种抗体着色为棕红色颗粒状。
3.4 形态学测量方法 使用NIKON相机(型号E4500)采用固定焦距(16 mm)光圈优先(f=3.4),分别随机拍摄肺腺癌边缘区和中心区高倍镜视野各5个,运用Image-Pro Plus软件,分别计数M2型巨噬细胞在各区域的分布数量,以平均值作为最终数值。Microsoft Excel 2003软件计算边缘/中心比值。
4 统计学处理
采用SPSS 16.0统计软件包处理,计量资料以均数±标准差(mean±SD)表示,多组间均数比较采用方差分析。采用单因素Kaplan-Meier法和log-rank检验对预后加以分析,并采用多因素Cox风险比例模型筛选独立预后危险因子。以P<0.05为差异有统计学意义。
结 果
1 M2型巨噬细胞在肺腺癌边缘区的分布特征
在117例手术切除的肺腺癌边缘区中均可查见巨噬细胞。光镜下可见棕褐色CD68阳性染色颗粒定位于巨噬细胞胞浆和胞膜,同时呈蓝黑色(CD163阳性着色)及棕红色(CD68阳性着色)双重着色细胞被识别为M2型巨噬细胞。M2型巨噬细胞主要位于癌性腺腔及间质内,上皮内偶可见灶性浸润。CD68阳性细胞数量明显多于CD163+/CD68+细胞,肿瘤组117例样本边缘区巨噬细胞M2表型的中位数为23.40(cells/HPF), 最小值及最大值分别为1.20 和58.20(cells/HPF)。M2型巨噬细胞形态学变化较大,癌性腺腔内细胞体积较间质明显增大,形态较为单一,多为圆形、卵圆形,变形细胞少见。相反,间质内细胞形态则多变,体积较小,大小不一,胞浆不规则,可见多个模糊的突起,部分核呈梭形。
2 M2型巨噬细胞在肺腺癌中边缘区与中心区的极化差异及边缘区/中心区比值的变化
117例肺腺癌样本中,边缘区M2型巨噬细胞数量高于中心区,差异有统计学意义(P<0.01)。其分布规律的直方图见图1。方差分析显示肺腺癌边缘区M2型巨噬细胞在3种肺腺癌类型之间比较时具有显著差异(F=69.275,P<0.01),同时显示其在中心区的分布也是存在显著差别的(F=16.445,P<0.01)。上述结果提示M2型巨噬细胞在边缘区和中心区均存在差别极化现象AIS组M2表型数量均明显低于MIA组和IA组P<0.01),值得注意的是,MIA组和IA组间M2表型数量比较未见明显差异(P>0.05)。对M2型巨噬细胞边缘/中心区比值进行统计及评估,结果显示AIS组边缘/中心比值为1.21±0.42,MIA为0.98±0.65,IA为0.53±0.66,F=18.758,P<0.01。AIS组M2表型边缘/中心比值与MIA组比较未见明显差别(P>0.05),但明显高于IA组(P<0.01);MIA与IA间比较,对应的边缘/中心比值变化也有显著差异(P<0.05),见表1。采用双重免疫组化与形态学结合的方法,观察到M2型巨噬细胞在不同类型肺腺癌中不同区域的变化,更直观地反映了上述数值变化,见图2。
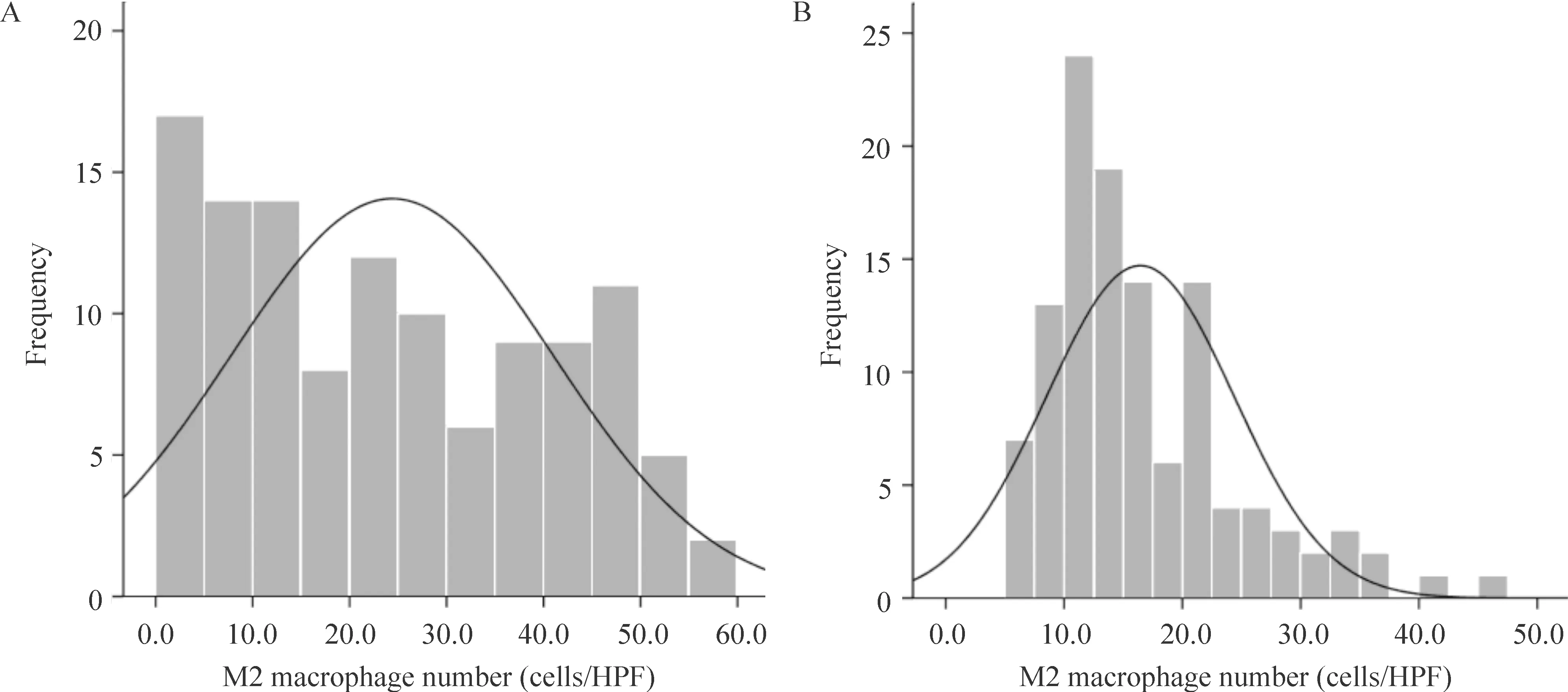
Figure 1. The distribution of M2 macrophages in the marginal (A) and central (B) regions of lung adenocarcinoma.

表1 肿瘤组巨噬细胞M2表型边缘区与中心区的分布差异
AC: lung adenocarcinoma; MR: marginal regions; CR: central regions; M/C ratio: MR/CR ratio.##P<0.01vsCR;*P<0.05,**P<0.01vsIA;△P<0.05,△△P<0.01vsMIA;▲▲P<0.01vsAIS.
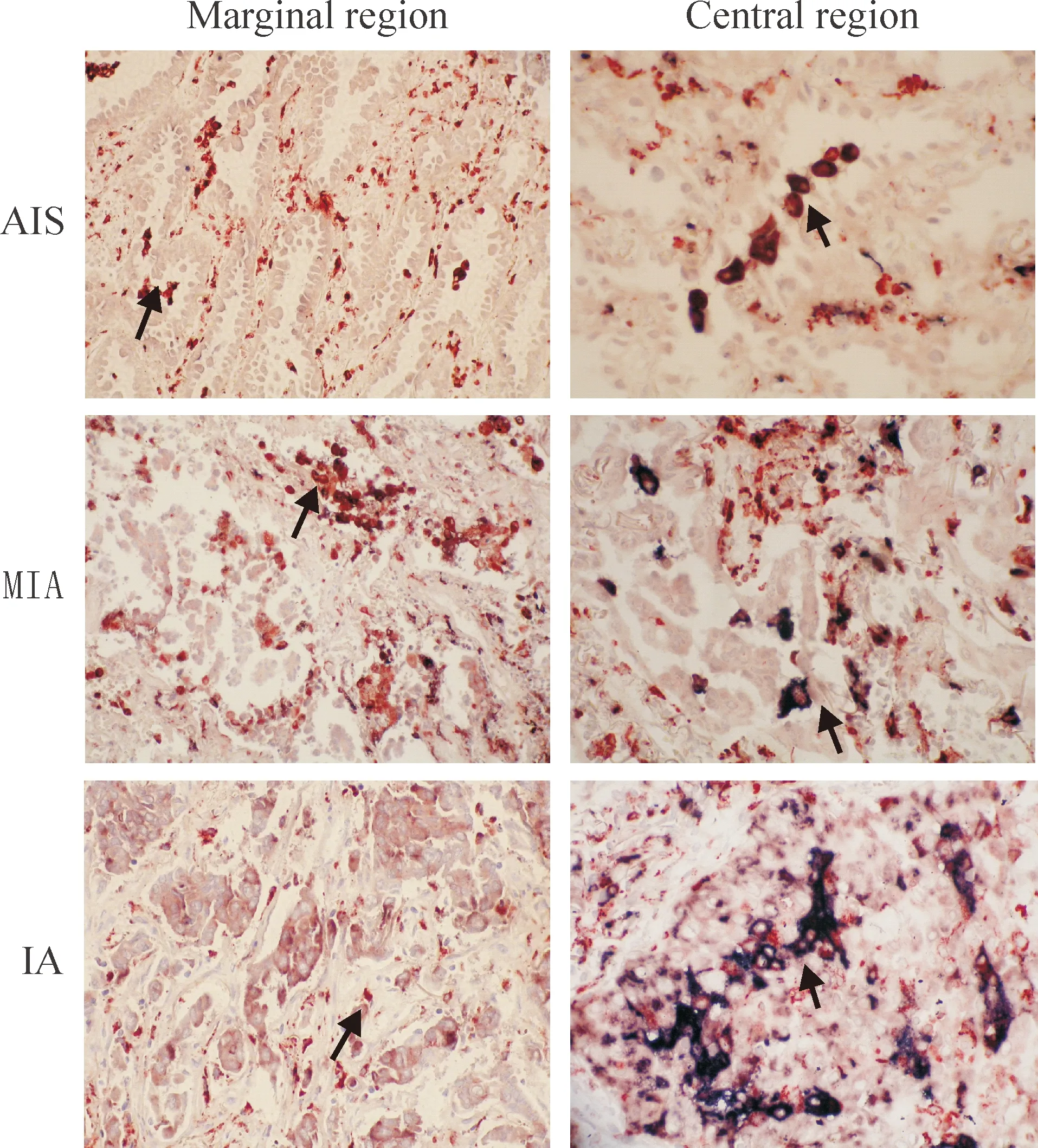
Figure 2.Expression and distribution of M2 macrophages in the marginal region and central region (double staining by SP method, ×400).
3 单因素Kaplan-Meier 生存曲线分析及log-rank检验
结果显示,M2型巨噬细胞高极化组患者生存时间明显短于低极化组(2=44.71,P<0.01),M2型巨噬细胞浸润的数量与生存时间呈负相关,见表2。低边缘/中心比值组生存时间明显长于高边缘/中心比值组(2=21.75,P<0.01),边缘/中心比值与生存时间呈负相关,见图3。
4 多变量Cox风险比例模型生存分析
采用Cox比例风险模型对边缘区M2型巨噬细胞极化状态、极化分组和边缘/中心比值进行多变量生存分析,以确定巨噬细胞M2表型不同极化状态、分组及边缘/中心比值是否与患者的生存时间独立相关。多因素生存分析结果显示肺腺癌中M2巨噬细胞极化状态及边缘/中心比值是判断患者预后的独立因素(P<0.01),但极化分组不是独立预后指标(P>0.05),见表3。
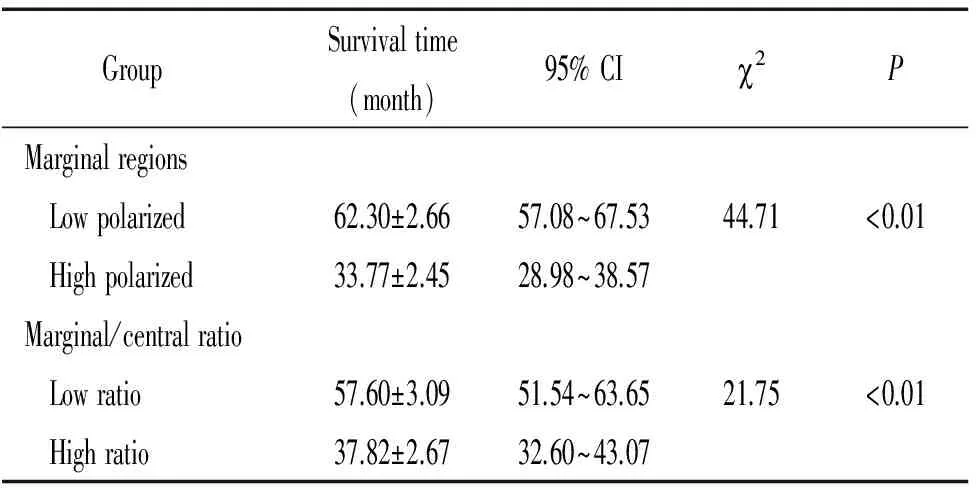
表2 单因素Kaplan-Meier 生存曲线分析及log-rank检验
3 cases were lost during follow-up.
讨 论
肺腺癌具有异质性,除表现多种形态学变化外,其周边癌组织浸润的情况也是非常复杂多变。边缘癌组织的分化程度、浸润形式及免疫反应一定程度反映了癌组织的侵袭能力,对患者预后可能会产生一定影响。M2型巨噬细胞是一种近年来人们逐渐认识到的巨噬细胞功能表型之一 ,为非经典替代性活化的巨噬细胞表型[7]。研究证实M2型巨噬细胞能促进小鼠肺癌移植瘤生长、淋巴管生成和淋巴结转移[8]。然而,目前还没有人体研究探讨M2型巨噬细胞在肺腺癌亚型中心区与边缘区的差异和机制,也尚未证实2种区域比值是否对预后会产生一定影响。
本实验通过双重免疫组化方法对肺腺癌巨噬细胞M2表型进行标记,结果显示M2型巨噬细胞计数显著高于对照组,这提示肺腺癌存在巨噬细胞表型的极向分化,与肺腺癌的发生机制可能密切相关。然而,这个M2型极化巨噬细胞在肺腺癌生长和转移过程的作用仍然是未知的。当然相关基础研究或许能给我们提供一些参考。Li等[9]的研究观察到肺癌A549细胞株与巨噬细胞共培养能诱导基质金属蛋白酶、血管内皮生长因子和单核细胞趋化因子的表达,提升A549细胞的浸润潜能。Mitsuhashi等[10]对肺表面活性物质相关蛋白A(surfactant protein-A,SP-A)基因转导的人肺腺癌细胞株进行研究,认为SP-A可能参与了对巨噬细胞的极化,通过巨噬细胞招募和活化NK细胞,进而抑制肺癌的进展。对这些巨噬细胞基因在肿瘤中表达的调节至少部分是由于缺氧诱导的低氧诱导因子 1α(hypoxia-inducible fac-tor 1α,HIF-1α)和HIF-2α因子上调导致的[11]。有研究认为巨噬细胞主要参与癌症相关的炎症反应,后者能促进肿瘤细胞增生及血管生成,最终对疾病进展过程产生重要的影响[12]。

Figure 3.Effects of polarized aggregation of M2 macrophages in the marginal region of lung adenocarcinoma and the marginal/central ratio on Kaplan-Meier survival curves.
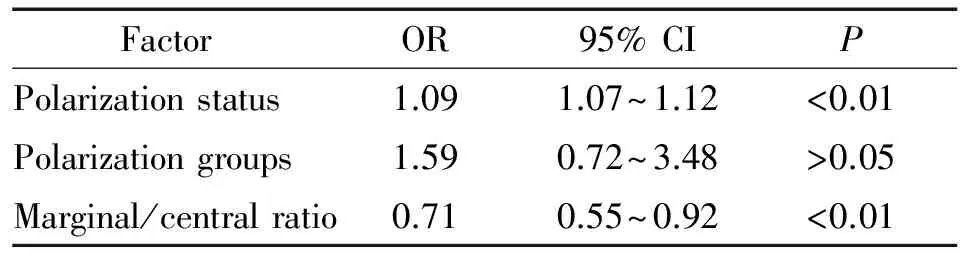
表3 多变量Cox风险比例模型分析巨噬细胞M2表型区域极化与预后的关系
我们研究中发现肺MIA和IA病例中边缘区M2型巨噬细胞数量出现了明显增多,AIS病例M2型巨噬细胞数量较前两者有较明显减少,说明肺腺癌边缘区M2型巨噬细胞数量变化肺腺癌不同阶段具有不同寻常的表现。我们发现边缘区M2型巨噬细胞数量变化很可能与肺腺癌的侵袭浸润能力呈正比关系,提示M2表型具有促进肿瘤侵袭的功能,是一种正向促进因素,反映其具有亲肿瘤的倾向,这与肺腺癌的发生发展与炎症细胞微环境相关[13]。糖皮质激素、IL-4、IL-13 和IL-10能诱导形成一个截然不同的M2巨噬细胞表型,其表达精氨酸酶I和表皮生长因子,促进血管形成,有利于组织重塑和浸润,并能通过分泌IL-10抑制炎症反应[14]。此外,M2型巨噬细胞极化机制可以参考一些基础动物实验的结论。例如王芳等[15]对糖尿病大鼠的课题研究发现巨噬细胞NO2-/NO3-生成量与巨噬细胞功能变化有关。但巨噬细胞诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)介导的NO产生和iNOS的表达是否与M2型巨噬细胞极化聚集有一定关联,仍需更多的临床研究证实。
本研究课题单因素生存分析显示肺腺癌边缘区M2型巨噬细胞数量与肺腺癌的生存时间呈负相关。多变量Cox风险模型生存分析表明M2型巨噬细胞计数与患者的生存时间没有独立的统计学相关性。Welsh等[16]对175例患者的研究中发现,肺腺癌组织内巨噬细胞数量是一个强有利的独立预后因素,巨噬细胞数量越多,预后越差。我们的实验结果部分验证了Welsh等的观点。一项研究认为TAMs尤其是M2表型在肿瘤的转移过程中有重要作用,并证明NSCLC中肿瘤相关巨噬细胞表达免疫抑制细胞因子IL-10是一种消极的预后因素,与肿瘤的淋巴结浸润,晚期及低生存率相关[17]。本研究结果表明巨噬细胞M2表型在肺腺癌边缘区浸润可能与肿瘤侵袭浸润有关,并对预后能造成一定影响。边缘区巨噬细胞M2表型的极化可能是预测患者预后的较好的参考指标。肺腺癌的预后与Th1/Th2细胞因子失衡机制有关,肺腺癌肿瘤微环境能发生Th2细胞因子分泌的偏移。Th2因子能诱导巨噬细胞M2表型激活,抑制免疫系统,促进淋巴管增生,从而促进肺腺癌发生淋巴结转移,对患者的预后产生消极影响[18]。包括肺肿瘤的数种恶性肿瘤,Th2细胞因子偏移与其恶性程度呈正相关[19]。巨噬细胞是可塑性细胞,例如,它们可以在激活的M1状态和激活M2状态间进行表型转换,这取决于它们所处微环境特定的信号。因为IL-4是M2型极化巨噬细胞的激活因子,IL-10具有促进单核细胞发育成M2型巨噬细胞的功能[20]。因此下调边缘区的M2型巨噬细胞数量可能有助于延缓肺腺癌进展,从而能达到改善患者短期预后的目标。
综上所述,巨噬细胞M2表型在肺腺癌周边交界处存在边缘极化效应,其边缘极化状态和边缘/中心比值是独立的预后危险因素。因此,我们推测术前通过肺穿刺等手段对判断边缘极化状态是一种可行的方法,而术后活检检测M2表型边缘/中心比值则可能成为评估预后方法之一。这也为定向清除M2型巨噬细胞以缓解免疫抑制的新技术研究提供应用参考指征,从而在指导肺腺癌术后治疗、改善预后方面发挥其积极的作用。
[1] Martinez FO, Helming L, Gordon S. Alternative activation of macrophages: an immunologic functional perspective[J]. Annu Rev Immunol, 2009, 27:451-483.
[2] Chung FT, Lee KY, Wang CW, et al. Tumor-associated macrophages correlate with response to epidermal growth factor receptor-tyrosine kinase inhibitors in advanced non-small cell lung cancer [J]. Int J Cancer, 2012, 131(3):E227-E235.
[3] Zhang B, Yao G, Zhang Y, et al. M2-polarized tumor-associated macrophages are associated with poor prognoses resulting from accelerated lymphangiogenesis in lung adenocarcinoma [J]. Clinics (Sao Paulo), 2011, 66(11):1879-1886.
[4] Kurahara H,Takao S, Maemura K, et al. M2-polarized tumor-associated macrophage infiltration of regional lymph nodes is associated with nodal lymphangiogenesis and occult nodal involvement in pN0 pancreatic cancer[J]. Pancreas, 2013, 42(1):155-159.
[5] Lan C, Huang X, Lin S, et al. Expression of M2-polarized macrophages is associated with poor prognosis for advanced epithelial ovarian cancer[J]. Technol Cancer Res Treat, 2013, 12(3):259-267.
[6] Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. Thorac Oncol, 2011, 6(2):244-285.
[7] Siveen KS, Kuttan G. Role of macrophages in tumour progression[J]. Immunol Lett, 2009, 123(2):97-102.
[8] 章必成,赵 勇,王 俊,等. 不同活化表型的巨噬细胞对小鼠肺癌移植瘤生长、淋巴管生成和淋巴结转移的影响[J]. 肿瘤, 2008, 28(08):660-663.
[9] Li X, Tai HH. Activation of thromboxane A2 receptor (TP) increases the expression of monocyte chemoattractant protein-1 (MCP-1)/chemokine (C-C motif) ligand 2 (CCL2) and recruits macrophages to promote invasion of lung cancer cells[J]. PLoS One, 2013, 8(1):e54073.
[10]Mitsuhashi A, Goto H, Kuramoto T, et al. Surfactant protein a suppresses lung cancer progression by regulating the polarization of tumor-associated macrophages[J]. Am J Pathol, 2013, 182(5):1843-1853.
[11]Chai CY, Chen WT, Hung WC, et al. Hypoxia-inducible factor-1alpha expression correlates with focal macrophage infiltration, angiogenesis and unfavourable prognosis in urothelial carcinoma[J]. J Clin Pathol, 2008,61(5):658-664.
[12]Solinas G, Germano G, Mantovani A, et al. Tumor-associated macrophages (TAM) as major players of the cancer-related inflammation[J]. J Leukoc Biol, 2009, 86(5):1065-1073.
[13]Gordon S, Martinez FO. Alternative activation of macrophages: mechanism and functions[J]. Immunity, 2010, 32(5):593-604.
[14]DeNardo DG, Barreto JB, Andreu P, et al. CD4+T cells regulate pulmonary metastasis of mammary carcinomas by enhancing protumor properties of macrophages[J]. Cancer Cell, 2009, 16(2):91-102.
[15]王 芳,陈筱菲,陈国荣,等. 银杏叶提取物对糖尿病大鼠脂代谢及巨噬细胞功能的影响[J]. 中国病理生理杂志, 2006, 22(10):2036-2039.
[16]Welsh TJ, Green RH, Richardson D, et al. Macrophage and mast-cell invasion of tumor cell islets confers a marked survival advantage in non-small-cell lung cancer[J]. J Clin Oncol, 2005, 23(35):8959-8967.
[17]Zeni E, Mazzetti L, Miotto D, et al. Macrophage expression of IL-10 is a prognostic factor in non-small cell lung cancer[J]. Eur Respir J, 2007, 30(4):627-632.
[18]Craig M, Ying C, Loberg RD. Co-inoculation of prostate cancer cells with U937 enhances tumor growth and angiogenesisinvivo[J]. J Cell Biochem, 2008,103(1):1-8.
[19]Alitalo K, Tammela T, Petrova TV. Lymphangiogenesis in development and human disease[J]. Nature, 2005, 438(7070):946-953.
[20]Stacker SA, Farnsworth RH, Karnezis T, et al. Molecular pathways for lymphangiogenesis and their role in human disease[J]. Novartis Found Symp, 2007, 281:38-43; discussion 44-53, 208-209.
Polarized distribution of M2 macrophages in marginal region around lung adenocarcinoma and its effect on prognosis
XIAO Wei-hua1, ZHAO Ling-ling2, YING Li-li2, MA Hai-fen1, WU Liang2, CHEN Guo-rong2
(1DepartmentofPathology,BeilunDistrictPeople’sHospitalinNingboCity,Ningbo315800,China;2DepartmentofPathology,TheFirstAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China.E-mail:chengr1978@aliyun.com)
AIM: To explore the polarized distribution of M2 macrophages in the marginal region around lung adenocarcinoma, the marginal/central ratio and their effect on the prognosis. METHODS: Double immunohistochemistry staining was used to determine the distribution and the difference of CD163+/CD68+(M2) macrophages in the marginal and central regions in 49 cases of lung adenocarcinomainsitu(AIS), 11 cases of minimally invasive adenocarcinoma (MIA) and 57 cases of invasive adenocarcinoma (IA) in order to explore the effect and mechanism of the polarized distribution and the marginal/central ratio on the progression of lung adenocarcinoma. Single- factor Kaplan-Meier survival curve analysis and multivariate Cox survival analysis were employed to explore the relationship between the polarized distribution of M2 macrophages and the prognosis. RESULTS: Polarized aggregation of M2 macrophages was observed in the marginal region of lung adenocarcinoma compared with that in the central region, and the difference was significant (P<0.01). Based on the median level, they were divided into high polarized group and low polarized group. In low polarized group, M2 macrophage count in AIS was not significantly different from that in MIA or IA. However, in high polarized group, M2 macrophage count in AIS was lower than that in MIA and IA in turn and there were statistically significant differences (P<0.01). Single-factor Kaplan-Meier survival curve analysis and log-rank test result showed that the number of M2 macrophages in the marginal region and marginal/central ratio were negatively correlated to the survival time (2=44.71,P<0.01;2=21.75,P<0.01). Multivariate Cox survival analysis showed that the high polarized distribution of M2macrophages in the marginal region and the marginal/central ratio were independent risk factors for the prognosis (P<0.01). CONCLUSION: There is a polarization effect of M2 macrophages on the marginal region of lung adenocarcinoma. The marginal polarization and the marginal/central ratio are independent risk factors of the prognosis. Therefore, it may be an effective method for the evaluation of the prognosis to judge the marginal polarization by preoperative puncture and to determine the marginal/central ratio of M2 macrophages by postoperative biopsy.
Lung neoplasms; Macrophages; Polarization; Prognosis
1000- 4718(2015)01- 0160- 06
2014- 05- 11
2014- 07- 11
浙江省科学技术厅国际科技合作专项(合作研究)项目(No. 2013C24031)
△通讯作者 Tel: 0577-55579795; E-mail: chengr1978@aliyun.com
R734.2
A
10.3969/j.issn.1000- 4718.2015.01.030
