转化生长因子α促进人内皮祖细胞增殖、迁移和黏附*
2015-04-17代文静周敬群向常清
代文静, 张 军, 周敬群△, 向常清, 王 刚
(三峡大学仁和医院 1心血管内科, 2ICU科, 湖北 宜昌 443000)
转化生长因子α促进人内皮祖细胞增殖、迁移和黏附*
代文静1, 张 军2, 周敬群1△, 向常清1, 王 刚1
(三峡大学仁和医院1心血管内科,2ICU科, 湖北 宜昌 443000)
目的: 探讨转化生长因子α(transforming growth factor α,TGF-α)对人内皮祖细胞(endothelial progenitor cells,EPCs)单克隆形成、增殖、迁移和黏附细胞功能的影响及机制。方法: 分离培养人内皮祖细胞,分别用浓度为1、5、10 μg/L TGF-α诱导处理细胞,并设置PBS对照组和表皮生长因子受体酪氨酸激酶抑制剂EGFR-TKI组(同时加入10 μg/L TGF-α和1∶1 000的EGFR-TKI)。利用单克隆形成实验、MTT法和EdU法、Transwell法和细胞黏附实验检测不同浓度TGF-α对各组EPCs单克隆形成能力、细胞增殖、细胞迁移能力及黏附功能的影响;并通过Western blotting法检测不同浓度TGF-α对各组EPCs中表皮生长因子受体(epithelial growth factor receptor,EGFR)和血管内皮生长因子(vascular endothelial growth factor,VEGF)表达的影响。结果: 不同浓度TGF-α均能显著诱导EPCs单克隆形成能力、增殖、迁移和黏附细胞功能,差异有统计学意义(P<0.05),并可以被EGFR-TKI抑制。Western blotting检测发现TGF-α显著诱导EPCs中EGFR和VEGF的表达(P<0.05),并呈浓度依赖性。结论: TGF-α能够显著促进人EPCs细胞单克隆形成、增殖、迁移和黏附相关细胞功能,并通过与EGFR结合诱导VEGF表达来发挥作用。
转化生长因子 α; 内皮祖细胞; 细胞增殖; 细胞迁移; 细胞黏附; 表皮生长因子受体
内皮祖细胞(endothelial progenitor cells,EPCs)是一类可以分化成内皮细胞的前体干细胞,参与到血管的新生和损伤修复,同时对于治疗缺血性疾病和监控心血管疾病具有重要应用价值[1]。EPCs的增殖、迁移和黏附细胞功能与其在血管生成与损伤修复中发挥作用密切相关。转化生长因子α(transforming growth factor α, TGF-α)是一种多功能性f生物活性细胞因子,在组织损伤愈合和促进细胞分化生长中发挥作用[2]。研究表明TGF-α与表皮生长因子类似,通过与细胞表面的表皮生长因子受体(epithelial growth factor receptor, EGFR)结合发挥作用,TGF-α与EGFR具有高亲和力,可激活受体内在酪氨酸激酶活性,从而启动信号转导[3]。已有研究发现TGF-α能够促进人脂肪来源干细胞、表皮干细胞增殖和分化等细胞功能[4]。但目前关于TGF-α对人内皮祖细胞相关细胞功能的影响及其作用机制尚未见报道,因此本文通过研究TGF-α对人EPCs细胞单克隆形成、增殖、迁移和黏附功能的影响及机制,为TGF-α在血管损伤修复及缺血性血管新生中的应用提供指导和依据。
材 料 和 方 法
1 试剂和材料
M199细胞培养基、胰酶、胎牛血清购自Hyclone;青霉素、链霉素、ECL化学发光试剂购自北京碧云天公司;Endogro细胞因子、TGF-α、表皮生长因子受体酪氨酸激酶抑制剂(epithelial growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)购自R&D;D-Hanks溶液、二甲基亚砜(DMSO)、CD133磁珠购自Sigma;人淋巴细胞分离液购自天津TBD公司;MTT试剂购自上海生工公司;Cell-LightTMEdU荧光显微镜检测试剂盒购自广州市锐博生物科技公司;Transwell Permeable Supports购自Corning;兔抗人EGFR、VEGF、β-actin多克隆抗体购自北京博奥森公司;辣根过氧化物酶标记山羊抗兔IgGⅡ抗购自中杉金桥公司;其它试剂均为国产分析纯。
2 主要方法
2.1 人内皮祖细胞EPCs的分离培养及鉴定 取健康志愿者捐献外周血,用人淋巴细胞分离液等体积混匀后密度梯度离心20 min,分离得到中间层人外周血单核细胞层。用D-Hanks液清洗并离心,弃去上清,用含10%胎牛血清和Endogro细胞因子的M199内皮祖细胞完全培养基重悬后,接种于胶原包被的细胞培养瓶中,37 ℃、5% CO2培养箱中连续培养。在培养24 h时,取出培养瓶换液,弃去未贴壁细胞后继续培养,每3 d换液1次,贴壁细胞继续培养。在倒置显微镜下观察分离的人EPCs的生长状态。EPCs培养至7 d时接种于6孔板中,细胞贴壁后加入DiI-ac-LDL(10 mg/L),37 ℃孵育4 h后,PBS漂洗2次,4%多聚甲醛固定细胞30 min,PBS漂洗后加入FITC-UEA-1(10 mg/L),37 ℃孵育2 h后,PBS漂洗2次,在荧光显微镜下观察EPCs细胞并拍照。EPCs可以摄取DiI-ac-LDL,并能特异性结合UEA-1,能同时摄取DiI-ac-LDL和FITC-UEA-1标记的确定为分化中的EPCs。
2.2 EPCs单克隆形成检测 采用相同的方法从人外周血中分离出单核细胞层后,利用CD133磁珠分选,在4 ℃用垂直混匀器混匀30 min后收集磁珠吸附的细胞,用EPCs细胞完全培养基重悬后分成5组,分别加入浓度为1、5、10 μg/L TGF-α,同时设置PBS对照组和表皮生长因子受体酪氨酸激酶抑制剂EGFR-TKI组(同时加入10 μg/L TGF-α和1∶1 000的EGFR-TKI)。将细胞悬液加入到甲基纤维素半固体培养基中,37 ℃、5% CO2培养箱中连续培养7 d后,在显微镜下高倍视野内随机观察各组中EPCs形成的单克隆并进行拍照和计数。
2.3 MTT和Edu增殖实验 将连续培养14 d的EPCs细胞用0.25%的胰酶消化,用M199内皮祖细胞完全培养基稀释至浓度为1×107/L接种在96孔板中,每孔加入200 μL。分别用含1、5、10 μg/L TGF-α的培养基培养3 d,同时设置PBS对照组和EGFR-TKI组。每组设置6个复孔。培养3 d后,每孔加入MTT溶液(5 g/L)20 μL,37 ℃继续培养4 h后弃去培养基,每孔加入150 μL DMSO,在摇床上振荡15 min后,在酶标仪上测定492 nm时各孔吸光度(A)值。同时在各组96孔板中EPCs经不同浓度TGF-α处理3 d后,每孔加入含50 μmol/L EdU培养基共孵育2 h,后弃培养基用4%多聚甲醛固定EPCs细胞,用0.2%甘氨酸孵育10 min,PBS洗涤后按照Cell-LightTMEdU方法反应染色并在荧光显微镜下拍照观察并计数每个高倍视野内的增殖细胞。
2.4 Transwell实验 将培养至14 d的EPCs细胞用0.25%的EDTA胰酶消化,900 r/min离心5 min收集细胞,用M199内皮祖细胞完全培养基重悬调整其浓度为1×108/L。在Transwell板培养室上孔中分别加入200 μL EPCs细胞悬液,下室中分别加入含PBS,1、5、10 μg/L TGF-α及TGF-α+EGFR-TKI的细胞培养基。37 ℃继续培养24 h后,用取出上室小皿用0.1 mg/L结晶紫染色30 min,后用PBS洗涤3遍。用棉签轻轻擦去上室的贴壁细胞,在显微镜下观察计数并拍照。
2.5 EPCs细胞黏附实验 培养至14 d的EPCs细胞用0.25%的EDTA胰酶消化后,按照2×107/L接种于6孔板中,并用含不同浓度的TGF-α(1、5、10 μg/L)进行培养24 h,同时设置PBS对照孔和TGF-α+GFR-TKI孔。培养结束后用胰酶消化各孔中EPCs细胞并离心收集。调整消化后EPCs细胞浓度一致后分别接种于人纤维连接蛋白包被的6孔板中,37℃下继续培养30 min后,弃去培养基并用PBS冲洗去未贴壁的细胞,每孔在倒置显微镜下随机选择9个视野(×200)。同时每组设置3个重复孔,计数各组黏附的EPCs细胞。
2.6 Western blotting检测EPCs中EGFR和VEGF表达 分离培养14 d的EPCs细胞用0.25%的EDTA胰酶消化后,将其分成5组,分别用含不同浓度的TGF-α(1、5、10 μg/L)培养基进行培养3 d,同时设置PBS对照组和TGF-α+EGFR-TKI组。培养结束后弃去培养基,用PBS洗涤后收集各组EPCs细胞,RIPA裂解液裂解细胞提取细胞中总蛋白,并用BCA试剂盒测定各组中蛋白浓度。每组分别取含30 μg总蛋白上样进行12%的SDS-PAGE分离蛋白,电泳结束后转至PVDF膜,封闭30 min后,分别孵育兔抗人VEGF I抗(1∶1 000)、EGFR I抗(1∶1 000)和β-actin抗体(1∶1 000) 4 ℃过夜,用TBST洗涤3遍各5 min,后孵育HRP标记山羊抗兔 II 抗(1∶5 000)2 h。TBST洗涤后ECL化学发光显影,曝光拍照。利用Quantity One软件分析各条带的相对吸光度,利用目的条带和内参照β-actin的比值表示其相对表达量。
3 统计学处理
采用SPSS 13.0软件进行统计分析,所有正态分布统计数据采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),各组间两两比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 人EPCs的培养鉴定结果
从健康人外周血中分离得到EPCs连续培养14 d后进行功能鉴定。如图1所示,所分离的人EPCs能够吞噬DiI-ac-LDL发红色荧光,并能够结合FITC-UEA-1发绿色荧光,而双阳性黄色荧光细胞即为正在分化中的EPCs细胞。图1中EPCs细胞吞噬DiI-ac-LDL和结合FITC-UEA-1双阳性率在90%以上,说明成功从人外周血中分离培养得到EPCs细胞。

Figure 1.The identification of human endothelial progenitor cells. A: FITC-UEA-1 positive cells; B: DiI-ac-LDL positive cells; C: double positive cells.
2 TGF-α对EPCs单克隆形成的影响
体外进行EPCs的甲基纤维半固体单克隆培养,在7 d时观察发现不同浓度的TGF-α均能够促进EPCs单克隆的形成,但TGF-α对EGFR-TKI组中EPCs单克隆形成没有作用,见图2。经统计,PBS对照组中每个高倍视野内EPCs单克隆形成数为11.80±2.58,而1、5、10 μg/L TGF-α处理组中每个高倍视野内EPCs单克隆数分别增加为20.00±2.55、26.40±2.31和34.60±2.34(均P<0.05)。同时加10 μg/L TGF-α和EGFR-TKI处理组中EPCs单克隆形成数未见增加,仅为10.60±1.82,显著低于单独10 μg/L TGF-α处理组,说明表皮生长因子受体酪氨酸激酶信号途径的抑制影响TGF-α对EPCs单克隆形成发挥作用,见图2。
3 TGF-α对EPCs增殖的影响
MTT检测发现与PBS对照组EPCs在492 nm波长A值相比,1、5、10 μg/L TGF-α处理组中A值均显著增加(P<0.05),但同时加入10 μg/L TGF-α和EGFR-TKI组中A值无明显变化。如图3所示,PBS对照组中A值为0.37±0.04,而1、5、10 μg/L TGF-α处理组中A值分别增加为0.47±0.02、0.54±0.02和0.60±0.03(均P<0.05)。TGF-α+EGFR-TKI组中EPCsA值为0.33±0.02,与PBS组相比变化不明显,但显著低于单独10 μg/L TGF-α处理组(P<0.05)。EdU实验显示在荧光显微镜下增殖期EPCs发红色荧光而其余细胞发蓝色荧光,见图4。与PBS对照组相比,经不同浓度TGF-α诱导处理组中处于增殖期的EPCs细胞均显著增加且呈浓度依赖效应,但EGFR-TKI组中增殖期EPCs细胞未见明显增加且显著低于TGF-α单独作用组。经统计,每个高倍视野(×200)内PBS对照组中增殖EPCs数为13.33±2.09,而1、5、10 μg/L TGF-α处理组中增殖EPCs数增加分别为27.33±1.52、32.33±1.53和45.00±2.00(均P<0.05),TGF-α+EGFR-TKI组中增殖EPCs数为10.33±2.05,同样显著低于单独10 μg/L TGF-α处理组(P<0.05)。MTT和EdU实验同时证明TGF-α能够促进EPCs细胞活力和增殖,但受到EGFR-TKI的抑制。

Figure 2.The monoclonal formation of EPCs exposed to TGF-α.A: control group; B: 1 μg/L TGF-α group; C: 5 μg/L TGF-α group; D: 10 μg/L TGF-α group; E: 10 μg/L TGF-α + EGFR-TKI group. Mean±SD. n=10. *P<0.05 vs control group; #P<0.05 vs 10 μg/L TGF-α group.

Figure 3.The effect of TGF-α on the proliferation of EPCs by MTT assay. A: control group; B: 1 μg/L TGF-α group; C: 5 μg/L TGF-α group; D: 10 μg/L TGF-α group; E: 10 μg/L TGF-α + EGFR-TKI group. Mean±SD. n=15. *P<0.05 vs control group; #P<0.05 vs 10 μg/L TGF-α group.
4 TGF-α对EPCs迁移的影响
如图5所示,被诱导的EPCs细胞能够从Transwell上室主动迁移到下室,经固定和结晶紫染色后可以观察到发生迁移的EPCs细胞。与PBS对照组相比,各TGF-α处理组可以显著诱导EPCs细胞迁移,但EGFR-TKI组中EPCs细胞迁移受到抑制。经过统计发现,PBS对照组中平均每个高倍视野(×200)内EPCs迁移数为38.75±4.92,而1、5、10 μg/L TGF-α处理组中EPCs细胞迁移数分别增加为63.50±3.69、75.25±2.76和90.75±3.50(均P<0.05),EGFR-TKI组中EPCs细胞迁移数为45.00±2.16,显著低于10 μg/L TGF-α单独处理组(P<0.05)。

Figure 4.The effect of TGF-α on the proliferation of EPCs detected by EdU assay.A:control group; B: 1 μg/L TGF-α group; C: 5 μg/L TGF-α group; D: 10 μg/L TGF-α group; E: 10 μg/L TGF-α + EGFR-TKI group. Mean±SD. n=6. *P<0.05 vs control group; #P<0.05 vs 10 μg/L TGF-α group.
5 TGF-α对EPCs细胞黏附能力的影响
如图6所示,TGF-α能够显著提高EPCs细胞的黏附能力,并具有浓度依赖效应。在相同时间内,随着TGF-α浓度的升高,EPCs细胞黏附能力提升。但TGF-α+EGFR-TKI组中EPCs细胞黏附能力未见明显提升。经过统计发现,与PBS对照组中EPCs细胞黏附数30.34±4.16相比,1、5、10 μg/L TGF-α处理组中EPCs细胞黏附数分别增加为54.33±5.69、76.67±3.21和96.33±3.05(均P<0.05),而TGF-α+EGFR-TKI组中EPCs细胞黏附数增加不明显,为34.33±3.15,显著低于10 μg/L TGF-α单独处理组(P<0.05)。
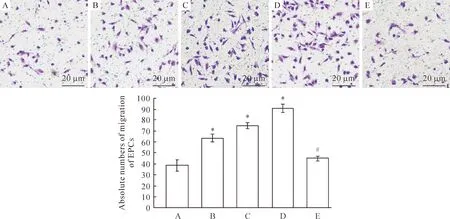
Figure 5.The effect of TGF-α on the migration of EPCs detected by Transwell method.A:control group; B: 1 μg/L TGF-α group; C: 5 μg/L TGF-α group; D: 10 μg/L TGF-α group; E: 10 μg/L TGF-α+EGFR-TKI group. Mean±SD. n=10. *P<0.05 vs control group; #P<0.05 vs 10 μg/L TGF-α group.

Figure 6.The effect of TGF-α on the adhesiveness of EPCs detected by cell adhesion experiment. A:control group; B: 1 μg/L TGF-α group; C: 5 μg/L TGF-α group; D: 10 μg/L TGF-α group; E: 10 μg/L TGF-α + EGFR-TKI group. Mean±SD. n=10. *P<0.05 vs control group; #P<0.05 vs 10 μg/L TGF-α group.
6 TGF-α对EPCs细胞中EGFR和VEGF蛋白表达的影响
如图7所示,Western blotting检测发现TGF-α能够诱导EPCs细胞中EGFR和VEGF的表达。相对PBS对照组,随着TGF-α作用EPCs浓度的升高,EGFR和VEGF蛋白表达量也显著上升,但EGFR-TKI组EGFR和VEGF蛋白表达量变化不明显。经目的蛋白EGFR和VEGF的灰度值和内参照β-actin的比值进行比较统计,PBS对照组EGFR相对表达量为0.15±0.03,而1、5、10 μg/L TGF-α处理组EPCs细胞EGFR相对表达量分别为0.34±0.03、0.56±0.02和0.94±0.02(均P<0.05),但TGF-α+EGFR-TKI组EGFR相对表达量为0.18±0.02,低于10 μg/L TGF-α单独处理组(P<0.05);PBS对照组中VEGF相对表达量为0.33±0.02,而1、5、10 μg/L TGF-α处理组EPCs细胞VEGF相对表达量分别为0.47±0.03、0.63±0.02和0.83±0.03(均P<0.05),但TGF-α+EGFR-TKI组VEGF相对表达量为0.36±0.02,低于10 μg/L TGF-α单独处理组(P<0.05)。

Figure 7.The expressions of EGFR and VEGF in the EPCs exposed to TGF-α. A:control group; B: 1 μg/L TGF-α group; C: 5 μg/L TGF-α group; D: 10 μg/L TGF-α group; E: 10 μg/L TGF-α + EGFR-TKI group. Mean±SD. n=10. *P<0.05 vs control group; #P<0.05 vs 10 μg/L TGF-α group.
讨 论
EPCs来源于骨髓、外周血和脐血等,可以分化成成熟内皮细胞。近年来研究表明EPCs在心脑血管疾病、外周血疾病、血管形成及创伤修复中均发挥重要作用[5],并可为缺血性疾病的研究治疗提供新的思路。当机体血管损伤或局部缺血时,EPCs可以通过增殖、迁移,黏附到血管损伤或缺血部位并直接分化成内皮细胞,从而发挥血管修复、新生作用[6]。同时血液中EPCs数量增多时亦可以直接修复损伤的血管,因此EPCs的细胞功能发挥对于血管损伤修复和新生有重要意义。转化生长因子是具有广泛生物学功能的细胞因子,在促进细胞增殖分化及组织损伤愈合中均发挥作用[7],但关于其对EPCs功能的影响及其在血管损伤修复和新生中是否发挥作用尚未知。本研究以不同浓度TGF-α诱导处理人外周血中分离培养的EPCs,进而揭示其对EPCs增殖、迁移和黏附细胞功能的影响及机制。
通常循环EPCs在正常人血液中数量较低,而有冠心病或急性心血管疾病的病人血液中EPCs数量则更为降低,且细胞活力下降[8]。另有研究发现血液中EPCs数量与冠心病等危险因素呈负相关[9]。EPCs对动脉粥样硬化性疾病具有独立预测价值,其数量减少与动脉粥样硬化严重性也相关。因此,EPCs可作为心血管疾病危险程度和预后的生物标志物,调控其增殖对于治疗心血管疾病有重要价值。本研究中通过EPCs的单克隆实验发现TGF-α能够增强其克隆形成能力并具有浓度效应,而MTT和EdU实验也显示TGF-α能够显著促进EPCs的增殖,进而说明TGF-α能够提升EPCs细胞活力,在EPCs增殖中发挥作用。
当组织缺血或血管发生损伤时,EPCs能够及时从骨髓动员到外周血并通过迁移和黏附作用到达损伤或缺血部位分化成内皮细胞,促进血管新生和修复[10]。因此,EPCs的迁移和黏附细胞功能直接影响到血管的损伤修复及新生。有研究表明TGF-α能够在组织损伤愈合中发挥重要作用[11],但关于其对血管损伤修复中关键细胞内皮祖细胞的影响尚未知。在本研究以1、5、10 μg/L 不同浓度TGF-α处理人EPCs,首次发现TGF-α能够诱导EPCs的细胞迁移及黏附,进而说明TGF-α能够在血管损伤修复和血管新生中发挥积极作用。但当10 μg/L TGF-α和EGFR-TKI同时作用于EPCs细胞时,EPCs单克隆形成及增殖、迁移和黏附能力促进效应均不明显,且显著低于10 μg/L TGF-α单独作用组,说明TGF-α对EPCs细胞功能发挥作用与表皮生长因子受体信号途径相关。
EGFR作为TGF-α的受体,能够与其结合进而激活机体细胞内信号转导途径发挥作用[12]。Zhao等[13]研究也发现TGF-α通过与EGFR结合,使受体酪氨酸磷酸化及信号转导,进而发挥生物学效应。VEGF是一种特异性作用于血管内皮细胞的因子,可以诱导血管的生成及新生[14]。Sufen等[15]研究已证实VEGF可以直接促进内皮祖细胞的增殖、游走迁移和黏附功能从而促进新生血管的形成。本研究利用Western-blotting检测不同浓度TGF-α对EPCs细胞中EGFR和VEGF表达的影响,发现随着TGF-α处理EPCs浓度的升高,EPCs细胞中EGFR和VEGF含量也随之显著升高,说明TGF-α通过EGFR信号途径对EPCs细胞发挥作用。TGF-α可以与EPCs细胞中受体EGFR结合,进而刺激VEGF的表达,促进EPCs的增殖、迁移和黏附等细胞功能。而在TGF-α+EGFR-TKI作用组,EPCs细胞中EGFR和VEGF表达量增加不明显且显著低于TGF-α单独作用组,再次说明TGF-α对EPCs细胞功能的影响与EGFR信号途径相关。
EPCs是治疗缺血性疾病和修复血管损伤的良好种子细胞,具有巨大的临床应用价值。在本研究中首次发现TGF-α在体外能够显著促进人EPCs的单克隆形成和增殖,增强其迁移和粘附细胞功能,诱导EFGR和VEGF表达发挥作用并与表皮生长因子受体信号途径有关,对于血管损伤修复和缺血性疾病的治疗具有重要意义。
[1] 赵 力, 王海昌, 尹 涛, 等. 高糖对内皮祖细胞功能的损害及胰岛素的影响[J]. 中国病理生理杂志, 2008, 24(4): 688-691.
[2] Herrmann JL, Wang Y, Abarbanell AM, et al. Preconditioning mesenchymal stem cells with transforming growth factor-alpha improves mesenchymal stem cell-mediated cardioprotection[J]. Shock, 2010, 33(1): 24-30.
[3] McClintock JL, Ceresa BP. Transforming growth factor-α enhances corneal epithelial cell migration by promoting EGFR recycling[J]. Invest Ophthalmol Visual Sci, 2010, 51(7): 3455-3461.
[4] 徐 鹏, 葛海燕. TGF-α 对人脂肪来源干细胞 Survivin 蛋白的影响[J]. 同济大学学报:医学版, 2013, 34(1): 17-20.
[5] 秦 臻, 黄水清. 当归补血汤对动脉粥样硬化兔内皮祖细胞及血清 VEGF、SDF-1 的影响[J]. 中国病理生理杂志, 2012, 28(2):211-215.
[6] Liu X, Li Y, Liu Y, et al. Endothelial progenitor cells (EPCs) mobilized and activated by neurotrophic factors may contribute to pathologic neovascularization in diabetic retinopathy[J]. Am J Pathol, 2010, 176(1):504-515.
[7] Grahovac J, Wells A. Matrikine and matricellular regulators of EGF receptor signaling on cancer cell migration and invasion[J]. Lab Invest, 2013, 94(1):31-40.
[8] Grisar JC, Haddad F, Gomari FA, et al. Endothelial progenitor cells in cardiovascular disease and chronic inflammation: from biomarker to therapeutic agent[J]. Biomarkers Med, 2011, 5(6): 731-744.
[9] Sandri M, Beck EB, Adams V, et al. Maximal exercise, limb ischemia, and endothelial progenitor cells[J]. Eur J Cardiovas Prev Rehabilitation, 2011, 18(1):55-64.
[10]Galasso G, De Rosa R, Ciccarelli M, et al. β2-Adrenergic receptor stimulation improves endothelial progenitor cell-mediated ischemic neoangiogenesis[J]. Circ Res, 2013, 112(7): 1026-1034.
[11]李点玲,张桂英. 瘦素和 TGF-α 在幽门螺杆菌感染慢性胃炎和胃溃疡患者胃黏膜内的表达及意义[J]. 世界华人消化杂志, 2005, 13(23): 2795-2798.
[12]Zhang J, Zhang C, Yao X, et al. Association of single nucleotide polymorphism in untranslated region ofEGFRgene with genetic susceptibility of gastric cancer[J]. Tumor, 2013, 33(4): 321-326.
[13]Zhao D, Zhai B, He C, et al. Upregulation of HIF-2α induced by sorafenib contributes to the resistance by activating the TGF-α/EGFR pathway in hepatocellular carcinoma cells[J]. Cell Signalling, 2014, 26(5): 1030-1039.
[14]Guo S, Yu L, Cheng Y, et al. PDGFRβ triggered by bFGF promotes the proliferation and migration of endothelial progenitor cells via p-ERK signalling[J]. Cell Biol Int, 2012, 36(10): 945-950.
[15]Sufen G, Xianghong Y, Yongxia C, et al. bFGF and PDGF-BB have a synergistic effect on the proliferation, migration and VEGF release of endothelial progenitor cells[J]. Cell Biol Int, 2011, 35(5): 545-551.
Transforming growth factor α promotes the proliferation, migration and adhesion of human endothelial progenitor cells
DAI Wen-jing1, ZHANG Jun2, ZHOU Jing-qun1, XIANG Chang-qing1, WANG Gang1
(1DepartmentofCardiology,2DepartmentofICU,RenheHospital,ThreeGorgesUniversity,Yichang443000,China.E-mail:zhoujingqun-1@medmail.com.cn)
AIM: To explore the effects of transforming growth factor-α (TGF-α) in the monoclonal formation, proliferation, migration and adhesiveness of human endothelial progenitor cells (EPCs). METHODS: The isolated and cultured EPCs were treated with various concentrations of TGF-α (final concentrations of 1, 5, 10 μg/L, respectively). At the same time, the PBS control and epidermal growth factor receptor-tyrosine kinase inhibitor (EGFR-TKI) group (10 μg/L TGF-α plus 1∶1 000 EGFR-TKI) were set. The effects of TGF-α on monoclonal formation, proliferation, migration and adhesiveness of EPCs were determined by clone formation experiment, thiazolyl blue tetrazolium bromide (MTT), EdU, Transwell and adhesion assays, respectively. The expression of epithelial growth receptor (EGFR) and vascular endothelial growth factor (VEGF) were measured by Western blotting. RESULTS: Different concentrations of TGF-α all significantly induced the monoclonal formation, proliferation, migration and adhesiveness of EPCs (P<0.01), which were inhibited by EGFR-TKI. The results of Western blotting showed that TGF-α also induced the expression of EGFR and VEGF with a certain concentration effect (P<0.01). CONCLUSION: By combining with EGFR induced the expression of VEGF, TGF-α significantly promotes the related cell function of monoclonal formation, proliferation, migration, adhesiveness in EPCs.
Transforming growth factor α; Human endothelial progenitor cells; Cell proliferation; Cell migration; Cell adhesion; Epidermal growth factor receptor
1000- 4718(2015)01- 0033- 07
2014- 08- 22
2014- 11- 01
教育厅自然科学研究计划重点项目(No. D20091308)
△通讯作者 Tel: 0717-6555730; E-mail: zhoujingqun-1@medmail.com.cn
R363.2
A
10.3969/j.issn.1000- 4718.2015.01.007
