融合蛋白TAP-SSL5对激活的血小板与人淋巴细胞结合的影响*
2015-04-17贝俊杰胡厚源
彭 松, 贝俊杰, 胡厚源, 陈 强
(第三军医大学西南医院心血管内科,重庆 400038)
融合蛋白TAP-SSL5对激活的血小板与人淋巴细胞结合的影响*
彭 松, 贝俊杰, 胡厚源△, 陈 强
(第三军医大学西南医院心血管内科,重庆 400038)
目的: 研究抗炎、抗凝双效融合蛋白蜱抗凝血肽(TAP)-金黄色葡萄球菌超抗原样蛋白5(SSL5)对激活的血小板与人淋巴细胞结合作用的影响。方法: 采用免疫磁珠分选法筛选人外周血总淋巴细胞;CCK-8法检测TAP-SSL5对细胞活力的影响;流式细胞术检测Jurkat细胞 (人外周血白血病T细胞株) 表面CD162 (PSGL-1)的表达及TAP-SSL5对小鼠抗人CD162单抗(KPL-1)与Jurkat细胞结合的抑制作用。以20 μmol/L ADP激活人血小板,流式细胞术检测血小板与Jurkat细胞或人淋巴细胞的结合情况,并研究TAP-SSL5的干预作用。 结果: 30 mg/L及以下浓度的TAP-SSL5对Jurkat细胞的活力无明显影响。流式细胞术检测显示,10 mg/L 的TAP-SSL5能显著抑制KPL-1与Jurkat细胞的结合;20 μmol/L ADP激活的血小板与Jurkat细胞或淋巴细胞的结合率分别为(11.86±4.49)% 和 (8.32±1.00)%;细胞经10 mg/L TAP-SSL5预先处理后,结合率分别降至 (6.73±2.71)% 和 (5.51±0.70)% ,差异有统计学意义。结论: TAP-SSL5可与淋巴细胞表面的PSGL-1结合,从而抑制激活的血小板与人淋巴细胞的结合,这可能是抗炎、抗凝双效融合蛋白TAP-SSL5发挥其抗炎作用的机制之一。
蜱抗凝血肽; 金黄色葡萄球菌超抗原样蛋白5; 融合蛋白; 血小板; 淋巴细胞; P-选择素糖蛋白配体1
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性疾病,免疫调节在其发生发展过程中起到重要作用。淋巴细胞和血小板作为免疫及炎症反应中的重要效应细胞,参与了动脉粥样硬化病程的各个环节。血小板与淋巴细胞之间通过直接接触和分泌可溶性介质的方式发生着相互作用而影响彼此功能,从而调控动脉粥样硬化等炎症性疾病的病理生理过程[1]。P-选择素糖蛋白配体1(P-selectin glycoprotein ligand 1, PSGL-1)广泛表达于白细胞表面,它可与激活的内皮或血小板表面的P-/E-选择素结合,导致白细胞在内皮或血小板表面的黏附,而促进白细胞在病变血管处的募集和白细胞-血小板聚集体的形成。在前期研究中,我们已将能够同PSGL-1结合的金黄色葡萄球菌超抗原样蛋白5 (staphylococcal superantigen like protein-5, SSL5)[2]与凝血因子Xa (FXa)的强效抑制剂蜱抗凝血肽(tick anticoagulant peptide, TAP)联合,成功构建了具有抗炎抗凝双效功能的融合蛋白TAP-SSL5。并且发现TAP-SSL5可抑制粒细胞在P-选择素表面的黏附,还可抑制激活血小板与粒细胞的结合[3-4]。血小板与淋巴细胞的结合可以在动脉血流条件下促进淋巴细胞黏附到内皮下基质[5],并影响淋巴细胞的增殖、分化等功能[6]。因此,本文进一步研究了人血小板同淋巴细胞的结合效应及融合蛋白TAP-SSL5对该结合的影响,旨在进一步探讨融合蛋白TAP-SSL5在抑制炎症方面的作用机制。
材 料 和 方 法
1 主要材料
RPMI-1640和胎牛血清购自HyClone;Ficoll-paque液购自Pharmacia;CCK-8试剂盒购自Dojindo;免疫磁珠细胞分选(MACS)试剂盒为Miltenyi Biotec产品;BSA、二磷酸腺苷(ADP)为Sigma产品; PE标记的小鼠抗人CD62P单克隆抗体、PE标记的小鼠抗人CD162(PSGL-1)单克隆抗体(KPL-1)和PE标记的小鼠IgG1(mIgG1-PE)为BD产品。融合蛋白 TAP-SSL5及重组SSL5蛋白的表达与纯化采用曲小龙等[3]介绍的方法实施,融合蛋白TAP-SSL5纯度≥95%,重组SSL5蛋白纯度≥95% 。
2 方法
2.1 人外周血白血病T细胞株Jurkat细胞的培养 Jurkat细胞由第三军医大学全军免疫学研究所赠送,采用含10%胎牛血清的RPMI-1640完全培养基,于37 ℃、5% CO2恒温箱中培养。
2.2 Ficoll-paque密度梯度离心法分离人外周血单个核细胞 取健康成人抗凝血白膜(取自西南医院输血科),用PBS等比例稀释,按2∶1的比例将白膜轻轻铺于Ficoll-paque分离液之上,400 ×g离心30 min,吸取单个核细胞层至无菌管中,PBS洗涤细胞3遍,去除红细胞、血小板,重悬于MACS缓冲液(含PBS、 0.5% BSA、1 mmol/L EDTA,pH 7.2)中。
2.3 免疫磁珠分选阳性总淋巴细胞 用90 μL MACS缓冲液重悬3×107个单个核细胞,加入30 μL FcR阻断剂,加入30 μL 生物素化的抗淋巴细胞混合抗体,在4 ℃孵育10 min;加入60 μL抗生物素磁性微珠,4 ℃孵育15 min;用MACS缓冲液洗涤细胞1次,并重悬至2×1011/L;将细胞加入位于磁场中的分选柱上,洗脱未结合的细胞;将分选柱移出磁场,洗脱并收集混合抗体标记的细胞。台盼兰染色鉴定细胞活力,以改良Tyrode’s 缓冲液(150 mmol/L NaCl,12 mmol/L NaHCO3,2.5 mmol/L KCl,2 mmol/L CaCl2,2 mmol/L MgCl2,1 g/L D-glucose,1 g/L BSA,pH 7.4)调整细胞浓度。
2.4 洗涤血小板悬液的准备 健康成人枸橼酸钠抗凝的浓缩血小板(取自西南医院输血科),1 000 r/min离心15 min,得到富含血小板血浆(platelet-rich plasma, PRP)。 2 700 r/min,离心10 min以沉淀血小板,以CGS缓冲液(12.9 mmol/L trisodium citrate、120 mmol/L NaCl,30 mmol/L D-glucose,pH 6.5)洗涤沉淀2次,以SysmexKX-21N血细胞自动分析仪计数血小板,用改良Tyrode’s 缓冲液调整浓度至2.5×1011/L。2.5 细胞活力的检测 取对数生长期的Jurkat细胞(1×108/L)接种于96孔板,100 μL/well, 每组设3个复孔,空白组只含培养基,不加细胞。置于37 ℃、5% CO2饱和湿度孵箱培养24 h后,干预组分别加入含TAP-SSL5或SSL5的培养基(终浓度为3、10和30 mg/L),阴性对照组以PBS代替重组蛋白,继续培养24 h。然后加入CCK-8溶液,10 μL/well,继续培养3 h。酶标仪(Bio-Rad)测定450 nm波长处的吸光度A450值,并计算细胞存活率。细胞存活率(%)=(实验组A450-空白组A450)/(阴性对照组A450-空白组A450)×100%。实验共重复3次。
2.6 Jurkat细胞表面PSGL-1的检测及TAP-SSL5对KPL-1结合作用的影响 取适量Jurkat细胞,加入终浓度为10 mg/L的融合蛋白TAP-SSL5或SSL5,冰上孵育20 min,0.01 mol/L PBS洗涤细胞2次,再加入KPL-1-PE,冰上孵育30 min,同时以mIgG1-PE为同型抗体阴性对照,PBS洗涤细胞2次,200 μL PBS重悬细胞,流式细胞仪检测TAP-SSL5对KPL-1在Jurkat细胞表面结合的影响。实验共重复3次。
2.7 血小板与Jurkat细胞或淋巴细胞的结合 实验分未激活血小板-淋巴细胞结合组(baseline组)、ADP激活血小板-淋巴细胞结合组(control组)、ADP激活血小板-经TAP-SSL5预处理的淋巴细胞结合组(1 mg /L 及10 mg/L TAP-SSL5组)、ADP激活血小板-经SSL5预处理的淋巴细胞结合组(SSL5组)。
取适量的Jurkat细胞或人淋巴细胞,调整细胞浓度至5×109/L,干预组分别加入终浓度为1 mg/L、10 mg/L 的TAP-SSL5或10 mg/L 的SSL5,冰上孵育20 min,以改良Tyrode’s缓冲液洗涤细胞2次,并调整细胞浓度为5×109/L。
取适量洗涤血小板悬液(2.5×1011/L),加入终浓度为20 μmol/L 的ADP以激活血小板,然后将其与Jurkat细胞或淋巴细胞(5×109/L)按等体积比例混合,再加入抗CD62P-PE mAb以标记血小板,并以mIgG1-PE作为同型对照,室温下于暗处孵育20 min,1%多聚甲醛固定。200 ×g离心10 min,弃上清,用1%多聚甲醛重悬细胞后行流式细胞仪检测。检测时,先确认Jurkat细胞或淋巴细胞群,然后在FL2通道检测细胞表面的血小板结合情况,进一步分析出结合有血小板的细胞占所检测细胞总数的百分比。实验共重复3~5次。
3 统计学处理
数据用均数±标准差(mean±SD)表示。采用GraphPad Prism 5.0软件进行统计分析,比较重组蛋白对细胞活力的影响使用单因素方差分析,比较干预因素对血小板与细胞结合的影响使用Student’s配对t检验。以P<0.05为差异有统计学意义。
结 果
1 融合蛋白TAP-SSL5对Jurkat细胞活力的影响
TAP-SSL5或SSL5作用于Jurkat细胞24 h后,采用CCK-8法检测细胞活力的结果表明,30 mg/L或以下的 TAP-SSL5对Jurkat细胞存活率无明显影响,10 mg/L的 SSL5对Jurkat细胞存活率无明显抑制,见图1。
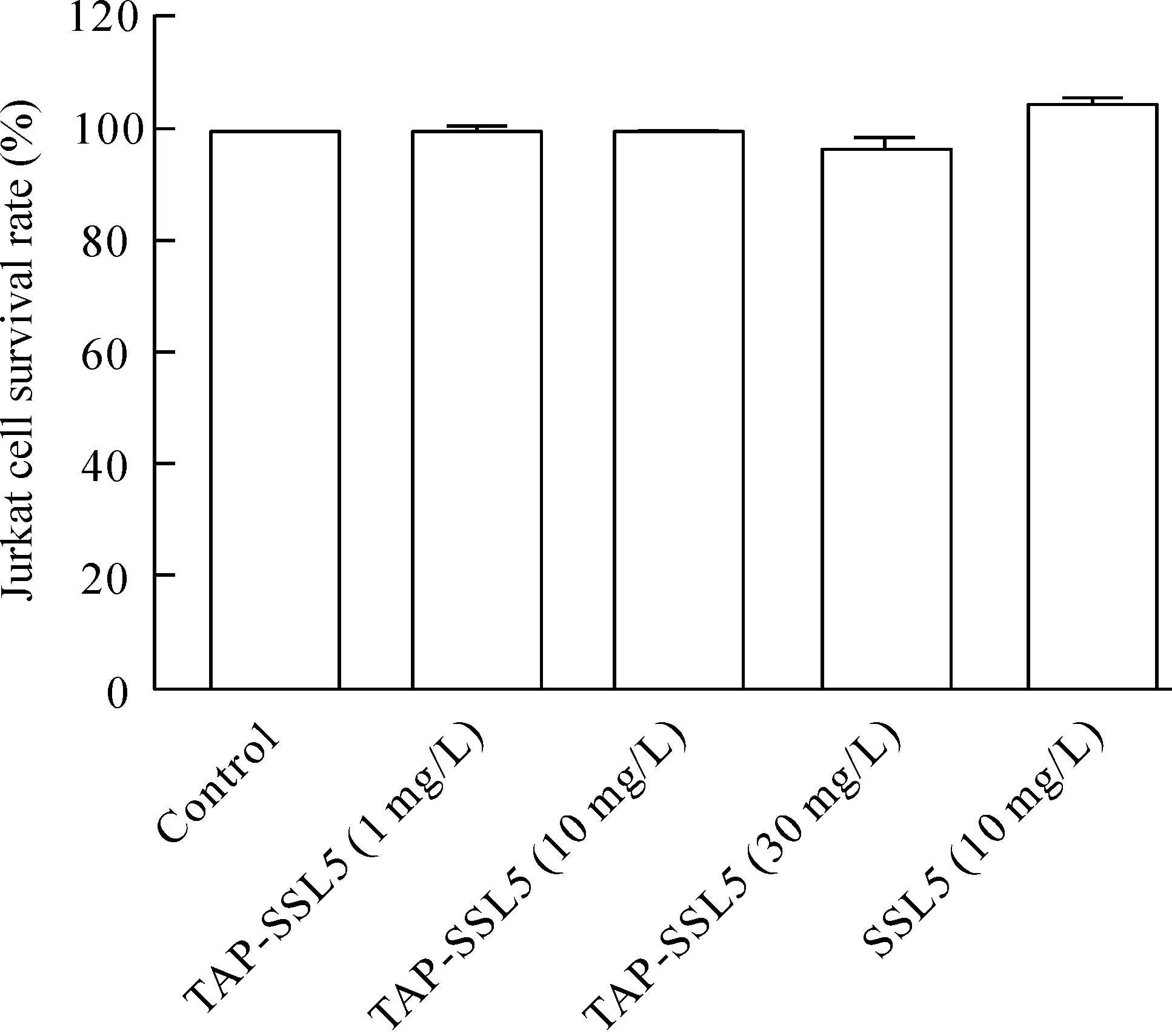
Figure 1.The effects of TAP-SSL5 and SSL5 on the viability of Jurkat cells.Mean±SD. n=3.
2 TAP-SSL5抑制KPL-1与Jurkat细胞的结合
流式细胞术检测显示,Jurkat细胞表面表达大量的PSGL-1(CD162),KPL-1(抗CD162 mAb)的结合阳性率为92.8%;10 mg/L 的TAP-SSL5 或SSL5能显著抑制KPL-1与Jurkat细胞的结合,见图2。

Figure 2.The effects of TAP-SSL5 and SSL5 on the binding of KPL-1 to Jurkat cells. a: isotype control; b,c: Jurkat cells pre-incubated with 10 mg/L SSL5(b) or TAP-SSL5(c), the binding of KPL-1 was significantly inhibited; d:Jurkat cells express abundant of PSGL-1, the binding rate of KPL-1 was 92.8%.
3 TAP-SSL5抑制ADP激活的血小板与Jurkat细胞的结合
在baseline组,未激活血小板与Jurkat细胞的结合率为(8.85±2.79)% ;在control组,血小板经20 μmol/L ADP 激活后与Jurkat细胞的结合率增加至 (11.86±4.49)% ,与baseline组比较差异有统计学意义(P<0.05);Jurkat细胞经1 mg/L TAP-SSL5预处理后,其与ADP 激活血小板的结合率降至(8.15±2.43)%; Jurkat细胞经10 mg/L TAP-SSL5 或10 mg/L SSL5预处理后,其与ADP 激活血小板的结合率分别为(6.73±2.71)% 和 (5.69±1.74)%,与control组比较均显著降低 (P<0.05);说明10 mg/L 的TAP-SSL5 和 SSL5均可显著抑制血小板与Jurkat细胞的结合,见图3。
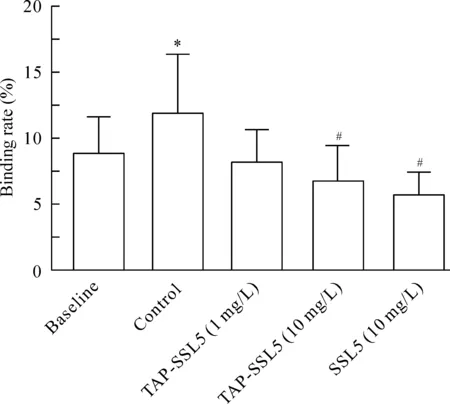
Figure 3.The effect of TAP-SSL5 on the binding of ADP-activated platelets to Jurkat cells. Mean±SD. n=5. *P<0.05 vs baseline; #P<0.05 vs control.
4 TAP-SSL5抑制ADP激活的血小板与外周血淋巴细胞的结合
在baseline组,未激活血小板与淋巴细胞的结合率为(4.99±0.64)%;在control组,血小板经20 μmol/L ADP 激活后与淋巴细胞的结合率增加至 (8.32±1.00)%,与baseline组比较差异有统计学意义(P<0.05);淋巴细胞经1 mg/L TAP-SSL5预处理后,其与ADP 激活血小板的结合率降至(7.02±0.82)%,淋巴细胞经10 mg/L TAP-SSL5 或10 mg/L SSL5预处理后,其与ADP 激活血小板的结合百分率分别为(5.51±0.70)% 和 (6.15±0.57)%,与control组比较均显著降低 (P<0.05);说明1 mg/L、10 mg/L 的TAP-SSL5 和10 mg/L的 SSL5均可显著抑制血小板与淋巴细胞的结合,见图4。

Figure 4.The effect of TAP-SSL5 on the binding of ADP-activated platelets to lymphocytes.Mean±SD. n=3. *P<0.05 vs baseline; #P<0.05,##P<0.01 vs control.
讨 论
传统观点认为动脉粥样硬化源于血管壁的脂质沉积,但越来越多的证据显示炎症反应在AS的病理过程中发挥重要作用[7-8],同时它还受到免疫机制的严密调控[9]。血小板和淋巴细胞是血栓和免疫炎症过程中的重要细胞成分,它们间的相互作用在血栓形成、炎症反应、机体免疫等病理生理过程中都显示出重要的调控作用[1]。血小板和淋巴细胞间可以通过直接接触和分泌可溶性介质的方式影响彼此功能。血小板可以促进辅助性T细胞(helper T cells,TH)、细胞毒性T细胞(cytotoxic T cells,Tc)、B淋巴细胞及自然杀伤细胞(natural killer,NK)的黏附和渗透;血小板还促进TC细胞的增殖和细胞毒力[10],影响TH细胞的因子分泌和免疫抑制活性[6],引起B淋巴细胞的表型转换和抗体分泌[10],还可以减轻NK细胞的吞噬能力[11]。这些在动脉粥样硬化的进程中起到重要的调控作用,针对血小板-淋巴细胞相互作用的干预措施,可能为动脉粥样硬化的防治提供新的思路和方向。
Li等[12]的研究指出,在血小板同淋巴细胞的结合中,P-选择素结合PSGL-1是基础,GPIIb/IIIa、CD11b、CD40L对结合有辅助作用。SSL5是金黄色葡萄球菌的分泌型蛋白,研究发现SSL5可与粒细胞表面的PSGL-1结合而抑制粒细胞在P-选择素或激活的内皮细胞表面的滚动和黏附[2],SSL5还能够与HL-60细胞表面的PSGL-1结合而抑制其同血小板或内皮细胞的结合[13]。鉴于炎症反应和血栓形成在心血管急症发生中的关键作用,在前期研究中,我们将SSL5与凝血因子Xa 的强效抑制剂TAP联合,成功构建了具有抗炎抗凝双效功能的融合蛋白TAP-SSL5,并证实TAP-SSL5可抑制粒细胞在P-选择素表面的黏附,还可抑制激活的血小板与粒细胞的结合。在此基础上,本研究进一步探讨了融合蛋白TAP-SSL5对血小板与淋巴细胞结合的影响。
流式细胞仪检测结果显示,人T淋巴细胞株Jurkat细胞表面有丰富的PSGL-1的表达。细胞毒性试验显示,终浓度为30 mg/L或以下的融合蛋白TAP-SSL5及10 mg/L的SSL5作用于细胞24 h后,对Jurkat细胞存活率无明显影响,提示该浓度的蛋白适合于淋巴细胞的体外实验。10 mg/L的TAP-SSL5或SSL5预处理细胞后,KPL-1同Jurkat细胞的结合明显减低,提示TAP-SSL5及SSL5能够同Jurkat细胞表面的PSGL-1结合而竞争性抑制KPL-1的结合。血小板激活后,大量P-选择素由α-颗粒体转移到细胞表面,进而加强其同白细胞结合的能力。为探讨激活血小板同淋巴细胞的结合作用及TAP-SSL5的影响,我们应用免疫磁珠分选的淋巴细胞同洗涤血小板进行研究,纯化了反应体系,能够更加精确分析这2种细胞间的相互作用。本研究小组前期的研究表明,融合蛋白TAP-SSL5具有抗凝血肽TAP的抗凝血活性[3]。本研究进一步显示,血小板在经ADP激活后,其与淋巴细胞的结合率明显增加; TAP-SSL5和SSL5可以显著抑制激活的血小板与淋巴细胞的结合,说明融合蛋白TAP-SSL5保留了SSL5的功能,即通过与细胞表面PSGL-1的结合发挥抑制炎症的作用[2]。TAP-SSL5及SSL5对激活血小板同淋巴细胞结合的抑制作用主要来源于对“P-选择素-PSGL-1”相互作用的抑制;课题组前期研究还发现TAP-SSL5及SSL5可与血小板表面的GPIbα结合[14-15],而GPIbα可同白细胞表面的Mac-1结合,由此推测TAP-SSL5及SSL5可能还通过阻断“GPIbα-Mac-1”途径抑制血小板同淋巴细胞的结合。
淋巴细胞从循环血流中迁移到炎症局部,是其发挥对动脉粥样硬化免疫调控作用的基础。同其它白细胞一样,淋巴细胞的迁移由选择素介导的接触、滚动,整合素介导的黏附和随后的跨内皮渗透所实现[1]。血小板和淋巴细胞的结合,不仅加强淋巴细胞在动脉血流条件下同血管内皮的黏附[5],还易化了它们间的物质代谢和相互影响。因此,针对血小板-淋巴细胞结合的干预措施,有望成为动脉粥样硬化等炎症性疾病防治的新手段。本研究证实了融合蛋白TAP-SSL5能够有效抑制激活血小板同淋巴细胞的结合,这种抑制作用在淋巴细胞的不同亚群间是否存在差异,以及对淋巴细胞激活、增殖和分化等功能的影响有待后续进一步研究。
[1] Li N. Platelet-lymphocyte cross-talk[J]. J Leukoc Biol, 2008, 83(5):1069-1078.
[2] Bestebroer J, Poppelier MJ, Ulfman LH, et al. Staphylococcal superantigen-like 5 binds PSGL-1 and inhibits P-selectin-mediated neutrophil rolling[J]. Blood, 2007, 109(7):2936-2943.
[3] 曲小龙,胡厚源,李 敏,等. 抗炎、抗凝双效融合蛋白TAP-SSL5表达载体的构建及其功能研究[J]. 第三军医大学学报, 2010, 32(1): 5-8.
[4] 龚丽莎,房兆飞,胡厚源,等. 融合蛋白TAP-SSL5对血小板与粒细胞结合的影响[J]. 第三军医大学学报, 2013, 35(8):754-758.
[5] Spectre G, Zhu L, Ersoy M, et al. Platelets selectively enhance lymphocyte adhesion on subendothelial matrix under arterial flow conditions[J]. Thromb Haemost, 2012, 108(2):328-337.
[6] Gerdes N, Zhu L, Ersoy M, et al. Platelets regulate CD4+T-cell differentiation via multiple chemokines in humans[J]. Thromb Haemost, 2011, 106(2):353-362.
[7] 王建丽,高春荣,李 莉,等. 冠状动脉外膜炎症在动脉粥样硬化病灶形成中的作用[J]. 中国病理生理杂志, 2006, 22(3): 431-434.
[8] 徐索文,刘培庆. C-反应蛋白与动脉粥样硬化炎症的关系[J]. 中国病理生理杂志, 2009, 25(12): 2487-2490.
[9] Libby P, Ridker PM,Hansson GK. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011, 473(7347):317-325.
[10]Elzey BD, Tian J, Jensen RJ, et al. Platelet-mediated modulation of adaptive immunity. A communication link between innate and adaptive immune compartments[J]. Immunity, 2003, 19(1):9-19.
[11]Kopp HG, Placke T,Salih HR. Platelet-derived transforming growth factor-beta down-regulates NKG2D thereby inhibiting natural killer cell antitumor reactivity[J]. Cancer Res, 2009, 69(19):7775-7783.
[12]Li N, Ji Q, Hjemdahl P. Platelet-lymphocyte conjugation differs between lymphocyte subpopulations[J]. J Thromb Haemost, 2006, 4(4):874-881.
[13]Walenkamp AM, Bestebroer J, Boer IG, et al. Staphylococcal SSL5 binding to human leukemia cells inhibits cell adhesion to endothelial cells and platelets[J]. Cell Oncol, 2010, 32(1-2):1-10.
[14]Hu H, Armstrong PC, Khalil E, et al. GPVI and GPIbα mediate staphylococcal superantigen-like protein 5 (SSL5) induced platelet activation and direct toward glycans as potential inhibitors[J]. PLoS One, 2011, 6(4):e19190.
[15]程 彦,房兆飞,曲小龙,等. 融合蛋白TAP-SSL5对人血小板功能的影响[J]. 第三军医大学学报, 2012, 34(6):477-480.
Effect of TAP-SSL5 fusion protein on binding of activated platelets to human lymphocytes
PENG Song, BEI Jun-jie, HU Hou-yuan, CHEN Qiang
(DepartmentofCardiology,SouthwestHospital,ThirdMilitaryMedicalUniversity,Chongqing400038,China.E-mail:houyuanhu@hotmail.com)
AIM: To study the effect of tick anticoagulant peptide-staphylococcal superantigen like protein 5 (TAP-SSL5), an anti-inflammatory and anticoagulant fusion protein, on the binding of activated platelets to human lymphocytes.METHODS: Human periphery lymphocytes were isolated by magnetic activated cell sorting (MACS). The toxicity of TAP-SSL5 on the viability of Jurkat cell was assessed by CCK-8 assay. Flow cytometry was applied to detect the expression of CD162 (PSGL-1) on the Jurkat cells (human peripheral blood leukemia T lymphocyte cell line) and the inhibitory effect of TAP-SSL5 on the binding of mouse anti-human CD162 monoclonal antibody (KPL-1) to Jurkat cells. Platelets were activated by ADP at concentration of 20 μmol/L, the binding rates of activated platelets to Jurkat cells or human lymphocytes were assayed by flow cytometry. RESULTS: The concentration of TAP-SSL5 below 30 mg/L didn’t affect the viability of Jurkat cells. TAP-SSL5 at 10 mg/L competitively inhibited KPL-1 binding to Jurkat cells. The binding rates of activated platelets to Jurkat cells or lymphocytes were (11.86±4.49)% and (8.32±1.00)%, respectively, which decreased to (6.73±2.71)% and (5.51±0.70)% after the Jurkat cells and lymphocytes were pre-incubated with 10 mg/L TAP-SSL5 (P<0.05).CONCLUSION: TAP-SSL5 binds to PSGL-1 expressed on lymphocyte surface and directly inhibits the binding of activated platelets to human lymphocytes, which may be one of the anti-inflammatory mechanisms of TAP-SSL5.
Tick anticoagulant peptide; Staphylococcal superantigen like protein 5; Fusion protein; Platelets; Lymphocytes; P-selectin glycoprotein ligand 1
1000- 4718(2015)01- 0023- 05
2014- 08- 12
2014- 09- 30
国家重大新药创制课题(No. 2013ZX09103003-001);国家自然科学基金资助项目(No. 81270362)
△通讯作者 Tel: 023-68765167; E-mail: houyuanhu@hotmail.com
R363; R331
A
10.3969/j.issn.1000- 4718.2015.01.005
