PI3K/PKB信号通路在TGF-β1诱导人肝星状细胞表达骨桥蛋白中的作用*
2015-04-15吴惠春周振华高月求
吴惠春, 李 曼, 周振华, 张 鑫, 张 斌△, 高月求, △
(1上海中医药大学附属曙光医院肝病科, 2上海市中医临床重点实验室,上海 201203)
PI3K/PKB信号通路在TGF-β1诱导人肝星状细胞表达骨桥蛋白中的作用*
吴惠春1, 李 曼2, 周振华2, 张 鑫2, 张 斌1△, 高月求1, 2△
(1上海中医药大学附属曙光医院肝病科,2上海市中医临床重点实验室,上海 201203)
目的: 研究磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/PKB)信号通路在转化生长因子β1(TGF-β1)诱导人肝星状细胞表达骨桥蛋白(OPN)的调控作用。方法: 体外培养LX-2人肝星状细胞株,予TGF-β1(终浓度2.5、5、10、20 μg/L)刺激24 h或予TGF-β1(终浓度10 μg/L)刺激12 h、24 h、48 h;先经PI3K/PKB信号通路特异性抑制剂wortmannin(0.1 μmol/L)预处理1 h,再予10 μg/L TGF-β1刺激24 h,收集细胞,采用real-time PCR及Western blotting法检测OPN表达情况。结果: TGF-β1能够促进LX-2细胞表达OPN,在一定浓度和时间范围内,其表达量随着TGF-β1浓度和时间的增加而增加,呈剂量和时间依赖性关系;经wortmannin预处理再予TGF-β1刺激的LX-2细胞,与对照组相比,OPN表达受到明显抑制(P<0.01)。结论: TGF-β1对LX-2人肝星状细胞OPN表达具有诱导作用,此作用可能受PI3K/PKB信号通路的调控。
骨桥蛋白; 肝星状细胞; 转化生长因子β1; PI3K/PKB信号通路
骨桥蛋白(osteopontin,OPN)是一种具有精氨酸-甘氨酸-天冬氨酸(RGD)序列的分泌型磷酸化糖蛋白,最早从骨基质中分离出来而得名。近年研究表明,OPN作为细胞外基质中一种重要的非胶原糖蛋白分子,能够调节肉芽肿的形成,参与组织修复和纤维化的形成[1-2]。转化生长因子β1(transforming growth factor-β1,TGF-β1)是一个强有力的促肝纤维化因子,在肝纤维化发生过程中具有活化肝星状细胞(hepatic stellate cells,HSC)、促进细胞外基质合成与沉积等作用,是肝纤维化最重要的始动因子之一。活化的HSC是肝纤维化时过量细胞外基质的主要来源。本研究用TGF-β1刺激LX-2人肝星状细胞株,并用PI3K/PKB信号通路特异性抑制剂wortmannin干预,观察OPN表达的变化,初步探讨TGF-β1对OPN表达的诱导作用及PI3K/PKB信号通路对其的调控作用。
材 料 和 方 法
1 细胞
表型活化的LX-2人肝星状细胞株由上海复蒙生物基因公司提供。
2 主要试剂和仪器
DMEM高糖培养基和澳洲胎牛血清购于Gibco;TGF-β1、wortmannin和兔抗人OPN抗体购于Sigma;兔抗人PKB和p-PKB抗体购于CST;Western blotting实验所需蛋白裂解、制胶、电泳等试剂均为碧云天生物技术研究所产品;Trizol购于Invitrogen;real-time PCR反应试剂盒为Ferments产品;所用引物由上海生工公司设计合成,序列见表1。

表1 Real-time PCR引物序列
生物安全柜(苏州安泰公司);倒置显微镜(OLYMPUS);二氧化碳培养箱(Heal Force);Millipore实验室纯水系统(Pall);水平离心机(Beckman Coulter);低温高速离心机和PCR仪(Eppendorf);垂直蛋白电泳仪、蛋白转膜仪(Bio-Rad)。
3 方法
3.1 细胞培养 LX-2细胞株接种于25 mm2塑料培养瓶中,用含10%胎牛血清的DMEM培养基于5% CO2、37 ℃的培养箱培养。当细胞生长接近于铺满整个瓶底时,用含0.25%胰酶和0.02% EDTA的胰酶消化液消化细胞,传代。
3.2 细胞干预 取生长良好的细胞,接种3×105个细胞于培养瓶内,待细胞生长至约铺满瓶底70%时开始干预。设对照组及TGF-β1干预组:对照组不加干预因素;TGF-β1干预组予加入TGF-β1(终浓度2.5、5、10、20 μg/L),继续培养24 h,或者加入TGF-β1(终浓度为10 μg/L),分别继续培养12 h、24 h、48 h。另设对照组、wortmannin+TGF-β1组、TGF-β1组及wortmannin组。对照组不加干预因素;wortmannin+TGF-β1组先予PI3K/PKB信号通路特异性抑制剂wortmannin(终浓度0.1 μmol/L)预处理1 h,再予TGF-β1(终浓度10 μg/L)刺激24 h;TGF-β1组直接予TGF-β1(终浓度10 μg/L)刺激24 h;wortmannin组予wortmannin(终浓度0.1 μmol/L)处理1 h。干预结束,收集各组细胞,检测OPN表达。
3.3 Real-time PCR法检测OPN mRNA表达 按照Trizol说明书提取细胞总RNA,取1 μg总RNA逆转录,再取2 μL逆转录产物进行PCR扩增反应。PCR反应条件为95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃30 s,共40个循环。根据2-ΔΔCt法,以GAPDH为内参照,进行OPN mRNA表达相对定量分析。
3.4 Western blotting法检测蛋白表达 细胞用预冷PBS清洗2次后加入含1% PMSF的裂解液提取总蛋白,BCA法测定蛋白浓度,取等量蛋白(30 μg、10 μL)进行凝胶电泳,蛋白经半干法电转至PVDF膜,5%脱脂牛奶封闭,I抗(1∶1 000)4 ℃孵育过夜,PBST洗膜后加入辣根过氧化物酶标记的II抗(1∶1 000)室温孵育1 h,PBST洗膜,ECL化学发光法显影。以GAPDH为内参照,结果用灰度值比值表示。
4 统计学处理
应用SPSS 15.0数据分析软件进行统计学分析,数据采用均数±标准差(mean±SD)表示,多组间差异比较采用单因素方差分析,两两比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
1 不同浓度TGF-β1对LX-2细胞OPN mRNA表达的影响
在TGF-β1作用下,OPN mRNA表达明显上调,各TGF-β1干预组的OPN mRNA相对表达量分别为1.328±0.091、1.937±0.196、2.565±0.150及2.935±0.201,与对照组相比,差异均有统计学意义。在实验所选浓度范围内,OPN mRNA表达量与TGF-β1干预浓度呈正相关,当TGF-β1终浓度为20 μg/L时,OPN mRNA表达上调最为显著,见图1。

Figure 1.The mRNA expression of OPN in LX-2 cells induced by different concentrations of TGF-β1 for 24 h. Mean±SD.n=3.*P<0.05,** P<0.01 vs 0 μg/L group.
2 不同浓度TGF-β1对LX-2细胞OPN蛋白表达的影响
Western blotting的实验结果显示,对照组LX-2有少量OPN蛋白表达,经过TGF-β1干预,其表达量明显增加,各组与对照组相比均有统计学意义(P<0.01)。OPN蛋白表达量随着TGF-β1干预浓度增加而增加,当TGF-β1终浓度为20 μg/L时,OPN蛋白表达增加最多,见图2。
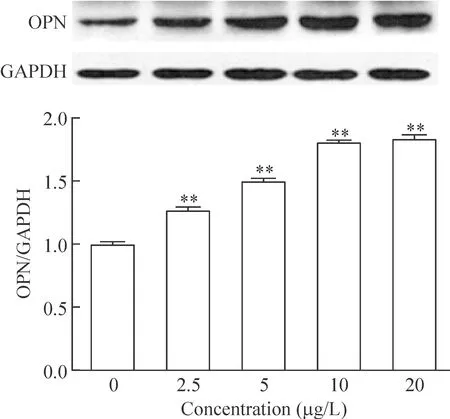
Figure 2.The protein expression of OPN in LX-2 cells induced by different concentrations of TGF-β1 for 24 h. Mean±SD.n=3. **P<0.01 vs 0 μg/L group.
3 TGF-β1作用不同时间对LX-2细胞OPN mRNA表达的影响
LX-2细胞经10 μg/L的TGF-β1干预12 h、24 h、48 h,各组OPN的mRNA表达均有上调,与对照组相比差异有统计学意义(P<0.01)。其中,24 h组OPN的mRNA相对表达量为3.008±0.253,上调最显著,见图3。
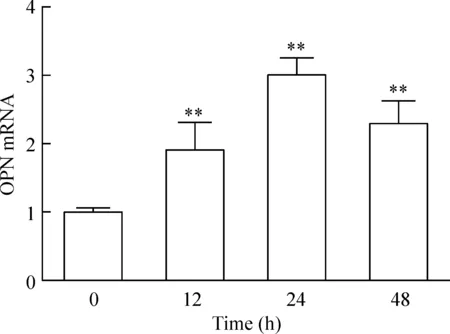
Figure 3.The mRNA expression of OPN in LX-2 cells stimulated by TGF-β1 at concentration of 10 μg/L for different time. Mean±SD.n=3. ** P<0.01 vs 0 h group.
4 TGF-β1作用不同时间对LX-2细胞OPN蛋白表达的影响
LX-2细胞经TGF-β1干预12 h,OPN蛋白表达稍有增加,24 h组及48 h组与对照组相比,OPN蛋白表达明显上调,其中48 h组最为显著(P<0.01),见图4。

Figure 4.The protein expression of OPN in LX-2 cells stimulated by TGF-β1 at concentration of 10 μg/L for different time. Mean±SD. n=3.*P<0.05,** P<0.01 vs 0 h group.
5 TGF-β1对PI3K/PKB信号通路活化的影响
以终浓度为10 μg/L的TGF-β1作用于LX-2细胞株,观察10 min、20 min、30 min及60 min时PI3K/PKB信号通路中PKB的磷酸化情况。Western blotting结果显示,未经TGF-β1刺激的对照组细胞有一定量p-PKB的表达,予以TGF-β1刺激后,p-PKB表达量在10 min时即开始增加,20 min时达到高峰,30 min时表达较前减少,到60 min时与对照组p-PKB表达相当,见图5。

Figure 5.The effects of TGF-β1 at concentration of 10 μg/L on the activation of PI3K/PKB signaling pathway. Mean±SD.n=3.*P<0.05 vs 0 min group;**P<0.01 vs 0 min group.
6 PI3K/PKB信号通路对TGF-β1诱导的LX-2细胞OPN mRNA表达的影响
LX-2细胞经PI3K/PKB信号通路抑制剂wortmannin预处理1 h,再予TGF-β1刺激,与TGF-β1刺激组相比,OPNmRNA表达量明显下调(P<0.01),与对照组相比也有明显统计学意义(P<0.01),提示加入PI3K/PKB信号通路抑制剂wortmannin,可以下调但不能完全阻断由TGF-β1所诱导LX-2的OPN mRNA的表达。Wortmannin处理1 h组与对照组相比,OPN的mRNA明显下调(P<0.01),见图6。
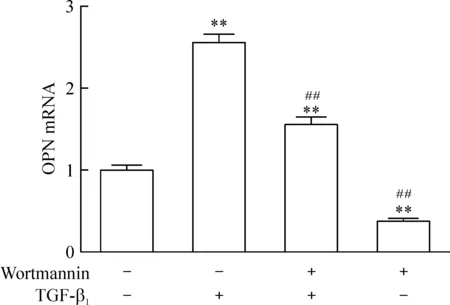
Figure 6.The effects of PI3K/PKB inhibitor wortmannin on the mRNA expression of OPN in LX-2 cells induced by TGF-β1. Mean±SD.n=3.**P<0.01 vs control group; ##P<0.01 vs TGF-β1 group.
7 PI3K/PKB信号通路对TGF-β1诱导的LX-2细胞OPN蛋白表达的影响
如前所述,未经TGF-β1刺激的对照组LX-2细胞有少量OPN蛋白表达,予以TGF-β1刺激后其表达量明显增多(P<0.01)。经PI3K/PKB通路抑制剂wortmannin预处理1 h后再予TGF-β1刺激的细胞,其OPN蛋白表达量介于对照组和TGF-β1刺激组之间,单用wortmannin处理1 h组,OPN蛋白表达受到明显抑制(P<0.01),见图7。

Figure 7.The effects of PI3K/PKB inhibitor wortmannin on the protein expression of OPN in LX-2 cells induced by TGF-β1. Mean±SD. n=3.**P<0.01 vs control group; ##P<0.01 vs TGF-β1 group.
讨 论
肝纤维化是肝脏受到各种慢性损伤后的自我修复反应,主要表现为细胞外基质的过量合成与沉积。肝脏损伤时,受损细胞产生的脂质过氧化物、细胞碎片、活性氧簇及TGF-β1等细胞因子均可刺激HSC增殖与活化,使其表型发生改变,表达α-SMA,大量合成胶原等细胞外基质。目前,普遍认为HSC的活化是肝纤维化形成的核心环节[3]。
TGF-β1是一种具有多种生物学功能的肽类生长因子,对细胞的生长、分化、细胞外基质的聚集和免疫反应等方面有着广泛的影响。TGF-β1是目前发现的最强的促纤维化因子,它与细胞表面受体结合后可通过TGF-β1/Smads及TGF-β1/PI3K/PKB途径传递活化信号,进而促进HSC表型转变、增殖及细胞外基质的合成[4-5]。
在细胞外基质中,除了大量的胶原成分之外,还存在一些功能独特的非胶原成分,如OPN、纤黏连蛋白、层黏连蛋白等,这些物质在肝纤维化的发生发展中也有着重要作用。OPN最初由骨基质中分离而来,是一种含有RGD序列的分泌型磷酸化糖蛋白,可由多种组织细胞合成与分泌,广泛存在于人体多种组织。OPN结构上与多种基质蛋白相似,在功能上却具有细胞因子的特点,能够调节肉芽肿的形成,参与组织修复、纤维化的形成等[1-2]。
我们课题组前期研究发现,正常大鼠肝组织OPN表达极弱,肝纤维化模型大鼠肝组织OPN表达明显上调,两者相比有显著差异[6-7]。国外学者报道酒精性肝病患者血清、脂肪组织和肝脏组织中OPN的含量均高于正常人,其表达量随着疾病的进展而升高;在肝脏,OPN的表达量与中性粒细胞浸润、肝脏炎症、TGF-β含量及肝纤维化程度呈正相关[8]。对慢性丙肝患者血清OPN水平与肝脏炎症、纤维化程度作相关性分析研究,也得到了与其一致的结果[9]。有研究报道静止的HSC基本不表达OPN mRNA,培养7 d和14 d后,其OPN的mRNA表达量明显上调,Western blotting结果与其一致。重组OPN与HSC共培养发现,OPN可引起HSC增殖与迁移,诱导MMP-2的产生与活化,上调I型胶原和TGF-β受体水平[10]。最新研究显示,OPN作为一种氧化应激敏感的细胞因子,能通过αVβ3整合素结合及活化PI3K/p-Akt/NF-κB途径上调肝星状细胞α-SMA和Ⅰ型胶原表达,加速肝纤维化的进程[11]。为此,OPN将可能成为判断慢性肝病纤维化进展的一个新的预测因子和生物学标志物。
本研究发现,LX-2人肝星状细胞株经TGF-β1刺激OPN表达明显上调,在一定范围内其上调量随着TGF-β1浓度及作用时间的增加而增加,表现出了剂量和时间依赖性的关系,提示OPN上调与肝星状细胞的活化程度密切相关。本实验所选用的LX-2细胞株乃是表型活化的细胞,实验结果显示未予TGF-β1刺激的对照组细胞也有少量OPN mRNA及蛋白的表达,恰好也证实了这一点。
PI3K/PKB信号途径是近年来研究较多的一个生长因子信号传导途径,越来越多的证据表明PKB与细胞的生长代谢、凋亡恶变等密切相关。在各种细胞因子作用下,PI3K活化,生成3位磷酸化的磷脂产物,该产物引起PKB与膜结合,在PDK的作用下,PKB发生磷酸化活化,活化的PKB离开细胞膜而进入胞质和胞核,使其下游分子发生磷酸化,从而促进细胞生存、代谢、细胞骨架重组等生物学事件[12]。本实验研究发现未经TGF-β1刺激的对照组细胞有少量磷酸化PKB表达,予TGF-β1刺激,磷酸化PKB表达量在10 min时即开始增加,20 min时达到高峰,30 min时表达较前减少,到60 min时与对照组磷酸化PKB表达相当,说明TGF-β1参与了对PI3K/PKB信号途径的诱导活化过程。LX-2细胞经PI3K/PKB特异性阻断剂wortmannin预处理后再予TGF-β1刺激,其OPN表达与单用TGF-β1刺激组相比明显下调,提示PI3K/PKB信号途径对OPN表达可能有调控作用。
[1] Fickert P, Thueringer A, Moustafa T, et al. The role of osteopontin and tumor necrosis factor alpha receptor-1 in xenobiotic-induced cholangitis and biliary fibrosis in mice[J]. Lab Invest, 2010, 90(6):844-852.
[2] Fan K, Zhang B, Yang H, et al. A humanized anti-osteopontin antibody protects from Concanavalin A induced-liver injury in mice[J]. Eur J Pharmacol, 2011, 657(1-3):144-151.
[3] Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008, 134(6):1655-1669.
[4] Kisseleva T, Brenner DA. Mechanisms of fibrogenesis[J]. Exp Biol Med, 2008, 233(2):109-122.
[5] Liu RM, Gaston Pravia KA. Oxidative stress and gluta-thione in TGF-beta mediated fibrogenesis[J]. Free Radic Biol Med, 2010, 48(1):1-15.
[6] 赵 莹, 张 斌, 王灵台. 血瘀型肝纤维化大鼠骨桥蛋白的动态变化特征[J]. 中西医结合肝病杂志, 2009, 19(6):356-359.
[7] 张 斌, 赵 莹, 陈建杰, 等. 肝纤维化时肝脏OPN和PAI-1的表达变化[J]. 中国病理生理杂志, 2010, 26(7):1407-1409.
[8] Patouraux S, Bonnafous S, Voican CS, et al. The osteopontin level in liver, adipose tissue and serum is correlated with fibrosis in patients with alcoholic liver disease[J]. PLoS One, 2012, 7(4):e35612.
[9] Huang W, Zhu G, Huang M, et al. Plasma osteopontin concentration correlates with the severity of hepatic fibrosis and inflammation in HCV-infected subjects[J]. Clin Chim Acta, 2010, 411(9-10):675-678.
[10]Lee SH, Seo GS, Park YN, et al. Effects and regulation of osteopontin in rat hepatic stellate cells[J]. Biochem Pharmacol, 2004, 68(12):2367-2378.
[11]Urtasun R, Lopategi A, George J, et al. Osteopontin, an oxidant stress sensitive cytokine, up-regulates collagen-I via integrin αVβ3engagement and PI3K/pAkt/NFκB signaling[J]. Hepatology, 2012, 55(2):594-608.
[12]Piguet AC, Dufour JF. PI(3)K/PTEN/AKT pathway[J]. J Hepatol, 2011, 54(6):1317-1319.
Effects of PI3K/PKB signaling pathway on expression of osteopontin in human hepatic stellate cells induced by transforming growth factor-β1
WU Hui-chun1, LI Man2, ZHOU Zhen-hua2, ZHANG Xin2, ZHANG Bin1, GAO Yue-qiu1, 2
(1DepartmentofHepatopathy,ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,2ShanghaiKeyLaboratoryofTraditionalChineseClinicalMedicine,Shanghai201203,China.E-mail:zhangbsh@126.com;gaoyueqiu@hotmail.com)
AIM: To investigate the regulatory effects of phosphatylinositol 3-kinase/protein kinase B (PI3K/PKB) signaling pathway on the expression of osteopontin (OPN) in transforming growth factor-β1(TGF-β1)-induced human hepatic stellate cells. METHODS: Human hepatic stellate cell line LX-2 was cultured in DMEM and stimulated by TGF-β1at the final concentration of 2.5, 5, 10 and 20 μg/L for 24 h or at final concentration of 10 μg/L for 12 h, 24 h and 48 h. LX-2 cells were pretreated with wortmannin, a specific inhibitor of PI3K/PKB signaling pathway, at final concentration of 0.1 μmol/L for 1 h, followed by incubation with TGF-β1at final concentration of 10 μg/L for 24 h. The cells were collected. The expression of OPN was detected by real-time PCR and Western blotting. RESULTS: In LX-2 cells, the expression of OPN was apparently elevated when incubated with TGF-β1. With the increase in TGF-β1concentration or the extension of incubation hours, the expression of OPN was increased gradually in a dose- and time-dependent manner with certain limits. LX-2 cells pretreated with wortmannin and incubated with TGF-β1had a significant decrease in the OPN expression as compared with control group (P<0.01). CONCLUSION: The expression of OPN in TGF-β1-induced LX-2 cells is regulated by the PI3K/PKB signaling pathway.
Osteopontin; Hepatic stellate cells; Transforming growth factor-β1; PI3K/PKB signaling pathway
1000- 4718(2015)01- 0093- 05
2014- 08- 06
2014- 10- 14
国家“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项(No. 2012ZX10005004-002; No. 2012ZX-10005010-002-003);国家自然科学基金资助项目(No. 81102570; No. 81202662);中国肝炎防治基金会王宝恩肝纤维化研究基金(No. CFHPC20131045; No. CFHPC20131046);上海市教育委员会重点学科建设资助项目(No. J50307)
△通讯作者 张斌 Tel: 021-20256507; E-mail: zhangbsh@126.com; 高月求 Tel: 021-20256188; E-mail: gaoyueqiu@hotmail.com
R363
A
10.3969/j.issn.1000- 4718.2015.01.018
