黄芪多糖对慢性心衰大鼠心肌AMPK活性和FFA代谢的影响*
2015-04-15胡阳黔
宋 杰, 胡阳黔, 刘 坚, 李 静△
(1湖北医药学院附属东风医院, 2湖北医药学院,湖北 十堰 442000)
黄芪多糖对慢性心衰大鼠心肌AMPK活性和FFA代谢的影响*
宋 杰1, 胡阳黔1, 刘 坚2, 李 静2△
(1湖北医药学院附属东风医院,2湖北医药学院,湖北 十堰 442000)
目的: 探讨黄芪多糖(APS)对慢性心力衰竭(CHF)大鼠心肌腺苷酸活化蛋白激酶(AMPK)活性和游离脂肪酸(FFA)代谢的影响。方法: 32只雄性SD大鼠随机分为4组:正常对照组、假手术组、模型组和APS组,每组8只。采用大鼠左侧冠状动脉结扎术建立心肌梗死后心衰模型。造模成功后,APS组大鼠给予APS(3 g·kg-1·d-1)连续灌胃6周。采用心脏超声检测左心室舒张期内径(LVD)、左心室收缩期内径(LVS)、左心室射血分数(LVEF)和短轴缩短率(FS);HE染色观察心肌病理形态学改变;乙酰辅酶A合成酶-乙酰辅酶A氧化酶法(ACS-ACOD)检测血清及心肌FFA浓度;Western blotting法测大鼠心肌总AMPK、磷酸化AMPK(p-AMPK)、脂肪酸转位酶(FAT/CD36)和肉毒碱软脂酰转移酶-1(CPT-1)的蛋白表达情况。结果: 假手术组与对照组比较各项指标无显著差异。模型组较对照组LVEF和FS显著降低(P<0.05)而LVD和LVS显著增加(P<0.05)。APS组LVEF和FS较模型组明显改善(P<0.05)并且LVD和LVS较模型组明显减小(P<0.05)。HE染色显示模型组较对照组心肌坏死灶增加,残余心肌细胞减少;而APS组较模型组心肌坏死灶减少,残余心肌细胞增多。模型组血清及心肌FFA浓度较对照组明显增加(P<0.05);APS组血清及心肌FFA浓度较模型组明显减少(P<0.05)。模型组p-AMPK、CPT-1和细胞膜FAT/CD36表达较对照组显著减少(P<0.05);而与模型组相比APS组p-AMPK、CPT-1和细胞膜FAT/CD36表达明显增加(P<0.05)。结论: APS可能通过激活慢性心衰大鼠AMPK相关通路促进心肌摄取利用FFA,从而改善慢性心衰。
黄芪多糖; 游离脂肪酸; 腺苷酸活化蛋白激酶; 慢性心力衰竭
慢性心力衰竭(chronic heart failure, CHF)是各种器质性或功能性心脏病导致心室射血能力受损的综合征,其病死率约50%。目前越来越多的临床及实验研究均表明,CHF都存在心肌能量代谢障碍和能量代谢重塑。在正常成人,心肌需要的高达60%~90%的能量由游离脂肪酸(free fatty acid, FFA)供给。CHF后期心肌FFA代谢障碍,能量大部分由葡萄糖酵解供给,糖酵解提供的能量很难满足心肌的需求,并由此伴随着心肌结构重构和心功能逐渐恶化。目前针对CHF能量代谢障碍的有确切疗效的药物很少,研究这方面药物有很好的市场前景及实用价值。我们先前研究发现,黄芪多糖(Astra-galuspolysaccharides, APS)具有降低FFA脂毒性、改善骨骼肌FFA代谢[1-2]以及改善胰岛素抵抗[3]的作用。另有研究表明APS具有改善CHF的功效[4-5],但目前机制尚不清楚。本研究旨在探索APS对CHF大鼠FFA代谢的影响及机制,为探讨治疗CHF的新药及发现新的治疗靶点提供依据。
材 料 和 方 法
1 主要试剂和仪器
雄性SD大鼠由武汉大学医学院动物中心提供;优化水煎工艺从膜荚黄芪(上海药材公司)中提取APS(80~120 kD)(湖北中医学院药用植物鉴定教研室鉴定)[6];游离脂肪酸检测试剂盒购自南京建成生物工程有限公司。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)抗体、磷酸化AMPK(phosphorylated AMPK,p-AMPK)抗体、肉毒碱软脂酰转移酶-1(carnitine palmitoyltransferase I,CPT-1)抗体和脂肪酸转位酶(fatty acid translocase,FAT/CD36)抗体均购自Upstate。BCA Protein Assay Kit购自Pierce;蛋白内参照采用GAPDH,购自Abcam;Protein Detector Western Blot Kit Lumiglo System购自KPL。Vevo 770高分辨率小动物超声系统购自Vi-sual Sonics。
2 方法
2.1 心力衰竭动物模型建立与分组 采用冠状动脉结扎术方法[7]:麻醉固定备皮后行气管插管连接小动物呼吸机,正压人工呼吸(潮气量7~8 mL,呼吸频率80 min-1,描记大鼠正常心电图。消毒铺巾后,沿胸骨左侧第3、4肋间隙开胸,用眼科小镊子轻提并剪开心包膜,暴露心脏用无菌齿镊轻提左心耳,暴露主动脉根部,线绕过冠状动脉(心上缘)结扎心肌组织2~3 mm,打2个死结,以缝线以下心肌色泽变浅苍白,同时心电监护示肢体导联R波振幅及ST段明显抬高为结扎成功。缝合胸壁,皮下注射青霉素8×105U、速尿0.2 mL和利多卡因0.2 mL,待恢复自主呼吸后撤离呼吸机。术后4 h常规饲养食水。第2周饲料减半。第3周每日增加游泳20 min。第28天麻醉后备皮,大鼠取仰卧位,应用Vevo 770高分辨率小动物超声系统检测,超声测量依据美国超声心动学会制定的大鼠达到心力衰竭诊断标准:射血分数(ejection fraction, EF)≤45% ,证明结扎左冠状动脉前降支可成功复制心肌梗死后心力衰竭大鼠模型。32只雄性SD大鼠随机分为4组:正常对照(control)组、假手术 (sham) 组、模型 (model) 组和APS 组,每组8只。造模成功后,APS组大鼠给予APS(3 g·kg-1·d-1)连续灌胃6周。
2.2 心脏超声检测 各组大鼠以10%水合氯醛3 mL/kg腹腔注射麻醉后备皮,应用Vevo 770高分辨率小动物超声系统测定左心室舒张期内径(left ventricular diastolic diameter,LVD)、收缩期内径(left ventricular systolic diameter,LVS)、左心室射血分数(left ventricular ejection fraction,LVEF)和短轴缩短率(fractional shortening,FS)。
2.3 血清及心肌FFA含量测定 大鼠处死后开胸取大鼠左心室心尖部心肌,用PBS冲洗3次,剪成小块,然后水浴下超声破碎细胞20次,每次5~10 s,再1 000 r/min 离心10 min,取上清液至EP管备用。按试剂盒说明书步骤采用乙酰辅酶A合成酶-乙酰辅酶A氧化酶(acetyl coenzyme A synthetase and acetyl coenzyme A oxidase, ACS-ACOD)法测定。用自动加样器分别移取待测血清及上清液10 μL;加入400 μL发色试剂A;5 min后,加入200 μL发色剂B;10 min后,测定吸光度(A),主波长546 nm,副波长660 nm。FFA浓度测定由全自动生化仪完成。
2.4 心肌病理形态学观察 大鼠处死后开胸取大鼠左心室心尖部心肌,以4 ℃预冷生理盐水冲洗,用4% 甲醛固定48 h。常规脱水、石蜡包埋,病理切片,HE染色,光镜下观察。
2.5 Western blotting检测 大鼠处死后开胸取大鼠左心室心尖部心肌,进行裂解,置4 ℃采用超速离心法分离提取总蛋白及胞膜蛋白,用BCA蛋白定量试剂盒定量。煮沸5 min,SDS-PAGE分离蛋白后,转印到PVDF膜上,封闭、漂洗后加入Ⅰ抗于4 ℃孵育过夜,漂洗后再加入辣根过氧化物酶标记的鼠抗兔Ⅱ抗(1∶800稀释,KPL)室温孵育1 h,漂洗后ECL显色,用高清晰度彩色病理细胞测量程序的图形分析软件系统测出相对光密度值。
3 统计学处理
所有数据均采用均数±标准差(mean±SD)表示,并采用SPSS 13.0统计软件处理,组间差异用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 心脏超声检测
假手术组与对照组比较各项指标无显著差异。与正常对照组比较,模型组LVEF和FS显著降低(P<0.05),LVD和LVS显著增加(P<0.05)。APS组LVEF和FS较模型组明显改善(P<0.05),与对照组比较差异显著(P<0.05);ASP组LVD和LVS较模型组明显减小(P<0.05),但与对照组比较无显著差异,见表1。

表1 各组LVS、LVD、LVEF和FS比较
△P<0.05vscontrol group;▲P<0.05vsmodel group.
2 血清及心肌FFA含量测定
与对照组比较,模型组血清及心肌FFA浓度明显增多(P<0.05);与模型组比较,APS组血清及心肌FFA浓度明显减少(P<0.05);假手术组与对照组比较无明显差异,见表2。
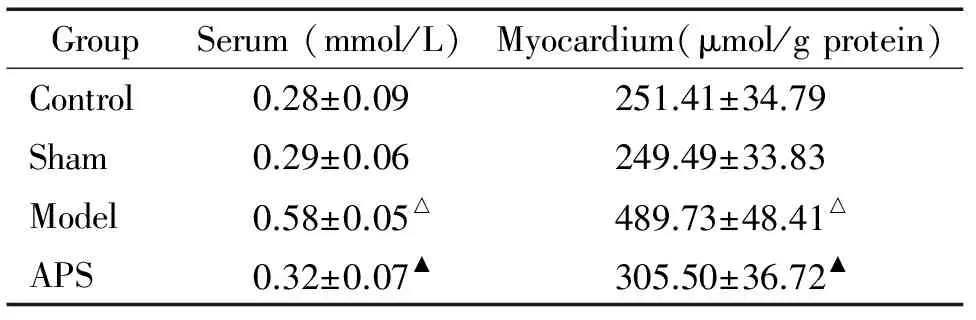
表2 APS对CHD大鼠血清及心肌FFA浓度的影响
△P<0.05vssham group;▲P<0.05vsmodel group.
3 心肌病理形态学变化
HE染色光镜下显示:正常组及假手术组心肌细胞核横纹清晰,未见变性坏死灶;模型组可见室壁局部不规则点片状坏死,心肌纤维数量明显减少,残余心肌染色变淡,横纹不清晰,部分坏死灶被胶原纤维疤痕组织替代,间质内炎性渗出明显,心肌纤维间有大量结缔组织增生;APS组坏死灶内心肌纤维数量明显减少,残余心肌细胞较模型组增加,横纹清晰,部分坏死灶被胶原纤维的疤痕组织取代,炎性渗出减少,见图1。
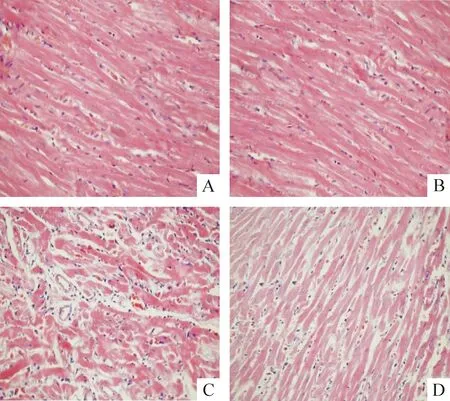
Figure 1.Myocardial morphological changes(HE staining,×40).A: control group;B: sham group;C: model group; D: APS group.
4 相关蛋白表达情况
由图2可见,对照组与假手术组各种相关蛋白表达比较无明显变化;模型组p-AMPK、CPT-1和细胞膜FAT/CD36表达显著减少(P<0.05);与模型组相比,APS组p-AMPK、CPT-1和细胞膜FAT/CD36表达明显增加(P<0.05)。各组总AMPK蛋白表达差异无统计学意义。
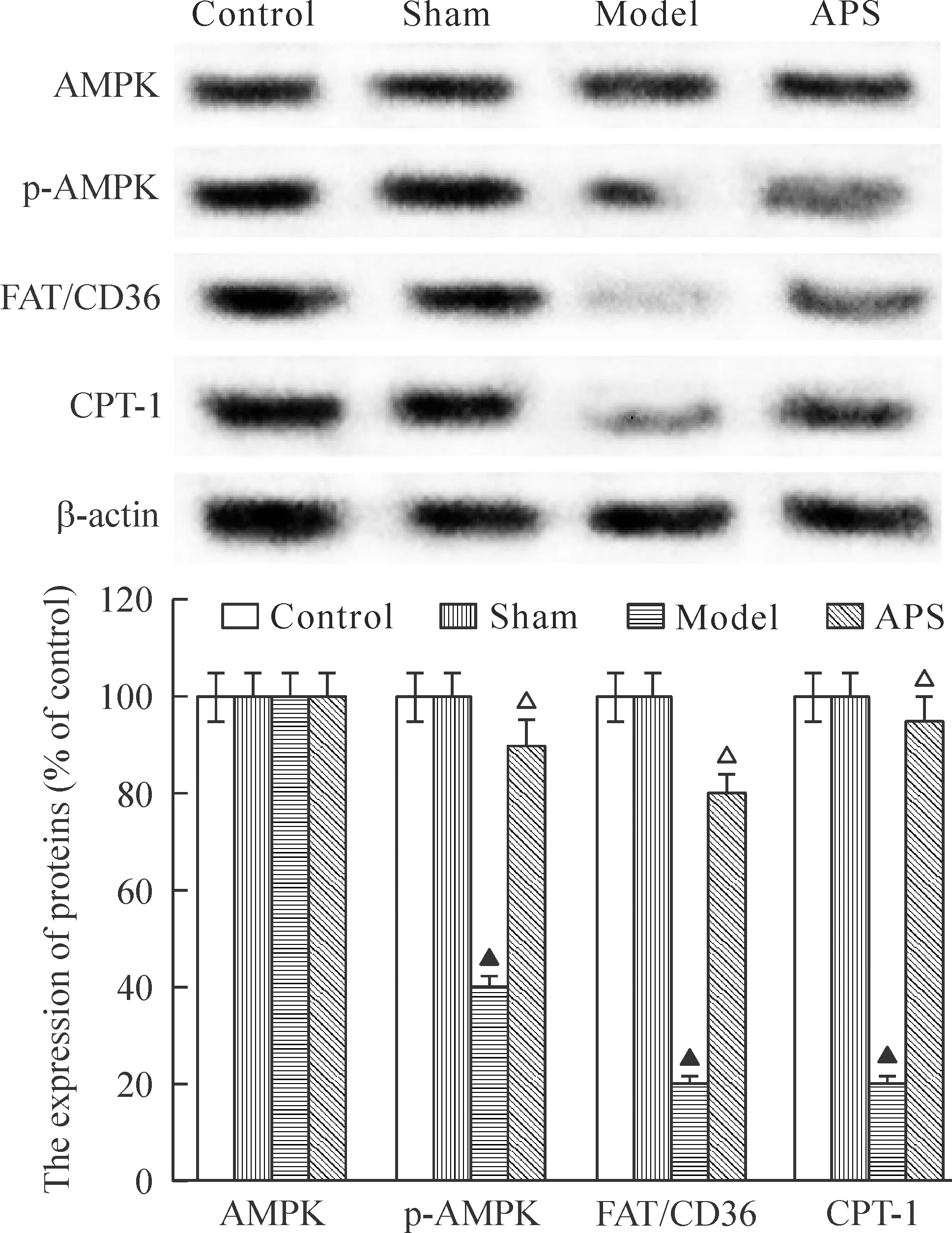
Figure 2.The expression of AMPK, p-AMPK, FAT/CD36 and CPT-1 proteins. Mean±SD. n=8. ▲P<0.05 vs control or sham group; △P<0.05 vs model group.
讨 论
大量研究表明, CHF时心肌能量代谢出现“胚胎化”,所谓胚胎化是指胚胎发育阶段心肌细胞能量供应主要来源于糖酵解和乳酸氧化,出生后,脂肪酸的氧化率急剧增加,很快成为心肌的主要能量来源,约占总能量来源的60%~90%,而心衰时出现的这种代谢底物摄取和选择向胚胎发育阶段的转变:即以利用葡萄糖供能逐渐增加,利用FFA供能逐渐减少的这种变化称为“胚胎化”。有人认为FFA选择的改变正是导致心功能受损的原因[8]。对于CHF疾病进展过程中FFA和葡萄糖作为能量代谢底物的动态演变过程尚有一些争议,综合相关研究,目前统一的观点是[9-11]:在心衰早期脂肪酸的利用不变或轻微增加,在心衰末期会显著降低;在葡萄糖利用方面,在心衰早期利用就明显增加,在末期由于胰岛素抵抗的存在可能会导致心肌对葡萄糖的利用减少。代谢底物葡萄糖氧化增加,可提高能源的使用效率,这在心衰早期是一种有利的代偿,而心衰后期FFA利用紊乱在心衰进展中则起到不利的效应。如果我们选择最佳的心脏代谢底物,将有利于改善心功能及减慢心衰的进展[12]。
CHF后期存在高FFA。大量流行病学资料证实FFA是引起胰岛素抵抗的最主要非激素物质之一。在众多心血管疾病的危险因素中胰岛素抵抗处于核心地位, 或者说胰岛素抵抗是滋生多种代谢相关疾病的共同土壤。我们先前研究发现: APS对于2型糖尿病动物模型具有增加胰岛素敏感性、改善糖耐量、降低血糖和血脂、减少肝脏脂肪沉积以及减轻体重等作用[13-14]。近期我们研究发现APS可以增加骨骼肌细胞对FFA的摄取利用[1-2]。有研究表明APS具有改善CHF的功效[4-5],但目前机制尚未研究清楚。
AMPK是一种高度保守的丝氨酸/苏氨酸蛋白激酶,被称为“能量代谢总开关”,与糖脂代谢密切相关。我们近期在细胞水平的一项研究中发现[1-2]:在高FFA的培养液中培养骨骼肌细胞,AMPK活性被抑制;而APS可以通过活化被抑制的AMPK活性从而增加FFA的摄取利用,降低培养液中FFA浓度。我们注意到在CHF晚期同样存在FFA利用障碍和高FFA水平;而APS被证实可改善CHF,那么APS是否可以通过改善CHF心肌细胞对FFA的摄取和利用改善心衰呢?本研究通过复制CHF模型,给予APS干预,发现APS可改善心脏功能,与前人研究一致。同时我们发现,CHF时FFA摄取利用障碍,存在血循环高FFA水平和心肌细胞内FFA蓄积;APS可改善心肌细胞对FFA的利用,同时降低血循环FFA水平。本研究还发现CHF时AMPK活性被抑制,APS干预可活化被抑制的AMPK。
AMPK活性变化与心肌FFA摄取和利用有什么关系呢?我们观察到与FFA转运密切相关的2个关键酶: FAT/CD36T和CPT-1。FAT/CD36主要表达于骨骼肌和心肌,CD36是心脏FAT的主要形式。FAT/CD36主要存在于胞浆中,它向细胞膜转位可促进FFA摄取;CPT-1存在于线粒体膜上,CPT-1表达增加可促进FFA进入线粒体氧化。本研究发现,CHF时FAT/CD36向细胞膜转位减少,同时CPT-1表达减少,这可能导致了FFA摄取利用障碍。
已经有较多研究证实AMPK可调节CPT-1表达,对于AMPK与FAT/CD36转位之间的关系目前尚未完全清楚。我们先前研究发现,体外培养骨骼肌细胞,模拟高FFA环境,APS干预可促进FAT/CD36转位;加用AMPK抑制剂compound C后,APS促进FAT/CD36转位的作用被抑制[1-2]。在CHF动物模型上,APS促进FAT/CD36转位也很可能是通过活化AMPK而完成,需要我们后续研究进一步证实。
综上所述,APS可以改善CHF,可能机制是CHF时AMPK活性被抑制,脂肪酸转运酶FAT/CD36细胞膜转位减少和CPT-1表达减少,从而导致FFA摄取利用障碍;而APS可活化被抑制的AMPK,增加FAT/CD36转位同时增加CPT-1表达,从而促进心肌对FFA摄取利用,改善心肌代谢底物结构,进而改善心衰。本研究进一步明确了CHF时FFA摄取利用障碍的机制以及APS的改善作用;为APS成为治疗CHF药物提供了理论和实验基础。
[1] 胡阳黔,李 静,刘 坚,等. 黄芪多糖活化AMPK促进骨骼肌FAT/CD36转位改善FFAs代谢[J]. 中国病理生理杂志,2013,29(4):637-640.
[2] 宋 杰, 李 静, 胡阳黔, 等. 黄芪多糖活化AMPK减轻游离脂肪酸对C2C12成肌细胞的细胞毒性[J]. 中国病理生理杂志,2012,28(2):298-301.
[3] 毛先晴,欧阳静萍.黄芪多糖对饮食诱导小鼠肝脏胰岛素抵抗的预防作用[J].中国病理生理杂志, 2007, 23(11):2222-2225.
[4] 吴 琪, 汪东良, 陈 琪, 等. 黄芪救心汤对慢性心衰患者TNF-α与IL-10水平的影响[J]. 中华中医药学刊,2011,29(7):1688-1690.
[5] 杨志霞, 林 谦, 马 利, 等. 黄芪多糖丹参酮对慢性心衰大鼠MIF表达的调控作用[J]. 中国药理学通报,2011,27(9):1214-1217.
[6] 倪 艳, 苏 强, 刘 霞, 等. 黄芪多糖水煎提取工艺的优化试验研究[J]. 中国中药杂志,1998,23(5):284-286.
[7] Chandler MP, Morgan EE, Mc Elfresh TA, et al. Heart failure progression is accelerated following myocardial infarction in type 2 diabetic rats[J]. Am J Physiol Heart Circ Physiol, 2007, 293(3):H1609-H1616.
[8] Dávila-Román VG, Vedala G, Herrero P, et al. Altered myocardial fatty and glucose metabolism in idiopathic dilated cardiomyopathy [J]. J Am Coll Cardiol,2002, 40(2):271-277.
[9] Stanley W, Recchia F, Lopaschuk G. Myocardial substrate metabolism in the normal and failing heart[J]. Physiol Rev,2005, 85(3):1093-1129.
[10]Taylor M, Wallhaus TR, Degrado TR, et al. An evaluation of myocardial fatty acid and glucose uptake using PET with [18F]fluoro-6-thia-heptadecanoic acid and [18F]FDG in patients with congestive heart failure[J]. J Nucl Med,2001, 42(1):55-62.
[11]Razeghi P, Young M, Alcorn J, et al. Metabolic gene expression in fetal and failing human heart[J]. Circulation, 2001, 104(24):2923-2931.
[12]Tang W, Francis G. Novel pharmacological treatments for heart failure[J].Expert Opin investig Drugs, 2003, 12(11):1791-1801.
[13]Wu k,Ouyang J, Wu Y, et al. Insulin sensitization and anti-obesity effects ofAstragaluspolysaccharide on high fat diet-fed C57BL/6J mice[J]. FASEB J, 2006, 20(5):A1146.
[14]Mao XQ, Wu Y, Wu K, et al.Astragaluspolysaccharide reduces hepatic endoplasmic reticulum stress and restores glucose homeostasis in a diabetic KKAy mouse model[J]. Acta Pharmacol Sin, 2007, 28(12):1947-1956.
Astragaluspolysaccharides improve chronic heart failure by promoting myocardial FFA metabolism via AMPK pathway
SONG Jie1, HU Yang-qian1, LIU Jian2, LI Jing2
(1DongfengHospital,HubeiUniversityofMedicine,2HubeiUniversityofMedicine,Shiyan442000,China.E-mail:doctorsongjie@163.com)
AIM: To investigate the effect ofAstragaluspolysaccharides (APS) on chronic heart failure and its mechanism. METHODS: Male SD rats (n=32) were randomly divided into control group, sham group, model group and APS group (8 rats in each group). The left coronary artery ligation in the rats was conducted to establish myocardial infarction heart failure model. After modeling, the rats in APS group were given APS (3 g·kg-1·d-1) by intragastric administration for 6 weeks. Left ventricular diastolic diameter (LVD), left ventricular systolic diameter (LVS), left ventricular ejection fraction (LVEF) and fractional shortening (FS) were detected by echocardiography. HE staining was used to observe the pathological changes. The concentrations of free fatty acid (FFA) in the serum and myocardium were observed by the method of acetyl coenzyme A synthetase and acetyl coenzyme A oxidase (ACS-ACOD). The protein levels of total AMP-activated protein kinase (AMPK), phosphorylated AMP-activated protein kinase (p-AMPK), fatty acid translocase (FAT/CD36) and carnitine palmitoyltransferase I (CPT-1) were measured by Western blotting. RESULTS: No significant difference in each index between sham group and control group was observed. Compared with control group, LVEF and FS in model group was significantly decreased, while LVD and LVS was significantly increased (P<0.05). The LVEF and FS in APS group were significantly improved compared with model group (P<0.05), and there was no significant difference between APS group and control group. LVD and LVS in APS group were obviously improved compared with mo-del group (P<0.05), and the difference was significant compared with control group (P<0.05). Compared with control group, focal myocardial necrosis increased, and residual myocardial cells reduced in model group, while those was much better in APS group as compared with model group (P<0.05). The FFA concentrations in the serum and myocardium in model group increased significantly compared with control group (P<0.05), while those decreased significantly in APS group as compared with model group (P<0.05). The protein levels of p-AMPK, CPT-1, and cell membrane FAT/CD36 in model group decreased significantly compared with control group (P<0.05), and those in APS group increased obviously compared with control group (P<0.05). CONCLUSION: APS improves chronic heart failure by activating the AMPK pathway and promoting myocardial ingestion and utiliation of FFA.
Astragaluspolysaccharides; Free fatty acid; AMP-activated protein kinase; Chronic heart failure
1000- 4718(2015)01- 0028- 05
2014- 06- 27
2014- 11- 06
国家自然科学基金资助项目(No. 30370673); 湖北省教育厅科学研究计划资助项目(No. B2013120;B2014062); 十堰市科学技术研究与开发项目(No. ZD2012037)
△通讯作者 Tel: 0719-8272543; E-mail: doctorsongjie@163.com
R363
A
10.3969/j.issn.1000- 4718.2015.01.006
