黑花生衣原花色素和花色苷的提取工艺研究
2015-04-12欧阳燕林谭兴和郭红英邓洁红张春艳
欧阳燕林,谭兴和 *,王 锋,郭红英,邓洁红,李 林,张春艳,张 喻
(1.湖南农业大学 食品科学与技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.湖南农业大学 农学院,湖南 长沙 410128)
黑花生衣中含有原花色素、花色苷、白藜芦醇、槲皮素等黄酮类化合物,具有很好的保健作用。杜蕾等[1]研究表明,黑花生衣中的原花色素含量达29.19%,王锋[2]研究表明,黑花生衣花色苷含量达4.93 mg/g干质量。黑花生衣约占黑花生仁质量的3%~4%[2],在黑花生加工过程中被剥除,造成资源浪费。开发和利用黑花生衣色素对资源的综合利用具有重大意义。
原花色素(proanthocyanidins)又称原花青素,是黄烷-3-醇衍生物的总称,由儿茶素和表儿茶素组成,有多种聚合体形式[3]。花色苷(anthocyanin)是花色素的糖苷衍生物,常见的花色素有矢车菊色素、飞燕草色素、天竺葵色素、芍药色素、牵牛花色素、锦葵色素等[4]。原花色素和花色苷都是高活性的天然抗氧化剂,原花色素的抗氧化能力是VC的20倍,是VE的50倍[5]。研究表明,原花色素和花色苷都有清除自由基、抗癌、抗心血管疾病、降血脂等作用[6-11]。目前,已运用到食品、保健品、医药、化妆品等领域。
响应面分析法(response surface method,RSM)可以分析试验指标与多个试验因素间的回归关系,是用于优化工艺条件的有效分析方法。根据相关研究,原花色素和花色苷的提取工艺条件相似,故本试验在单因素试验的基础上,用响应面分析法同时优化黑花生衣原花色素和花色苷的提取工艺参数,使提取液中原花色素和花色苷的含量同时达到最大,节约分别提取的成本。本试验研究同时提取黑花生衣原花色素和花色苷的工艺条件,旨在减少提取时间和提取剂用量,从而提高提取效率,降低成本,减少环境污染,为工业生产提供参考。
1 材料与方法
1.1 材料与试剂
黑花生衣:湖南省江永县义华花生制品有限公司;乙醇、甲醇、盐酸、硫酸等试剂(均为分析纯):国药集团化学试剂有限公司;原花青素标准品(纯度≥95%):成都曼斯特生物科技有限公司。
1.2 仪器与设备
SKY-恒温培养振荡器:上海苏坤实业有限公司;RE-2000B旋转蒸发器、SHZ-D(Ⅲ)循环水真空泵:巩义市予华仪器有限责任公司;HH-8数显恒温水浴锅:上海浦东物理光学仪器厂;WFJ7200型可见分光光度计:尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 原花色素、花色苷的提取
黑花生衣磨碎,过30目筛,准确称取0.2 g黑花生衣碎末于50 mL的锥形瓶中,加入一定体积、浓度和pH值的乙醇溶液,用保鲜膜封口,置于一定温度的恒温摇床中,遮光,保持摇动频率为120 r/min,振荡一定的时间。提取完成后进行抽滤,取1/2滤液(按加入的乙醇提取剂体积计算),经40 ℃旋转蒸发后,用水定容至10 mL,测定花色苷含量,稀释3倍后测定原花色素含量。
1.3.2 原花色素含量的测定
原花色素含量的测定:采用香草醛-硫酸法测定,参考SUN B等[12]方法。
原花青素标准曲线的绘制:配制质量浓度为0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL的原花青素标准溶液,分别取0.5 mL标液,加入2.5 mL 1%香草醛-甲醇溶液,再加入2.5 mL 25%硫酸-甲醇溶液,在波长500 nm处测定其吸光度值,绘制标准曲线。
样品原花色素含量的测定:取0.5 mL样液,加入2.5 mL 1%香草醛-甲醇溶液,再加入2.5 mL 25%硫酸-甲醇溶液,在波长500 nm处测定其吸光度值A1;对照组:取0.5 mL样液,加入2.5 mL甲醇,再加入2.5 mL 25%硫酸-甲醇,在波长500 nm处测定其吸光度值A0。
原花色素吸光度值A=A1-A0,计算原花色素含量。原花色素得率计算公式如下:

式中:c为原花色素质量浓度,mg/mL;v为样液体积,mL;m为样品黑花生衣质量,mg。
1.3.3 原花青素的回收率试验
由于黑花生衣提取液中含有花色苷,呈红色,原花色素在香草醛和硫酸的作用下也呈红色,故本试验采取对照试验消除花色苷引起的误差。称取10 mg黑花生衣粗提物粉末,用水定容至10 mL,稀释一倍后,按上述方法测定原花色素含量;称取6.4mg原花青素标准品,用水定容到10 mL,配制成质量浓度为0.64mg/mL溶液。在黑花生衣提取液中加入一定量的原花青素标液,测定原花色素含量。
1.3.4 花色苷含量的测定
用pH示差法测定,参考GINSTI M M等[13]方法测定花色苷的含量。花色苷得率的计算公式如下:

式中:A为吸光度差值;Mw为矢车菊-3-葡萄糖苷的分子质量,449.2;DF为稀释因子;ε为矢车菊-3-葡萄糖苷摩尔消光系数,26 900;1为光程,cm。
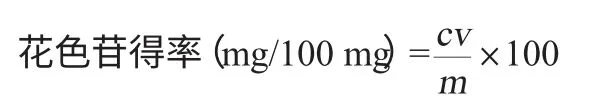
式中:c为花色苷质量浓度,mg/mL;v为样液体积,mL;m为黑花生衣质量,mg。
1.3.5 单因素试验
准确称取0.2 g黑花生衣碎末于50 mL的锥形瓶中,以黑花生衣中原花色素和花色苷的得率为评价指标,分别考察pH值(2、3、4、5、自然)、液料比(30∶1、40∶1、50∶1、60∶1、70∶1(mL∶g))、乙醇体积分数(30%、40%、50%、60%、70%、80%、90%)、提取温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃)、提取时间(30 min、60 min、90 min、120 min、150 min、180 min)对原花色素和花色苷提取效果的影响。
1.3.6 响应面试验
根据单因素试验结果,固定pH 3,提取时间120 min。选择液料比(A)、乙醇体积分数(B)、提取温度(C)3个因素为自变量,以原花色素得率(Y1)和花色苷得率(Y2)为响应值,响应面试验因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface design
2 结果与分析
2.1 原花青素标准曲线

图1 原花青素标准曲线Fig.1 Standard curve of proanthocyanidin
以原花青素含量(x)为横坐标,吸光度值(y)为纵坐标,绘制原花青素标准曲线,结果见图1。
由图1可知,标准曲线回归方程:y=0.826 0x-0.001 7,相关系数为R2=0.999 8,表明原花青素含量与吸光度值在0.1~0.5 mg/mL质量浓度范围内具有良好的线性关系。
2.2 原花青素的回收率
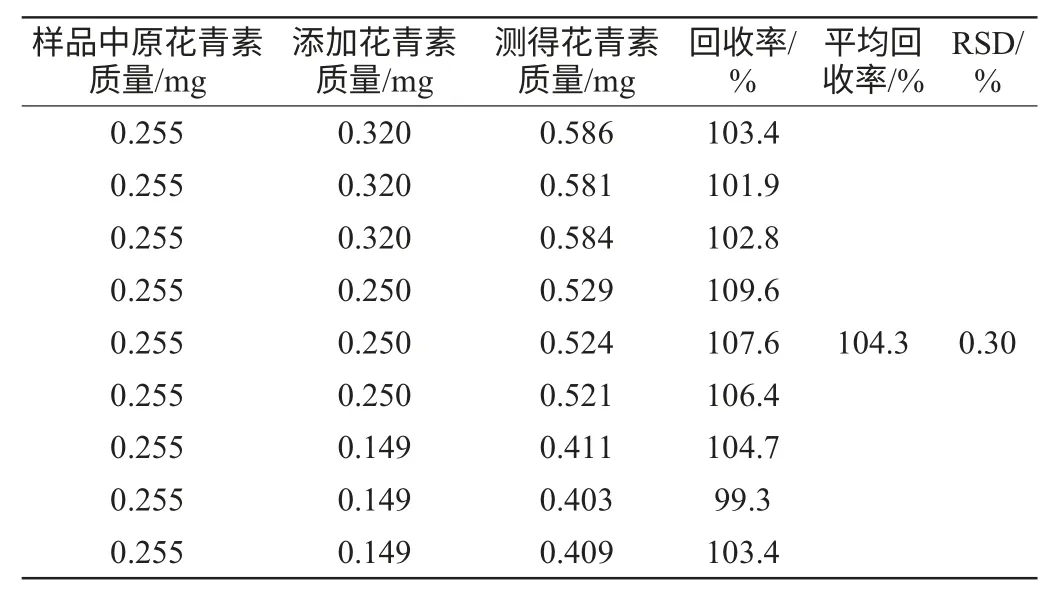
表2 回收率试验结果Table 2 Results of the recovery tests
由表2可知,该测定方法的回收率在99.3%~109.6%,平均回收率为104.3%,相对标准偏差(relative standard deviation,RSD)为0.30%,由此可知该检测方法准确度良好,可以用于测定原花色素含量,彭芳刚等[14]也用到了此法来消除其他色素引起的误差。
2.3 单因素试验结果
2.3.1 pH对原花色素和花色苷提取效果的影响

图2 pH对原花色素(A)和花色苷(B)提取效果的影响Fig.2 Effect of different pH on the extraction of proanthocyanidins(A) and anthocyanins (B)
由图2可知,原花色素的得率在pH值为3及5处分别出现峰值,分别为12.883 mg/100 mg、12.047 mg/100 mg,由于原花色素中含有酚羟基,呈弱酸性,因此在pH值较低和接近中性时,提取效果较好,故适宜的酸性条件有利于原花色素溶出;花色苷得率随pH上升而下降,在pH值为2时达到最高,为0.636 mg/100 mg,原因是花色苷在酸性条件下稳定。pH值为3时花色苷得率下降不明显,综合考虑原花色素和花色苷的得率,故选择pH值为3较为合适。
2.3.2 液料比对原花色素和花色苷提取效果的影响

图3 液料比对原花色素(A)和花色苷(B)提取效果的影响Fig.3 Effect of different liquid-material ratio on the extraction of proanthocyanidins (A) and anthocyanins (B)
由图3可知,原花色素得率和花色苷得率都随液料比增加先快速上升,再逐渐趋于平稳,都在液料比50∶1(mL∶g)时达到最高点,分别为12.883 mg/100 mg、0.610 mg/100 mg。液料比的大小与液固两相的浓度差(即传质推动力)有关,在提取过程中,液料比小,则液相浓度增加快,两相浓度差减少快,故传质推动力减弱的速度加快,不利于目标物的得率增加[15]。从经济角度考虑,故选择液料比50∶1(mL∶g)为宜。
2.3.3 乙醇体积分数对原花色素和花色苷提取效果的影响
由图4可知,原花色素得率和花色苷得率都随乙醇体积分数的增加先上升后下降,都在乙醇体积分数为50%时达到最大,分别为12.774 mg/100 mg、0.651 mg/100 mg。根据相似相溶的原理,原因可能是原花色素和花色苷的极性与乙醇水溶液极性接近时,溶出效果最好[16];还有可能是因为乙醇体积分数低,蛋白质、糖类等水溶性物质易溶出,乙醇体积分数过高,脂溶性物质易溶出,影响原花色素和花色苷溶出[17]。故选择乙醇体积分数50%为宜。
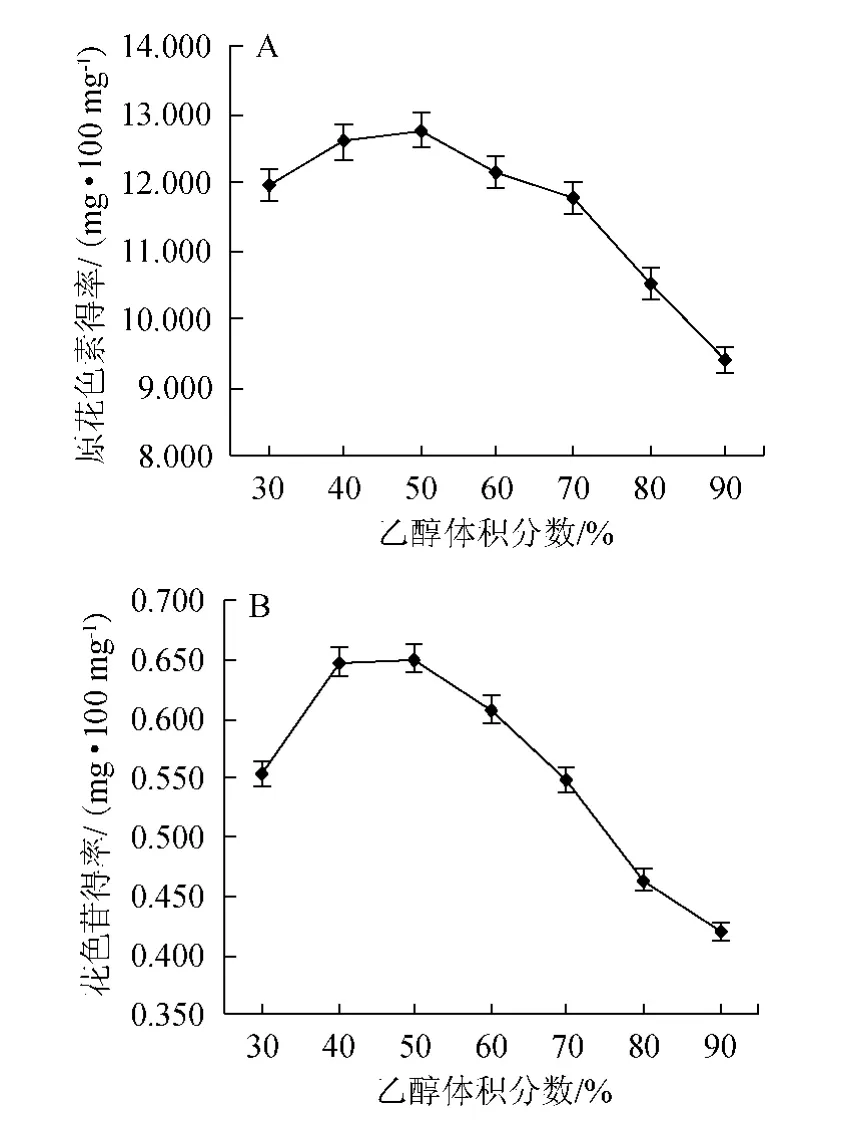
图4 乙醇体积分数对原花色素(A)和花色苷(B)提取效果的影响Fig.4 Effect of different ethanol concentration on the extraction of proanthocyanidins (A) and anthocyanins (B)
2.3.4 提取温度对原花色素和花色苷提取效果的影响
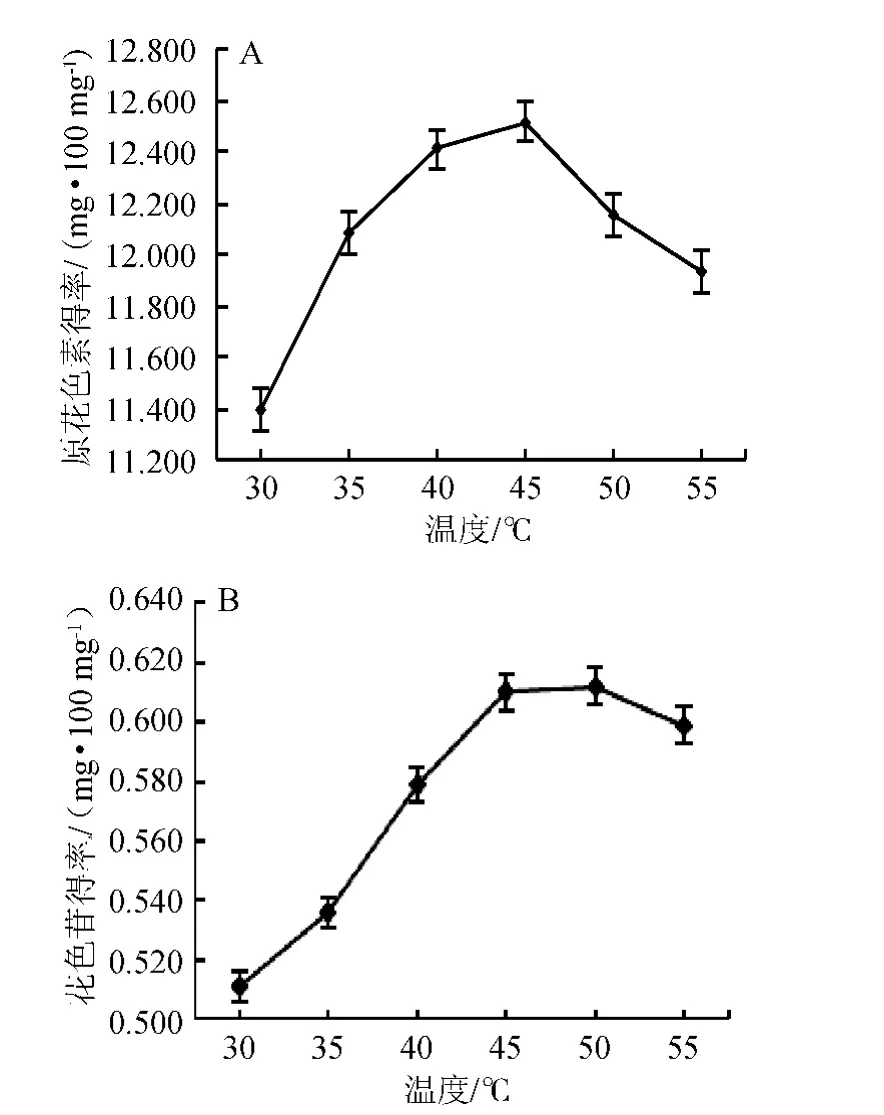
图5 提取温度对原花色素(A)和花色苷(B)提取效果的影响Fig.5 Effect of different extraction temperature on the extraction of proanthocyanidins (A) and anthocyanins (B)
由图5可知,原花色素得率随着温度的上升先上升后下降,在45 ℃达到最大,为12.519 mg/100 mg;花色苷得率随着温度的上升先上升,然后趋于平稳,达到最大值后下降,在50 ℃达到最大,为0.612 mg/100 mg。花色苷得率在45 ℃和50 ℃时无明显差异,温度升高可以加快分子的扩散速度,但温度过高可能导致原花色素分解和花色苷降解。综合考虑原花色素和花色苷的得率,故选择45 ℃为适宜提取温度。
2.3.5 提取时间对原花色素和花色苷提取效果的影响

图6 提取时间对原花色素(A)和花色苷(B)提取效果的影响Fig.6 Effect of different extraction time on the extraction of proanthocyanidins (A) and anthocyanins (B)
由图6可知,原花色素和花色苷得率都随着提取时间的增加而上升,最后下降,原花色素得率在120 min时达到最大,为13.536 mg/100 mg;花色苷得率在150 min时达到最大,为0.623 mg/100 mg。提取时间对于提取效果很关键,提取时间延长,原花色素和花色苷溶出越多,最后提取液接近饱和,原花色素和花色苷溶出速度变慢;而且时间太长可能会导致原花色素和花色苷氧化。通过分析数据可知,花色苷在120 min和150 min的得率变化不显著(P=0.612>0.05),综合考虑两个指标的得率,故选择提取时间120 min为宜。
2.4 响应面试验结果分析
2.4.1 响应面试验结果与分析
响应面试验设计及结果分析见表3,利用Design Expert 8.0.5软件对表3试验数据进行回归分析,得到数学模型,并对所得模型进行方差分析,结果分别见表4、表5。

表3 响应面试验结果Table 3 Results of response surface analysis
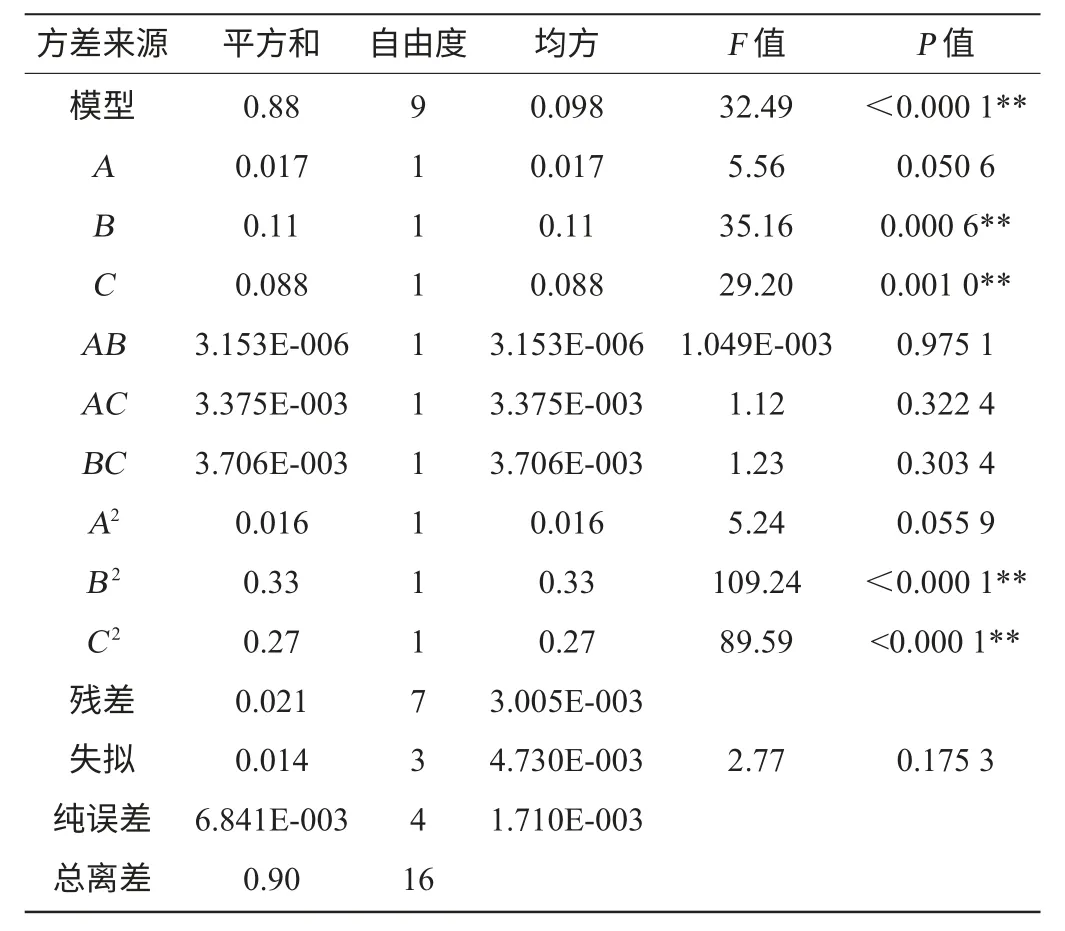
表4 以原花色素含量为响应值的回归模型方差分析Table 4 Variance analysis of regression model using proanthocyanidins contents as response value
以原花色素得率(Y1)和花色苷得率(Y2)为响应值,3个因素的二次多项回归方程分别为:


表5 以花色苷含量为响应值的回归模型方差分析Table 5 Variance analysis of regression model using anthocyanins contents as response value
比较上述两个方程A、B、C对应系数的绝对值可以判断出3个因素对提取效果的影响大小顺序。3个因素对原花色素提取效果影响的大小为B>C>A,对花色苷提取效果影响的大小为B>A>C。
由表4可知,模型P<0.000 1,说明模型极显著,失拟项P=0.175 3>0.05,说明失拟度不显著,残差由随机误差引起,说明模型拟合度良好,可以用来对原花色素提取效果进行分析和预测。决定系数R2=0.976 6,说明该模型拟合97.66%的试验数据。变异系数(coefficient of variation,CV)值越低,说明试验可靠性越高。变异系数CV=0.41%,说明本试验的可靠性高。从表4可以看出,B、C、B2、C2对响应值Y1的影响极显著(P<0.01),其余项均不显著。这表明试验因素对响应值不是简单的线性关系,同时交互项不显著,说明任意两因素间不存在交互作用。
由表5可知,模型P=0.005 7<0.01,说明模型极显著,失拟项P=0.153 7>0.05,说明失拟度不显著,说明模型拟合度良好,可以用来对花色苷提取效果进行分析和预测。决定系数R2=0.912 9,说明该模型拟合91.29%的试验数据;变异系数CV=0.90%,说明本试验的可靠性高。从表5看出,A2、B2对响应值Y2的影响极显著,B对响应值Y2的影响显著,其余项均不显著。这表明试验因素对响应值不是简单的线性关系,同时交互项不显著,说明任意两因素间不存在交互作用。
2.4.2 响应曲面分析及优化
通过Design Expert 8.0.5 软件对各因素之间的交互作用进行响应面分析,绘制响应面曲线及等高线,结果见图7。
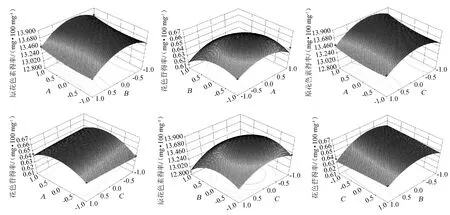
图7 液料比、乙醇体积分数和提取温度交互作用对原花色素和花色苷提取效果影响的响应面及等高线Fig.7 Responsive surface plots and contour line of effects of interaction between liquid-material ratio,ethanol concentration and extraction temperature on the extraction efficiency of proanthocyanidins and anthocyanins
由图7可知,液料比、乙醇体积分数和温度,任意两个因素之间的交互作用都不显著,对原花色素和花色苷得率的影响不大,原因可能是各个因素水平间距不大,原花色素和花色苷得率在所取的水平范围内变化不显著。
2.4.3 提取工艺优化结果和验证
用Design Expert 8.0.5软件分析试验数据得到的最佳提取工艺条件为:液料比52.00∶1(mL∶g)、乙醇体积分数47.75%、提取温度43.91 ℃,此条件下原花色素和花色苷的预测得率分别为13.779 mg/100 mg和0.659 mg/100 mg。考虑到实际操作可行性,选择液料比52∶1(mL∶g)、乙醇体积分数48%、提取温度44 ℃,在此条件下检验预测结果的可靠性,重复3次提取黑花生衣原花色素和花色苷,得到的原花色素和花色苷得率分别为(13.769±0.015)mg/100 mg、(0.660±0.002)mg/100 mg,与预测值很接近,说明该模型反映出的提取条件可靠,此优化方法可行。
3 结论
本研究在单因素试验的基础上,固定pH值为3、提取时间120 min,选取液料比、乙醇体积分数和提取温度设计响应面试验,考察各自变量及其交互作用对原花色素得率和花色苷得率的影响。最终优化得到的条件为:液料比52∶1(mL∶g)、乙醇体积分数48%、提取温度44 ℃。经试验验证,该条件下的原花色素和花色苷得率分别为13.769mg/100mg、0.660 mg/100 mg,与模型预测值接近。在优化的工艺条件下,原花色素和花色苷得率较高,减少了资源消耗,提高了提取效率,可为进一步研究黑花生衣原花色素和花色苷提供参考依据。
[1]杜 蕾,李新华.黑、红花生衣中原花色素的分析[J].食品科学,2014,35(4):190-193.
[2]王 锋.黑花生衣色素的研究[D].长沙:湖南农业大学博士论文,2007.
[3]XIE D Y,DIXON R A.Proanthocyanidin biosynthesis-still more questions than answers?[J].Phytochemistry,2005,66:2127-2144.
[4]邓洁红,谭兴和,潘小红,等.葡萄花色苷研究进展[J].包装与食品机械,2006,24(6):22-28.
[5]张长贵,董加宝,谢伍容.原花色素抗氧化生物活性研究进展[J].粮食与油脂,2009(6):10-12.
[6]王庆玲,罗小玲,董 娟,等.花生红衣低聚原花色素抗氧化性的研究[J].中国食品学报,2011,2:91-94.
[7]MA Y Y,KERR W L,SWANSON R B.Peanut skins-fortified peanut butters:Effect of processing on the phenolics content,fibre content and antioxidant activity[J].Food Chem,2014,145:883-891.
[8]ASHA DEVI S,SAGAR CHANDRASEKAR B K,MANJULA K R,et al.Grape seed proanthocyanidin lowers brain oxidative stress in adult and middle-aged rats[J].Exp Gerontol,2011,46(11):958-964.
[9]赵 丹.酒体系中原花青素的聚合转化及其性质的研究[D].广州:华南理工大学硕士论文,2013.
[10]杜 蕾,李新华,陈芳芳.黑花生衣色素抗氧化作用的研究[J].食品工业科技,2012,33(13):100-103.
[11]张丽霞.黑莓花色苷降解与辅色及抗氧化活性研究[D].南京:南京农业大学博士论文,2012.
[12]SUN B S,RICARDO-DA-SILVA J M,SPRANGER I.Critical factors of vanillin assay for catechins and proanthocyanidins[J].J Agr Food Chem,1998,46:4267-427.
[13]GINSTI M M,WROLSTAD R E.Anthocyanins,characterization and measurement with UV visible spectroscopy[M].New York:Current protocols in food analytical chemistry,2006.
[14]彭芳刚,李绮丽,吴卫国.响应面法优化红莲外皮原花青素的提取工艺研究[J].现代食品科技,2013,29(6):1349-1354.
[15]李大婧,宋江峰,刘春泉,等.超声波辅助提取黑豆皮色素工艺优化[J].农业工程学报,2009,25(2):273-279.
[16]令 博,王 捷,吴洪斌,等.葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J].食品科学,2011,32(18):24-29.
[17]田春莲,蒋凤开.茜草总黄酮提取工艺研究[J].食品科学,2011,32(24):60-63.
