替代原料发酵产生物丁醇及其他高级醇的研究进展
2015-04-12平振杰苏亚蕊关爱民郜晓峰
平振杰,苏亚蕊,关爱民,郜晓峰*
(1.河南大学 药学院,河南 开封 475000;2.河南大学 生命科学学院,河南 开封 475000)
随着全球经济的快速发展,能源问题成为经济发展的重要因素,寻找能够取代化石燃料的潜在能源迫在眉睫。生物发酵生产燃料成为最有效的方法之一,而生物丁醇则为生物燃料最具前景的研究之一。丁醇不仅是一种重要的有机化工原料,也是一种极具潜力的新型生物燃料。与乙醇相比,丁醇具有如下优点[1]:性质更接近烃类,其热值(2.7×107J/L)比乙醇(2.1×107J/L)更为接近汽油(3.0×107J/L),能与汽油任意比例混合,能量密度与燃烧值高,且具有较低的蒸汽压,挥发性低,腐蚀性小,水溶性低,污染轻等,因此丁醇被认为是汽油最好的潜在替代燃料。但从20世纪50年代开始,由于石油工业的迅速崛起,欧洲,北美等地生物丁醇发酵工业受到强烈的冲击,逐渐被化石燃料工业取代[1]。最近几年,随着石油价格的波动及环境污染的加剧,生物发酵生产丁醇及其相关化合物又重新受到广泛关注。
当前,工业生产高级醇大多使用甘薯、玉米等粮食作物作为原料,而潜在可替代原料(木质纤维素,合成气,CO2,废蛋白类等)往往被当做废弃物处理掉。随着生物技术的不断成熟,可替代原料已逐渐应用到生物丁醇发酵过程中。该文系统介绍了近年来多种替代原料应用到生物丁醇的研究进展,探讨并展望了其在生物燃料发酵行业存在的问题及发展前景,提出了提高废弃物生产丁醇的策略,对提高废弃资源的利用效率、减少环境污染等方面具有一定意义。
1 生物丁醇以及高级醇生产的潜在替代原料
1.1 木质纤维素类
纤维素是一种最具开发潜力的生物燃料发酵原料,主要由纤维素(35%~50%)、半纤维素(25%~35%)和木质素(10%~20%)构成。能分解木质纤维素的微生物主要包括梭菌属(Clostridium)和链霉菌属(Streptomyces)等细菌,以及真菌中的曲霉属(Aspergillus)、腐质霉属(Humicola)、白腐菌属(Phanerochaete)和木霉属(Trichoderma)等[2]。HIGASHIDE W等[3]从一株腐烂的杂草中分离出能直接利用纤维素的解纤维梭菌(Clostridium cellulolyticum),此梭菌是一种能天然利用纤维素和半纤维素的嗜温梭菌。然而一般产溶剂菌株不具备分解木质纤维的能力,往往需要预处理后才能用于溶剂生产。不同纤维原料采用处理方式的不同,发酵丁醇产率也有差异。SU H F等[4]酶水解甘蔗渣以C.beijerinckiiNCIMB 8052进行发酵,丙酮、丁醇、乙醇(acetone-butanol-ethanol,ABE)总溶剂量达到11.9 g/L,其中丁醇产量为6.4 g/L。YANG M等[5]通过添加木聚糖酶和表面活性剂PEG 4000对大麦秸秆进行预处理,处理后葡萄糖得率由53.2%提高到86.9%,木糖得率由36.2%提升到70.2%,C.acetobutylicumDSM 1731菌株发酵酶解液中ABE总溶剂产量10.8 g/L,其中丁醇产量达到7.9 g/L。LU C C等[6]以C.acetobutylicumJB200(丙酮丁醇梭菌)发酵木薯渣水解液,气提分离丁醇产量可以达到20 g/L。LIU Z Y等[7]以C.beijerinckiiATCC 55025发酵麦麸水解液,72 h后丁醇的产量为8.8 g/L。若针对不同纤维原料,开发出廉价的、简便的前期处理工艺或选育不需要预处理就能直接发酵丁醇的菌株,能显著加快纤维素生产丁醇的发展。近几年来一些关于菌株发酵纤维产丁醇的相关报道见表1。
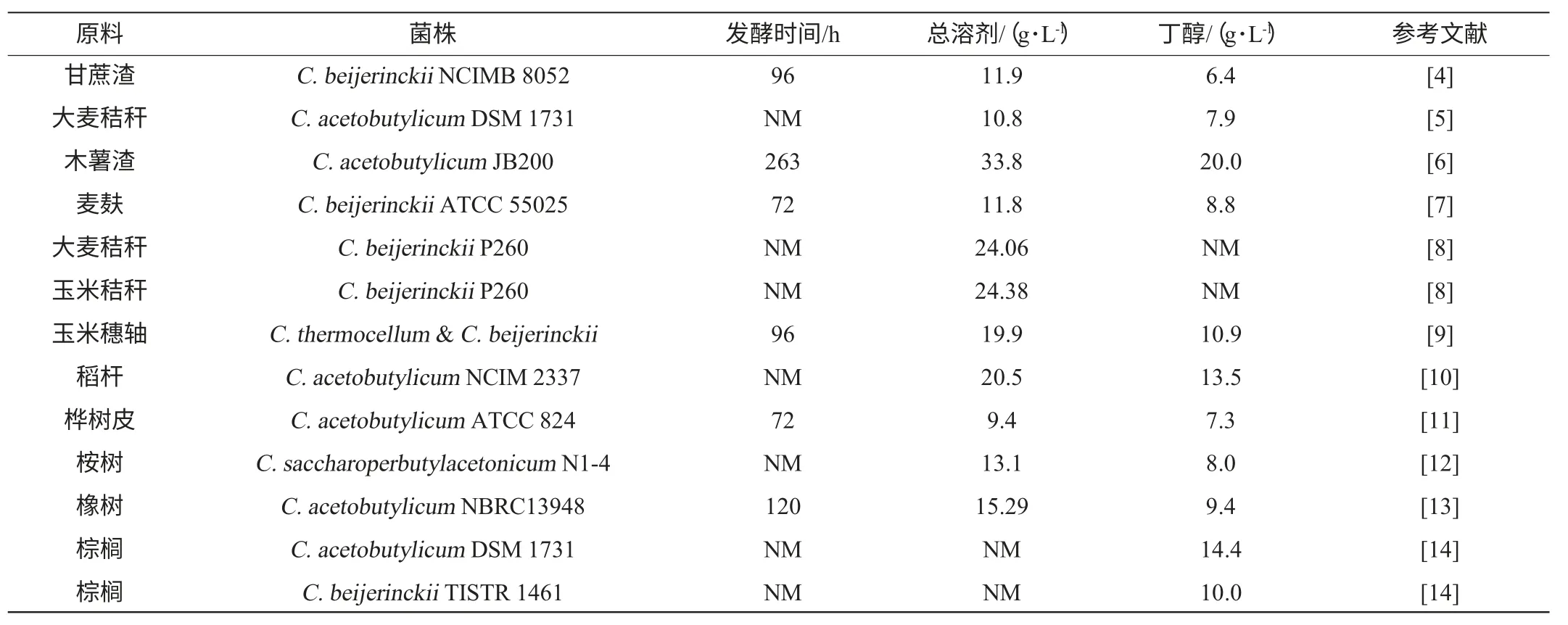
表1 关于木质纤维素生产丁醇的相关报道Table 1 Reports about cellulosic butanol in recent years
1.2 合成气
合成气即由CO、H2、CO2等组成的混合气体,一般来说,能利用合成气发酵的微生物要么是以CO或CO2为碳源、以氢为能源,要么以CO为碳源和能源,但这些微生物发酵丁醇产量都很低,无法达到以粮食或植物纤维为原料生产丁醇的水平,故需寻找一些合成气利用效率较高但不能生产丁醇的微生物,通过基因工程在其体内构建生成丁醇的代谢途径;或原本能利用合成气生产丁醇的微生物进行代谢工程改造,从而提高丁醇生产能力。目前报道的可自然利用合成气发酵合成生物丁醇的菌株仅有梭状芽胞杆菌(C.carboxidivorans)和食甲基丁酸杆菌(Butyribacterium methylotrophicumDSM 3468)[15]。C.carboxidivorans在自然条件下能利用合成气产正丁醇、乙醇、丁酸和乙酸[16]。但野生型C.carboxidivorans主要产乙酸(每消耗1mol CO产56 mmol乙酸),正丁醇是次要产物(每消耗1 mol CO产8.9 mmol正丁醇[15])。PHILLIPS J R等[16]利用C.carboxidivorans在特定比例合成气(CO∶H2∶CO2=70∶20∶10)中改进发酵条件,丁醇质量浓度超过1 g/L。Alkalibaculum bacchiCP15利用合成气能代谢乙醇,却不能合成丁醇,LIU K等[17]通过A.bacchiCP15和C.propionicum混合培养发酵,利用合成气发酵产乙醇、正丙醇及正丁醇,其中正丁醇质量浓度也达到1 g/L。TANNER R S等[18]通过研究发现C.ljungdahlii利用合成气能独立生产乙醇但却不能独立生产正丁醇,KOPKE M等[19]将丁醇代谢途径的关键基因在C.ljungdahlii中同源表达,成功构建了基于合成气原料的生物丁醇转化平台。
1.3 CO2光合作用
微藻类是生活在海洋或淡水中的一类光合微生物,包括硅藻(chromalveolata)、蓝藻(cyanobacteria)及其他单细胞藻类(如chlorophyta等),其光合作用速率和效率比陆地植物高得多,生物燃料产量可达1.2 L/m2[20]。ATSUMI S等[21]通过改变生物合成途径结合KivD(2-酮异戊酸脱羧酶基因)和YqhD(乙醇脱氢酶基因)合成异丁醇。枯草芽孢杆菌(Bacillus subtilis)乙酰乳酸合酶基因(AlsS)和大肠杆菌缬氨酸生物合成酶基因(IlvC、IlvD)在Synechococcus elongatusPCC 7942中过量表达,使工程菌6 d的异丁醇产量为450 mg/L[21],超过了目前Cyanobacteria产氢气和乙醇的产量。ATSUMI S等[21]还在类似的研究中验证了二磷酸酮糖羧化酶的过量表达能提高中间产物异丁醛的量(1.1 g/L),结果同时表明代谢途径的改变,使得光合作用速率得到提高。MACHADO I M等[22]也试图构建S.elongatus生产其他燃料和化工原料,并已取得了显著成效。利用Cyanobacteria合成正丁醇则较为困难,LAN E I等[23]将AtoB、Hbd、Crt、Ter、和AdhE2等基因在S.elongatusPCC 7942中成功表达,重建S.Elongatus正丁醇代谢途径,然而正丁醇产量依旧很低,发酵液中恒温培养7 d的丁醇产量仅为14.5 mg/L。ETHAN I L等[24]将梭菌属丁醇代谢途径导入S.elongatusPCC 7942,通过添加多聚组氨酸附加物提高了Ter酶的表达,而Ter是利用烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)驱动还原的重要酶,因此提高了丁醇合成的效率,亦表明了发酵过程中氧的移除是提高丁醇发酵的重要因素。BOND-WATTS B B等[25]发现S.elongatus在光合作用下产丁醇的代谢途径中存在能量差(通过底物浓度1 mmol/L,pH值7,离子强度1 mmol/L的平衡装置测定[26]),认为这是导致丁醇代谢困难的主要原因,为平衡此能量差,代谢过程中乙酰辅酶A的浓度必须大于双乙酰辅酶A,SHEN C R等[27]通过在大肠杆菌中积累细胞内乙酰辅酶A和NADH解决了能量差的问题,结果表明NADH的积累驱动下一步代谢过程合成正丁醇,但由于S.elongatus中乙酰辅酶A和NADH的浓度受限,此过程在S.elongatus中非常难以构建。LAN E I等[28]利用ATP的能量维持两分子乙酰辅酶A缩合的热力学上的能量平衡,绕开了乙酰辅酶A和NADH浓度作为驱动力用于正丁醇合成这个瓶颈,在光合作用下正丁醇产量为30 mg/L。CHENG H H等[29]利用微藻类的光合作用产物,又通过C.acetobutylicum发酵,最终得到3.86 g/L的丁醇,此法有效的将藻类的光合作用吸收CO2同微生物发酵产溶剂相结合,避开了对微藻的工程改造。
1.4 CO2电子流
光反应可以通过利用人造太阳能电池将光能转化成电能,而作为替代物,光反应和暗反应(CO2的固定和生物燃料的生产)被分离开,然后电能在黑暗中直接或者通过电子媒介驱动CO2的固定[30-31],CO2能够转化为燃料和化学能而不需要直接的光合作用,这也是一种将电能储存在液体燃料中的有效方法[31],由此电能转化为化学能储存在生物燃料中。利用传统技术,电能首先必须转换成简单的电子载体,如H2,然后化能自养型生物利用储存在H2中的能量固定CO2和合成生物燃料。但因H2在水中的低溶解性及存在安全隐患,对于微生物来说,H2不是理想的电子源,而作为替代物的甲酸具有高溶解性,并可以通过电解CO2和H2O得到[32]。此外,甲酸也能够被一些微生物通过甲酸脱氢酶代谢产生NADH和CO2[32]。罗尔斯通氏菌(Ralstonia eutropha)是一种能固定CO2并利用甲酸作为能量来源的化能自养微生物,LI H等[31]通过一个完整的电能驱动生物燃料生产程序,利用R.eutropha生产异丁醇和3-甲基丁醇,将电能转化为以生物燃料为载体的化学能。聚羟基丁酸酯是R.eutropha的碳储存库,将参与异丁醇代谢的相关基因(alsS,ilvCD,kivD和yqhD)重组于R.eutropha中,使异丁醇生产途径取代原有的代谢过程。为构建一个以电能为能量输入的综合程序,需构建一个清除超氧阴离子O2-和NO的生物反应器,该反应器在特定媒介能够鉴别甲酸副产品并抑制细胞生长。此综合流程能够使异丁醇产量达到100mg/L,3-甲基丁醇产量为50mg/L[31]。通过直接供应甲酸,R.eutropha的改造菌株在发酵罐中培养130h,异丁醇产量达到846 mg/L,3-甲基丁醇产量达到570 mg/L[31]。
1.5 废弃蛋白质类
随着人口的增长及社会发展,富含氮磷钾的动物垃圾和粪便如何处理成了一个巨大的难题,回收利用废弃蛋白质用于生物燃料生产可以成为解决该问题的有效方法。然而,微生物一般利用脂类或糖类转化生物燃料,若以蛋白质作为碳源转化生产生物燃料,需要对野生菌株代谢途径进行改造。HUO Y X等[33]定向改造大肠杆菌后,以蛋白质为唯一碳源,高级醇产量406 mg/L,包括异丁醇、2-甲基丁醇、3-甲基丁醇等;进一步破坏氨同化作用途径中关键基因gdhA和glnA,leuDH,avtA,ilvE,ilvA和sdaB过量表达,此工程改造是使氨基酸代谢得以平衡,最终工程菌利用氨基酸生产高级醇的产量为4 g/L,最大理论产率达到55.7%[33]。其研究同时也证明了以预先处理过的海藻和细菌生物质能为原料生产高级醇,产量为3 g/L。CHOIA K Y等[34]通过灭活B.subtilis中的支链氨基酸代谢途径及敲除脂肪酰转移酶手段,弱化了菌株酮酸脱氢酶和乙醇脱氢酶活性,改造后的菌株可以发酵多肽生产丁醇、异丁醇等生物燃料。以废弃蛋白质合成高级醇仍是一个相对不成熟的技术,需要继续研究探讨商业化的可行性。
2 提高可替代原料发酵产丁醇的策略
2.1 发酵工艺的改进
2.1.1 两段式发酵法
两段式发酵法是在传统发酵的基础上进一步发展的一种丁醇发酵方法,第一步是用厌氧梭菌将底物通过代谢转化为丁酸,第二步将第一步得到的丁酸为底物发酵生成丁醇。发酵过程的产酸和产溶剂两个过程分别在两个发酵罐中独立完成,有效地降低丁醇的毒性,保证发酵稳定连续的进行。ANGENENT L等[35]将玉米发酵乙醇的副产物玉米纤维回收后放入沼气池,与数千种不同的微生物混合发酵,将其转化为丁酸,再利用丁酸进行丁醇发酵,使得丁醇产率大大提高。
2.1.2 固定化发酵法
固定化发酵技术是将微生物固定在载体上进行富集,利用细胞内酶来实现酶催化反应的,其本身是多酶体系。与传统发酵法相比,其具有反应速度快,产率高;重复利用性好,粮耗和能耗少;设备投资少,控制方便等优点。EFREMENKO E等[36]对微藻类进行预处理,然后将菌株C.acetobutylicumB-1787固定于聚乙烯醇(poly vinyl alcohol,PVA)水凝胶(一种固定细胞的载体)厌氧发酵,取得了较高的溶剂产率及醇转化率。
2.1.3 四步发酵法
四步发酵法由QURESI N等[37]研究开发,即将生物丁醇生产过程中预处理、水解、发酵和回收4个步骤整合,酶和细菌将同时完成各自的任务。与其他方法相比,生物丁醇的生产能力将比传统的葡萄糖发酵方法提高两倍。
2.1.4 同步糖化发酵法
同步糖化发酵法(simulataneous saccharification and fermentation,SSF)是指将糖化和发酵这两个不同的工艺过程在同一个生物反应器中同时进行。纤维原料水解产物葡萄糖对纤维素酶存在反馈抑制,将纤维素酶对纤维素的水解和产丁醇菌发酵生成丁醇的过程在同一容器内连续进行,使酶水解产物源源不断的被产丁醇菌利用,消除了葡萄糖对酶的抑制作用。其优点包括[13]:(1)通过转化抑制纤维素酶活性的糖,提高了水解速度,降低了酶的用量;(2)葡萄糖被提前利用产丁醇,反应时间较短,丁醇产率高;(3)酶解与发酵在同一生物反应器中进行,降低设备成本。
2.2 提取工艺的优化[38-39]
2.2.1 吸附法
吸附是一种选择性地从发酵液中分离丁醇的节能的方法。在该技术中,丁醇被吸附到合适的吸附剂表面上,并随后通过升温或使用置换器解吸附以产生浓缩丁醇溶液。吸附剂的选择要考虑吸附率、吸附容量、解吸附的难易程度、所需产物的选择性和吸附剂成本等。WIEHN M等[40]应用膨胀床吸附从ABE发酵液中吸附分离溶剂,吸附剂为大孔疏水性合成树脂,经过38.5 h得总溶剂40.7 g/L,其中正丁醇27.2 g/L,和传统的分批发酵相比,总溶剂产率提高了2.3倍,正丁醇产率提高2.2倍,运用此技术丁醇回收率达到81%。LIU D等[41]利用一种生物膜反应器结合KA-I大孔吸附树脂交联聚苯乙烯结构从发酵液中回收丁醇,溶剂生产率为1.5 g/(L·h),溶剂产量为0.33 g/g,同时也表明KA-I树脂共吸附大大提高了发酵性能。
2.2.2 气提法
气提是指选择性去除发酵液中挥发性组分的一种分离方法[42]。利用发酵产气或者喷射入惰性气体为载气,使其在动力作用下进入发酵体系并带走有机溶剂,然后冷凝回收,而循环气体再次进入反应器作为载气使用,从而达到分离目的。此法经济合理,但会受气泡大小、流速、消泡剂等因素的影响。SETLHAKU M等[42]用氮气为载气的气提装置研究C.acetobutylicumATCC 824菌株发酵性能,在发酵温度35 ℃,ABE蒸汽冷凝温度-2 ℃,气体循环速率为4.8~6.6 L/min的条件下,3次分批补料发酵溶剂含量达到72.9 g/L。
2.2.3 液-液萃取
液-液萃取是利用萃取剂提取溶解在一定溶剂混合液中特定物质的分离方法。采用萃取和发酵相结合,将代谢产物从发酵液中萃取分离出来,减轻或消除产物抑制,从而提高丁醇产率。优良的萃取剂是高效提取的关键。KURKIJARVI A等[43]以汽油为萃取剂,采用双抽提对ABE发酵液进行萃取,此法为两列萃取柱,第一列萃取出抑制微生物生长的ABE溶剂,第二列则对有毒溶剂萃取以使发酵液利于菌株生长,并使未利用的发酵液得到重新利用,固定和过滤能有效的避免菌种进入萃取柱,过程中代谢物的混合物也被用于汽油添加剂。该研究亦表明乙基叔丁基醚和甲基叔丁基醚为萃取丁醇最有效的萃取剂。
2.2.4 反渗透
反渗透是一种普遍应用于水的淡化和饮用水净化的技术,同样此技术也可用于产物的分离。在分离丁醇中聚酰胺膜被认为是最好的半透膜。DILTZ R A等[44]利用反渗透法处理厌氧发酵液,用乙醇、丁醇、丁酸、乳酸、乙二酸和乙酸6种化合物为实验品,其中丁酸、乳酸和丁醇在5 515.8 kPa下反渗效率高于99%,而乙酸,乙醇和乙二酸反渗效率为79%~92%,与单一成分反渗透相比,以发酵液为进料能提高有机成分的滞留量。
2.2.5 膜蒸馏
膜蒸馏是一种利用微孔疏水膜在不同温度下进行溶液分离的过程。膜蒸馏过程类似于常规蒸馏,需要对发酵液加热,以获得欲分离物的汽化热度。膜蒸馏基于蒸汽/液体平衡[45]。
2.2.6 渗透蒸发
渗透蒸发是一种利用膜分离技术分离液体混合物的方法。此法根据液体混合物中组分溶解与扩散性能不同,在膜两侧组分的蒸汽分压差作用下,对液体混合物进行部分蒸发,从而达到分离的目的。渗透蒸发技术的关键是选择合适的膜,以期达到最佳的分离效果。SHIN C等[46]在利用C.acetobutylicum发酵分离丁醇中,以十二烷基硫酸钠凝胶膜(sodium dodecyl sulfate,SDS)和二甲基硅氧烷(polydimethylsiloxane,PDMS)作对比,结果发现前者明显优于后者,速率由0.45 g/(L·h)提高到0.66 g/(L·h),最高达到0.94 g/(L·h)。KUJAWA J等[47]通过对丁醇水溶液渗透蒸发提取,探究了氧化铝和氧化钛陶瓷膜的表面疏水性能,对膜表面修饰,使膜改性,改性后的膜由亲水性变为疏水性,改性膜能选择性地从丁醇水溶液中分离丁醇(分离系数为2)。
2.3 工程菌株的改良
利用基因工程和代谢工程技术,解除代谢过程中可能存在的产物或者中间产物的抑制,提高菌种对丁醇的耐受性,强化丁醇生产中的关键酶,切断丙酮、乙醇的生成代谢途径,提高丁醇在溶剂中的比例。菌株改良途径可分为以下3个水平:
第一为单基因水平,即酶蛋白的表达,对生物元件(包括酶蛋白和启动子等)特性的理解还不够深入,重组蛋白表达的技术如基因拷贝数的修饰,密码子的优化,启动子的选择,核糖体的结合位点等都是异源途径的功能性表达的重要考虑因素。BOKINSKY G等[48]将纤维素酶、半纤维素酶、木聚糖酶、β-糖苷水解酶、木糖酶等相关基因导入大肠杆菌中并成功表达,发酵秸秆处理液丁醇产量达到28 mg/L。成功实现利用基因工程技术改造菌株E.coil合成生物丁醇。
第二为通路水平,即通过减少毒副作用途径来优化过程,破坏竞争过程,提高底物和辅助因子的有效性。TING C N W等[49]经特定筛选得到一菌株屎肠球菌(Enterococcus faeciumIB1),此菌为兼性厌氧型,并在厌氧条件下产丁醇等溶剂,丁醇耐受性高达2.5%~3%,异丁醇耐受性高达3%,乙醇耐受性高达10%,从而有效降低了丁醇生产过程的毒副作用。此外,要提高异源途径的性能,驱动力也是不可或缺的,脱羧反应、产物的分离和反应不可逆等驱动力有利于产物的形成。
第三为系统水平,也是最深层次的菌株改良过程,需要系统分析的高通量技术,用于确定不明显的竞争途径和超表达的相关酶的“组学”技术和芯片模型。基因组重建模型已经在许多工业微生物中得到开发,GAO X F等[50]采用基因组改组技术,以高链霉素、2-脱氧-D-葡萄糖和丁醇抗性突变株为亲本,经两轮的原生质体融合,经特定筛选获得一株高产丁醇菌株F2-GA,溶剂产量提高34.28%,丁醇产量为14.15 g/L,占总溶剂产量的63.71%。
3 展望
随着石油资源的不断减少和环境问题的日趋恶化,纤维素材料、合成气、CO2、废弃蛋白质等可替代原料发酵产生物丁醇受到更加广泛的关注与应用。这些废弃资源的利用能有效地解决能源、环境问题和废物管理问题。然而可替代资源先进的燃料生产开发还处在一个探索阶段,除了木质纤维素外,其它资源尚未得到广泛研究。在进行可替代原料生产丁醇研究过程中,现有用于研究菌种的生物丁醇合成能力低下、溶剂耐受力弱,可以考虑发掘新型生产菌株,寻找耐性更强的菌株,综合应用应用基因组学、转录组学、蛋白组学、代谢组学及生物信息学等先进分子生物学技术手段,构建发酵时间短,溶剂耐受力强,丁醇产量高的菌株;同时进一步开发经济适用的原材料预处理工艺、改善发酵方式、优化溶剂提取工艺,降低成本。相信随着丁醇高新技术研发的突破与应用,在不久的将来可再生的替代原料生物发酵产丁醇发酵会得到更全面发展。
[1]XUE C,ZHAO X Q,LIU C G.et al.Prospective and development of butanol as an advanced biofuel[J].Biotechnol Adv,2013,31(8):1575-1584.
[2]SUKUMARAN R K,SINGHANIA R R,PANDEY A.Microbial cellulases-production,applications and challenges[J].J Sci Ind Res,2005,64(11):832-844.
[3]HIGASHIDE W,LI Y,YANG Y,et al.Metabolic engineering ofClostridium cellulolyticumfor production of isobutanol from cellulose[J].Appl Environ Microbiol,2011,77(8):2727-2733.
[4]SU H F,LIU G,HE M X,et al.A biorefining process:Sequential,combinational lignocellulose pretreatment procedure for improving biobutanol production from sugarcane bagasse[J].Bioresour Technol,2015,187:149-160.
[5]YANG M,ZHANG J H,SUVI K,et al.Enhanced sugar production from pretreated barley straw by additive xylanase and surfactants in enzymatic hydrolysis for acetone-butanol-ethanol fermentation[J].Bioresour Technol,2015,189:131-137.
[6]LU C C,ZHAO J B,YANG S T,et al.Fed-batch fermentation for n-butanol production from cassava bagasse hydrolysate in a fibrous bed bioreactor with continuous gas stripping[J].Bioresour Technol,2012,104:380-387.
[7]LIU Z Y,YING Y,LI F L,et al.Butanol production byClostridium beijerinckiiATCC 55025 from wheat bran[J].J Ind Microbiol Biotechnol,2010,37(5):495-501.
[8]QURESHI N,COTTA M A,SAHA B C.Bioconversion of barley straw and corn stover to butanol (a biofuel) in integrated fermentation and simultaneous product recovery bioreactors[J].Food Bioprod Process,2014,92:298-308.
[9]WEN Z Q,WU M B,LIN Y J,et al.A novel strategy for sequential co-culture ofClostridium thermocellumandClostridium beijerinckiito produce solvents from alkali extracted corn cobs[J].Process Biochem,2014,49(11):1941-1949.
[10]RANJAN A,KHANNA S,MOHOLKAR V.Feasibility of rice straw as alternate substrate for biobutanol production[J].Appl Energ,2013,103:32-38.
[11]RASIKA L,KUDAHETTIGE N,JONAS H,et al.Biobutanol production byClostridium acetobutylicumusing xylose recovered from birch Kraft black liquor[J].Bioresour Technol,2015,176:71-79.
[12]ZHENG J,TASHIRO Y,WANG Q H,et al.Feasibility of acetone-butanol-ethanol fermentation from eucalyptus hydrolysate without nutrients supplementation[J].Appl Energ,2015,140:113-119.
[13]SASAKI C,KUSHIKI Y,ASADA C,et al.Acetone-butanol-ethanol production by separate hydrolysis and fermentation(SHF)and simultaneous saccharification and fermentation (SSF) methods using acorns and wood chips ofQuercus acutissimaas a carbon source[J].Ind Crops Prod,2014,62:286-292.
[14]KOMONKIAT I,CHEIRSILP B.Felled oil palm trunk as a renewable source for biobutanol production byClostridiumspp.[J].Bioresour Technol,2013,146:200-207.
[15]BRUANT G,LEVESQUE M J,PETER C,et al.Genomic analysis of carbon monoxide utilization and butanol production byClostridium carboxidivoransstrain P7[J].PloS One,2010,5(9):e13033.
[16]PHILLIPS J R,ATIYEH H K,TANNER R S,et al.Butanol and hexanol production inClostridium carboxidivoranssyngas fermentation:medium development and culture techniques[J].Bioresour Technol,2015,194:114-121.
[17]LIU K,ATIYEH H K,STEVENSON B S,et al.Continuous syngas fermentation for the production of ethanol,n-propanol and n-butanol[J].Bioresour Technol,2014,151:69-77.
[18]TANNER R S,MILLER L M,YANG D.Clostridium ljungdahliiSp-Nov,an acetogenic species in clostridial ribosomal-RNA homology group-I[J].Int J Syst Bacteriol,1993,43:232-236.
[19]KOPKE M,HELD C,HUJER S,et al.Clostridium ljungdahliirepresents a microbial production platform based on syngas[J].Proc Natl Acad Sci USA,2010,107:13087-13092.
[20]BAHADAR A,KHAN M B.Progress in energy from microalgae:A review[J].Renew Sust Energ Rev,2013,27:128-148.
[21]ATSUMI S,HIGASHIDE W,LIAO J C.Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde[J].Nat Biotechnol,2009,27(12):1177-1180.
[22]MACHADO I M,ATSUMI S.Cyanobacterial biofuel production[J].J Biotechnol,2012,162(1):50-56.
[23]LAN E I,LIAO J C.Metabolic engineering of cyanobacteria for 1-butanol production from carbon dioxide[J].Metab Eng,2011,13(4):353-363.
[24]ETHAN I L,JAMES C L.Metabolic engineering of cyanobacteria for 1-butanol production from carbon dioxide[J].Metab Eng,2011,13(4):335-363.
[25]BOND-WATTS B B,BELLEROSE R J,CHANG M C Y.Enzyme mechanism as a kinetic control element for designing synthetic biofuel pathways[J].Nat Chem Biol,2011,7(4):222-227.
[26]FLAMHOLZ A,NOOR E,BAR-EVEN A.et al.Equilibrator-the biochemical thermodynamics calculator[J].Nucleic Acids Res,2012,40:770-775.
[27]SHEN C R,LAN E I,DEKISHIMA Y,et al.Driving forces enable high-titer anaerobic 1-butanol synthesis inEscherichia coli[J].Appl Environ Microbiol,2011,77(9):2905-2915.
[28]LAN E I,LIAO J C.ATP drives direct photosynthetic production of 1-butanol in cyanobacteria[J].Proc Natl Acad Sci USA,2012,109(16):6018-6023.
[29]CHENG H H,WHANG L M,CHAN K C,et al.Biological butanol production from microalgae-based biodiesel residues byClostridium acetobutylicum[J].Bioresour Technol,2015,184:379-385.
[30]NEVIN K P,HENSLEY S A,FRANKS A E,et al.Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic microorganisms[J].Appl Environ Microbiol,2011,77(9):2882-2886.
[31]LI H,OPGENORTH P H,WERNICK D G,et al.Integrated electromicrobial conversion of CO2to higher alcohols[J].Science,2012,335(6076):1596.
[32]KANG P,CHENG C,CHEN Z F,et al.Selective electrocatalytic reduction of CO2to formate by water-stable iridium dihydride pincer complexes[J].J Am Chem Soc,2012,134(12):5500-5503.
[33]HUO Y X,CHO K M,RIVERA J G L,et al.Conversion of proteins into biofuels by engineering nitrogen flux[J].Nat Biotechnol,2011,29:346-351.
[34]CHOIA K Y,WERNICKA D G,TATA C A,et al.Consolidated conver-sion of protein waste into biofuels and ammonia usingBacillus subtilis[J].Metab Eng,2014,23:56-61.
[35]ANGENENT L,QURESHI N.New techniques create butanol a superior biofuel[EB/OL].(2008-01-28) [2008-10-7].Http//www.sciencedaily.com/releases/2008/01/080123153142.html.
[36]EFREMENKO E,NIKOLSKAYA A,LAYGIN L,et al.Production of biofuels from pretreated microalgae biomass by anaerobic fermentation withimmobilizedClostridiumacetobutylicumcells[J].Bioresour Technol,2012,114:342-348.
[37]QURESHI N,BADAL C,COTTA M A.Butanol Produetion from wheat straw hydrolysate usingClostridium beijerinckii[J].Bioprocess Biosyst Eng,2007,30(6):419-427.
[38]KUJAWSKA A,KUJAWSKI J,Bryjak M,et al.ABE fermentation products recovery methods—A review[J].Renew Sust Energ Rev,2015,48:648-661.
[39]ABDEHAGH N,TEZEL F H,THIBAULT J.Separation techniques in butanol production:Challenges and developments [J].Biomass Bioenergy,2014,60:222-246.
[40]WIEHN M,STAGGS K,WANG Y C,et al.In situ butanol recovery fromClostridium acetobutylicumfermentations by expanded bed adsorption[J].Biotechnol Prog,2014,30(1):68-78.
[41]LIU D,CHEN Y,DING F Y,et al.Biobutanol production in aClostridium acetobutylicumbiofilm reactor integrated with simultaneous product recovery by adsorption[J].Biotechnol Biofuels,2014,7(1):5.
[42]SETLHAKU M,HEITMANN S,GORAK A,et al.Investigation of gas stripping and pervaporation for improved feasibility of two-stage butanol production process[J].Bioresour Technol,2013,136:102-108.
[43]KURKIJARVI A,LETHONEN J.Dual extraction process for the utilization of an acetone-butanol-ethanol mixture in gasoline[J].Ind Eng Chem Res,2014,53(31):12379-12386.
[44]DILTZ R A,MAROLLA T V,HENLEY M V,et al.Reverse osmosis processing of organic model compounds and fermentation broths[J].Bioresour Technol,2007,98(3):686-695.
[45]KHAYETHAYET M.Membranes and theoretical modeling of membrane distillation:a review[J].Adv Colloid Interface Sci,2011,164(1-2):56-88.
[46]SHIN C,BAER Z C,CHEN X C,et al.Block copolymer pervaporation membrane for in situ product removal during acetone-butanol-ethanol fermentation[J].J Membr Sci,2015,484:57-63.
[47]KUJAWA J,CERNEAUX S,KUJAWSKI W.Removal of hazardous volatile organic compounds from water by vacuum pervaporation with hydrophobic ceramic membranes[J].J Membr Sci,2015,474:11-19.
[48]BOKINSKY G,PERALTA-YAHYA P P,GEORGE A,et al.Synthesis of three advanced biofuels from ionic liquid-pretreated switchgrass using engineeredEscherichia coli[J].Proc Natl Acad Sci USA,2011,108(50):19949-19954.
[49]TING C N W,WU J C,TAKAHASHI K,et al.Screened butanol-tolerant enterococcus faecium capable of butanol production[J].Appl Biochem Biotechnol,2012,168(6):1672-1680.
[50]GAO X F,ZHAO H,ZHANG G H,et al.Genome shuffling ofClostridium acetobutylicumCICC 8012 for improved production of acetone-butanol-ethanol(ABE)[J].Curr Microbiol,2012,65(2):128-132.
