黄酒酵母的改良及对产物中尿素和氨基甲酸乙酯含量的影响
2015-04-12方逸群郑校先霍克克
方逸群,倪 斌,郑校先,霍克克*
(1.复旦大学 生命科学院,上海 200433;2.上海金枫酒业股份有限公司,上海 200051)
氨基甲酸乙酯(ethyl carbamate,EC)具有遗传毒性和致癌性,是发酵食品中普遍存在的代谢产物,是在酒类的生产加工过程中产生的,广泛存在于发酵酒如葡萄酒、黄酒等产品中[1]。2007年国际癌症研究机构(international agency for research on cancer,IARC)将EC列入Group 2A组,是人类可能的致癌物。联合国粮农组织和世界卫生组织下的食品添加剂联合专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)对所有食品EC污染物开展的系统风险评估研究表明,EC的食品安全风险主要源于高EC含量酒精饮料,建议世界各国采取预防措施降低饮料酒中氨基甲酸乙酯含量。国际权威组织机构已经明确建议降低酒精饮料中氨基甲酸乙酯含量并将其作为食品法典修订的参考依据。因此,目前EC及其前体代谢物质的生成机制已成为食品行业的研究热点。
作为我国传统发酵酒类,黄酒中EC含量普遍高于国际通畅性酒种。尿素是生成EC的重要前体物质,经酵母代谢可生成氨基甲酸乙酯。尿素普遍存在于发酵食品的原料及生产过程中。黄酒中大部分的EC由尿素与乙醇反应生成。黄酒中富含各种氨基酸,研究表明L-精氨酸等是尿素的主要前体。黄酒酿造过程中,酒体中的精氨酸在精氨酸酶作用下代谢形成尿素,尿素与乙醇反应最终形成EC[2-6]。因此,控制黄酒酵母发酵过程中尿素的生成是黄酒中EC预防控制措施最为关键的手段之一。
除控制原料中不慎带入的少量尿素外,降低黄酒中尿素含量的方法主要有:添加脲酶降解尿素,从而降低EC含量[7-8];自然突变、诱变、杂交等方法的菌种选育[9];基因敲除或基因过表达的工程菌构建[10-15]。本研究以黄酒酵母JF501为出发菌种,通过比较紫外诱变和基因过表达两种不同的改良方法,获得低产尿素的酵母菌种,进而降低了产品中氨基甲酸乙酯的含量。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌种
14°Bx米曲汁发酵液:上海石库门酿酒有限公司;TaqDNA聚合酶、胶回收试剂盒、PCR纯化试剂盒、抽质粒试剂盒、内切酶、DNA Marker:大连Takara公司;
黄酒酵母JF501:上海石库门酿酒有限公司;大肠埃希氏菌(Escherichia coli)Top10、pYX212质粒:上海石库门酿酒有限公司实验室保存。
1.1.2 培养基
酵母浸出粉胨葡萄糖琼脂培养基(yeast peptone dextrose,YPD):2%蛋白胨、1%酵母粉、2%葡萄糖、2%琼脂。
初筛培养基采用刀豆氨酸-精氨酸-鸟氨酸培养基(canavanine arginine ornithine,CAO):0.17%酵母碳源基础(yeast carbonbase,YCB)培养基(不含氮)、刀豆氨酸10 mg/L、精氨酸1 mmol/L、鸟氨酸5 mmol/L、2%葡萄糖、2%琼脂。
复筛培养基采用(1)精氨酸培养基(arginine medium,AM):0.17%YCB培养基(不含氮)、精氨酸5 mmol/L、2%葡萄糖、2%琼脂;(2)鸟氨酸培养基(ornithine medium,OM):0.17%YCB培养基(酵母碳源基础,不含氮)、鸟氨酸5 mmol/L、2%葡萄糖、2%琼脂。
Luria-Bertani(LB)培养基:0.5%酵母粉、1%蛋白胨、1%氯化钠(固体培养基加2%琼脂)。
1.1.3 主要化学试剂及溶液的配制
醋酸锂、氢氧化钠、氯化钠、磷酸、硫酸、二乙酰一肟、氨基硫脲(均为分析纯)、EC标准品(优级纯):上海虹口东风化学试剂有限公司。
酸铁溶液的配制:100 mL磷酸和300 mL硫酸,加到含有0.1 g三氯化铁的600 mL蒸馏水中。
二乙酰一肟溶液的配制:称取二乙酰一肟0.900 g,溶于80 ℃左右的蒸馏水中,定容至50 mL棕色容量瓶中。
氨基硫脲溶液的配制:称取氨基硫脲0.030 g,溶于80 ℃左右的蒸馏水中,定容至50 mL棕色容量瓶中。
尿素检测显色剂的配制:临用前取二乙酰一肟溶液∶氨基硫脲(1∶1,V/V)混匀,2 h内有效。
尿素标准储备液的配制:称取尿素0.100 g,用蒸馏水溶解,定容至100 mL容量瓶中,尿素标准储备液质量浓度为1 000 μg/mL。
尿素标准使用液:分别移取质量浓度为1 000 μg/mL尿素标准储备液1.0 mL、2.5 mL、5.0 mL、7.5 mL、10.0 mL,分别定容至100 mL容量瓶中,尿素标准使用质量浓度分别为10 μg/mL、25 μg/mL、50 μg/mL、75 μg/mL、100 μg/mL。
1.2 仪器与设备
DNP-9272生化培养箱:上海精宏实验设备有限公司;BS210S电子天平:北京赛多利斯天平有限公司;PTC-200型聚合酶链反应(polymerase chain reaction,PCR)仪:美国MJ Research公司;FR-250型电泳仪:上海复日科技有限公司;UV-2102紫外可见光分光光度计:尤尼柯(上海)仪器有限公司;2695高效液液相色谱仪:沃特世科技(上海)有限公司;5975C气相色谱仪、6890N质谱仪、萃取头为65 μm PDMS/DVB固相微萃取:美国安捷伦科技有限公司。
1.3 试验方法
1.3.1 菌种改良方法
(1)紫外诱变
对出发菌种黄酒酵母JF501分别进行不同时长的紫外照射,照射距离30 cm,诱变时间0.5 min、1.0 min、2.0 min、3.0 min、4.0 min、5.0 min。诱变后进行恢复培养,并使用CAO培养基为初筛培养基,精氨酸培养基(AM)及鸟氨酸培养基(OM)为复筛培养基,在AM上不生长而在OM上生长的酵母菌株即可判断为目的菌株:精氨酸酶缺陷型酵母菌株。目标菌株在发酵过程中无法分解精氨酸产生尿素,从而降低了产品中尿素的含量,进一步能降低EC的含量[16]。紫外诱变的筛选原理如图1所示。诱变率、致死率计算公式如下:

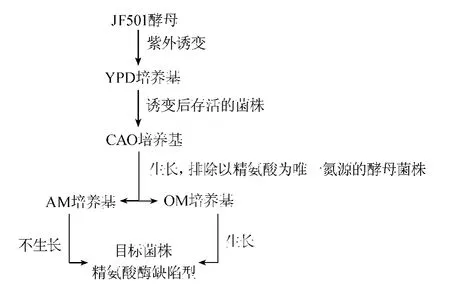
图1 紫外诱变筛选示意图Fig.1 Diagram of UV-induced mutagenesis
(2)黄酒酵母转化子的筛选、鉴定
构建含有脲基酰胺酶基因编码框的重组表达载体pYX212-DUR1,2及含抗生素标记的共转载体pYX212-Sh ble的重组酵母菌株,通过质粒共转的方式(醋酸锂法)将其转入出发菌株JF501,并使用含有抗生素博莱霉素(zeocin)的选择性完全培养基(YPD)进行筛选,聚合酶链式反应(PCR)鉴定阳性转化子,获得目标菌株[17-18]。表1列出主要引物序列,其中引物1、2用于构建表达载体,引物3、4用于构建共转载体,引物5、2用于鉴定阳性转化子。
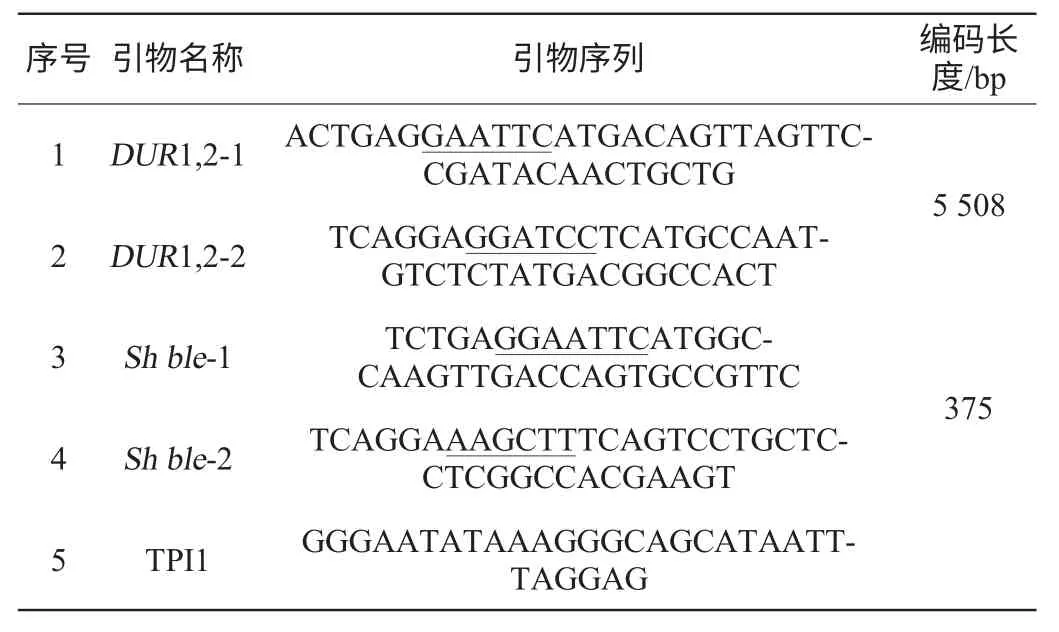
表1 构建载体的主要引物序列Table 1 Primers sequences for carrier establishment
1.3.2 发酵试验方法
(1)发酵性能试验
将菌株于米曲汁琼脂斜面上划线30 ℃培养24 h进行活化;取活化后菌种一环接入14°Bx的米曲汁发酵液中,30 ℃培养24 h,并将该酵母种子液浓度调整至107个/mL;将种子液接种至14°Bx的三角瓶米曲汁发酵液中,30 ℃恒温培养,每24 h称质量一次,当质量损失<0.2 g/d时,认为发酵结束。
(2)发酵酿酒试验
分别采用获得的改造菌株与出发菌株进行黄酒的发酵试验。将目的菌株活化制成酒母,按表2比例投料,进行模拟发酵酿酒试验。投料温度控制在28 ℃,经过前发酵、后发酵、压榨、煎酒后获得黄酒产品。

表2 酿酒试验的投料比例Table 2 Formula of wine fermentation tests
1.3.3 分析检测
(1)黄酒常规理化指标检测
参照国家标准GB/T 13662—2008《黄酒》中的方法,测定黄酒的酒精度、总糖、总酸、氨基酸态氮、β-苯乙醇等理化指标。
(2)精氨酸含量的检测
参照行业标准QB/T 4356—2012《黄酒中游离氨基酸的测定高效液相色谱法》中的方法,测定黄酒中精氨酸含量。
(3)尿素含量的检测
采用分光光度计法测定尿素含量。取不同质量浓度的尿素标准使用液200 μL于试管中,再分别加入3 mL酸铁溶液和1 mL显色剂,盖上塞子摇匀。置于沸水浴中反应15 min,取出后冰水迅速冷却3 min,并用蒸馏水定容至10 mL,摇匀。在波长525 nm处测定其吸光度值,绘制尿素标准曲线[19]。
样品按相同处理后进行测定,以标准曲线回归方程计算样品中尿素含量。
(4)EC含量的检测[20]
吸取100 mL不同质量浓度的EC标准溶液(20 μg/L,50 μg/L、100 μg/L、200 μg/L)于三角瓶中,加入1.5 mL、300 g/L的NaOH溶液,混匀;吸取5 mL上述溶液,加入2 g NaCl,混匀;采用固相微萃取(solid phase micro-extraction,SPME)于70 ℃顶空吸附15 min;240 ℃下解析1 min,气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS)进行EC含量分析检测。
气相色谱(GC)条件:毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度220 ℃;升温程序:初始温度35 ℃(0 min),以5 ℃/min升至80 ℃,再以15 ℃/min升至110 ℃;进样方式:分流进样(分流比60∶1);载气:高纯氦气(纯度99.999%)、载气流速1.0 mL/min。
质谱(MS)条件:电子电离(electron ionization,EI)源,离子源温度250 ℃,电子能量70 eV,接口温度230 ℃,电子倍增器电压1 568 V,检测离子m/z 62、74、89,定量离子m/z 62,同时m/z 50~200全扫描进行验证。
使用SPME固相微萃取前处理方法,结合GC/MS外标法检测黄酒中EC含量。
2 结果与分析
2.1 尿素标准曲线
以尿素质量浓度为(x)横坐标,吸光度值(y)为纵坐标,绘制尿素标准曲线,结果见图2。
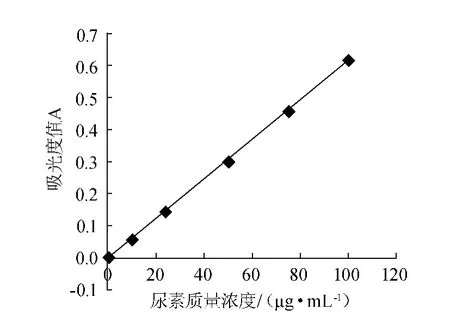
图2 尿素标准曲线Fig.2 Standard curve of urea
由图2可知,标准曲线回归方程为y=0.006 2x-0.007 5,相关系数R2=0.999 1,表明尿素质量浓度和吸光度值在10~100 μg/mL 的质量浓度范围内呈良好的线性关系,因此,该标准曲线满足黄酒中尿素含量的测定要求。
2.2 目标菌株的获得
2.2.1 紫外诱变
以黄酒酵母JF501为出发菌株,进行不同时间的紫外诱变,经过培养基筛选,选出精氨酸酶缺陷型酵母代表菌株,不同诱变时间的紫外诱变结果见表3。
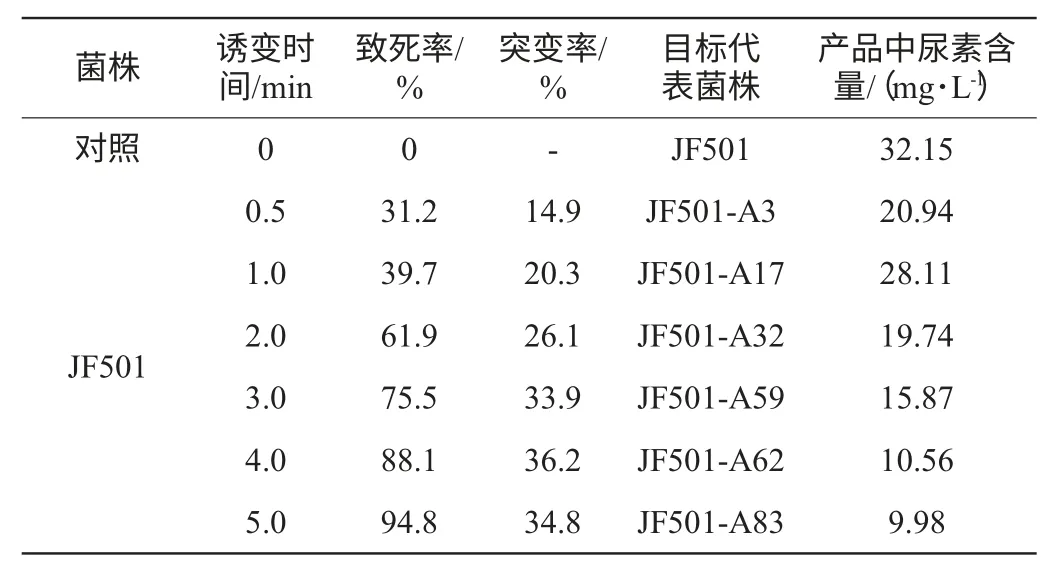
表3 不同诱变时间的紫外诱变结果Table 3 Ultraviolet mutagenic results with different mutagenesis time
由表3可知,根据目标菌株酿酒试验获得的产品中尿素含量,经过紫外诱变,经过初筛和复筛后获得6株菌,发酵产品中尿素的含量均低于对照组,说明紫外诱变获得了低产尿素的菌株。比较表3的结果,诱变时间在0.5~5.0 min时,随着诱变时间的增加,致死率升高、突变率提高(其中诱变时间4.0 min时突变率最高)、产品中尿素含量减少(其中诱变时间5.0 min时尿素含量最低);诱变时间>5.0 min(数据未列出)致死率进一步升高,但突变率和尿素含量变化不明显。因此紫外诱变时间在4.0 min及5.0 min为宜,选择JF501-A62、JF501-A83进行发酵性能试验。
2.2.2 发酵性能试验
黄酒酵母的发酵度是重要的发酵特性之一,它反映了酵母对糖的利用能力。黄酒酵母菌发酵米曲汁时释放CO2,使发酵液质量损失。因此根据发酵液的质量损失速率可以大致了解其发酵速率。将诱变菌株JF501-A62、JF501-A83进行发酵性能试验,并测定发酵144 h的理化指标,结果见图3和表4。
由图3可知,诱变菌株JF501-A62的发酵速率达到与出发菌株相近的水平,而JF501-A83发酵速率初期缓慢,后期逐步慢提升至与出发菌株相近的水平,说明JF501-A62发酵速率与出发菌株更相近、更能符合发酵需求,而JF501-A83初期发酵缓慢,容易使酒体寡淡无味,因此在发酵性能方面JF501-A62更优。
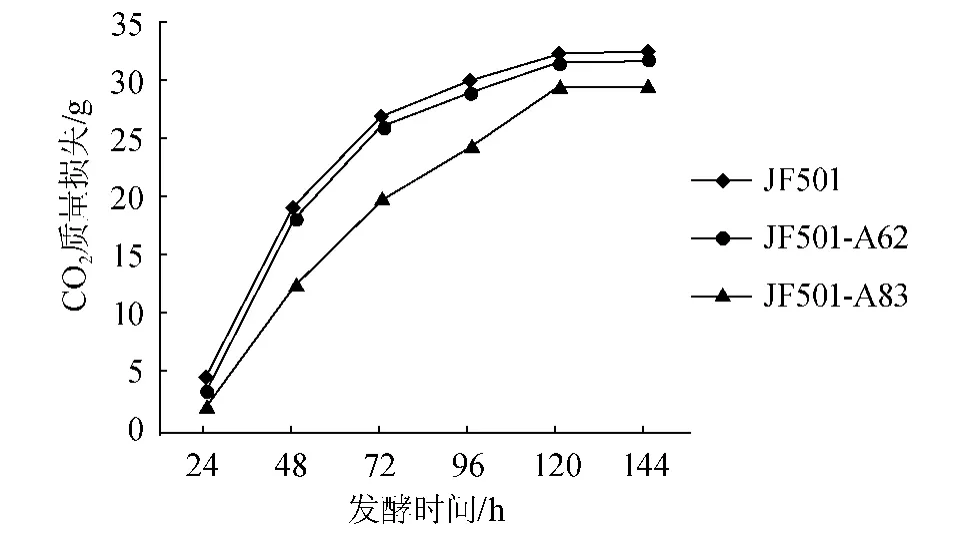
图3 紫外诱变菌种发酵速率曲线Fig.3 Fermentation rate curve of strains generated by UV-induced mutagenesis
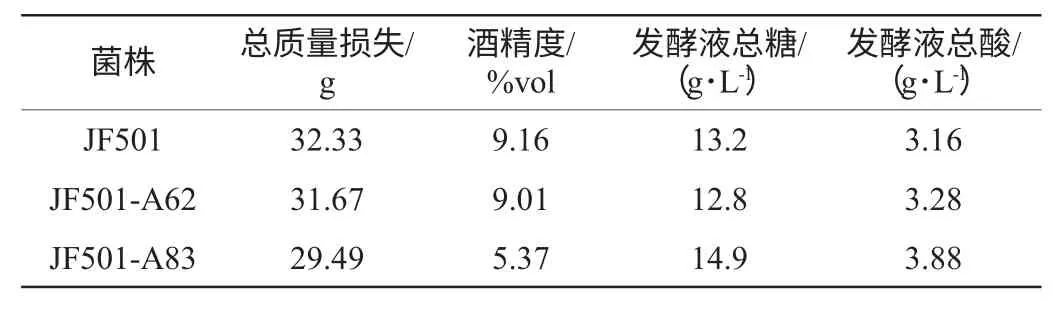
表4 紫外诱变菌株发酵性能试验结果Table 4 Results of fermentation performance test of strains generated by UV-induced mutagenesis
由表4可知,与JF501相比,诱变菌株的总质量损失、总糖含量及总酸含量基本不变,JF501-A62的酒精度与出发菌种相近,但JF501-A83的产酒精能力大大下降,酒精度仅为5.37%vol,无法满足酿酒需求。因此综合发酵速率及各项理化指标的对比,选择诱变菌株JF501-A62为紫外诱变的最佳目标菌株。
2.2.3 黄酒酵母转化子的筛选、鉴定
构建重组表达载体pYX212-DUR1,2及含抗生素标记的共转载体pYX212-Sh ble的重组酵母菌株,通过质粒共转的方式(醋酸锂法)将其转入出发菌株JF501,并使用含有抗生素博莱霉素(zeocin)的选择性完全培养基(YPD)进行筛选,聚合酶链式反应(PCR)鉴定阳性转化子,结果如图4所示。
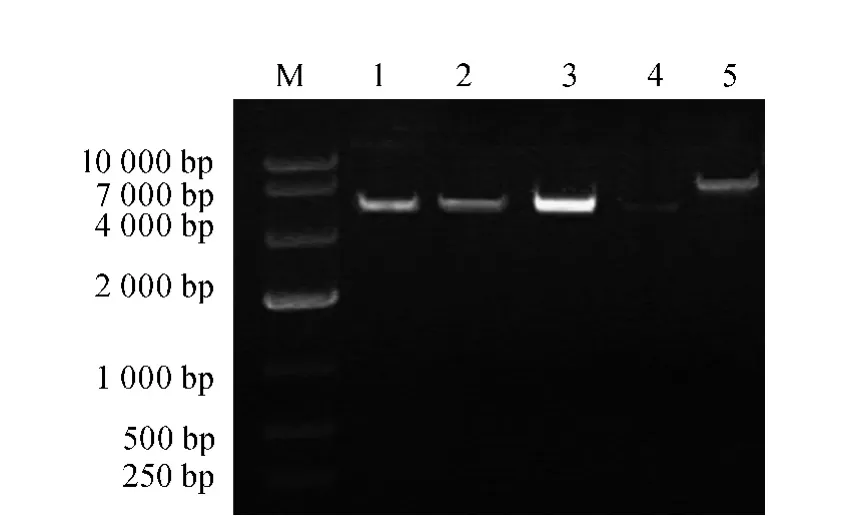
图4 酵母转化子的PCR鉴定Fig.4 PCR identification of yeast transformants
由图4可知,1-4为筛选到含有DUR1,2基因的菌株,PCR得到引物5、2扩增的条带大小为5.5 kb,但未含有启动子TPI1;5为PCR得到引物5、2扩增出来的条带,说明启动子TPI1及DUR1,2已同时整合到酵母中。因此5为1株DUR1,2过表达酵母菌种,命名为JF501-B5。
对目的菌株进行发酵试验,发酵时间为144 h,检测发酵液的各种理化指标,结果如图5及表5所示。由图5可知,JF501-B5在发酵初期发酵速率比出发菌株快,后期与出发菌株持平,说明菌株JF501-B5发酵速率与出发菌株相近、可以满足发酵需求。
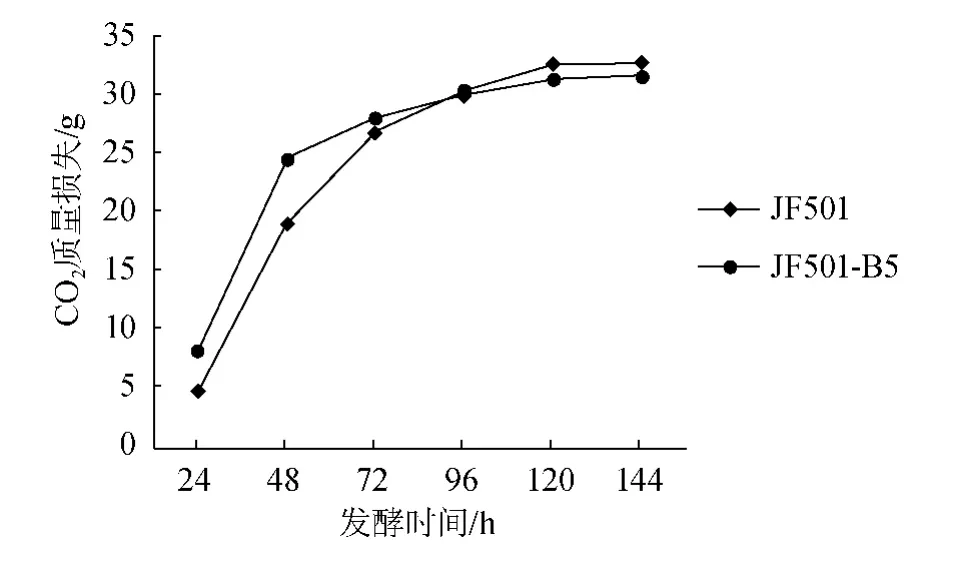
图5 基因过表达菌种发酵速率曲线Fig.5 Fermentation rate curve of strains generated by gene over-expression
由表5可知,目标菌株发酵液的总质量损失、总糖、总酸和酒精度与出发菌株发酵液的无明显差异,且产品中尿素含量大大降低,由32.15 mg/L降至3.84 mg/L,因此可判定JF501-B5能够正常发酵,为基因过表达的目标菌株。
2.3 改良菌株进行酿酒试验获得的产品指标比较
将JF501-A62、JF501-B5和JF501作为酒母菌种,对发酵后的黄酒进行常规理化指标测定,结果见表6;精氨酸、尿素及EC含量的测定,结果见表7。
由表6可知,2株菌株均正常发酵,获得黄酒产品。与出发菌株相比,改造菌株酿造的黄酒在出酒率、酒精度、总糖、总酸、氨基酸态氮和β-苯乙醇没有明显的差异,且各发酵产物指标均符合国家标准GB/T 13662—2008《黄酒》的要求。
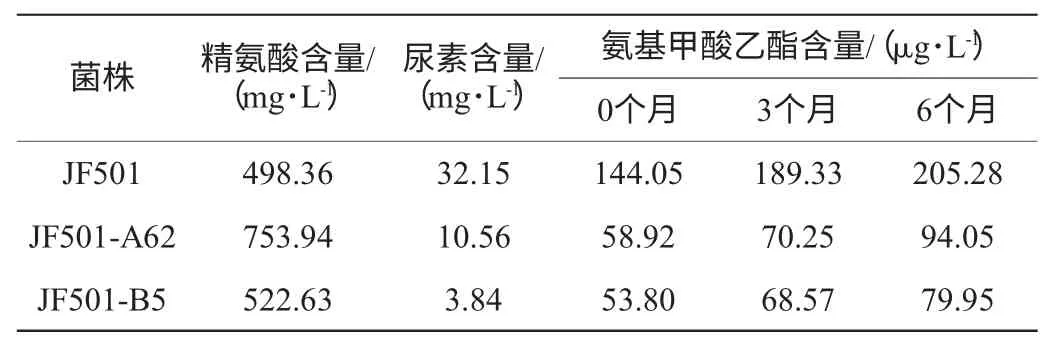
表7 出发菌株与目标菌株酿酒产品精氨酸、尿素、EC含量的比较Table 7 Comparison of arginine,urea and EC in Chinese rice wine fermented by original strain and target strain
由表7可知,与出发菌株相比,JF501-A62由于是精氨酸酶缺陷型,精氨酸无法正常代谢生成尿素,因此产品中累积较多的精氨酸含量;JF501-B5发酵产品中精氨酸含量则与出发菌株基本持平,而两者产品中尿素和EC含量均有显著降低,JF501-A62发酵产物尿素含量降低了67%,EC含量降低了59%;JF501-B5发酵产物尿素含量降低了88%,EC含量降低了63%。经过6个月贮存期,3个产品中的氨基甲酸乙酯含量都有所增加,但JF501-B5发酵产品中的氨基甲酸乙酯含量始终最低,且增加量最少。说明JF501-B5在降低产品中尿素、EC含量方面更优,是最佳目的菌株。
3 结论
本研究通过紫外诱变和基因重组试验,筛选获得2株改良黄酒酵母菌种,即紫外诱变菌株JF501-A62和基因过表达菌株JF501-B5。经过改良菌种发酵获得黄酒产品及对其理化指标进行检测可知,与出发菌株相比,改造菌株酿造的发酵性能和黄酒的出酒率、酒精度、总糖、总酸、氨基酸态氮和β-苯乙醇没有明显的差异。而诱变菌株JF501-A62发酵产物尿素含量降低了67%,EC含量降低了59%;基因过表达菌株JF501-B5发酵产物尿素含量降低了88%,EC含量降低了63%。两者均有很好的发酵性能,并取得了较好地降低产品中尿素含量、进而降低氨基甲酸乙酯含量的效果。与紫外诱变相比,基因过表达的改良方法获得了尿素含量更低的菌株,并在一段时间的贮存期之后产品中的氨基甲酸乙酯含量更低。这一菌株改良方法能有效降低黄酒中EC的含量,为解决黄酒行业中存在的由氨基甲酸乙酯造成的潜在食品安全问题打下扎实基础。
[1]WEBER J V,SHARYPOV V I.Ethyl carbamate in foods and beverages:a review[J].Environ Chem Lett,2009,7(3):233-247.
[2]BELTRAN G,NOVO M,ROZÈS N,et al.Nitrogen catabolite repression inSaccharomyces cerevisiaeduring wine fermentations[J].Feder Eur Microbiol Soc Yeast Res,2004,4(6):625-632.
[3]ZHAO X R,ZOU H J,FU J W,et al.Nitrogen regulation involved in the accumulationof ureainSaccharomycescerevisiae[J].Yeast,2013,30(11):437-447.
[4]王 宾,杨 勇.传统黄酒发酵过程中精氨酸、瓜氨酸、鸟氨酸浓度变化规律的研究[J].酿酒,2013,40(1):57-60.
[5]孙双鸽,白卫东,钱 敏,等.从黄酒的酿造工艺上探讨氨基甲酸乙酯[J].中国酿造,2013,32(12):9-13.
[6]罗苏仅,白卫东,赵文红,等.发酵酒中氨基甲酸乙酯形成的代谢途径及控制[J].中国酿造,2013,32(9):9-12.
[7]周建弟,丁关海,郑志强.酸性脲酶分解黄酒中尿素特性的研究[J].中国酿造,2006,25(11):45-47.
[8]王松华,田亚平.产酸性脲酶菌株的筛选、鉴定及其脲酶的应用初探[J].生物技术通报,2008,24(6):175-178.
[9]马力辉,孙 辉,齐明君,等.酶电极法测定发酵酒中尿素含量[J].现代食品科技,2013,29(9):223-226,281.
[10]GENBAUFFE F S,COOPER T G.Induction and repression of the urea amidolyase gene inSaccharomyces cerevisiae[J].Mol Cell Biol,1986,6(11):3954-3964.
[11]方若思,董亚晨,徐腾洋,等.精氨酸代谢酶对传统黄酒发酵氨基甲酸乙酯产生的调控作用[J].浙江大学学报,2013,39(2):203-208.
[12]KATSUHIKO K,ODA K,GOMI K,et al.Genetic engineering of a sake yeast producing no urea by successive disruption of arginase gene[J].Appl Environ Microbiol,1991,57(1):301-306.
[13]COULON J,HUSNIK J I,INGLIS D L.Metabolic engineering ofSaccharomyces cerevisiaeto minimize the production of ethyl carbamate in wine[J].Am J Enol Viticult,2006,57(2):113-124.
[14]DAHABIEH M S,HUSNIK J I,VUUREN H J J.Functional enhancement of Sake yeast strains to minimize the production of ethyl carbamate in Sake wine[J].J Appl Microbiol,2010,109:963-973.
[15]赵然然,陆 健,谢广发.基于PCR 方法敲除黄酒酵母精氨酸酶基因的工程菌构建[J].食品工业科技,2012,33(17):159-162.
[16]王晓娟.低产尿素黄酒酵母的选育及黄酒发酵工艺研究[D].乌鲁木齐:新疆农业大学硕士论文,2009.
[17]江南大学.低尿素工业黄酒酵母代谢工程菌及其构建方法:中国,201310728796.8[P].2014.04.09.
[18]朱旭亚,陆 健,谢广发.脲基酰胺酶基因在黄酒酵母中的整合型表达[J].食品工业科技,2012,33(17):173-183.
[19]王立媛,冯 靓,吴平谷,等.分光光度法测定黄酒中尿素含量[J].中国卫生检验杂志,2010,20(11):3059-3061.
[20]钟其顶,姚 亮,熊正河.采用GC/MS 和HPLC-FLD2 种方法测定黄酒中的EC 含量[J].食品与发酵工业,2007,33(3):115-119.
