不同来源前列腺基质细胞对前列腺癌细胞IGF-1和p-AKT表达的影响
2015-04-07倪少滨赵忠山焦治兴
倪少滨,刘 迪,赵忠山, 麻 立, 焦治兴
(哈尔滨医科大学附属第一医院泌尿外科,黑龙江哈尔滨 150001)
·基础研究·
不同来源前列腺基质细胞对前列腺癌细胞IGF-1和p-AKT表达的影响
倪少滨,刘 迪,赵忠山, 麻 立, 焦治兴
(哈尔滨医科大学附属第一医院泌尿外科,黑龙江哈尔滨 150001)
目的 探讨胰岛素样生长因子在前列腺癌肿瘤-基质交互作用中的地位及其作用机制。方法 将前列腺癌旁基质细胞和良性前列腺基质细胞分别与前列腺癌细胞系PC-3细胞分隔共培养(并设空白对照),之后检测前列腺癌细胞中IGF-1 mRNA (半定量RT-PCR)和p-AKT蛋白表达(Western blot)。结果 与空白对照组相比较,癌旁基质细胞共培养组IGF-1 mRNA表达有所上调、p-AKT蛋白表达有所上调,但无统计学意义(P>0.05);良性基质细胞共培养组IGF-1 mRNA和p-AKT蛋白表达显著下调(P<0.05)。相关性分析显示各组前列腺癌细胞IGF-1 mRNA与p-AKT蛋白表达呈正相关。结论 良性前列腺基质细胞通过水溶性因子抑制前列腺癌细胞中IGF-1及其下游因子表达,前列腺癌旁基质细胞则丧失了该抑制作用。
前列腺癌;胰岛素样生长因子;基质细胞
前列腺癌为欧美男性发病率最高的恶性肿瘤,在我国发病也逐年上升。近年来的研究成果显示细胞信号转导系统异常在肿瘤发生中有重要地位,该系统作为肿瘤治疗靶点的潜力也日趋明朗。针对细胞信号转导系统的药物,也成为了当前抗肿瘤药物开发的重要方向。为了明确胰岛素样生长因子(insulin-like growth factor,IGF)在前列腺癌肿瘤-基质交互作用的地位及其作用机制,我们检测了前列腺癌肿瘤-基质共培养条件下PC-3前列腺癌细胞中IGF-1及其下游癌相关基因表达。
1 材料与方法
1.1 材料
1.1.1 细胞 前列腺癌细胞:非雄激素依赖性前列腺癌细胞系PC-3。前列腺基质细胞:前列腺癌基质细胞分离自前列腺癌根治手术标本;良性前列腺基质细胞分离自膀胱癌根治手术标本。
1.1.2 主要试剂和材料 RPMI 1640 培养基(Gibco)、小牛血清(Gibco)、WAJC 培养基(Gibco)、插入杯(Sigma)、RT-PCR试剂盒(Promab)、引物(上海生工)、Western blotting 试剂盒(PIERCE)、兔抗人多克隆抗体p-AKT(CST)、羊抗兔HRP-conjugated(PIRECE)。
1.2 方法
1.2.1 前列腺基质细胞原代培养 取手术切除正常前列腺/前列腺癌组织标本,Ⅰ型胶原酶消化,得基质细胞置入含5%小牛血清(体积分数)的RPMI1640培养液,4℃保存,病理证实后继续培养。
1.2.2 上皮/基质细胞共培养 取PC-3细胞和单独培养14d后的原代间质细胞,消化脱壁,用上皮/间质细胞混合培养液(等容积混合)重悬并计数后,上皮细胞以20×103个细胞/孔接种至6孔板;间质细胞以4×103个细胞/ 孔接种至插入杯。2 h培养使细胞充分沉降后,将含有间质细胞的插入杯移到培养孔内进行共培养,设置插入杯内没有细胞而其他条件完全相同的培养板为共培养空白对照组,每组8孔,每3 d 换液1次,共培养12 d。
1.2.3 半定量RT-PCR检测IGF-1 mRNA表达 mRNA引物设计如表1。操作过程及其他参数略。
表1 mRNA引物序列设计

目的基因片段长度(bp)引物序列IGF-1171上游:5-GATCTAAGGAGGCTGGAGAT-3;下游:5-AGGGTCTTCCTACATCCTGT-3 GAPDH450上游:5-ACCACAGTCCATGCCATCAC-3;下游:5-TCCACCACCCTGTTGCTGTA-3
1.2.4 Western blot检测p-AKT蛋白表达 孔板中的贴壁细胞PBS洗涤后转移到EP管,离心弃上清,加入细胞裂解液裂解后取上清-20℃储存。上样,80 V电泳积聚蛋白,100 V分离蛋白并转膜,TBS-T封闭1 h。加一抗4℃孵育过夜后,洗膜5 min×3次,在加二抗室温下孵育1 h,洗膜5 min×3次,加入ECL化学发光显示剂在室温下反应1 min后,X光片曝光、定影、显影。选择β-actin作内参照。
1.2.5 统计学分析 所有数据经SPSS 10.0统计软件处理。组间比较采用方差分析、Dunnet’t检验,相关性检验采用直线相关分析。P<0.05为差异有显著性意义。
2 结 果
2.1 前列腺基质细胞原代培养显微镜下观察,约于培养开始72 h后始有细胞贴壁,20~24 d达到80%~85%融合,需要传代。此时平滑肌细胞呈典型长梭状,核/浆比例较大,细胞堆积呈“峰与谷”特征。传代后生长速度稍加快,约每12 d传代1次。
2.2 IGF-1 mRNA表达检测用凝胶图像分析仪分析电泳结果,各组IGF-1 mRNA表达比值(IGF-1/GAPDH)见表2。统计学分析显示,与空白对照组相比较,癌旁基质细胞共培养组IGF-1 mRNA表达有所上调,但无统计学意义(P>0.05);正常基质细胞共培养组IGF-1 mRNA表达显著下调(P<0.05)。
2.3 p-AKT蛋白表达实验结果见图1。利用Quantity One软件分析,各组p-AKT与内参照β-actin的比值见表2。统计学分析显示,与空白对照组相比较,癌旁基质细胞共培养组p-AKT蛋白表达有所上调,但无统计学意义(P>0.05);正常基质细胞共培养组p-AKT蛋白表达显著下调(P<0.05)。
表2 PC-3细胞中IGF-1 mRNA和p-AKT蛋白表达

组别nIGF-1表达比值p-AKT比值空白对照组80.513±0.0340.692±0.081良性基质细胞共培养组80.322±0.0510.557±0.079癌旁基质细胞共培养组80.581±0.0210.707±0.066
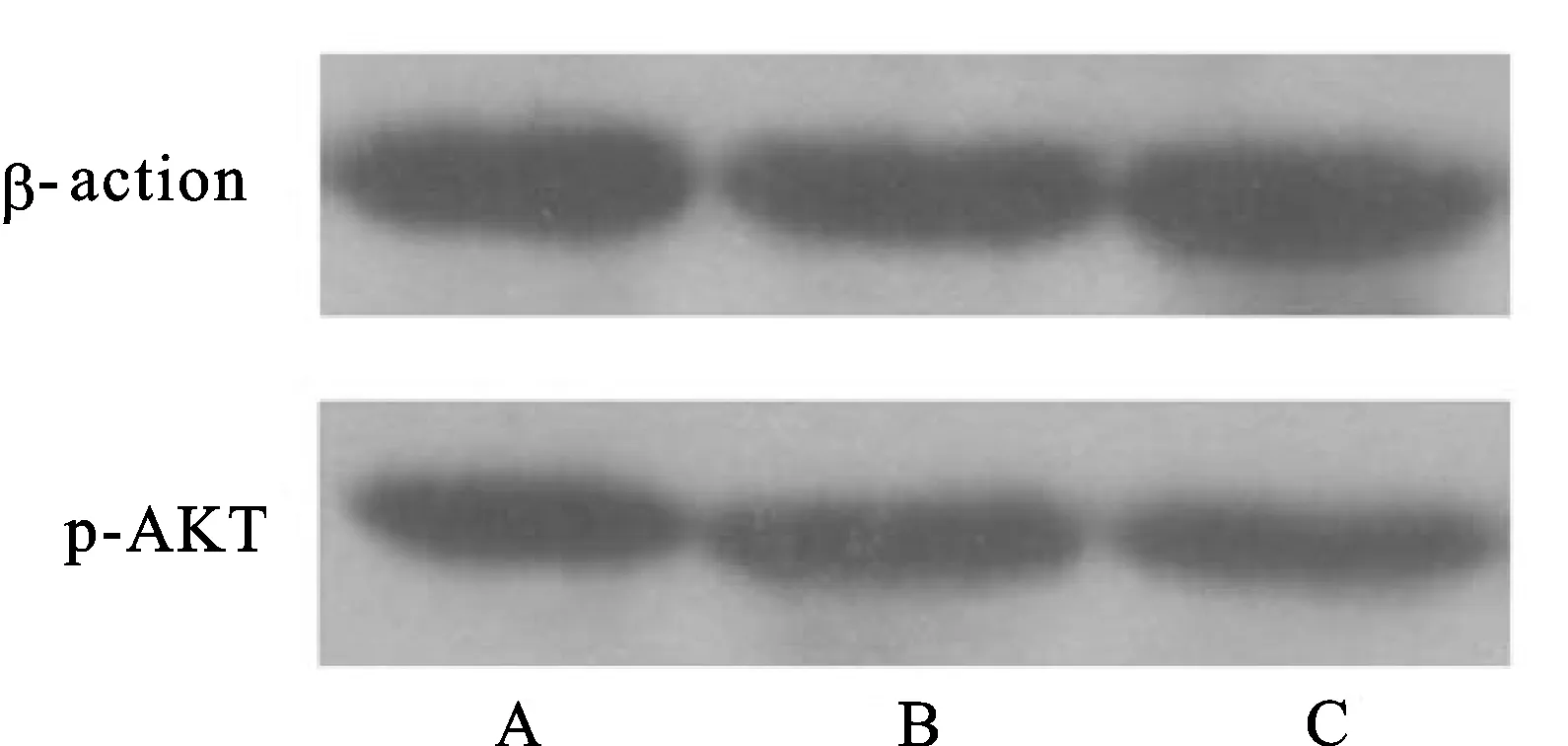
图1 Western blot检测p-AKT蛋白表达
A: 空白对照组;B:癌旁基质细胞共培养组;C:正常基质细胞共培养组。
3 讨 论
前列腺癌正成为我国发病率最高的泌尿系统肿瘤之一。现阶段,早期发现的前列腺癌可以进行根治性切除,中晚期前列腺癌通常进行以雄激素阻断为主的内分泌治疗,而进展至激素难治性阶段后,就很难找到有效的治疗方法。所以,医学界迫切地需要进一步明确前列腺癌发生和发展的机制,找到新的有效的治疗靶点。
肿瘤-基质交互作用在前列腺癌的基础研究中早已受到重视,而对于基质细胞影响肿瘤细胞的作用途径则尚无定论。JIANG等[1]发现分离自外周带的前列腺基质细胞对PC-3细胞的诱导增殖作用更强,这一作用是通过被性激素调节的生长因子达成的。还有其他研究证明前列腺基质细胞在前列腺癌的发生和发展中的作用,而生长因子在这一作用过程中占有重要位置[2-3]。
在与前列腺癌相关的诸多生长因子中,IGF是前列腺癌的研究中的热点[4-6]。NORDSTRAND 等[7]发现IGF-1阻断对于前列腺癌骨转移具有强烈的诱导凋亡的作用。本研究在应用分隔共培养方式探讨前列腺癌肿瘤-基质交互作用机制的过程中发现,良性的前列腺基质细胞可以明显抑制PC-3细胞中IGF-1 mRNA和p-AKT蛋白的表达,且对以上两者的抑制作用有明确的相关性。鉴于在分隔共培养系统中肿瘤、间质细胞间无直接接触,我们可以认为良性前列腺基质细胞对于PC-3细胞的作用是通过水溶性因子达成的。这种抑制作用在前列腺癌相关基质细胞与PC-3细胞之间则未观察到。由此结果我们可以认为,正常的前列腺基质细胞通过水溶性因子途径对于前列腺癌细胞的部分生长因子及下游介质表达有抑制作用,而前列腺癌相关基质细胞则失去了这种抑制能力。该作用的具体作用途径和介质有待进一步研究确认。
综上所述,本研究的结果提示,良性前列腺基质细胞可以通过水溶性因子对PC-3前列腺癌细胞中IGF-1 mRNA和p-AKT蛋白的表达发挥明确的抑制作用,而前列腺癌相关基质细胞则不具备这种抑制能力。这验证了前列腺癌的发生和发展与基质细胞关系密切的观点。
[1] JIANG Q, HAN BM, ZHAO FJ, et al. The differential effects of prostate stromal cells derived from different zones on prostate cancer epithelial cells under the action of sex hormones [J]. Asian J Androl, 2011, 13(6): 798-805.
[2] KAWADA M, INOUE H, ARAKAWA M, et al. Transforming growth factor-beta1 modulates tumor-stromal cell interactions of prostate cancer through insulin-like growth factor-I [J]. Anticancer Res, 2008, 28(2A):721-730.
[3] KAWADA M, INOUE H, OHBA S, et al. Leucinostatin A inhibits prostate cancer growth through reduction of insulin-like growth factor-I expression in prostate stromal cells [J]. Int J Cancer, 2010,15; 126(4):810-818.
[4] KAWADA M, INOUE H, MASUDA T, et al. Insulin-like growth factor I secreted from prostate stromal cells mediates tumor-stromal cell interactions of prostate cancer [J]. Cancer Res, 2006, 15; 66(8):4419-4425.
[5] KAPLAN-LEFKO PJ, SUTHERLAND BW, EVANGELOU AI, et al. Enforced epithelial expression of IGF-1 causes hyperplastic prostate growth while negative selection is requisite for spontaneous metastogenesis [J]. Oncogene, 2008, 1; 27(20): 2868-2876.
[6] BANUDEVI S, SENTHILKUMAR K, SHARMILA G, et al. Effect of zinc on regulation of insulin-like growth factor signaling in human androgen-independent prostate cancer cells [J]. Clin Chim Acta, 2010, 411(3-4): 172-178.
[7] NORDSTRAND A, LUNDHOLM M, LARSSON A, et al. Inhibition of the insulin-like growth factor-1 receptor enhances effects of simvastatin on prostate cancer cells in co-culture with bone [J]. Cancer Microenviron, 2013, 6(3):231-240.
(编辑 何宏灵)
Stromal cells from different sources influence the expression of IGF-1 and p-AKT in prostate cancer cells
NI Shao-bin, LIU Di, ZHAO Zhong-shan, MA Li, JIAO Zhi-xing
(Department of Urology, the First Affiliated Hospital of Harbin Medical University, Harbin 150001, China)
Objective To explore the role of insulin-like growth factor (IGF) in tumor-stromal cell interactions of prostate cancer. Methods PC-3 cells were seeded in TRANSWELL plate and interacted with different effector cells including benign and cancer-associated prostate stromal cells. Semi-quantitative RT-PCR was used to detect the expression of IGF-1 mRNA; Western blot was used to detect the expression of p-AKT. Results Compared with the control group, the expression of IGF-1 mRNA and p-AKT in PC-3 cells cocultured with benign prostate stromal cells were decreased (P<0.05), while there were no significant changes in the expression of IGF-1 mRNA and p-AKT in PC-3 cells cocultured with cancer-associated prostate stromal cells. The expression of IGF-1 mRNA was positively correlated with the expression of p-AKT (r=0.723,P<0.05). Conclusion Benign prostate stromal cells can suppress the expression of IGF-1 mRNA and its downstream protein factor in PC-3 cells, while cancer-associated prostate stromal cells do not have this effect.
prostate cancer; insulin-like growth factor; stromal cells
2014-09-29
2014-10-29
黑龙江省自然科学基金(No. D201080)
倪少滨(1960-),男(汉族),主任医师,教授.E-mail:nsb1960@aliyun.com
R697.3
A
10.3969/j.issn.1009-8291.2015-01-014
