尿道外口皮下注射透明质酸建立大鼠膀胱出口梗阻模型及效果评价
2015-04-07王永权熊智勇周占松卢根生
王永权,熊智勇,龚 薇,方 强,周占松,卢根生
(第三军医大学西南医院泌尿外科,重庆 400038)
·基础研究·
尿道外口皮下注射透明质酸建立大鼠膀胱出口梗阻模型及效果评价
王永权,熊智勇,龚 薇,方 强,周占松,卢根生
(第三军医大学西南医院泌尿外科,重庆 400038)
目的 通过尿道外口皮下注射透明质酸的方法建立一种简单微创、重复性好的大鼠膀胱出口梗阻(BOO)动物模型,并与传统开放手术BOO动物模型进行比较,评估其梗阻效果及并发症情况。方法 共40只成年雌性SD大鼠进行试验,随机分为3组,即尿道外口透明质酸注射组(简称注射组)、开放手术近端尿道结扎组(简称手术组)和对照组。注射组(n=15)采用0.2 mL透明质酸在尿道外口皮下周围注射的方法建立模型;手术组(n=15)利用传统开放性近端尿道结扎的方法建立模型;另10只正常大鼠作为对照。4周后检测各组充盈性膀胱测压检测梗阻效果、术后并发症、膀胱重量、以及HE染色检测膀胱组织学改变。结果 注射组较手术组的模型操作时间显著缩短(P<0.05),无切口感染和膀胱结石等并发症;充盈性膀胱测压结果提示:与对照组相比,注射组和手术组均检测到膀胱容量、排尿频率和残余尿量增加及储尿末期逼尿肌不稳定收缩的典型膀胱出口梗阻的尿动力学表现;注射组和手术组膀胱重量明显增加(P<0.05),HE染色可见梗阻后膀胱黏膜下及间质明显水肿、肌层厚度均显著高于对照组(P<0.05)。结论 大鼠尿道外口透明质酸注射简单微创、并发症少、效果明确、可重复性好,是一种有效的膀胱出口梗阻动物模型。
透明质酸;膀胱出口梗阻;动物模型
膀胱出口梗阻(bladder outlet obstruction,BOO)常见于良性前列腺增生、女性膀胱颈梗阻、尿道狭窄、神经源性膀胱等储/排尿功能障碍性疾病,引起一系列下尿路相关并发症[1]。临床上对其病理生理学机制尚缺乏充分认识,因此,深入了解和探索膀胱出口梗阻后储/排尿功能的病理生理学变化,有重要的临床意义。
研究疾病的发病机制和病理生理变化常常需要依靠建立理想的动物模型,一个好的疾病模型应具有再现性好、复制率高、专一性好等特点[2]。大量关于BOO的研究中都涉及动物模型的构建,其原理是利用手术的方法模拟膀胱流出道梗阻[3]。目前研究BOO的动物模型主要采用开放手术行近端尿道部分结扎或者在膀胱颈植入束缚环的方法[4-6],这些方法虽然可以有效模拟BOO状态,但是存在手术操作时间相对较长、创伤较大、结扎松紧程度不易控制、异物排斥反应、术后感染、膀胱结石等并发症发生率较高等缺点。膨胀剂在泌尿外科领域通过增加尿道阻力的原理常常被应用于治疗尿失禁[7],因此,理论上通过相同的原理可以建立BOO动物模型。因此针对传统模型的一些不足和缺陷,应用膨胀剂局部注射的原理,本研究通过透明质酸尿道口周围皮下注射的方法建立一种新的大鼠膀胱出口梗阻模型,并与传统手术结扎的方法在手术时间、术后并发症及梗阻效果等方面进行比较,为更好研究BOO后的储/排尿功能障碍提供一种良好的实验工具。
1 材料与方法
1.1 动物模型准备总共40只 Sprague-Dawley雌性大鼠(体重220~260 g,第三军医大学动物中心提供)进行研究。手术操作前,所有的动物均用戊巴比妥钠(50 mg/kg)腹腔内注射进行麻醉。尿道口周围透明质酸注射组(注射组,n=15)通过尿道外口周围皮下5、7、12点方位分别注射0.2 mL透明质酸钠(瑞典Q-Med公司)制作膀胱出口梗阻模型(图1A)。开放手术尿道结扎组(手术组,n=15)按照KIM等人[8]的方法进行手术操作:将直径为1 mm的硬膜外导管经尿道外口插入膀胱,以此作为尿道支撑。取下腹部正中切口,长约1.5~2 cm,逐层切开皮肤及皮下组织,分离腹壁肌肉,打开腹膜,仔细游离膀胱-尿道交界处,近端尿道稍作分离,于此处穿过3-0丝线,结扎近端尿道,然后拔除尿道内导管,逐层缝合关闭切口(图1B)。另取10只正常大鼠作为对照组。4周后,观察模型动物存活情况、并发症情况、充盈性膀胱测压检测梗阻效果及膀胱组织学检测。
1.2 充盈性膀胱测压根据文献[9]的方法行充盈性膀胱测压检测:麻醉同前,大鼠取仰卧位,四肢体固定,酒精消毒尿道外口及会阴部,将外直径为0.5 mm的聚乙烯导管,经尿道外口插入膀胱;轻压豚鼠腹部,排尽尿液,导管经三通管与尿动力检测仪及微量灌注泵相连;用微量灌注泵以0.2 mL/min速率灌注,膀胱灌注液采用生理盐水,同步记录随容积增加膀胱压力波形、最大膀胱容量(maximum cystometric capacity,MCC)、最大排尿压力(maximal micturition pressure,Pmax)、排尿频率(Frequency)、充盈期膀胱不稳定收缩波(non-voiding detrusor contractions,NVCs)以及膀胱残余尿(postvoiding residual volume,PRV)等。

图1 尿道外口透明质酸注射及开放性近端尿道结扎建立BOO模型示意图
1.3 组织学观察建模后4周,各组动物断颈处死,开腹取出膀胱并称重,计算膀胱重量(mg)和体重(g)之比。所有膀胱标本都用10%甲醛(体积分数)固定。石蜡组织包埋后以5 μm厚度切片。切片用苏木精-伊红染色(HE)在光学显微镜下观察膀胱组织学改变,同时测量各组膀胱体部黏膜和浆膜层之间的平滑肌层厚度进行比较。
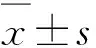
2 结 果
注射组平均手术时间(3.5±0.3)min,显著短于手术组操作时间(15.6±5.4)min(P<0.01)。对照组和注射组大鼠均存活至术后4周。注射组大鼠无一只出现感染、膀胱结石等并发症;手术组大鼠中,共有2只发生手术切口感染,其中1只死于严重感染。2只大鼠由于尿道结扎过紧并发膀胱结石。3组大鼠并发症情况比较详见表1。所有出现并发症的动物被排除进入充盈性膀胱测压和组织学观察。
表1 注射组、手术组和对照组术后并发症情况(例)
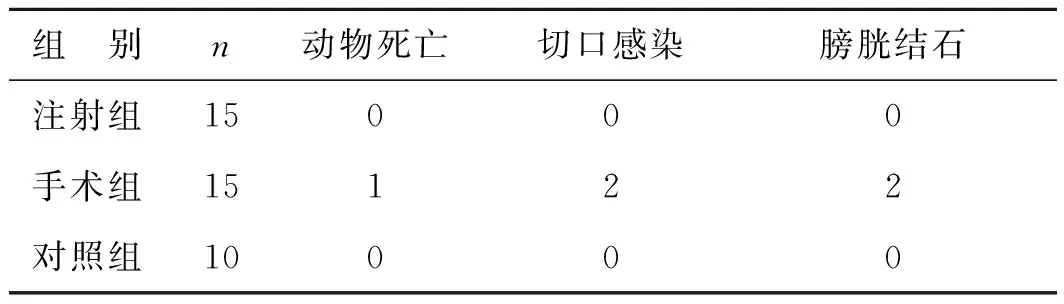
组 别n动物死亡切口感染膀胱结石注射组15000手术组15122对照组10000
充盈性膀胱测压结果显示注射组和手术组大鼠均出现非常典型的膀胱出口梗阻尿动力学表现, Pmax、排尿频率、MCC、PRV与对照组相比明显增加(P<0.01,表2);在储尿期均可观察到高于10 cmH2O(1 cmH2O=0.098 kPa)的NVCs(图2)。虽然上述指标注射组和手术组相比无统计学差异,但值得注意的是,注射组各项数据指标的标准差均小于手术组,进一步显示注射组模型的一致性和可重复性较好。
表2 注射组、手术组和对照组术后4周行充盈性膀胱测压结果

组 别n最大膀胱容量(mL)最大排尿压力(cmH2O)排尿间隔(s)残余尿(mL)注射组151.66±0.17*39.47±3.13*152.13±20.13*0.26±0.10*手术组151.81±0.59*42.11±7.99*165.23±56.30*0.28±0.13*对照组101.38±0.13 31.28±3.37 256.2±25.550
与对照组相比,*P<0.05。
建模后4周后称重结果显示注射组(206.1±17.3) g、手术组(210.2±14.6) g、与对照组[(209.2±16.2) g]没有显著差异;但建模后膀胱重量(mg)/体重(g)比率结果表明:手术组(1.41±0.37)和注射组(1.26±0.13)与对照组(0.47±0.03)相比显著提高(P<0.01),提示BOO后出现膀胱的代偿性肥厚和增生。HE染色镜下观察也发现注射组膀胱平滑肌层厚度 (805±77) μm和手术组厚度(961±186) μm显著高于对照组[(442±39)μm,P<0.01];还观察到注射组和手术组黏膜下层和间质充血水肿以及膀胱平滑肌肥大等组织病理学特征(图3),为BOO典型的膀胱组织结构变化[10]。
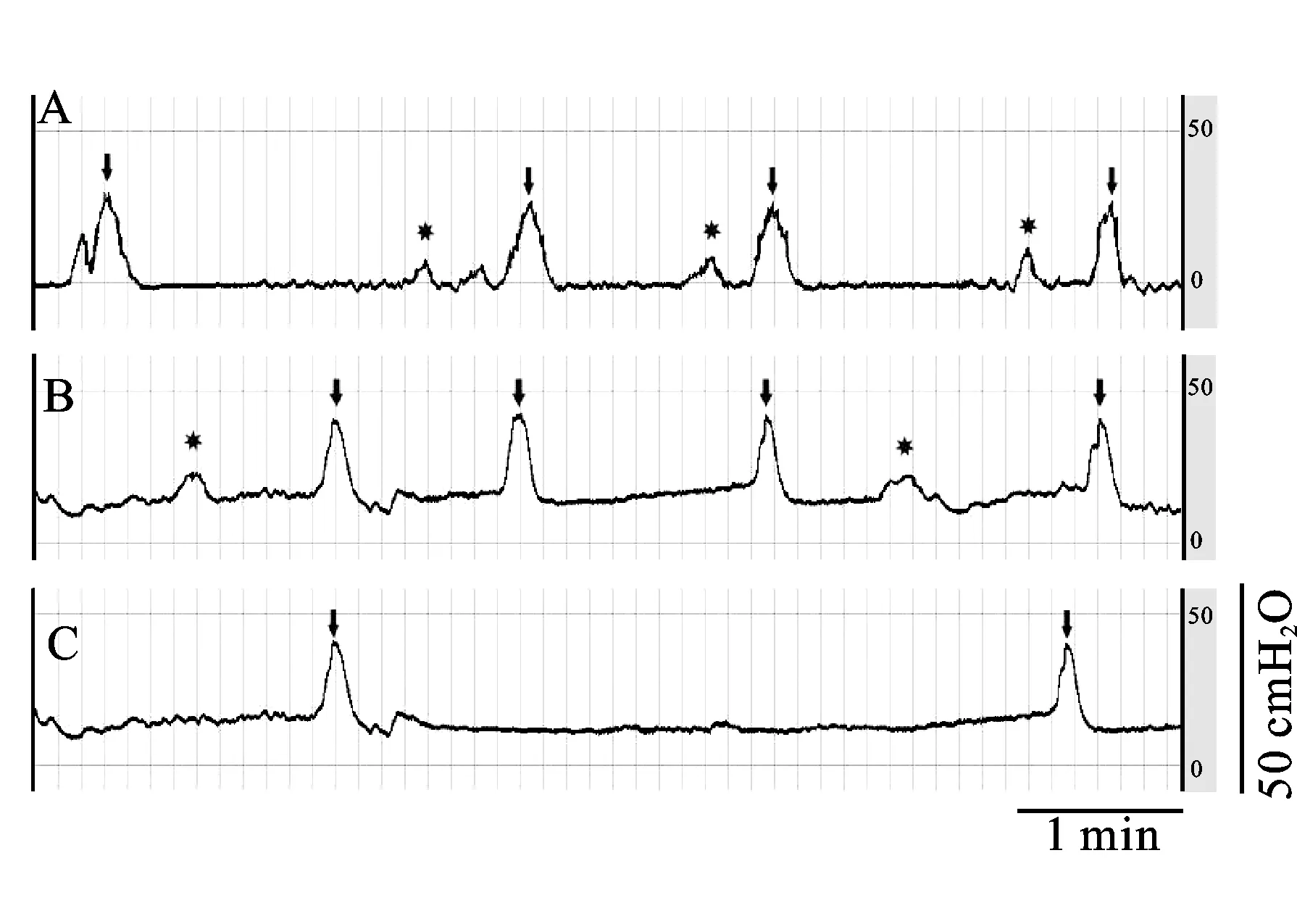
图2 注射组、手术组和对照组术后4周行充盈性膀胱测压图
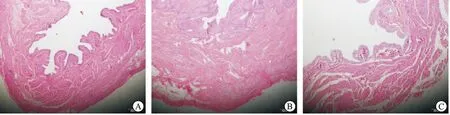
图3 注射组、手术组和对照组术后4周膀胱组织(HE,×40)
3 讨 论
尽管细胞生物学和分子生物学等研究方法高速发展,然而为了观察和检测机体的协调活动和整体状态,使用动物模型模拟病理状态的方法仍然是必不可少的[11]。最早出现的大鼠BOO的模型是1988年STEER等人[12]用尿道结扎的方法建立,在结扎后6周观察大鼠膀胱容量、重量、排尿频率以及排尿反射等病理生理学变化,并沿用至今。随后的几年中,一些学者又采用了膀胱颈或后尿道植入物的方法将硅胶或金属环、气囊等通过手术的方法置入大鼠体内[5, 13-14],也能获得同结扎类似的效果,并且利用异物产生的炎症反应,局部纤维瘢痕不断增加的原理可模拟慢性梗阻加重的变化过程。然而上述模型的制作方法均是通过外科手术的方式,创伤较大,术后感染或膀胱结石等并发症常难以避免,丝线结扎尿道的方法也较难保证每只动物的结扎松紧度一致,如结扎过紧可能导致严重肾积水、泌尿系结石等导致动物死亡的风险[15];而外源性置入物可能产生的异物排斥反应也部分限制了其应用范围,因此到目前为止,没有一种BOO大鼠模型是完美的。
膨胀剂的应用最早出现在整形外科领域,利用组织相容性良好的填充物对局部的组织缺陷进行修复,以达到治疗或美容的目的[16-17]。而在泌尿外科领域最早应用于治疗尿失禁(如聚四氟乙烯等材料)[18],但是有报道一些患者注射后可出现下尿路梗阻的并发症[19],因此并没有得到广泛应用,但提供了新的思路,CANNING等人[20]首先报道了在兔的尿道周围注射自体脂肪制作BOO模型,可模拟尿频、膀胱重量增加和对胆碱类药物反应更敏感等改变,但是自体脂肪组织存在吸收和感染的风险较大。透明质酸(或玻尿酸)是一种酸性黏多糖,存在于组织间、关节头的滑液中和眼球内的玻璃质中,起到黏合、润滑和保护的作用。医用的玻尿酸常常是整形外科领域的良好填充剂,可用于除皱、隆鼻等领域,在泌尿外科中也有报道应用于治疗小儿先天性膀胱输尿管返流[21]。透明质酸的优点在于良好的组织相容性、很难被机体吸收、方便注射等[22],因此对于研究膀胱出口慢性梗阻提供了一种良好的材料,我们的研究结果表明:透明质酸尿道口局部注射简便易行,无需开放手术,操作时间明显短于开放手术结扎,术后无明显并发症,动物存活率100%。尿动力学的结果也提示注射透明质酸的方法可达到和开放手术结扎相同的膀胱出口梗阻效果,在膀胱排尿压力、排尿频率、不稳定收缩和残余尿等指标上均表现为典型的BOO表现,而且注射组的各项数据的标准差都小于手术组,提示其可重复性和稳定性优于手术组。组织学的观察也发现了典型的逼尿肌肥大、肌层增厚和间质充血水肿的梗阻后膀胱病理学改变。这些结果都提示了大鼠尿道周围注射是一种简单有效、相关并发症少、安全微创、可重复性好的BOO动物模型,是研究膀胱功能障碍的一种良好工具。
[1] IRWIN DE, KOPP ZS, AGATEP B, et al. Worldwide prevalence estimates of lower urinary tract symptoms, overactive bladder, urinary incontinence and bladder outlet obstruction [J]. BJU Int, 2011, 108(7): 1132-1138.
[2] PARSONS BA, DRAKE MJ. Animal models in overactive bladder research [M]. Handb Exp Pharmacol, 2011(202): 22-43.
[3] KOBAYASHI K, KATO R, HISASUE S, et al. Animal model for the study of the relationship between lower urinary tract symptoms/bladder outlet obstruction and erectile dysfunction. [J]. Int J Urol, 2011, 18(10): 710-715.
[4] BRODERICK GA, LONGHURST PA, JUNIEWICZ PE, et al. A novel canine model of partial outlet obstruction secondary to prostatic hypertrophy [J]. World J Urol, 1994, 12(5): 245-248.
[5] BUTTYAN R, CHEN MW, LEVIN RM. Animal models of bladder outlet obstruction and molecular insights into the basis for the development of bladder dysfunction [J]. Eur Urol, 1997, 32(Suppl 1): 32-39.
[6] MELMAN A, TAR M, BOCZKO J, et al. Evaluation of two techniques of partial urethral obstruction in the male rat model of bladder outlet obstruction [J]. Urology, 2005, 66(5): 1127-1133.
[7] VAN KERREBROECK P, TER MEULEN F, et al. Treatment of stress urinary incontinence: recent developments in the role of urethral injection [J].Urol Res, 2003, 30(6): 356-362.
[8] KIM SO, OH BS, CHANG IY, et al. Distribution of interstitial cells of Cajal and expression of nitric oxide synthase after experimental bladder outlet obstruction in a rat model of bladder overactivity [J]. Neurourol Urodyn, 2011, 30(8): 1639-1645.
[9] KUBOTA Y, HASHITANI H, SHIRASAWA N, et al. Altered distribution of interstitial cells in the guinea pig bladder following bladder outlet obstruction [J]. Neurourol Urodyn, 2008, 27(4): 330-340.
[10] SCHRODER A, KIRWAN TP, JIANG JX, et al. Rapamycin attenuates bladder hypertrophy during long-term outlet obstruction in vivo: tissue, matrix and mechanistic insights [J]. J Urol, 2013, 189(6): 2377-2384.
[11] STEERS WD. Rat: overview and innervation [J]. Neurourol Urodyn, 1994, 13(2): 97-118.
[12] STEERS WD, DE GROAT WC. Effect of bladder outlet obstruction on micturition reflex pathways in the rat [J]. J Urol, 1988, 140(4): 864-871.
[13] KATO K, WEIN AJ, KITADA S, et al. The functional effect of mild outlet obstruction on the rabbit urinary bladder [J]. J Urol, 1988, 140(4): 880-884.
[14] DAS AK, HORAN P, LEGGETT RE, et al. Use of abdominal fascia to create partial outlet obstruction in rabbits [J]. Neurourol Urodyn, 1998, 17(3): 231-239.
[15] PANDITA RK, FUJIWARA M, ALM P, et al. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction [J]. J Urol, 2000, 164(4): 1385-1389.
[16] STEINSAPIR KD, STEINSAPIR SM. Deep-fill hyaluronic acid for the temporary treatment of the naso-jugal groove: a report of 303 consecutive treatments [J]. Ophthal Plast Reconstr Surg, 2006, 22(5): 344-348.
[17] CERVELLI V, LUCARINI L, SPALLONE D, et al. Use of platelet-rich plasma and hyaluronic acid in the loss of substance with bone exposure [J]. Adv Skin Wound Care, 2011, 24(4): 176-181.
[18] BENSHUSHAN A, BRZEZINSKI A, SHOSHANI O, et al. Periurethral injection for the treatment of urinary incontinence [J]. Obstet Gynecol Surv, 1998, 53(6): 383-388.
[19] PERSSON J, IOSIF C, WOLNER-HANSSEN P. Risk factors for rejection of synthetic suburethral slings for stress urinary incontinence: a case-control study [J]. Obstet Gynecol, 2002, 99(4): 629-634.
[20] CANNING DA. Autologous periurethral fat injections for the creation of bladder outlet obstruction [J]. Adv Exp Med Biol, 1995, 385: 261-263.
[21] TSAI CC, LIN V, TANG L. Injectable biomaterials for incontinence and vesico-ureteral reflux: current status and future promise [J]. J Biomed Mater Res B Appl Biomater, 2006, 77(1): 171-178.
[22] BEASLEY KL, WEISS MA, WEISS RA. Hyaluronic acid fillers: a comprehensive review [J]. Facial Plast Surg, 2009, 25(2): 86-94.
(编辑 王 玮)
Urethralorifice hyaluronic acid injections: a novel animal model of bladder outlet obstruction
WANG Yong-quan, XIONG Zhi-yong, GONG Wei, FANG Qiang, ZHOU Zhan-song,LU Gen-sheng
(Department of Urology, Southwestern Hospital, the Third Military Medical University, Chongqing 400038, China)
Objective To reduce surgery trauma and achieve the effect of bladder outlet obstruction (BOO), we explored a novel animal model by hyaluronic acid periurethral injection and compared the obstructive effects and complications of this model with traditional open partial proximal urethral obstruction surgery.Methods A total of 40 Sprague-Dawley female rats were divided into 3 groups: 15 rats were subcutaneously injected with 0.2 mL hyaluronic acid at 5,7,12 o’clock of urethral orifice respectively, another 15 rats undertook traditional open partial proximal urethral obstruction surgery, and 10 normal rats were set as control. After 4 weeks, the bladder weight, complications, filling cystometric study and histopathological features were evaluated by hematoxylin and eosin (HE) staining in each group. Results Hyaluronic acid periurethral injection caused increased maximum cystometric capacity, maximum bladder pressure, micturation interval, and postvoid residual urine volume compared with control (P<0.01). Moreover, the injection group had significantly shorter operative time, less incidence of incision infection compared to the surgery group (P<0.01). HE staining showed suburothelial and interstitial hyperemia edema and smooth muscle hypertrophy in both injection and surgery bladders, which could not been found in control group. There was a significant increase in the bladder weight and thickness of smooth muscle in the bladders of injection group and surgery group compared with control group (P<0.01). Conclusions Hyaluronic acid periurethral injection provided a simple and effective model of BOO with fewer complications and simpler process compared with traditional surgery model. It seems to be a useful research tool for understanding the pathophysiological change of BOO.
hyaluronic acid;bladder outlet obstruction; animal model
2014-06-24
2014-09-08
国家自然科学基金资助项目(No.81000288 81270845)
卢根生,教授. E-mail:lugeng8@hotmail.com
王永权(1980-),男(汉族),博士,主治医师,讲师.研究方向:排尿功能障碍和尿动力学.E-mail: wangyongquan@aliyun.com
R694
A
10.3969/j.issn.1009-8291.2015-01-013
