黄海南部近岸小黄鱼产卵群体生物学的初步研究❋
2015-03-31胡海生叶振江李增光王明琳文清源于洪亮
胡海生, 叶振江❋❋, 李增光, 王明琳, 文清源, 于洪亮
(1.中国海洋大学水产学院, 山东 青岛 266003; 2.威海市文登区海洋与渔业局, 山东 威海 264400)
黄海南部近岸小黄鱼产卵群体生物学的初步研究❋
胡海生1, 叶振江1❋❋, 李增光1, 王明琳1, 文清源1, 于洪亮2
(1.中国海洋大学水产学院, 山东 青岛 266003; 2.威海市文登区海洋与渔业局, 山东 威海 264400)
通过分析2006年5月和2013年5月在黄海南部吕泗渔场近岸调查采集的792和247尾小黄鱼标本,对小黄鱼产卵群体的生物学特征进行初步研究。研究显示:2006年小黄鱼产卵群体体长范围为136~249 mm,纯体重范围为17.48~107.11 g,年龄组成I~II龄,I龄占55%。绝对繁殖力F变动于2006~34509粒,平均(14193±1131)粒/尾;体重相对繁殖力FW变动于30~635粒/g,平均(252±23)粒/g。绝对繁殖力与纯体重的关系为F=248.36W+177.18,与体长的关系为F=0.053×L2.321 4。2013年小黄鱼产卵群体体长范围为132~204 mm,纯体重范围为29.95~102.40 g,年龄组成I~II龄,I龄占82%。绝对繁殖力F变动于5586~21688粒,平均(11069±946)粒/尾;体重相对繁殖力FW变动于171~331粒/g,平均(235±19)粒/g。绝对繁殖力与纯体重的关系为F=178.70W+2504.1,与体长的关系为F=0.010×L2.746 9。与历史记录比较,发现其繁殖力水平有减小的趋势。
黄海南部;小黄鱼;产卵群体;生物学
小黄鱼(Larimichthyspolyactis)属硬骨鱼纲(Osteichthyes)鲈形目(Perciformes)石首鱼科(Sciaenidae)黄鱼属(Larimichthys),属于近海暖温性底层鱼类[1],广泛分布于中国东海、黄海和渤海以及朝鲜半岛西岸海域[2]。由于小黄鱼具有较高的经济价值,历来为中国、日本、韩国、朝鲜等国家底拖网、帆张网、定置张网和流刺网等渔业所共同利用,在中国传统渔业历史上与大黄鱼(Larimichthyscrocea)、墨鱼(Sepiellamaindroni)、带鱼(Trichiurusjaponicus)并称“四大海产”,是中国海洋渔业开发利用中重要的经济物种[3-4]。中国大陆地区小黄鱼年产量在1957年达16.3万t,此后在波动中趋于下降,到1989年仅为1.7万t,1990年起小黄鱼资源开始回升,到1995年产量回升至15.3万t,1995年起的伏季休渔又促进了资源进一步上升,年产量显著提高,到2010年达40.1万t,为历年最高记录[5]。
目前小黄鱼渔获物个体小型化、低龄化和性成熟提早等现象十分突出[6-8],其摄食习性[9-10]、繁殖习性[11-16]以及生长特征[17-20]等方面产生较大变化。最新研究显示小黄鱼种群可划分为4个群系,即黄海北部-渤海群系、黄海中南部群系、东海北部群系和东海南部群系[21-22]。吕泗渔场位于黄海南部,是中国小黄鱼最大的产卵场,其区域与经济地位十分重要,小黄鱼在吕泗渔场渔获中重量和尾数占比亦较大[23]。关于黄海南部小黄鱼产卵群体生物学,邱望春等和林龙山等分别于1959—1961年和2006年对黄海南部和东海群体进行了研究[11,16];水柏年于1993—1995年对吕泗渔场和舟山渔场小黄鱼进行了研究[12];任一平等于2000年对黄海南部群体进行了研究[13]。上述研究的调查地点大多位于吕泗渔场拖网禁渔线东侧的离岸海域,而吕泗渔场近岸海域则少见报道。本文利用2006年5月和2013年5月的调查资料,研究分析了吕泗渔场近岸海域小黄鱼产卵群体组成和个体繁殖力状况,以期全面认识该水域小黄鱼繁殖生物学特征,为小黄鱼渔业生物学研究、资源评估和渔业管理提供科学支撑。
1 材料和方法
1.1 样品采集
2006年5月和2013年5月分别于黄海南部近岸吕泗渔场沿岸流刺网作业渔获物中选取小黄鱼样品,2006年采集792尾,2013年采集247尾,采样地点见图1。
1.2 样品处理
样品在实验室内进行常规生物学测定。测量体长、纯重,鉴定性别并采集成熟度达到Ⅳ期的卵巢做为产卵群体样品进行繁殖力测定。其中,2006年采集69尾,2013年采集50尾。

图1 小黄鱼采样地点
绝对繁殖力和相对繁殖力计算:从性腺成熟度达到Ⅳ期的卵巢样品的左、右卵巢的前、中、后部分取样称重0.2~0.4 g,计录有卵黄沉积的卵子数,用质量比例法即可得到小黄鱼的个体绝对繁殖力,用F表示。分别以FL和FW表示单位体长和单位纯体重的相对繁殖力。
以小黄鱼矢耳石作为年龄鉴定材料,样品取出耳石后,用清水清洗、干燥,用环氧树脂将耳石固定,利用耳石切片机将其横切为厚度0.5 mm的薄片,切片时与耳石长轴稍微成一定角度。利用Nikon SMZ800体视显微镜及配套的图像采集系统进行耳石图像的采集和个体年龄的观察鉴定。其中,2006年鉴定69尾,2013年鉴定50尾。小黄鱼耳石切片见图2。
年龄鉴定由两人采用盲读法[21,24]进行,鉴定结果一致后纳入后续数据的处理。
1.3 数据分析
实验所得数据用SPSS 20.0软件进行分析处理,用Spearman等级相关分析对小黄鱼的个体绝对繁殖力与其体长及纯体重之间关系进行分析。
2 结果
2.1 产卵群体组成
2.1.1 体长、纯重组成 2006年小黄鱼样品体长范围为136~249 mm,平均体长(194±3.14) mm,优势体长组在区间190~220 mm,占总数的65.2%;纯体重范围为17.48~107.11 g,平均纯体重(55.24±1.69) g,优势纯体重组在区间50~80 g之间,占总数的63.8%(见图3、4)。2013年样品体长范围为132~204 mm,平均体长(159±2.01) mm,主要体长组在区间140~160 mm,占总数的82%;纯体重范围为29.95~102.40 g,平均纯体重(47.93±1.19) g,优势纯体重组在区间30~40 g,占总数的74%(见图3和4)。

图2 小黄鱼耳石切片图(2龄)
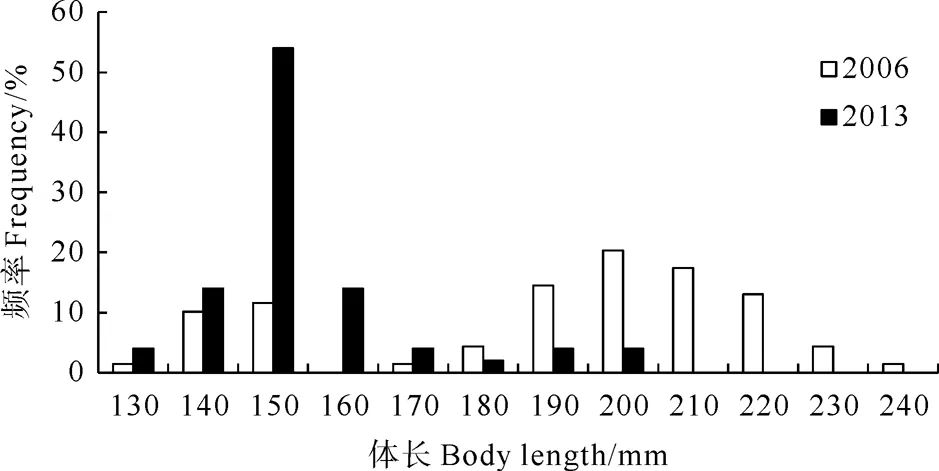
图3 黄海南部近岸小黄鱼体长频率分布

图4 黄海南部近岸小黄鱼纯体重频率分布
2.1.2 性比 2006样品中计数305尾,其中雌鱼188尾,雄鱼117尾,雌、雄比为1.6∶1;2013年样品中计数90尾,其中雌鱼50尾,雄鱼40尾,雌、雄比1.25∶1。
2.1.3 年龄组成 2006年产卵群体由Ⅰ~Ⅱ龄组成,其中Ⅰ龄鱼占55%,Ⅱ龄鱼占45%;2013年产卵群体Ⅰ龄鱼占82%,Ⅱ龄鱼占18%。
2.2 繁殖力
2006年小黄鱼产卵群体的绝对繁殖力范围为2 006~34 509粒,平均(14 193±1 131)粒/尾;体长相对繁殖力FL范围为11~232粒/mm,平均(70±12)粒/mm;体重相对繁殖力FW范围为30~635粒/g,平均(252±23)粒/g。2013年小黄鱼产卵群体绝对繁殖力范围为5 586粒~21 688粒,平均(11 069±946)粒/尾;体长相对繁殖力FL范围为40~106粒/mm,平均(69±9)粒/mm;体重相对繁殖力FW范围为171~331粒/g,平均(235±19)粒/g。
2.2.1 个体绝对繁殖力 2006年和2013年小黄鱼各体长组和纯体重组的绝对繁殖力变化分别见表1和2,由表1和2可以看出,小黄鱼绝对繁殖力随体长和纯体重的增加而增加。利用Spearman等级相关分析对小黄鱼的个体绝对繁殖力与其纯体重之间关系进行分析,结果表明其间存在正相关关系(相关系数R2006=0.471,P2006=0.001;R2013=0.572,P2013=0.001)。
绝对繁殖力与纯体重呈直线关系(见图5和图6),其关系式为:
2006年,F=248.36W+177.18,(R2=0.584 8,n=69);
2013年,F=178.70W+2 504.10,(R2=0.741 3,n=50)。
绝对繁殖力与体长呈幂函数关系(见图7和图8),其关系式为:
2006年,F=0.053L×2.3214,(R2=0.543 5,n=69);
2013年,F=0.010L×2.7469,(R2=0.751 2,n=50)。
式中:F为绝对怀卵量(粒);W为纯体重(g);L为体长(mm)。
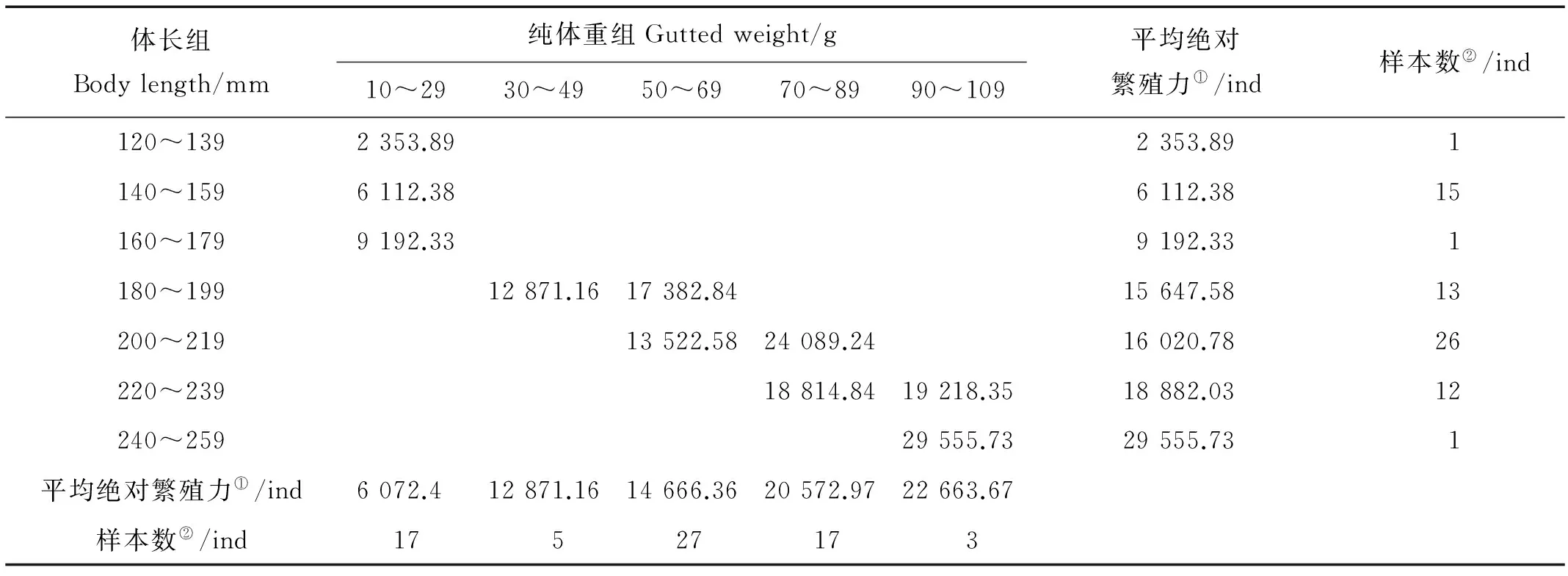
表1 2006年黄海南部近岸小黄鱼绝对繁殖力与体长和纯体重的关系
Note:①Absolute fecundity;②Samples number
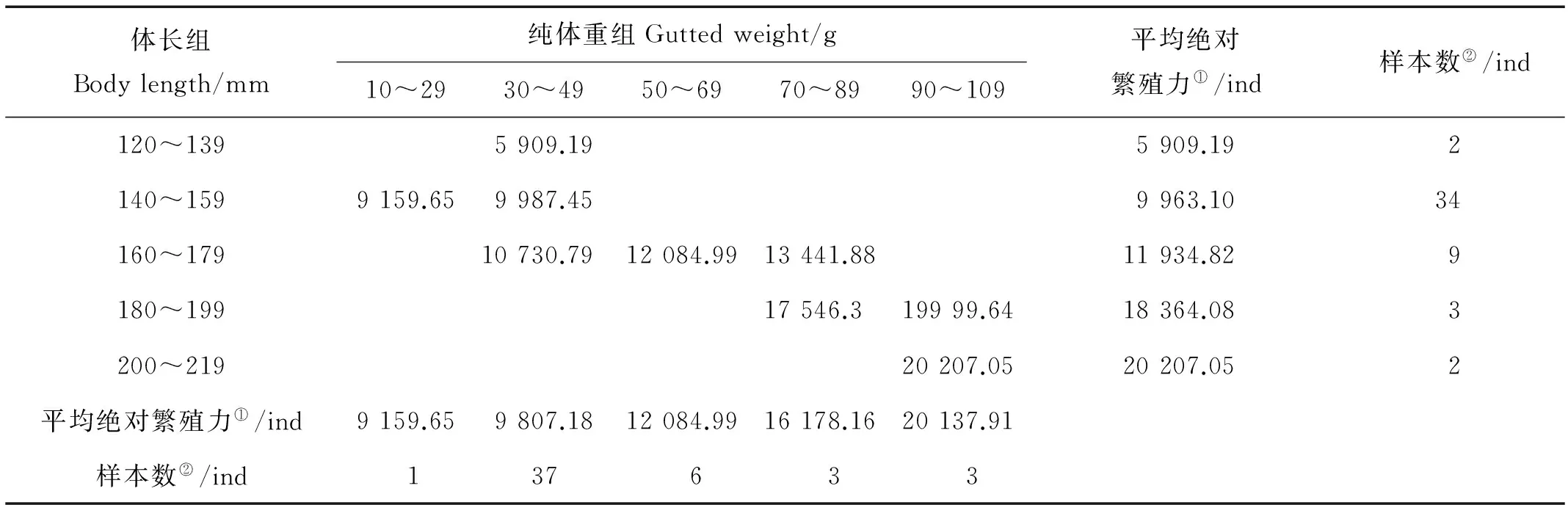
表2 2013年黄海南部近岸小黄鱼绝对繁殖力与体长和纯体重的关系
Note:①Absolute fecundity;②Samples number

图5 2006年黄海南部近岸小黄鱼绝对繁殖力与纯体重的关系

图6 2013年黄海南部近岸小黄鱼绝对繁殖力与纯体重的关系
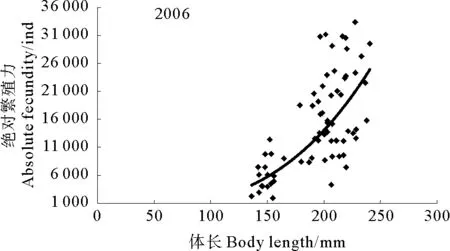
图7 2006年黄海南部近岸小黄鱼绝对繁殖力与体长的关系
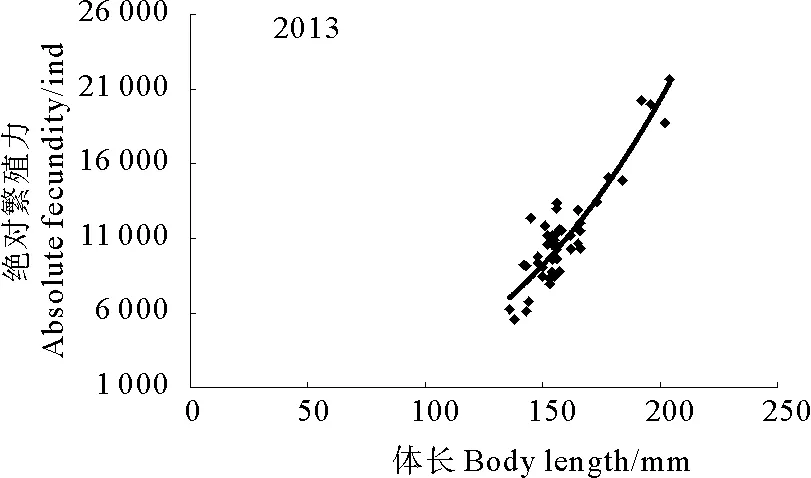
图8 2013年黄海南部近岸小黄鱼绝对繁殖力与体长的关系
2.2.2 体长相对繁殖力 2006年和2013年小黄鱼产卵群体各体长组和纯体重组的体长相对繁殖力变化见表3和4。由表3可以看出,2006年小黄鱼最小的单位体长相对繁殖力落在体长组120~139 mm和纯体重组10~29 g(16.54粒/mm)中,最大值落在体长组240~259 mm和体重组90~109 g中(122.64粒/mm)。由表4可以看出,2013年小黄鱼最小的单位体长相对繁殖力落在体长组120~139 mm和体重组30~49 g中(43.15粒/mm),最大值落在体长组180~199 mm和体重组90~109 g中(102.04粒/mm)。从总的趋势来看,小黄鱼单位体长相对繁殖力随体长和纯体重的增加有增加趋势。
2.2.3 体重相对繁殖力 小黄鱼产卵群体各体长组和纯体重组的体重相对繁殖力变化见表5和6。由表5和6可看出小黄鱼单位体重相对繁殖力并不随体长和纯体重之增大而增大,而是在一定范围内波动。
3 讨论
3.1 小黄鱼产卵群体组成
研究结果显示,2006年吕泗渔场近岸小黄鱼产卵群体样品平均体长为(194±3.14)mm,平均纯体重为(55.24±1.69)g;2013年群体样品平均体长为(159±2.01)mm,平均纯体重(47.93±1.19)g;2013年群体较2006年群体明显偏小(见图3和4),呈现出明显的小型化趋势。2006年产卵群体Ⅰ龄鱼占54.7%,Ⅱ龄鱼占45.3%;2013年产卵群体Ⅰ龄鱼占82%,Ⅱ龄鱼占18%,产卵群体年龄结构趋于简单,呈现出明显的低龄化趋势,这与单秀娟、李忠炉等在黄海中南部的调查结果相一致[10,19-20]。捕捞因素是造成小黄鱼生物学特征年代际变化的最主要原因[19],过度捕捞可引起海洋生物资源量和补充量关系失衡,捕食与被捕食关系不匹配[25],目标种群资源可因过度利用而衰退,群落生物量显著降低,小个体,短生命周期补偿生长提高,因而形成资源结构“小型化”的现象[26]。
3.2 小黄鱼产卵群体繁殖力变化
表7为黄海南部小黄鱼产卵群体不同年份间繁殖力对比,从中可以看出,1990年代以来,其绝对繁殖力随时间变化有减小的趋势,这可能与其在长期捕捞等外部环境影响下的遗传进化以及对其生存环境的适应性响应有关[25-26]。
综合历史研究和本次研究数据发现,小黄鱼繁殖力波动范围较大,即使在相近的年份繁殖力数值也会有较大差异,这一方面表现了小黄鱼资源状况及繁殖生物学的适应性变化,另一方面或许与不同研究者的采样海域、时间、样品局限性等复杂的具体研究背景有关。另外,小黄鱼属分批繁殖鱼类[27],现行的繁殖力评估方法大多是以统计繁殖前卵巢中所有卵黄卵的数量估算年繁殖力,即按照不分批繁殖鱼类的方法来评估;然而,分批繁殖鱼类每年潜在的繁殖力并不固定于开始繁殖前含卵黄卵的数量,不成熟的卵在繁殖季节可继续发育成熟并产出[28],因而这种方法会产生一定的误差[29]。关于小黄鱼等分批产卵鱼类的繁殖生物学研究,尚需今后进一步对其分批繁殖力[30-32]、产卵分数[33-35]等进行针对性系统研究,以期全面反映其繁殖生物学特征,为其资源评估及科学管理提供支撑。

表3 2006年黄海南部近岸小黄鱼单位体长相对繁殖力与体长和纯体重的关系
Note:①Absolute fecundity;②Samples number
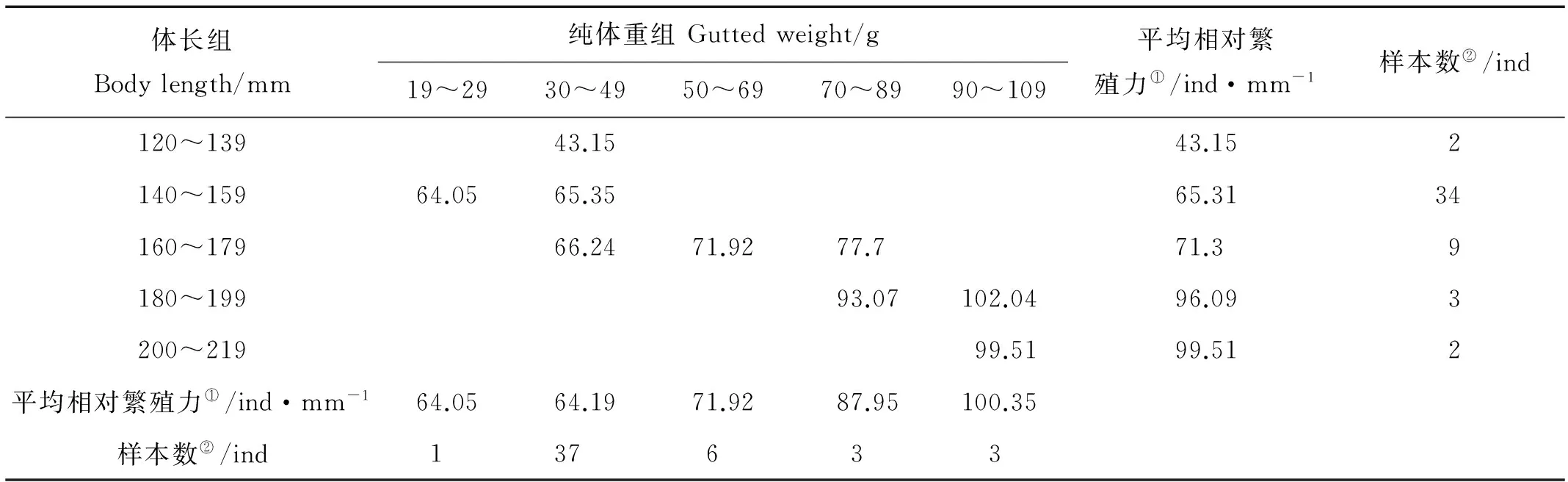
表4 2013年黄海南部近岸小黄鱼单位体长相对繁殖力与体长和纯体重的关系
Note:①Absolute fecundity;②Samples number
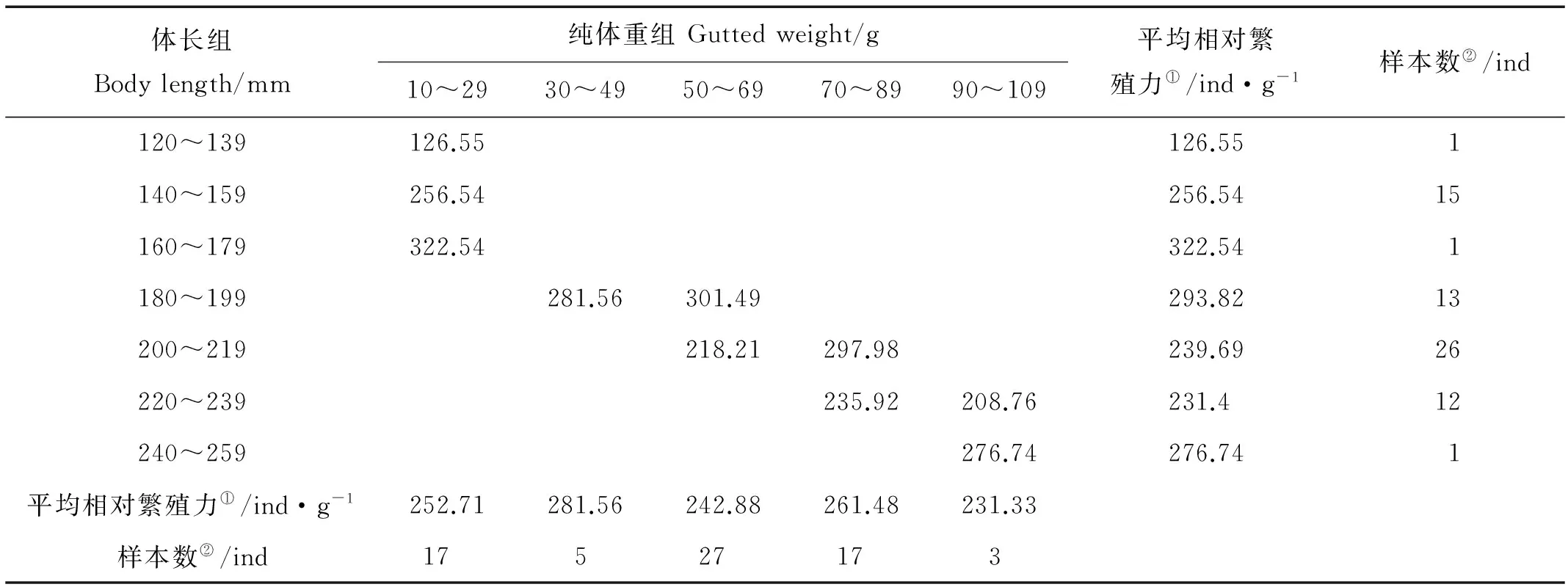
表5 2006年黄海南部近岸小黄鱼单位体重相对繁殖力与体长和纯体重的关系
Note:①Absolute fecundity;②Samples number
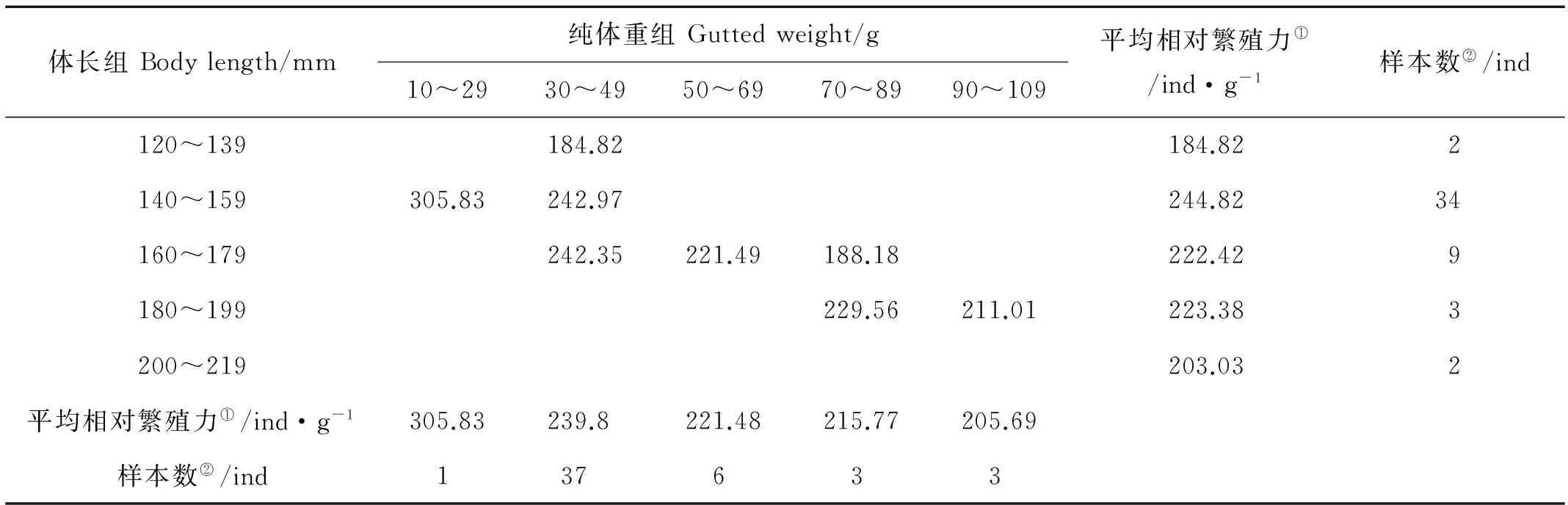
表6 2013年黄海南部近岸小黄鱼单位体重相对繁殖力与体长和纯体重的关系
Note:①Absolute fecundity;②Samples number
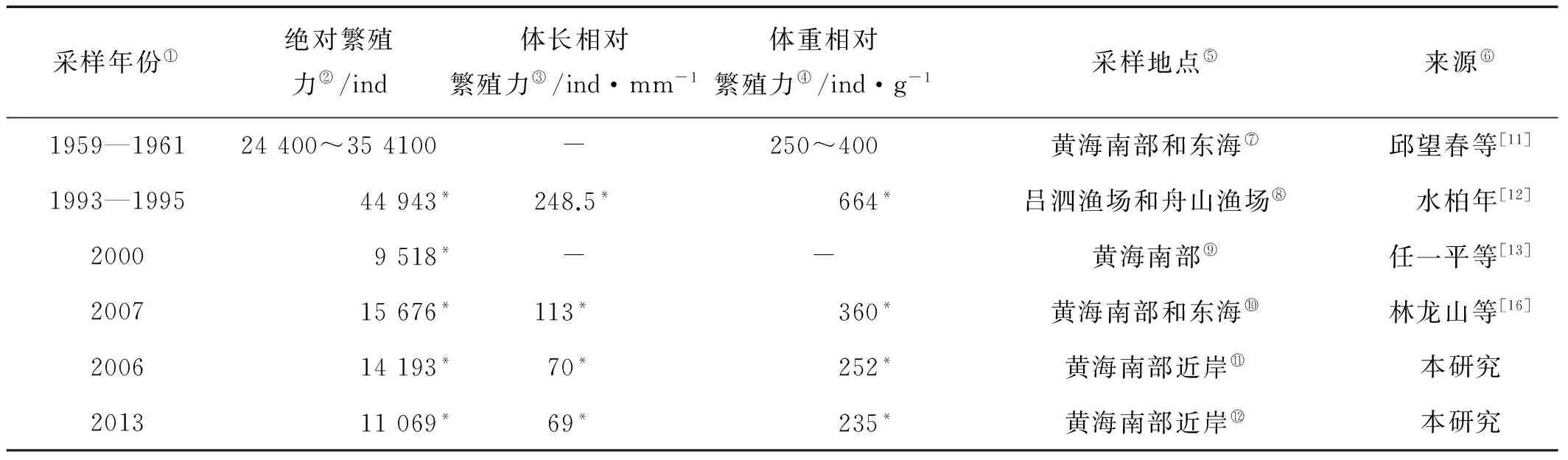
表7 不同年份间小黄鱼繁殖力比较
注:“-”为文章中未提及;“*”为平均值。Note: “-” :Not mentioned in paper;“*”:Mean.
①Sampling years;②Absolute fecundity;③Relative fecundity;④Relative fecundity;⑤Sampling sites;⑥Source;⑦Southern Yellow Sea and East China Sea;⑧Lusi fishing grounds and Zhoushan fishing grounds;⑨Southern Yellow Sea;⑩Southern Yellow Sea and East China Sea;Offshore of Southern Yellow Sea;Offshore of Southern Yellow Sea
[1] 刘效舜, 吴敬南, 韩光祖. 黄渤海区渔业资源调查与区划[M]. 北京: 海洋出版社, 1990.
[2] 赵传, 刘效舜, 曾炳光, 等. 中国海洋渔业资源[M]. 杭州: 浙江科学技术出版社, 1990.
[3] 农牧渔业部水产局, 农牧渔业部东海区渔业指挥部. 东海区渔业资源调查和区划[M]. 上海: 华东师范大学出版社, 1987.
[4] 金显仕, 赵宪勇, 孟田湘, 等. 黄,渤海生物资源与栖息环境[M]. 北京: 科学出版社, 2005.
[5] 郑元甲, 洪万树, 张其永. 中国主要海洋底层鱼类生物学研究的回顾与展望[J]. 水产学报, 2013, 37(1): 151-160.
[6] 金显仕. 黄海小黄鱼(Pseudosciaenapolyactis)生态和种群动态的研究[J]. 中国水产科学, 1996, 3(1): 32-46.
[7] 林龙山, 程家骅. 东海区小黄鱼渔业生物学现状的分析[J]. 中国海洋大学学报(自然科学版), 2004, 34(4): 565-570.
[8] 林龙山, 程家骅, 任一平. 等. 东海区小黄鱼种群生物学特性的分析[J]. 中国水产科学, 2004, 11(4): 333-338.
[9] 薛莹, 金显仕, 张波, 等. 黄海中部小黄鱼的食物组成和摄食习性的季节变化[J]. 中国水产科学, 2004, 11(3): 237-243.
[10] 单秀娟, 李忠炉, 戴芳群, 等. 黄海中南部小黄鱼种群生物学特征的季节变化和年际变化[J]. 渔业科学进展, 2011, 32(6): 7-16.
[11] 邱望春, 蒋定和. 黄海南部、东海小黄鱼繁殖习性的初步研究[C].//海洋渔业资源论文选集. 北京: 农业出版社, 1965: 58- 71.
[12] 水柏年. 小黄鱼个体生殖力及其变化的研究[J]. 浙江海洋学院学报(自然科学版), 2000, 19(1): 58-69.
[13] 任一平, 高天翔, 刘群, 等. 黄海南部小黄鱼渔获群体结构与繁殖特征的初步研究[J]. 海洋湖沼通报, 2001(1): 41-46.
[14] 曾玲, 金显仕, 李富国, 等. 渤海小黄鱼生殖力及其变化[J]. 海洋科学, 2005, 29(5): 80-83.
[15] 林龙山, 程家骅, 姜亚洲, 等. 黄海南部和东海小黄鱼(Larimichthyspolyactis)产卵场分布及其环境特征[J]. 生态学报, 2008, 28(8): 3485-3494.
[16] 林龙山, 姜亚洲,严利平, 等. 黄海南部和东海小黄鱼产卵亲体分布特征与繁殖力的研究[J]. 上海海洋大学学报, 2009, 18(4): 453-459.
[17] 水柏年. 黄海南部,东海北部小黄鱼的年龄与生长研究[ J]. 浙江海洋学院学报(自然科学版), 2003, 22(1): 16-20.
[18] 郭旭鹏, 金显仕, 戴芳群. 渤海小黄鱼生长特征的变化[J]. 中国水产科学, 2006, 13(2): 243-249.
[19] 张国政, 李显森, 金显仕, 等. 黄海中南部小黄鱼生物学特征的变化[J]. 生态学报, 2010, 30(24): 6854-6861.
[20] 李忠炉, 金显仕, 单秀娟, 等. 小黄鱼体长-体质量关系和肥满度的年际变化[J]. 中国水产科学, 2011, 18(3): 602-610.
[21] Zhang C, Ye Z, Wan R, et al. Investigating the population structure of small yellow croaker (Larimichthyspolyactis) using internal and external features of otoliths[J]. Fisheries Research, 2014, 153: 41-47.
[22] Wang L, Liu S, Zhuang Z, et al. Population genetic studies revealed local adaptation in a high gene-flow marine fish,the small yellow croaker (Larimichthyspolyactis) [J]. PloS One, 2013, 8(12) : 83493.
[23] 叶振江, 王巍令, 徐宾铎, 等. 吕泗渔场海洋学特征与定置网渔获性能的研究[J]. 中国海洋大学学报(自然科学版), 2010, 40(12): 27-31.
[24] 刘效舜, 杨丛海, 叶冀雄. 黄海北部渤海小黄鱼的鳞片和耳石年龄特征及其形成周期的初步研究[C].//海洋渔业资源论文选集. 北京: 农业出版社, 1965: 136-148.
[25] Bundy A. Fishing on ecosystems: The interplay of fishing and predation in Newfoundland Labrador[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(6): 1153-1167.
[26] Myers R A, Worm B. Rapid worldwide depletion of predatory fish communities[J]. Nature, 2003, 423(6937): 280-283.
[27] Lim H K, Le M H, An C M, et al. Reproductive cycle of yellow croakerLarimichthyspolyactisin southern waters off Korea[J]. Fisheries Science, 2010, 76(6): 971-980.
[28] Hunter J R, Macewicz B J, Lo N C H, et al. Fecundity,spawning, and maturity of female Dover soleMicrostomuspacificus, with an evaluation of assumptions and precision[J]. Fishery Bulletin, 1992, 90(1): 101-128.
[29] Hunter J R, Lo N C H, Leong R J H. Batch fecundity in multiple spawning fishes[J]. NOAA Technical Report NMFS, 1985, 36: 67-77.
[30] Arocha F. Oocyte development and maturity classification of swordfish from thenorth-western Atlantic[J]. Journal of Fish Biology, 2002, 60(1): 13-27.
[31] Carter A B, Williams A J, Russ G R. Increased accuracy of batch fecundity estimates using oocyte stage ratios inPlectropomusleopardus[J]. Journal of Fish Biology, 2009, 75(3): 716-722.
[32] Shiraishi T, Ketkar S D, Katoh Y, et al. Spawning frequency of the Tsushima Current subpopulation of chub mackerelScomberjaponicusoff Kyushu, Japan[J]. Fisheries Science, 2009, 75(3): 649-655.
[33] Ganias K, Nunes C, Stratoudakis Y. Degeneration of postovulatory follicles in the Iberian sardineSardinapilchardus: structural changes and factors affecting resorption[J]. Fishery Bulletin, 2007, 105(1): 131-139.
[34] Ganias K, Nunes C, Vavalidis T, et al. Estimating oocyte growth rate and its potential relationship to spawning frequency in teleosts with indeterminate fecundity[J]. Marine and Coastal Fisheries, 2011, 3(1): 119-126.
[35] Ganias K. Thirty years of using the postovulatory follicles method:Overview,problems and alternatives[J]. Fisheries Research, 2012, 117/118(4): 63-74.
责任编辑 朱宝象
A Preliminary Study on the Biology of the Spawning Stock of Small Yellow Croaker (Larimichthyspolyactis) Inhabiting the Near Shore of Southern Yellow Sea
HU Hai-Sheng, YE Zhen-Jiang, LI Zeng-Guang, WANG Ming-Lin, WEN Qing-Yuan, YU Hong-Liang
(1.College of Fisheries, Ocean University of China, Qingdao 266003, China,2.Bureau of Oceanic and Fishery of Wendeng District, Weihai 264400, China)
Based on 792 and 247 small yellow croaker individuals collected in May 2006 and May 2013, respectively, from near shore seawater of Lvsi fishing ground, Southern Yellow Sea, we described preliminarily the biological characteristics of the spawning stock of small yellow croaker (Larimichthyspolyactis). The body length of this spawning stock ranged from 136 to 249 mm, and the gutted weight ranged from 17.48 to 107.11 g in 2006. The stock was composed of individuals at ages between I and II, and individuals at age I accounted for 55% of the total. The individual absolute fecundityF(ind.) ranged from 2006 to 34 509 (14193±1131), and the individual relative fecundityF/W(ind./g) ranged from 30 to 635 (252±21). The relationship between the individual absolute fecundityF(ind.) and net weightW(g) was expressed asF=248.36×W+177.18. The relationship between individual absolute fecundityF(ind.) and body lengthL(mm) was expressed asF=0.053×L2.321 4. In 2013, the body length of spawning stock ranged from 132 to 204 mm, and the gutted weight ranged from 29.95 to 102.40 g. The stock was composed of individuals at ages between I and II, and the individuals at age I accounted for 82% of the total. The individual absolute fecundityF(ind.) ranged from ,5586 to 21 688 (11069±946), and the individual relative fecundityF/W(ind./g) ranged from 171 to 331 (235±19). The relationship between the individual absolute fecundityF(ind.) and gutted weightW(g) was expressed asF=178.70×W+2 504.1. The relationship between the individual absolute fecundityF(ind.) and body lengthL(mm) was expressed asF=0.010×L2.746 9. Compared with historical data,the fecundity of small yellow croaker tended to decrease.
Southern Yellow Sea;Larimichthyspolyactis; spawning stock; biology
高等学校博士学科点专项科研基金项目(20120132130001);中央高校基本科研业务费专项资金项目(201262004)资助
2014-10-15;
2015-05-06
胡海生(1989-),男,硕士生。E-mail: kokaop@163.com
❋❋通讯作者: E-mail:yechen@ouc.edu.cn
S917
A
1672-5174(2015)12-043-08
10.16441/j.cnki.hdxb.20140325
