汇集白膜层制备单人份血浆悬浮去白混合浓缩血小板应用研究
2015-03-29赵凤绵戚海张爱红牛宏伟韩卫刘敬闪李建民陈筱麟张金彩陈红霞
赵凤绵 戚海 张爱红 牛宏伟 韩卫 刘敬闪 李建民 陈筱麟 张金彩 陈红霞
目前,我国临床应用的浓缩血小板以单采血小板为主,随着临床对单采血小板需求量的飙升,血站与临床的供需矛盾越来越凸显,科学合理、安全有效利用手工采集全血中血小板资源、缓解单采血小板供应不足的问题是血站亟需考虑的问题。因从单袋全血中提取单人份手工血小板的血小板含量低,患者需要输注数袋才能达到血小板的治疗效果,输注过程繁琐,反复穿刺易交叉感染,不能滤除白细胞易导致由白细胞引起的输血反应等等,诸多弊端限制了手工血小板在临床应用。欧洲国家普遍输注混合浓缩血小板,甚至有些国家混合浓缩血小板在临床占有绝对的比例。为满足临床输注血小板的需求,综合利用手工采集全血中的血小板资源,进一步提升血小板的质量和更理想的提高手工血小板的治疗效果,我们开展了利用汇集白膜层方法、用单人份男性献血者血浆作为悬浮介质、制备去白混合浓缩血小板研究,为我国建立手工浓缩血小板的汇集、滤除白细胞的操作规程和标准提供科学依据。
1 资料与方法
1.1 一般资料 选择我中心符合《献血者健康检查要求》、2011年10月至2012年2月共计445名随机献血者捐献的400 ml/袋全血。
1.2 设备与试剂 (1)日本久保田KUBOTA994L大型离心机;(2)泰尔茂SC-201A TSCD无菌导管接口机;(3)美国COULTER/AC.TC 5diff A血细胞计数仪;(4)英国西门子865血气分析仪及配套试剂盒(批号:72497,54154);(5)显微镜和Nageotte白细胞计数板;(6)美国BD公司FACSCantoⅡ流式细胞仪,抗CD62p(Chrono-log,批号 09),抗 CD41(Chrono-log,批号 35),同型对照mouse IgG1 FITC、IgG1 PE;(7)美国Chronolog590-4D血小板凝聚仪和配套的血小板聚集诱导剂:ADP(批号3407),胶原(批号3414);(8)瑞士SunRise-Basic TECAN酶标仪;(9)山东威高一次性去白全血采血袋Q-400联袋(1108241,1112151);(10)南京双威FTS-PL白细胞过滤器(110412)(试验Ⅰ组);成都双陆KF-WFP-B-IU白细胞过滤器(110813)(试验Ⅱ组,);单采血小板作为对照组;(11)去白混合浓缩血小板中任一男性献血者血浆;(12)南京双威二联空袋(110605);(13)Turk’s溶液(自配)。
1.3 方法
1.3.1 去白混合浓缩血小板制备:将采集的400 ml/袋新鲜全血,保存在(22±2)℃,在4~6 h内重离心,分离出白膜层(BC)(30~40 ml,其中血浆15~20 ml,BC 和红细胞15~20 ml),在(22±2)℃条件下静置,次日将7袋检验合格并且同血型的BCs通过无菌导管接口机汇集在二联空袋内,并加入提前挑选的其中一名男性献血者的血浆200 ml(包括冲洗BC袋子所用),轻轻混合均匀后离心,分离出混合浓缩血小板;将混合浓缩血小板通过无菌导管接口机与白细胞过滤器相连接,调节流量调节器,使混合PRP以快速滴状经过滤盒,过滤时间控制在12 min左右。过滤完毕热合去掉滤器,即得去白混合浓缩血小板(以下简称“产品”)。
1.3.2 血小板和红细胞残留量计数:用血细胞计数仪测定试验Ⅰ组、试验Ⅱ组过滤前/后产品的血小板计数和红细胞混入量,根据容量计算每袋产品的血小板含量。
1.3.3 白细胞残余量测定:制备当天,试验Ⅰ组和试验Ⅱ组的产品均用Nageotte计数法测定白细胞残留量。用试管取产品 100 μl,加入 900 μl Turk,s溶液混匀,静置10 min,再次震荡试管后吸取约600 μl混合液滴入Nageotte计数板中,室温沉降15 min后,在显微镜下计数1个满格子(5 μl)上的白细胞,样品按1∶10稀释,计算结果为每格中 WBCs/μl。计算公式:每袋中白细胞个数=白细胞实测值×10×103×容量/100。
1.3.4 血小板抗低渗休克反应(HSR)测定
1.3.4.1 样本的制备 每袋产品均用无菌接口机将母袋与二联空袋相连接,取产品10 ml后热合与母袋离断,离心分离出贫血小板血浆(PPP)用于稀释样本用;另接一空袋取产品10 ml,吸取适量,根据血小板计数用PPP稀释成浓度为(250~300)×109/L的样本。
1.3.4.2 HSR 的测定 用 SunRise-Basic TECAN 酶标仪测定试验Ⅰ组和试验Ⅱ组制备当天产品的HSR,波长630nm。样本与蒸馏水按1∶2比例混合,用蒸馏水调零,测定最小吸光度T0和该样本15 min后的吸光度T15;样本与产品自身的 PPP按1∶2比例混合,用PPP调零,测最大吸光度Tmax,HSR恢复率=(A15-A0)/(Amax-A0)×100%。
1.3.5 pH值和代谢产物的测定:用血气仪和配套试剂盒测定试验Ⅰ组和试验Ⅱ组产品制备当天的pH值,葡萄糖 (mmol/L)、乳酸盐 (mmol/L)、PCO2(mm Hg)、PO2(mm Hg)和碳酸氢盐以及钠离子、钾离子、氯离子的含量。
1.3.6 血小板聚集功能测定:用590系列电阻聚集仪测定血小板聚集率,当电极插入装有磁棒和血小板浓缩液的反应杯中时,在电极的表面立刻附着一层血小板,加入诱导剂后大量血小板进一步聚集。在此电极回路中,因血小板聚集电阻增加,电流减少,仪器通过检测电阻的变化来确定血小板的聚集率。分别用ADP(10 μmol/L)和胶原(2 μg/ml)测定试验Ⅰ组和试验Ⅱ组产品第1天的电阻值。测定前将产品用PPP稀释至浓度为(250~300)×109/L的样本。
1.3.7 用流式细胞仪测定试验Ⅰ组和试验Ⅱ组产品的血小板CD62p阳性率。取2支流式细胞仪专用试管,分别标记为对照管和测定管并分别加入同型对照mouse IgG1 FITC、IgG1 PE;测定管再加入CD41-FITC、CD62p-PE;加入处理好的标本,混匀避光反应20 min;用1%多聚甲醛4℃固定血小板,10 min后用流式细胞仪测定 CD62p阳性表达率(用流式细胞仪内置的Cellquest软件分析)。
1.4 质量标准 依据GB18469-2012《全血及成分血质量要求》中去白单采血小板的要求:血小板含量≥2.5 ×1011/袋,红细胞混入量≤8.0 ×109/袋,pH 值为6.4 ~7.4。白细胞混入量≤5.0 ×106/袋,无细菌生长。
1.5 统计学分析 应用SAS 9.0统计软件,计量资料以±s表示,组间行独立样本t检验,组内行成对样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组过滤前后血小板回收率情况 2组产品过滤后回收率在90%以上,差异有统计学意义(P<0.05)。见表1。
表1 2组过滤前后血小板回收率情况±s

表1 2组过滤前后血小板回收率情况±s
组别 滤前(×1011/袋) 滤后(×1011/袋) 回收率(%) t值 P 值 细菌培养试验Ⅰ组(n=35) 2.90 ±0.39 2.62 ±0.26 90.34 ±2.32 4.996 0.000无菌生长试验Ⅱ组(n=25) 2.93 ±0.35 2.71 ±0.29 92.49 ±1.17 7.023 0.000无菌生长
2.2 2组去白混合浓缩血小板的质量变化情况 2组产品血小板的含量和红细胞的残留量均符合单采血小板的标准,产品白细胞的残留量比去白细胞单采血小板标准低数10倍,比普通单采血小板低数千倍。见表2。
表2 2组去白混合浓缩血小板的质量变化情况±s

表2 2组去白混合浓缩血小板的质量变化情况±s
项目 试验Ⅰ组(n=35) 试验Ⅱ组(n=25) t值 P值容量(ml)294.00 ±37.00 290.00 ±34.00 0.347 0.730血小板含量(×1011/袋) 2.62 ±0.26 2.71 ±0.29 1.258 0.213 MPV(fl) 6.78 ±0.53 6.93 ±0.29 1.329 0.189 RBC 混入量(×109/袋) 6.16 ±2.98 6.13 ±2.11 0.047 0.963 WBC混入量(×106/袋)0.15 ±0.14 0.15 ±0.16 0.231 0.818
2.3 3组去白混合浓缩血小板的功能变化情况 t1、p1分别为试验Ⅰ组与对照组的值,t2、p2分别为试验Ⅱ组与对照组的值,t3、p3分别为试验Ⅰ组与试验Ⅱ组的值,差异有统计学意义(P<0.05)。抗低渗休克反应试验Ⅰ组高于对照组,差异有统计学意义(P<0.05);试验Ⅱ组低于试验Ⅰ组和对照组,差异有统计学意义(P<0.05)。活化标志物CD62p试验Ⅰ组合试验Ⅱ组均低于对照组,差异有统计学意义(P<0.05)。胶原诱导的聚集率比ADP诱导的聚集率高(P<0.05)。见表3。
表3 3组去白混合浓缩血小板的功能变化情况±s
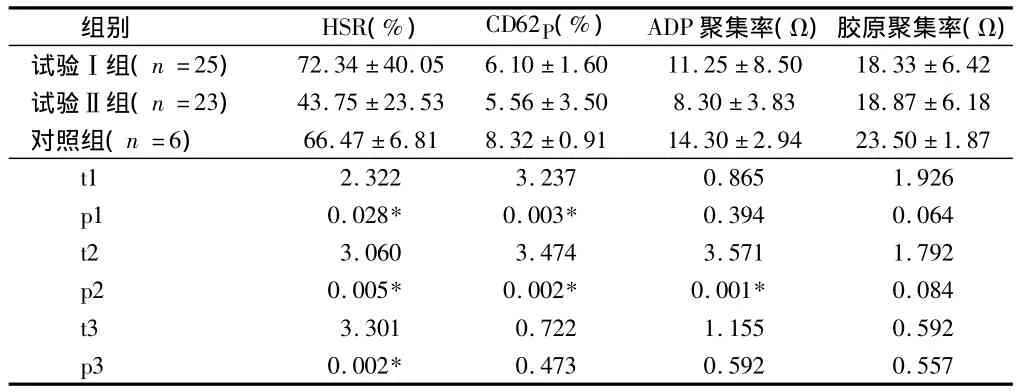
表3 3组去白混合浓缩血小板的功能变化情况±s
组别 HSR(%) CD62P(%) ADP聚集率(Ω)胶原聚集率(Ω)试验Ⅰ组(n=25) 72.34 ±40.05 6.10 ±1.60 11.25 ±8.50 18.33 ±6.42试验Ⅱ组(n=23) 43.75 ±23.53 5.56 ±3.50 8.30 ±3.83 18.87 ±6.18对照组(n=6) 66.47 ±6.81 8.32 ±0.91 14.30 ±2.94 23.50 ±1.87 t1 2.322 3.237 0.865 1.926 p1 0.028* 0.003* 0.394 0.064 t2 3.060 3.474 3.571 1.792 p2 0.005* 0.002* 0.001* 0.084 t3 3.301 0.722 1.155 0.592 p3 0.002*0.473 0.592 0.557
2.4 3组去白混合浓缩血小板第1天代谢指标变化情况 t1、p1分别为试验Ⅰ组与对照组的值,t2、p2分别为试验Ⅱ组与对照组的值,t3、p3分别为试验Ⅰ组与试验Ⅱ组的值,差异有统计学意义(P<0.05)。两试验组的pH值符合GB18469-2012《全血及成分血质量要求》对混合浓缩血小板的要求,但均与对照组差异有统计学意义(P<0.05),两试验组之间差异也有统计学意义(P<0.05);乳酸盐和PCO2比较,试验Ⅱ组显著大于试验Ⅰ组,差异有统计学意义(P<0.05)。见表4。
表4 3组去白混合浓缩血小板第1天代谢指标变化情况±s
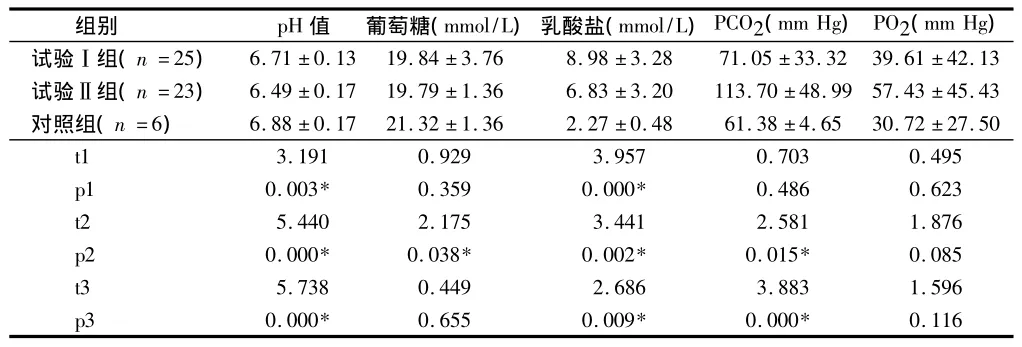
表4 3组去白混合浓缩血小板第1天代谢指标变化情况±s
组别 pH值 葡萄糖(mmol/L)乳酸盐(mmol/L)PCO2(mm Hg)PO2(mm Hg)试验Ⅰ组(n=25) 6.71 ±0.13 19.84 ±3.76 8.98 ±3.28 71.05 ±33.3239.61 ±42.13试验Ⅱ组(n=23) 6.49 ±0.17 19.79 ±1.36 6.83 ±3.20 113.70 ±48.99 57.43 ±45.43对照组(n=6) 6.88 ±0.17 21.32 ±1.36 2.27 ±0.48 61.38 ±4.65 30.72 ±27.50 t1 3.191 0.929 3.957 0.703 0.495 p1 0.003* 0.359 0.000* 0.486 0.623 t2 5.440 2.175 3.441 2.581 1.876 p2 0.000* 0.038* 0.002* 0.015* 0.085 t3 5.738 0.449 2.686 3.883 1.596 p3 0.000* 0.655 0.009* 0.000*0.116
3 讨论
我国利用手工采集全血中血小板资源与欧洲国家相比有很大差距。2004年欧洲国家混合浓缩血小板的应用比率范围为10% ~98%。2007年德国临床应用混合浓缩血小板占40%,2008年达到97%,3%的单采血小板只用于需要HLA/HPA配型的患者[1]。面对国内临床对血小板需求量越来越大的现实,仅仅依靠单采血小板已不能满足临床需求,充分利用手工采集全血中血小板资源、制备去白混合浓缩血小板是解决血站与临床血小板供需矛盾的有效途径。
表1显示,7袋BC汇集制备的产品,血小板含量能够达到1个治疗量,过滤后回收率在90%以上,表2显示白细胞残留量比标准要求的少数10倍,可以减少由白细胞引起的输血反应。BCs在22℃过夜保存期间,BCs中的白细胞仍有吞噬细菌的能力,通过过滤去除白细胞也去除了可能污染的细菌,可以减少患者输注后的败血症风险。
HSR是检测血小板在低渗环境中发生肿胀后,由膜的完整性和能量代谢使肿胀的血小板恢复其原有形状的能力,测定HSR可以预测血小板在体内的存活力[2]。表3显示,试验Ⅰ组的HSR显著高于对照组,而试验Ⅱ组显著低于对照组,但2个试验组的血小板HSR范围为54% ~82%,在文献报道的40% ~80%范围内[2],表明酶标仪测定血小板HSR具有比较好的准确性,操作简便,需要的样本量少,重复性好,检测速度快,一次可以对多份样本测定。
CD62p是血小板活化的重要指标,CD62p存在于血小板α颗粒的内表面,血小板未发生活化时其外表面不表达CD62P,一旦血小板受到各种刺激被激活时,其颗粒膜与质膜发生融合,导致CD62p在质膜上表达而被检测到,成为活化血小板标志。本研究测定的两个试验组的CD62p均比对照组有显著性差异,也比文献报道[两种滤器分别是(8.06 ±4.11)和(10.34±3.26)][3]低。据报道汇集 BC 在离心过程中,有红细胞和白细胞作缓冲,使血小板受到的切割力较小,减少了血小板的制备损伤,使以CD62p为代表的活性标志物减少[4]。
本研究是用电阻法测定血小板的聚集率,同一诱导剂测出的电阻越大,说明血小板的聚集功能越好。血小板聚集率大小与使用的聚集诱导剂的种类有关,ADP是弱的诱导剂,胶原是强诱导剂,胶原能够使血小板产生相当多的α颗粒而使血小板聚集反应增加。表3显示,胶原诱导的聚集率2个试验组和对照组没有显著性差异,而且显著高于ADP诱导的聚集率(P<0.05),并与文献报道的电阻法测定正常人的聚集率(ADP 为6 ~13 Ω,胶原为 10 ~18 Ω)[5]相一致,但与 文 献 报 道 的 比 浊 法 (ADP 70.55%[3],胶 原87.40%[6])低。比浊法和电阻法是两种不同的测定血小板聚集率的方法,据报道两种方法的测定结果不具有可比性,特别在临床检测中不建议两种方法替代使用[5]。
表4显示,2个试验组的pH值符合GB18469-2012《全血及成分血质量要求》对混合浓缩血小板的要求,但与对照组比较,差异有统计学意义(P<0.05),两试验组之间差异也有统计学意义(P<0.05);乳酸盐和PO2试验Ⅱ组显著大于试验Ⅰ组(P<0.05)。这可能与BC过夜保存和使用的血小板保存袋有关:BC在过夜保存期间由于代谢产生CO2,当制成产品后,能呼吸的血小板保存袋(试验I组)可以通透气体,产生的CO2能够从袋内逸出,O2也能够进入保存袋内,维持了介质的pH值,不能呼吸的袋子(试验Ⅱ组)产生的CO2不能逸出,使得CO2分压越来越大,pH值下降。
在提取BC时尽量减少血浆量,使混合血小板中来自各个献血者的血浆量尽量少,再用其中1名男性献血者血浆作为悬浮介质,可以减少 TRALI发生率[7];血小板含量能够达到1个治疗量,方便临床输注,可以作为单采血小板供应不足的补充,使更多的需要输注血小板的患者得到治疗;能够实现血液资源的综合利用,减少浪费;为研究去白混合浓缩血小板的制备工艺和制定标准提供数据支持。
血站制定血小板的供应策略,既要考虑患者的特殊需求,又有考虑现有的资源条件,对于未产生同种免疫的患者,可以输注去白混合浓缩血小板,对于含有HLA抗体或HPA抗体的患者来说,需要输注与患者抗原相匹配的单采血小板。为保证产品的质量安全,不用第一次献血者的血液制备本产品;从节约血液资源角度考虑,应该充分利用手工采集全血中的血小板资源,除非有特殊的临床需求。一个血站单采血小板和去白混合浓缩血小板都应该开展,在全血采集量较少的季节比如节假日或患者的特殊需要应考虑供应单采血小板,在采血旺季应提倡供应去白混合浓缩血小板。
1 Schrezenmeier H,Seifried E.Buffy-coat-derived pooled platelet concentrates and apheresis platelet concentrates:which product type should be preferred.Vox Sanguinis,2010,99:1-15.
2 Murphy S,Rebulla P,Bertolini F,et al.In vitro assessment of the quality of stored platelet concentrates.Transfus Med Rev,1994,8:29-36.
3 王红,刘嘉馨,雷宇,等.2种国产血小板滤器滤除白细胞对体外血小板功能的影响.中国输血杂志,2011,24:232-236.
4 Murphy S.Platelets from pooled buffy coats:an update.Transfusion,2005,45:634-639.
5 乔蕊,李蕾,张捷.全血电阻法血小板聚集试验监测抗血小板治疗的应用评价.实用医学杂志,2011,27:3050-3052.
6 赵凤绵,梁晓虎,张爱红.洗涤混合血小板的质量和部分体外功能的测定.中国输血杂志,2006,19:375-377.
7 Hume HA.TRALI moving toward prevention.Transfusion,2009,49:402-405.
