白藜芦醇顺反异构体及第一三重激发态结构的理论研究
2015-03-23何云清胡启山刘柳斜
何云清,胡启山,胡 文,刘柳斜
(1.四川文理学院化学化工学院,达州 635000; 2.特色植物开发研究四川省高校重点实验室,达州 635000; 3.四川师范大学化学与材料科学学院,成都 610066)
白藜芦醇顺反异构体及第一三重激发态结构的理论研究
何云清1,2,胡启山1,2,胡 文1,刘柳斜3
(1.四川文理学院化学化工学院,达州 635000; 2.特色植物开发研究四川省高校重点实验室,达州 635000; 3.四川师范大学化学与材料科学学院,成都 610066)
在B3LYP/6-311++G(d,p)水平对白藜芦醇顺反异构体及第一三重激发态进行了结构优化、频率计算和自然键轨道(Natural Bond Orbital,NBO)分析.在MP2/6-311++G(d,p)//B3LYP/6-311++G(d,p)水平比较了白藜芦醇顺反异构体的能量.反式白藜芦醇整个分子呈平面结构,顺式白藜芦醇两苯环之间存在约30o扭角.第一三重激发态中两苯环几乎处于互相垂直的关系,C7-H5与C8-H6键也是几乎互相垂直的关系.顺式和反式白藜芦醇C7-C8的σ键成键情况分别为sp1.53-sp1.53和sp1.59-sp1.60,C7与C8各自提供p轨道形成π键,即形成C7=C8双键.三重态中,C7-C8的成键情况为sp1.92-sp1.89,没有p-p π键,C7、C8均还有一个2p轨道未参与杂化,NBO分析证实C7、C8的各自剩下的2p轨道均几乎独立形成了高能量的反键轨道,分别垂直于单羟基和双羟基苯环,C7-C8键长明显长于白藜芦醇顺反异构体.顺式白藜芦醇比反式白藜芦醇的自由能高约1.3-2.5 kcal/mol,反式构型是热力学稳定构型.含时密度泛函方法(Time-Dependent Density Functional Theory,TD-DFT)方法,B3LYP/6-311++G(d,p)水平计算得反式和顺式白藜芦醇最强紫外吸收峰分别在330 nm和319 nm.
白藜芦醇; 异构体; 三重态; 自然键轨道; 前线轨道; UV
1 引 言
白藜芦醇(resveratrol)是一种非黄酮类天然活性多酚化合物,广泛存在于分布于葡萄科(Vitis)、桑科木波罗属(Artocarpus)、桑属(Morus)、山毛榉科假山毛榉属(Nothofagus)、松科松属(Pinus)等植物体内.在自然条件下,它主要以反式构型存在,有抗细菌及真菌、降低血脂、抗血小板凝聚等作用,对动脉粥样硬化、冠心病具有保护作用,对癌变及细胞组织变异都有抑制作用,对癌症有化学预防作用,通过抑制cAMP磷酸二酯酶(PDEs)改善由衰老引起的代谢疾病[1-10].白藜芦醇的功效主要来自于它的反式结构,反式白藜芦醇在物理及化学因素的诱导下可生成顺式异构体[7-9],白藜芦醇顺反异构体结构见图1.Forster在Muliken研究基础上,提出烯烃光致异构化反应是在同一个三重态上发生的,顺反异构体从各自的最低激发单重态经过系间窜跃到达相应的三重态.Hammond等从实验上证实烯烃顺反异构化反应可以通过三重态有效发生[11,12].刘宇平等对反式白藜芦醇热稳定性与光致异构化进行了研究,在4~40℃条件下反式白藜芦醇溶液避光保存600h浓度没有明显下降,在254 nm和365 nm紫外光照射下则迅速发生异构化反应[13].史先敏等的研究则证实反式白藜芦醇具有光不稳定和热不稳定性,在光照和/或加热下有部分转变为顺式白藜芦醇,反式白藜芦醇溶液在太阳光照射下其含量迅速减少,温度的升高对其稳定性影响增加,白藜芦醇热稳定性高于光稳定性,样品在-20、4、30、40、60 ℃放置白藜芦醇溶液60h,-20和4℃处理的溶液在306 nm的吸光度几乎没有变化,31℃处理的溶液306 nm吸光度有少量降低,60℃处理的溶液306 nm处吸光度下降32%[14].文献[13]报道反式和顺式白藜芦醇最大吸收波长分别为306 nm和286 nm,吴波等[15]的研究表明反式白藜芦醇在304 nm和325 nm处有较强吸收,从戴蕴青等[9]研究报道的紫外光谱图可以看出,反式白藜芦醇在302~322 nm范围有较强吸收,顺式白藜芦醇在288 nm左右有较强吸收.对白藜芦醇顺反异构体及第一三重激发态的结构进行详细的理论研究是非常有必要的.本研究采用密度泛函B3LYP[16,17]方法对白藜芦醇顺反异构体及第一三重激发态进行了几何结构、电子结构的理论研究,采用导体极化连续模型(Conductor-like Polarizable Continuum Model,CPCM)[18,19]方法和考虑相关效应的MP2方法对各结构进行了溶剂化效应和相关效应计算.采用含时密度泛函方法(Time-Dependent Density Functional Theory,TD-DFT)在B3LYP/6-311++G(d,p)水平计算了白藜芦醇顺反异构体的紫外光谱.
图1 白藜芦醇顺反异构体Fig. 1 Resveratrol isomers
2 计算方法
在B3LYP/6-311++G(d,p)水平对白藜芦醇顺反异构体及第一三重激发态进行了结构优化、频率计算和自然键轨道(Natural Bond Orbital,NBO)分析.B3LYP/6-311++G(d,p)水平下反式白藜芦醇优化结构中C4-C7、C7-C8、C8-C9的键长分别为1.463、1.346和1.467 Å,C7C8C9C10和C5C4C7C8二面角分别为 -4.00和-3.61度(见表1),对应的晶体X-射线衍射结构参数[20]则分别为1.460、1.333、1.468 Å和-3.0、8.0度,可以看出计算结果与实验结果吻合得很好,说明B3LYP/6-311++G(d,p)水平计算结果是可靠的.同时,采用上述水平优化结构,在MP2/6-311++G(d,p)水平上计算了白藜芦醇顺反异构体在气相、乙醇溶液、水溶液条件下的单点能,进行电子相关效应和溶剂化效应校正,采用的溶剂化模型是CPCM模型,该计算水平记为MP2/6-311++G(d,p)//B3LYP/6-311++G(d,p).我们也在MP2/6-311++G(d,p)优化了白藜芦醇的结构,并没有获得跟实验结果更接近的结构,认为采用考虑电子相关效应的MP2方法优化白藜芦醇的结构是没有必要的.所有计算在GAUSSIAN 09程序包[21]上进行.
3 结果与讨论
3.1 优化构型
图2是B3LYP/6-311++G(d,p) 水平优化得到的白藜芦醇顺反异构体和三重态的结构,部分键长、键角和二面角参数列于表1.
从白藜芦醇顺反异构体结构参数分析:白藜芦醇顺反异构体的各键长、键角数据很接近,C7-C8键长均为1.346 Å,与乙烯的C=C键长(1.337 Å)[22]一致;分子的两苯环中C-C键长在1.37-1.41 Å,键长介于C=C与C-C单键之间,证实苯环的共轭结构;顺式白藜芦醇中C4-C7和C8-C9键长分别为1.472和1.477 Å,反式白藜芦醇中C4-C7和C8-C9键长分别为1.463和1.467 Å,均为分子体系中最长C-C键,但比C-C单键(1.54 Å)短,与C-C单键的差小于与C=C的差,表明在白藜芦醇中C4-C7和C8-C9主要表现为单键性质,具有一定的双键性质;反式白藜芦醇的C7C8C9C10、C9C8C7H5、C5C4C7C8、C4C7C8H6二面角分别为-4.00、-0.64、-3.61和-0.72度,表明C4、C5、C7、C8、C9、C10、H5和H6几乎在同一平面内,又由于苯环的平面结构,反式白藜芦醇的所有原子几乎都在同一平面内;顺式白藜芦醇的C9C8C7H5和C4C7C8H6二面角分别为-174.58和-173.93度,表明C4、C7、C8、C9、H5和H6仍然几乎在同一平面内,而C7C8C9C10和C5C4C7C8二面角分别为39.36和31.71度,表明C9、C10和C4、C5所在的两苯环与C4、C7、C8、C9、H5和H6所在平面并不重合,而是存在约30°的扭角.顺式白藜芦醇中C8C9C10C11和C2C3C4C7二面角分别为177.34和-178.41度,表明C8、C9、C10、C11共平面,C2、C3、C4、C7共平面,即C7、C8分别与相连的苯环共平面;而C10C9C8H6和C5C4C7H5二面角分别为-139.88和-146.89度,表明H5、H6偏离了两平面,而反式白藜芦醇中H5、H6与其它原子共平面.
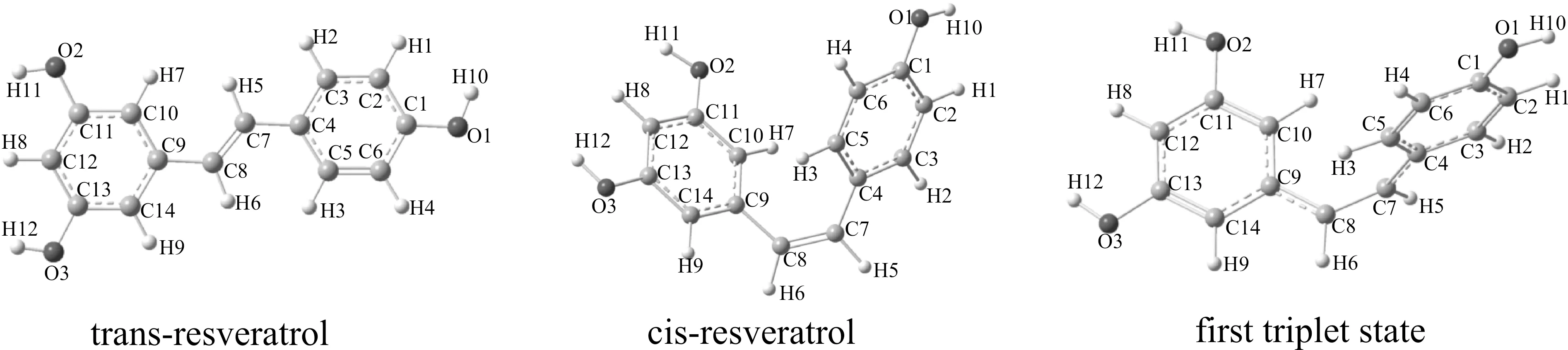
图2 B3LYP/6-311++G(d,p) 水平优化的白藜芦醇顺反异构体及第一三重激发态的结构Fig. 2 Molecular structures of cis/trans-resveratrol and first triplet state opted at B3LYP/6-311++G(d,p) level
表1 B3LYP/6-311++G(d,p)水平下白藜芦醇顺反异构体及第一三重激发态优化结构的键长、键角和二面角参数
Table 1 Bond distances,bond angles and dihedral angles for trans/cis-resveratrol (trans-Res and cis-Res) and first triplet state obtained at B3LYP/6-311++G(d,p) level

trans-Rescis-Restripletstatetrans-Rescis-RestripletstateBondDistances/ÅC1-O11 3681 3691 368C4-C71 4631 4721 414C11-O21 3701 3701 370C7-C81 3461 3461 466C13-O31 3701 3701 371C8-C91 4671 4771 419C1-C21 3941 3951 401C9-C101 4051 4011 419C2-C31 3911 3921 383C10-C111 3881 3911 385C3-C41 4041 4031 424C11-C121 3991 3981 402C4-C51 4091 4061 426C12-C131 3951 3961 402C5-C61 3851 3871 381C13-C141 3921 3921 384C1-C61 3981 3971 401C9-C141 4031 4021 421BondAngles/degreeC2C1C6119 66119 73119 81C10C9C14119 04119 48118 79C2C1O1122 95122 81122 70C10C9C8122 97122 03121 51C6C1O1117 39117 46117 49C14C9C8117 99118 39119 70C1C2C3119 74119 69120 10C11C10C9119 98119 80119 95C2C3C4121 81121 68121 61C10C11O2117 21117 20117 44C3C4C5117 15117 40116 72C10C11C12121 12120 98121 07C3C4C7119 04118 98120 72O2C11C12121 67121 82121 49C5C4C7123 82123 52122 57C13C12C11118 80118 95119 16C6C5C4121 64121 48121 62C14C13C12120 71120 68120 87C5C6C1120 00119 99120 15C14C13O3117 20117 27117 56C8C7C4127 32131 11125 36C12C13O3122 09122 05121 57C7C8C9126 78130 54125 42C13C14C9120 36120 08120 15Dihedralangles/degreeC7C8C9C10-4 0039 36-2 41C5C4C7C8-3 6131 71-2 43C9C8C7H5-0 64-174 58-91 78C4C7C8H6-0 72-173 93-91 70C10C9C8H6176 54-139 88-179 36C5C4C7H5176 84-146 89-179 28C8C9C10C11179 77177 34179 91C2C3C4C7-179 91-178 41-179 91
从白藜芦醇三重态结构参数分析:C7-C8、C4-C7和C8-C9键长分别为1.466、1.414和1.419 Å,相对白藜芦醇顺反异构体基态来说,C7-C8明显的变长,而C4-C7和C8-C9则较明显的缩短了,但三个键均介于单双键之间,C7-C8键与白藜芦醇顺反异构体中C4-C7和C8-C9键长很相近,C4-C7和C8-C9则更接近于苯环中C-C键长,表明三重态中的C7-C8键主要表现为单键性质,C4-C7和C8-C9则类似于苯环中的C-C键;C7C8C9C10、C10C9C8H6、C5C4C7C8、C5C4C7H5二面角分别为-2.41、-179.36、-2.43和-179.28度,表明C7、C8、C9、C10、H6几乎在一个平面内,C4、C5、C7、C8、H5也几乎在一平面内;而C9C8C7H5、C4C7C8H6二面角分别为-91.78和-91.70度,表明C7-H5键几乎垂直于C7、C8、C9、H6所在平面,C8-H6键几乎垂直于C4、C7、C8、H5所在平面,即两苯环几乎处于互相垂直的关系,C7-H5与C8-H6键也是几乎互相垂直的关系.
3.2 电子结构
3.2.1 NBO构成分析
表2列出了白藜芦醇顺反异构体及第一三重激发态的占据键轨道构成情况.
反式白藜芦醇中C1以sp1.63杂化轨道与C2的sp1.89杂化轨道形成σ键,记作sp1.63-sp1.89,C1与C2各自提供p轨道形成π键,记作p-p,即形成C1=C2双键.其它在C3-C4、C5-C6、C7-C8、C9-C14、C10-C11、C12-C13成键情况与C1=C2类似,顺式白藜芦醇的NBO构成情况与反式结构类似,详见表2.三重态中,带有两个羟基的苯环成键情况与白藜芦醇顺反异构体比较没有明显差异,C1-C2、C3-C4、C7-C8之间没有了p-p π键,而C2-C3增加了p-p π键,形成了C2=C3 双键.C7-C8的成键情况为sp1.92-sp1.89,C7、C8杂化轨道的p成分都增加了(没有了p-p π键,C7-C8键长明显长于白藜芦醇顺反异构体.这样的C7-C8有利于键的旋转,从三重态回到基态的白藜芦醇顺反异构体,实现白藜芦醇的光致异构化.C7分别以sp1.92、sp1.66和sp2.55与C8、C4、H5成键,C8分别以sp1.89、sp1.68和sp2.55与C7、C9、H6成键,C7、C8的平均杂化情况均为sp2,那么C7、C8均还有一个2p轨道未参与杂化,NBO分析证实C7、C8的各自剩下的2p轨道均几乎独立地形成了高能量的反键轨道,那么来自C7的p轨道垂直于单羟基苯环,来自C8的p轨道垂直于双羟基苯环.这正是文献中的p-几何状态[13,23].
3.2.2 前线轨道(Frontier Orbital)分析
图3是白藜芦醇顺反异构体及第一三重激发态的最高占据轨道(Highest Occupied Molecular Orbital,HOMO)和最低空轨道(Lowest Unoccupied Molecular Orbital,LUMO).从HOMO看,反式白藜芦醇的HOMO是一个涵盖整个分子体系的共轭分子轨道,而顺式白藜芦醇的HOMO分子轨道主要分布区域为C7、C8和含2个羟基的苯环,所以反式结构的能量应该低于顺式结构,为热力学稳定结构.三重态的HOMO则主要分布于C7、C8和含1个羟基的苯环.三者的LUMO的轨道分布区域与对应的HOMO分布区域类似,只是截面更多,能量更高.

表2 顺/反式白藜芦醇及第一三重激发态的键轨道构成
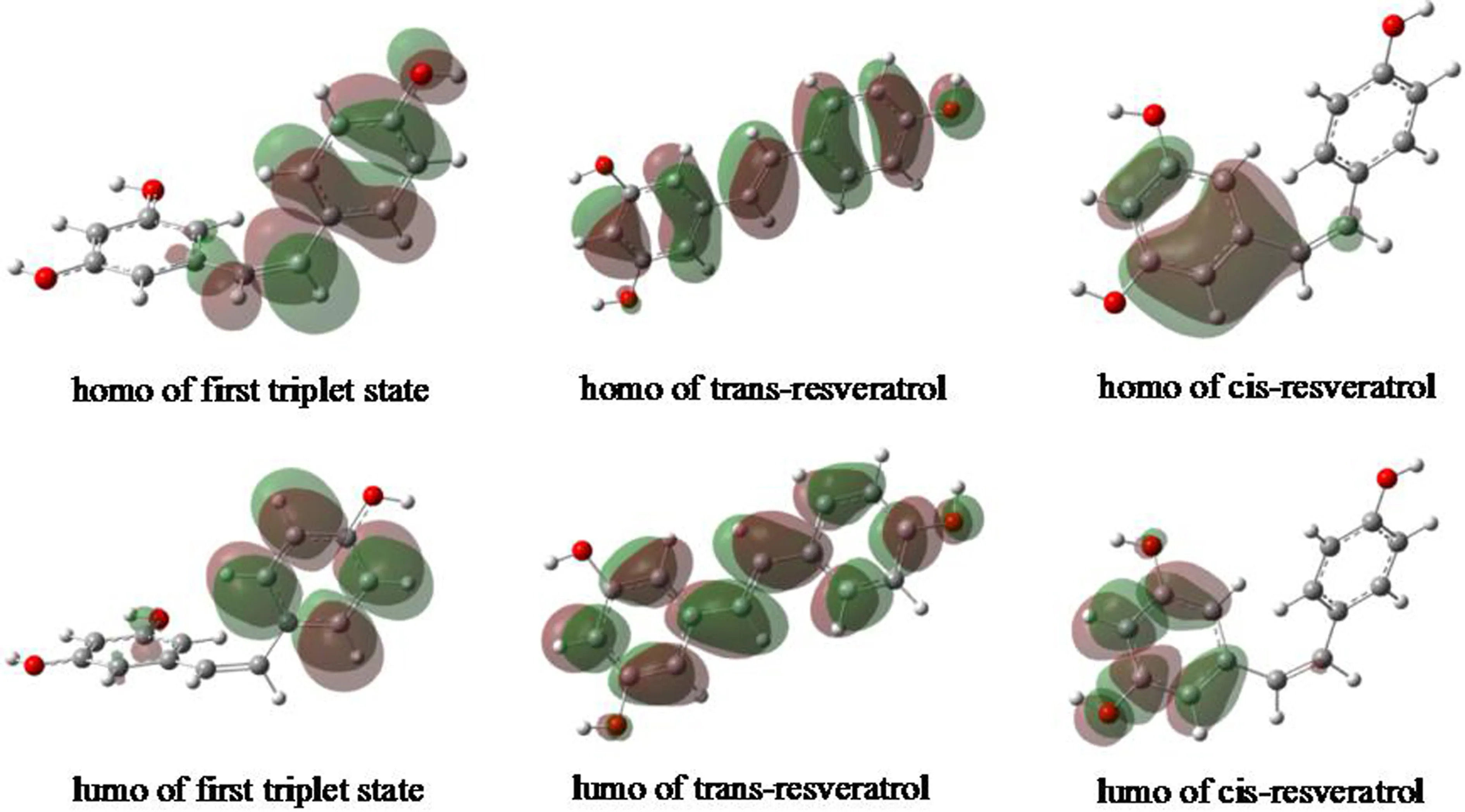
图3 白藜芦醇顺反异构体及第一三重激发态的HOMO和LUMOFig. 3 HOMOs and LUMOs of cis/trans-resveratrol and first triplet state
4 白藜芦醇顺反异构体的相对自由能
采用B3LYP/6-311++G(d,p)水平进行构型优化和振动频率计算,采用B3LYP/6-311++G(d,p)水平优化构型在MP2/6-311++G(d,p)水平在气相、乙醇溶液、水溶液条件下分别进行单点能计算,计算温度为298.15 K.各点自由能由频率计算得到的自由能校正项加上MP2单点能得到.表3列出了在气相、乙醇溶液、水溶液中白藜芦醇顺反异构体的自由能相对值,白藜芦醇顺式构型和反式构型的能量差别不大,考虑电子相关效应的计算结果显示顺式比反式的自由能高约1.3-2.5 kcal/mol,说明反式构型是热力学稳定构型,这有利于反式白藜芦醇制品中反式有效成分的保存.如前所述,顺反式白藜芦醇C7-C8键长均为1.346 Å,与乙烯的C=C键长(1.337 Å)一致,即为双键C7=C8,不能自由旋转,反式白藜芦醇的热稳定性应该比较良好,常温或低温避光储存不会快速的异构化.这一结论与刘宇平、史先敏等的实验研究[13,14]的结果是一致的.

表3 白藜芦醇顺反异构体的自由能相对值(kcal/mol)
5 紫外光谱
顺式白藜芦醇相对于反式白藜芦醇的相对电子能量为4.993 kcal/mol,即顺式能量高于反式,而烯烃光致异构化反应是在同一个三重态上发生的[11,12],故顺式白藜芦醇形成三重激发态需要更高能量.采用TD-DFT方法在B3LYP/6-311++G(d,p)水平进行了激发态能量计算,反式白藜芦醇在286 nm、314 nm和330 nm处有吸收峰,330 nm为最强吸收峰;顺式白藜芦醇在在277 nm、301 nm和319 nm处有吸收峰,319 nm为最强吸收峰.最强吸收均产生于60到61分子轨道能级之间的跃迁.我们的计算与戴蕴青及吴波等[9,15]的实验结论较吻合.而实验吸收峰展宽,是由于C7=C8键轨道是强成键轨道,需要紫外精细光谱.
6 结 论
白藜芦醇顺反异构体的各键长、键角数据很接近,C7-C8为典型的双键,C4-C7和C8-C9主要表现为单键性质,具有一定的双键性质.反式白藜芦醇整个分子呈平面结构,顺式白藜芦醇两苯环不共面.三重态中两苯环几乎处于互相垂直的关系,C7-H5与C8-H6键也是几乎互相垂直的关系.白藜芦醇顺反异构体中C7-C8的σ键成键情况分别为sp1.53-sp1.53和sp1.59-sp1.60,C7与C8各自提供p轨道形成p-p π键,形成C7=C8双键.三重态中,C7-C8为sp1.92-sp1.89σ键,无p-p π键,C7-C8键长明显长于白藜芦醇顺反异构体;C7分别以sp1.92、sp1.66和sp2.55与C8、C4、H5成键,C8分别以sp1.89、sp1.68和sp2.55与C7、C9、H6成键,C7、C8的平均杂化情况均为sp2,C7、C8各自剩下的2p轨道均几乎独立形成了高能量的反键轨道,分别垂直于单羟基和双羟基苯环,即文献中所说的p-几何状态的三重态.反式白藜芦醇的HOMO是一个涵盖整个分子体系的共轭分子轨道,而顺式白藜芦醇的HOMO分子轨道主要分布区域为C7、C8和含2个羟基的苯环,顺式比反式的自由能高约1.3-2.5 kcal/mol,反式构型是热力学稳定构型,常温或低温避光储存反式白藜芦醇不会快速异构化.TD-DFT方法在B3LYP/6-311++G(d,p)水平进行了激发态能量计算,反式白藜芦醇在286 nm、314 nm和330 nm处有吸收峰,330 nm为最强吸收峰;顺式白藜芦醇在在277 nm、301 nm和319 nm处有吸收峰,319 nm为最强吸收峰.最强吸收均产生于60到61分子轨道能级之间的跃迁.
[1] Sun W,Sheng J.Ahandbookofbioactivecompoundsfromplants[M]. Beijing: China Medical-Pharmacological Science and Technology Publishing House,1998: 481 (in Chinese)[孙文基,绳金房. 天然活性成分简明手册[M]. 北京:中国医药科技出版社,1998: 481]
[2] Ganini S,etal.Kinase inhibitors from polygonum cuspidatum[J].NaturalProduct,1993,56: l805.
[3] Siemann E H,Creasy L L,etal.Concentration of the phyeoalexin resveratrol in wine[J].Am.J.Enol.Vitic,1992,43: 49.
[4] Bertelli A A E,Giovannini L,Giannessi D,etal.Antiplatelet activity of synthetic and natured resveratrol in red wine[J].OfficeInternationaldelaVigneetduVin,1995,17: 1.
[5] Jang M,Cai L,Udeani G O,etal.Cancer chemopreventive activity of resveratrol,a natural product derived from grapes[J].Science,1997,275: 218.
[6] Pace-Asciad C R,Hahn S E,etal.The red wine phenolics trans-resveratrol and quercetin block human platelet aggregation and eicosanoid synthesis:Implications for protection against coronary heart disease[J].Clin.ChimicaActa,1995,235: 207.
[7] Deak M,Falk H. On the chemistry of the resveratrol diastereomers[J].MonatsheftefürChemie/ChemicalMonthly,2003,134: 883.
[8] Brent C. Resveratrol isomericmolar absorptivities and stability[J].J.Agric.FoodChem.,1996,44: 1253.
[9] Dai Y Q,Han Y S,Hui B D,etal. Analysis of the geometrical isomers of resveratrol and resveratrol glucoside from red wines produced in China by HPLC[J].JournalofChinaAgriculturalUniversity,2002,7: 14 (in Chinese)[戴蕴青,韩雅珊,惠柏棣,等. 红葡萄酒中白藜芦醇及其糖苷异构体的反相HPLC分析[J]. 中国农业大学学报,2002,7: 14]
[10] Park S J,Ahmad F,Philp A,etal. Resveratrol ameliorates aging-related metabolic phenotypes by inhibiting cAMP phosphodiesterases[J].Cell,2012,148: 421.
[11] Willam M H,Pill-Soon Song.CRChandbookoforganicphotochemistryandphotobiology[M]. Florida: CRC Press Inc.,1995: 3.
[12] Hammond G S,Saltiel J,Lamola A A,etal. Mechanisms of photochemical reactions solution. XXII. Photochemical cis-trans isomerization[J].J.Am.Chem.Soc.,1964,86: 3197.
[13] Liu Y,Wen D,Chen Z,etal. Study on thermostability and photo-isomerization of trans-resveratrol by high performance liquid chromatography and liquid chromatography-electrospray ionization-mass spectrometry[J].ChineseJournalofChromatography,2004,22: 583(in Chinese)
[14] Shi X M,Yan Z M,Xie J H,etal. Study of photo-stability and thermo-stability of resveratrol[J].ChinaSurfactantDetergent&Cosmetics, 2011,41: 204(in Chinese)
[15] Wu B,Zhang H J. Quantitative determination of the (E)- and (Z)-diastereomers of resveratrol and resveratrol glucoside in the roots of Polygonum cuspidatum by HPLC and elementary study on their fluorescence[J].ActaPharmaceuticaSinica.,2006,41: 522(in Chinese)
[16] Beck A D. Densityfunctional thermochemistry. III. the role of exact exchange[J].J.Chem.Phys.,1993,98: 5648.
[17] Parr R G,Yang W.Densityfunctionaltheoryofatomsandmolecules[M]. Oxford: Oxford University Press, 1989.
[18] Barone V,Cossi M. Quantum calculation of molecular energies and energy gradients in solution by a conductor solvent model[J].J.Phys.Chem. A,1998,102: 1995.
[19] Cossi M,Rega N,Scalmani G,etal. Energies,structures,and electronic properties of molecules in solution with the C-PCM solvation model[J].J.Comput.Chem.,2003,24: 669.
[20] Francesco C,Joseph T,Adriel V-E,etal. Structural basis for antioxidant activity of trans-resveratrol: ab initio calculations and crystal and molecular structure[J].J.Agric.FoodChem.,2004,52: 7279.
[21] Frisch M J,Trucks G W,Schlegel H B. Gaussian Inc.,Wallingford CT,2009.
[22] Allen F H,Watson D G,Brammer L,etal. Chapter 9,Sec 5.Typicalinteratomicdistances:organiccompounds.Ininternationaltablesforcrystallography,Vol.C:mathematical,physicalandchemicaltables[M]. 3rd ed.,Prince E,Ed.,Kluwer Academic Publishers: Boston,MA,2004: 790.
[23] Xing Q,Xu R,Zhou Z,etal.Fundamentalorganicchemistry[M]. 2nd ed. Beijing: Higher Education Press, 1994: 813 (in Chinese)
A theoretical study on the structures of cis/trans-resveratrol and the first triplet state
HE Yun-Qing1,2,HU Qi-Shan1,2,HU Wen1,LIU Liu-Xie3
(1. College of Chemistry and Chemical Engineering,Sichuan University of Arts and Science,Dazhou 635000,China;2. Key Laboratory of Exploitation and Study of Distinctive Plants in Education Department of Sichuan Province,Dazhou 635000,China; 3. College of Chemistry and Materials Science,Sichuan Normal University,Chengdu 610066,China)
The geometry optimizations,vibration frequencies,and natural bond orbital (NBO) analysis of cis/trans-resveratrol and the first triplet state were performed at B3LYP/6-311++G(d,p) level,free energies of two isomers were obtained at B3LYP /6-311++G(d,p)//B3LYP/6-311++G(d,p) level. Trans-resveratrol is a planar structure,a torsional angle of benzene rings of cis-resveratrol is about 30o. One benzene ring of the first triplet state is perpendicular to the other,and C7-H5 bond is perpendicular to C8-H6. C7-C8 σ bonds in cis/trans-resveratrol are sp1.53-sp1.53and sp1.59-sp1.60,respectively,and a π bond is formed using p orbital from C7 and C8. C7-C8 in the triplet state is sp1.92-sp1.89σ bond,2p orbital of C7 or C8 forms one high energy antibonding orbital independently,and similar to C8,and is perpendicular to the benzene ring with one hydroxy and two hydroxies,respectively,with its C7-C8 bond length longer than that in cis/trans-resveratrol. Trans-resveratrol is the thermodynamic stable structure because its free energy is lower than that of cis-resveratrol 1.3-2.5 kcal/mol. The strongest ultraviolet absorption peaks of trans- and cis-resveratrol are at 330 nm and 319 nm,respectively,achieved at B3LYP/6-311++G(d,p) level using TD-DFT method.
Resveratrol; Isomers; Triplet state; Natural bond orbital (NBO); Frontier orbital; UV
2014-12-04
特色植物开发研究四川省高校重点实验室开放课题重点项目(sctz201302);四川省大学生创新创业训练项目(201310644016);四川文理学院化学化工学院大学生应用创新能力训练计划项目(hg2014xly03)
103969/j.issn.1000-0364.2015.08.008
O561.1
A
1000-0364(2015)08-0572-07
作者介绍: 何云清(1971—), 女,博士,副教授,主要从事天然产物和量子化学研究. E-mail: heyunqing625@126.com
