三疣梭子蟹血淋巴6种免疫指标对病原菌刺激的响应
2015-03-22韩艳楠王锡波赵青松陈寅儿
韩艳楠, 王 丽, 王锡波, 赵青松, 金 珊, 陈寅儿
(宁波大学 海洋学院, 宁波 315211)
三疣梭子蟹血淋巴6种免疫指标对病原菌刺激的响应
韩艳楠, 王 丽, 王锡波, 赵青松, 金 珊, 陈寅儿
(宁波大学 海洋学院, 宁波 315211)
为进一步了解三疣梭子蟹对病原菌侵入的免疫调节机制,分别采用0.1 mL浓度约为107cells·mL-1的溶藻弧菌(Vibrioalginolyticus)和葡萄牙假丝酵母(Candidalusitaniae)菌悬液注射三疣梭子蟹,在实验第1、2、3、4、5、6和7 d分别检测蟹血细胞总数(THC)、血细胞吞噬指数(PI)及呼吸爆发、总酚氧化酶(POT)、丝氨蛋白酶(SP)和血清酚氧化酶(PO)活性等6种免疫相关指标的变化。结果显示,两种病原菌刺激后三疣梭子蟹血淋巴6种免疫相关指标均出现了极显著的变化(P<0.01),不同菌刺激后同一免疫指标的变化趋势基本相同但不同步。THC呈下降-上升-恢复的变化趋势,而PI、呼吸爆发、POT、SP和PO等活性均呈迅速上升-逐渐下降-恢复的变化趋势。说明低剂量病原菌的刺激确实可以诱导三疣梭子蟹血淋巴免疫指标的活性,但对各免疫指标的诱导强度及免疫指标的响应时间各不相同。
三疣梭子蟹;溶藻弧菌;葡萄牙假丝酵母;血淋巴;免疫指标
三疣梭子蟹(Portunustrituberculatus)广泛分布于中国南北各海域,是中国沿海地区重要的养殖品种及出口畅销产品。但是,随着养殖规模和集约化程度的不断提高、养殖大环境的逐渐恶化、养殖中水产药物滥用及养殖管理措施不当等诸多原因,导致三疣梭子蟹养殖病害频发,且日趋严重。据报道,对养殖三疣梭子蟹危害较大的病原主要有溶藻弧菌(Vibrioalginolyticus)[1]、副溶血弧菌(V.Parahaemolyticus)[2]、恶臭假单胞菌(Pseudomonasputida)[3]、葡萄牙假丝酵母(Candidalusitaniae)[1]、白斑综合征病毒(white spot syndrome virus, WSSV)[4]和血卵涡鞭虫(Hematodiniumsp.)等[5]。特别是由溶藻弧菌(V.alginolyticus)和葡萄牙假丝酵母(C.lusitaniae)引起的三疣梭子蟹乳化病,发病率高,危害严重,是当前三疣梭子蟹养殖中的主要病害。
由于甲壳动物缺乏获得性免疫,但是它们具有完善的先天免疫系统。当外界病原菌入侵时,宿主的模式识别蛋白能够快速特异性地识别并结合病原菌,一方面促使宿主血细胞的吞噬作用,另一方面通过激活酚氧化酶原激活系统等免疫通路产生一系列具有生理活性的物质,这些活性物质可通过多种方式参与宿主防御反应,最终实现黑化、硬化、伤口愈合及免疫保护的作用[6-7]。而血细胞总数(THC)、吞噬指数(PI)和呼吸爆发是血细胞杀菌机能的重要指标[8-9],丝氨酸蛋白酶(SP)和酚氧化酶(PO)是酚氧化酶原激活系统发挥免疫功能的重要参与者[10-11],因此,它们在甲壳动物抗外源病菌入侵的免疫应答中都起着重要的作用。作者在研究病原菌刺激下三疣梭子蟹模式识别蛋白脂多糖-β-1,3-葡聚糖结合蛋白(LGBP)基因和酚氧化酶(PO)基因组织表达的基础上[12],采用低剂量病原菌——溶藻弧菌和葡萄牙假丝酵母分别刺激三疣梭子蟹,检测其血细胞总数(THC)、血细胞吞噬指数(PI)及呼吸爆发、总酶氧化酶(POT)、丝氨酸蛋白酶(SP)和血清酚氧化酶(PO)等6种非特异性免疫相关指标的变化,以期为进一步探讨三疣梭子蟹对病原菌的免疫应答机制提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验用蟹及实验用菌
实验用三疣梭子蟹(P.trituberculatas)购自宁波鄞州梭子蟹养殖场,同一批个体,蟹体健康活泼、附肢完整,体重200~250 g,共150只。实验用水为海水精配置,水温为(20±2)℃,盐度为28±2,pH值为8.0±1;每天及时吸掉排泄物并根据水质情况换水1~2次。
溶藻弧菌(V.alginolyticus)和葡萄牙假丝酵母(C.lusitaniae)用于病原菌刺激实验,酿酒酵母(Saccharomycescerevisiae)用于血细胞吞噬实验,3种菌均由宁波大学水产病害防控实验室提供。
1.1.2 主要药品和试剂
3,4-二羟苯丙氨酸(L-多巴,L-dihydroxyphenylalanine, Sigma),氯化硝基四氮唑蓝(NBT),N,N-二甲基甲酰胺(DMF),BAPNA(Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐),二甲基亚砜,1 mg/mL脂多糖(Sigma),1 mg/mL胰蛋白酶,ACD抗凝剂,10 mmol/L PBS缓冲液,50%乙酸溶液,0.85%生理盐水。
1.2 实验方法
1.2.1 病原菌刺激实验
实验设3个组,实验组分别注射溶藻弧菌和葡萄牙假丝酵母,对照组注射同量生理盐水。每组共50只蟹,分别用1 mL无菌注射器于第3步足基部注射0.1 mL用0.85%生理盐水配置的约107cells·mL-1的菌悬液或0.1 mL 0.85%的生理盐水。
1.2.2 样品采集和处理
在实验开始后0、1、2、3、4、5、6和7 d分别从每个实验组中随机取5蟹,用无菌注射器从第二或三步足基部抽取血淋巴用于制备血清、抗凝血和血细胞破碎物上清液(HLS),已抽取血淋巴的蟹另外饲养,不再进行本次实验。HLS的制备方法参考Sung等[13]的方法作适当修改后如下:用含有5 mL 4℃预冷的ACD抗凝剂的10 mL灭菌玻璃注射器从蟹的第二或三步足基部抽取5 mL血淋巴液制成抗凝血,3 000 r/min(4℃)离心5 min,弃上清液,血细胞沉淀用4℃预冷的10 mmol/L PBS缓冲液(pH值为7.0)按上法离心洗涤3次,将血细胞沉淀在5 mL PBS中重新悬浮,然后置于冰浴中用超声波细胞破碎仪匀浆(每次5 s,共5次),最后在4℃下12 000 r/min离心20 min,所得的上清液即为HLS,并保存于-40℃备用。
1.2.3 血淋巴6种免疫相关指标的测定
THC的测定按Neubuer氏改良方法[14]进行,血细胞PI的测定参照彭程远等[15]的方法进行。血细胞呼吸爆发活性测定采用NBT还原法[16]。血细胞总酚氧化酶(POT)测定按照Sung[13]的方法进行,酶活性定义为:28℃下每分钟D490 nm增加0.001为1个酶活性单位(U)。血清PO测定参照刘振兴[17]等方法进行,酶活性定义为:室温环境下,以每分钟D490 nm增加0.001定义为1个酶活性单位(U)。SP测定参照潘鲁青[18]的方法。
1.2.4 数据处理及分析
所有实验数据处理利用SPSS16.0软件进行,采用单因素方差分析(ANOVA),差异极显著(P<0.01)用“**”表示;差异显著(0.01
2 结果
2.1 病原菌刺激对三疣梭子蟹血细胞总数(THC)的影响
注射溶藻弧菌和葡萄牙假丝酵母后,三疣梭子蟹THC的变化见表1。与对照组相比,各实验组THC均呈先急剧下降再逐渐恢复到正常水平的变化趋势。两个实验组在实验第2天THC均降到最低,分别下降了37%和31%。溶藻弧菌注射组在实验第3~4天THC虽略有回升,但仍显著低于对照组(P<0.05),至实验第5天才基本恢复到正常水平;葡萄牙假丝酵母注射组THC则从实验第3天起就基本恢复到正常水平。
2.2 病原菌刺激对三疣梭子蟹血细胞吞噬指数(PI)的影响
注射溶藻弧菌和葡萄牙假丝酵母后,三疣梭子蟹血细胞PI的变化见表2。与对照组相比,各实验组血细胞PI均呈先升高后降低的变化趋势。溶藻弧菌注射组血细胞PI在实验第1~4天均显著高于对照组(P<0.05),峰值出现在实验第3天,为3.86±0.08(P<0.01),其它各实验时间点没有显著变化;葡萄牙假丝酵母注射组血细胞PI在实验第1和第2天就出现了极显著上升(P<0.01),在实验第2天达到最大值为4.66±0.16,随后逐渐下降,但在实验第3和第4天仍显著高于对照组(P<0.05),之后再下降恢复到正常水平。
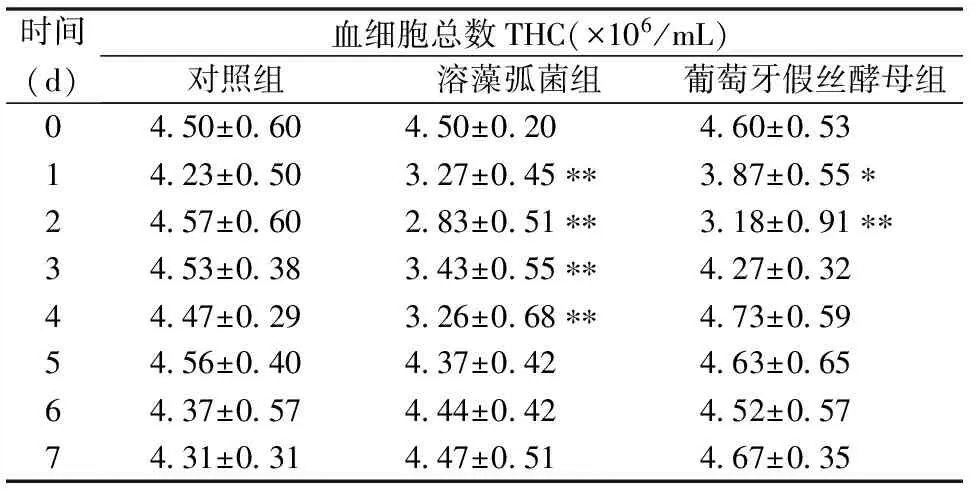
表1 病原菌刺激后三疣梭子蟹THC的变化
数据表示为平均数±标准误(n=5),“*”表示实验组和对照组存在显著性差异(P<0.05),“**”表示实验组和对照组存在极显著性差异(P<0.01)。下同。
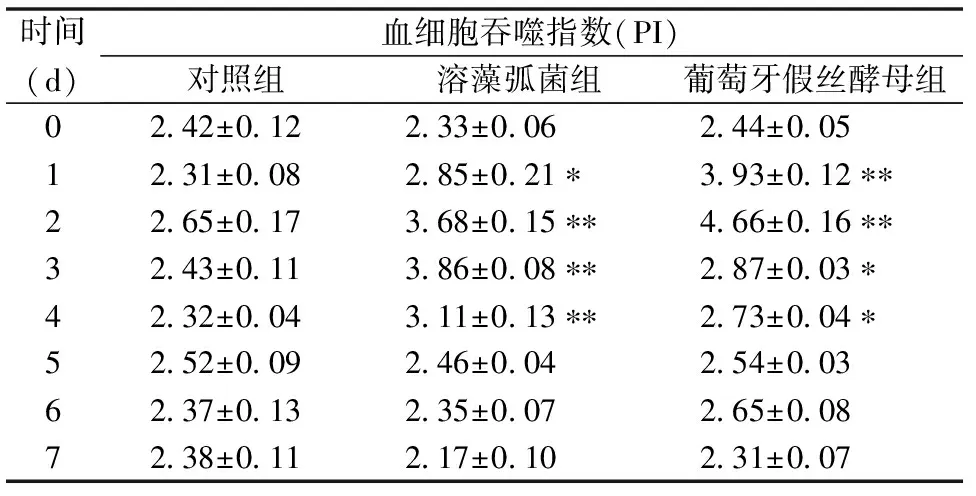
表2 病原菌刺激后三疣梭子蟹血细胞PI的变化
2.3 病原菌刺激对三疣梭子蟹血细胞呼吸爆发活性的影响
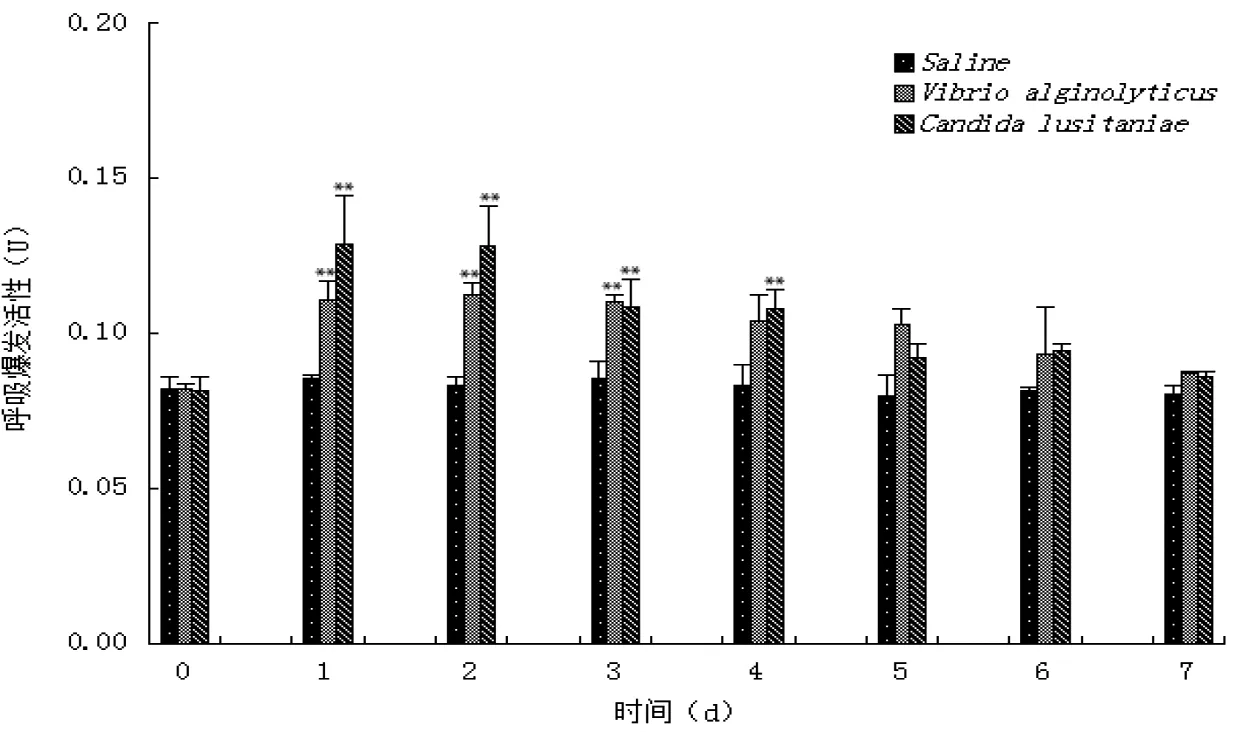
图 1 病原菌刺激后三疣梭子蟹血细胞呼吸爆发活性的变化
“**”表示差异极显著(P<0.01),“*”表示差异显著(P<0.05),下同。
注射溶藻弧菌和葡萄牙假丝酵母后,三疣梭子蟹血细胞呼吸爆发活性的变化见图1。与对照组相比,各实验组血细胞呼吸爆发活性均呈先升高后降低的变化趋势。溶藻弧菌注射组血细胞呼吸爆发活性在实验1~3天均极显著高于对照组(P<0.01),这3天的血细胞呼吸爆发活性基本都维持在0.11 U左右,第4天后逐渐下降,并最终恢复至初始水平。葡萄牙假丝酵母注射组血细胞呼吸爆发活性在实验第1~2天就极显著升高,分别为(0.129±0.02)U和(0.128±0.01)U(P<0.01),第3~4天虽有下降,但仍显著高于对照组(P<0.01),实验第5天后才逐渐恢复到正常水平。
2.4 病原菌刺激对三疣梭子蟹血细胞总酚氧化酶(POT)活性的影响
注射溶藻弧菌和葡萄牙假丝酵母后三疣梭子蟹血细胞POT活性的变化见图2。与对照组相比,各实验组血细胞POT活性均呈先升高后降低的变化趋势。溶藻弧菌注射组血细胞POT活性在整个实验周期内均极显著高于对照组(P<0.01),峰值出现在实验第3天,为(24.60±2.27) U(P<0.01)。葡萄牙假丝酵母注射组血细胞POT活性在实验第1~6天也极显著高于对照组(P<0.01),峰值出现在实验第2天,为(27.30±1.59) U(P<0.01),实验第7天虽仍高于对照组,但变化不显著(P>0.05)。
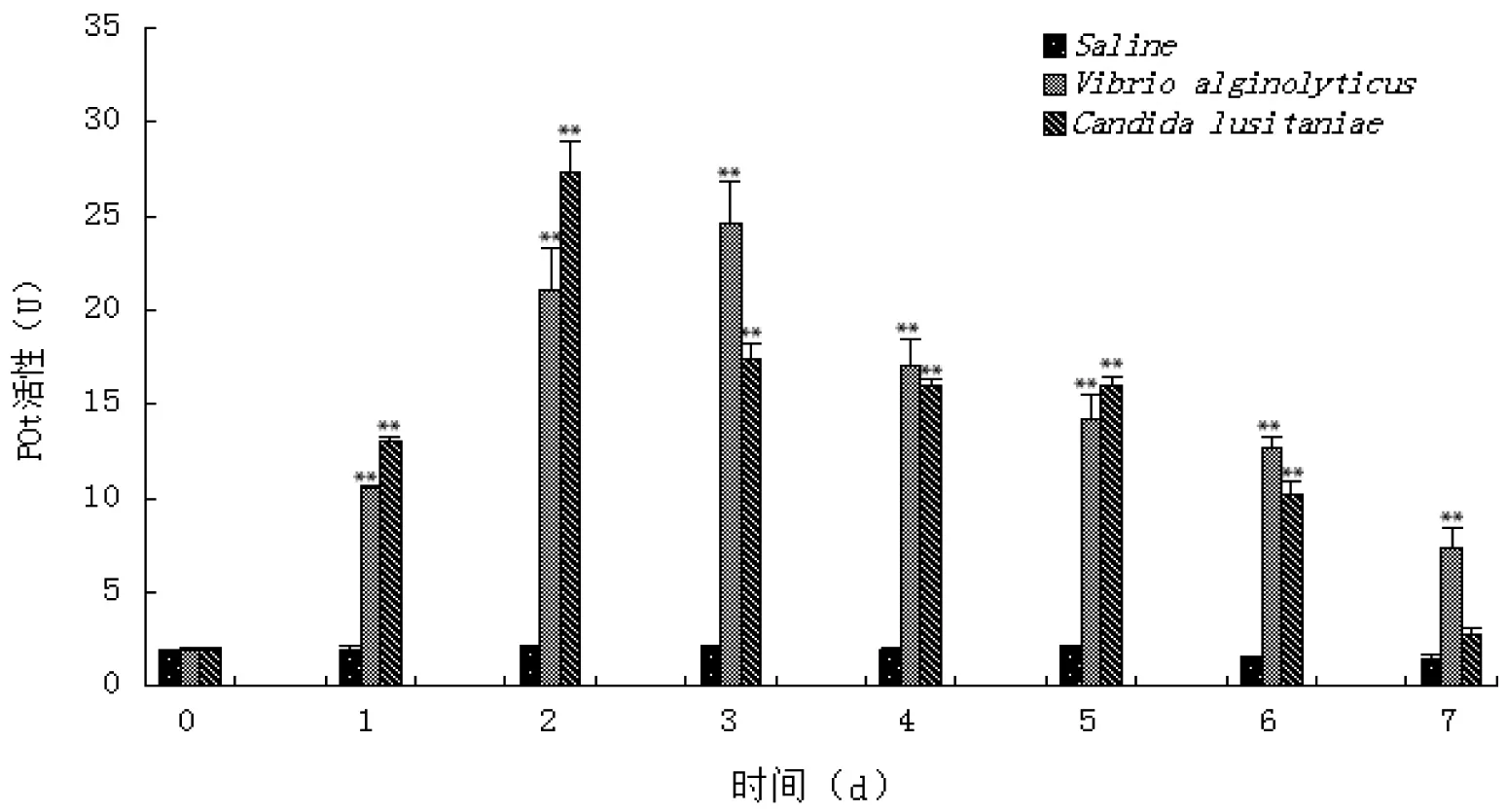
图2 病原菌刺激后三疣梭子蟹血细胞POT的变化
2.5 病原菌刺激对三疣梭子蟹血清酚氧化酶(PO)活性的影响
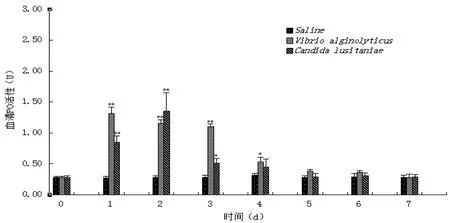
图3 病原菌刺激后三疣梭子蟹血清PO的变化
注射溶藻弧菌和葡萄牙假丝酵母后三疣梭子蟹血清PO活性的变化见图3。与对照组相比,各实验组血清PO活性均呈先升高后降低的变化趋势,两实验组在实验第1天血清PO活性就出现显著升高现象,分别在实验第1天和第2天达到峰值,为(1.32±0.10) U(P<0.01)和(1.35±0.30) U(P<0.01),其后都呈下降趋势,溶藻弧菌注射组血清PO活性在实验第6天基本恢复正常水平,而葡萄牙假丝酵母注射组血清PO活性在实验第5天恢复正常水平。
2.6 病原菌刺激对三疣梭子蟹血细胞丝氨酸蛋白酶(SP)活性的影响
注射溶藻弧菌和葡萄牙假丝酵母后三疣梭子蟹血细胞SP活性的变化见图4。由图4可见,与对照组相比,各实验组血细胞SP活性均呈先逐渐升高后再降低的变化趋势,两实验组在实验第1天血细胞SP活性基本没有变化,实验第2天均出现显著升高现象。溶藻弧菌注射组血细胞SP活性在实验第3~4天均极显著高于对照组(P<0.01),峰值出现在实验第3天,为(0.19±0.003)U(P<0.01);在实验第2、5、6天显著高于对照组(P<0.05),至实验第7天基本恢复正常水平。葡萄牙假丝酵母注射组血细胞SP活性在实验第2~6天均极显著高于对照组(P<0.01),5天的血细胞SP活性基本都维持在0.19 U左右,实验第7天虽有下降,但仍显著高于对照组(P<0.05)。
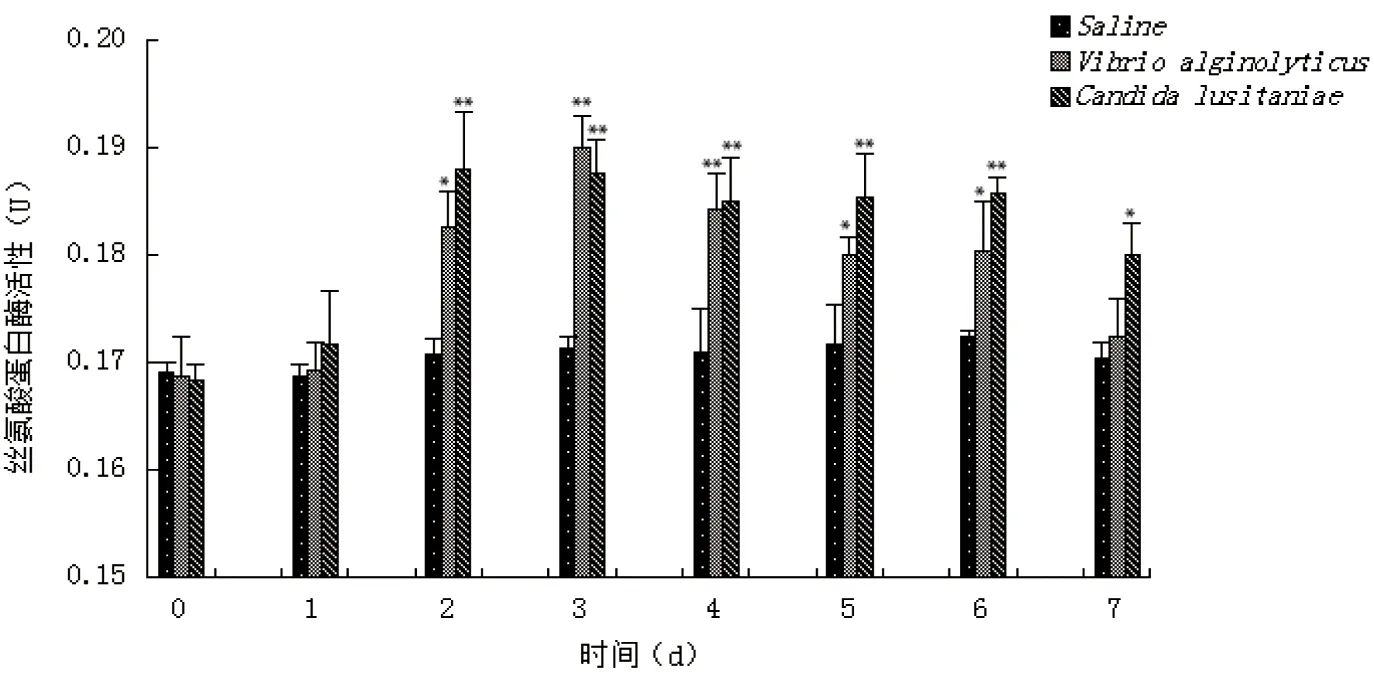
图4 病原菌刺激后三疣梭子蟹血细胞SP活性的变化
3 讨论
由于甲壳动物只有先天免疫系统,因此,其血细胞的免疫功能在机体的抗病免疫中占有重要地位。三疣梭子蟹血细胞主要有无颗粒细胞、小颗粒细胞和大颗粒细胞,它们主要参与机体的血液凝集、吞噬作用、包囊作用及节结形成、伤口修复等作用[19]。当外界病原入侵时,血细胞作为机体免疫的第二道屏障即刻起着吞噬和包囊病原的作用,故在短时间内会造成血淋巴中细胞总数下降。刘振兴[17]、Sung[20]和谢建军[21]等分别用嗜水气单胞菌和溶藻弧菌注射克氏螯虾、罗氏沼虾、三疣梭子蟹后证实,3种虾蟹的THC都呈先降低后逐渐恢复的变化趋势,在实验24 h内均显著低于对照组。而本实验结果也表明,经溶藻弧菌和葡萄牙假丝酵母刺激后2 d内三疣梭子蟹THC分别在实验4 d内和2 d内显著低于对照组,说明外界菌侵入后血细胞短时间内就积极地参与到了清除病原菌的过程当中,从而造成血淋巴液中细胞数下降,而在实验第3~4天溶藻弧菌血细胞数明显少于酵母菌组,这可能与溶藻弧菌毒性较强有关。此外,实验结果也显示溶藻弧菌和葡萄牙假丝酵母0.1 mL 107cells·mL-1的感染量不会在短时间内对三疣梭子蟹造血器官造成损害。
血细胞的吞噬活性在一定程度上可以反映动物机体的健康状况,外界异物可以刺激血细胞提高其吞噬能力[22]。如对克氏原螯虾和扇贝注射病毒和细菌可显著提高它们血细胞的吞噬活性[23-26]。本实验结果也显示,注射溶藻弧菌和葡萄牙假丝酵母后,三疣梭子蟹血细胞的PI在实验第1天就出现显著上升趋势,实验4 d内均显著高于对照组,且血细胞对葡萄牙假丝酵母的吞噬能力更强。
酚氧化酶是一类含铜的氧化酶,它广泛存在于动植物和微生物体内,在分子氧存在下,能把酚类氧化成邻苯醌或对一苯醌,醌在非酶促条件下可以形成黑色素,同时也产生一些抗菌活性物质。因此,酚氧化酶被认为是一种参与机体免疫的重要因子[29],尤其在甲壳动物抗微生物免疫中至关重要[11,16,20]。本实验结果显示,注射溶藻弧菌和葡萄牙假丝酵母后,三疣梭子蟹血细胞POT和血清PO活性在实验第1天均迅速上升,两实验组POT在整个实验期间基本都维持在较高水平,PO仅在实验4 d内明显高于对照组,实验第5天后已基本恢复正常水平,说明病原菌刺激确实可以在一定时间内诱导血细胞POT和血清PO活性的增强,且对血细胞POT的诱导作用大于血清PO。这是因为正常情况下甲壳动物的PO是以无活性的酚氧化酶原(proPO)的形式存在于血细胞的颗粒中,只有当外界病原菌侵入后才能激活酚氧化酶原激活系统,使proPO转化为PO,而血清PO一部分来源于血细胞破碎,一部分来源于血蓝蛋白[30],因此血清PO的量可能低于血细胞POT。另外,本实验结果也表明,溶藻弧菌和葡萄牙假丝酵母对血细胞POT和血清PO活性的诱导趋势和诱导强度基本相同。
丝氨酸蛋白酶是一个蛋白酶家族,具有广泛的生物学功能[10, 32-33]。在无脊椎动物中,丝氨酸蛋白酶主要介导胚胎发育及免疫应答中的蛋白水解级联反应,当外界病原侵入时,丝氨酸蛋白酶可以迅速参与激活酚氧化酶原激活系统等免疫通路,调控血淋巴凝结、抗菌肽合成、黑化包裹病原体等多种免疫防御反应[10,34]。目前关于甲壳动物丝氨酸蛋白酶的报道很少,主要是针对基因的克隆及表达,已有的研究显示丝氨酸蛋白酶基因主要在血细胞、鳃、肝胰腺、胃等组织中表达,细菌刺激能诱导丝氨酸蛋白酶基因的表达[32-33,35]。本实验针对三疣梭子蟹血细胞丝氨酸蛋白酶活性进行研究,结果显示,经溶藻弧菌和酵母菌刺激后两实验组丝氨酸蛋白酶活性在实验第2天均出现了显著升高现象,并在随后的整个实验期间基本保持较高水平,说明丝氨酸蛋白酶在机体的抗菌免疫中确实起着重要作用。
[1]王国良, 金 珊, 陈寅儿, 等. 三疣梭子蟹肌肉乳化病的病原及其致病性研究[J]. 海洋科学进展, 2006, 24(4):526-531.
[2]阎斌伦, 梁立国, 张晓君. 三疣梭子蟹主要病害研究进展[J]. 水产科技情报, 2010, 37(1):29-37.
[3]许文军, 施 慧, 徐汉祥, 等. 养殖梭子蟹血卵涡鞭虫感染的初步研究[J]. 水产生物学报, 2007, 31(9):637-640.
[4]王高学, 黄增荣, 袁 明. 三疣梭子蟹牛奶病病原的分离鉴定[J]. 西北农林科技大学学报, 2007, 35(6):29-33.
[5]许文军, 绳秀珍, 施 慧, 等. 白斑综合征病毒感染梭子蟹试验及组织病理学观察[J]. 上海水产大学学报, 2007, 16(1):33-39.
[6]Glinski Z, Jarosz J. Molluscan immune defenses[J]. Arch Immunol Ther Exp, 1997, 45(2/3): 149-155.
[7]肖克宇. 水产动物免疫学[M]. 北京:中国农业出版社, 2011, 102-137.
[8]Welch W D, Devlin P. Analysis and comparison of the luminal-dependent chemiluminescence response of alveolar macrophages and neutrophils[J]. Reticuloendothel Soc, 1980, 28:273-283.
[9]Horan T D, Mcpherson T A. Association of neutropjil chemiluminescence with microbicidal activity[J]. Clin Immunol Immunophathol, 1982, 22:259.
[10]高 坤, 邓祥元, 郭锡杰. 免疫系统中丝氨酸蛋白酶的研究进展[J].免疫学杂志,2010,26(11):1003-1007.
[11]吴 曙, 王淑红, 王艺磊, 等. 软体动物和甲壳动物酚氧化酶的研究进展[J]. 动物学杂志, 2009, 44(5): 137-146.
[12]王锡波, 金 珊, 陈寅儿,等. 不同病原菌刺激下三疣梭子蟹主要组织LGBP基因的时序表达[J]. 生物学杂志,2013, 30(6). 5-9.
[13]Sung H H, Chang H J, Her C H, et al. Phenoloxidase activity of hemocytes derived fromPenaeusmonodonandMacrobrachiumrosenbergii[J]. J Invertebr Pathol, 1998, 71: 26-33.
[14]解景川,赵 静.生理学实验[M]. 北京:高等教育出版社, 2002, 57-60.
[15]彭程远, 谢 俊, 金 珊, 等. 鰤鱼诺卡氏菌全肽聚糖对乌鳢非特异性免疫力的影响[J]. 动物营养学报, 2013, 25(9): 2150-2159.
[16]Song Y L, Hsieh Y T. Immunostimulation of tiger shrimp (Penaeusmondon) hemocytes for generation of microbicidal substances:analysis of reactive oxygens pecies[J]. Dev Comp Immunol, 1994, 18(3):201-209.
[17]刘振兴, 陈昌福, 高 宇, 等. 嗜水气单胞菌对克氏原螯虾免疫相关因子活性的影响[J]. 华中农业大学学报, 2011, 30(3):358-363.
[18]潘鲁青, 朱现晔, 景福涛. 低溶解氧对凡纳滨对虾酚氧化酶原激活系统和相关免疫因子的影响[J]. 海洋湖沼通报, 2012, 2:1-10.
[19]周 晖. 常见虾蟹血细胞染色观察及分类研究[D]. 广州:暨南大学, 2004.
[20]Sung H H, Hwang S F, Tasi F M. Response of giant freshwater prawn(Macrobrachiumrosenbergii) to challenge by two strains ofAeromonasspp.[J]. J Invertebr Pathol, 2000, 76:278-284.
[21]谢建军, 许文军, 施 慧, 等. 溶藻弧菌诱导对三疣梭子蟹血淋巴非特异性免疫水平的影响[J]. 水产学报, 2011, 35(9):1392-1397.
[22]Shi L. Cloning and characterization of a putative inhibitor of melanization fromAnophelesgambiae[J]. Insect Mol Biol, 2006, 15:313-320.
[23]李海兵, 宋晓玲, 韦 嵩, 等. WSSV感染对克氏原螯虾血细胞吞噬和肝胰腺磷酸酶活性的影响[J]. 渔业科学进展, 2011, 32(2):78-82.
[24]Johansson M W, Keyser P, Sritunyalucksana K. Crustacean heamocytes and haematopoiesis[J]. Aquaculture, 2000, 191(1-3):45-52.
[25]许秀芹, 王宜艳, 孙虎山. 病毒感染对栉孔扇贝血细胞类型和功能的影响[J].上海水产大学学报, 2007,16(3):242-247.
[26]孙虎山, 李光友. 栉孔扇贝血细胞的吞噬作用及其扫描电镜研究[J]. 高技术通讯, 2001(4):16-19.
[27]王宝杰, 王 雷. 中国对虾血细胞吞噬活动中超氧阴离子(O2-)的产生[J]. 中国水产科学, 2003, 10(1):14-18.
[28]Munoz M, Cedeno R, Rodriguez J, et al. Measurement of reactive oxygen intermediate production in haemocytes of the penaeid shrimp,Penaeusvannamei[J]. Aquaculture, 2000, 191:89-107.
[29]刘永贵, 李 义, 王 玥. 嗜水气单胞菌微胶囊疫苗对中华绒螯蟹免疫机能的影响[J]. 饲料工业, 2009, 30(8):24-27.
[30]庞秋香, 庞书香, 赵博生. 酚氧化酶及其酶原的生化特性与分子生物学研究进展[J].现代生物医学进展, 2008, 8(1):196-200.
[31]潘鲁青, 李彦飞. 注射病原菌对凡纳滨对虾血蓝蛋白合成、酚氧化酶活力的影响[J]. 中国海洋大学学报, 2009, 39(5):889-896.
[32]许振龙. 中国明对虾丝氨酸蛋白酶基因的研究[D]. 济南:山东大学, 2007.
[33]李倩倩. 三疣梭子蟹(Portunustrituberculatus)丝氨酸蛋白酶及其同源物的基因克隆和表达分析[D]. 青岛:中国科学院海洋研究所, 2012.
[34]马照鹏. 中华绒螯蟹模式识别丝氨酸蛋白酶(EsPRSP)和丝氨酸蛋白酶抑制剂(Esserpin)基因的表达与功能研究[D]. 青岛:中国科学院海洋研究所, 2013.
[35]刘逸尘. 中国明对虾体内凝结作用相关免疫基因的克隆与表达研究[D]. 青岛:中国科学院海洋研究所, 2005.
Effects of the six immune indexes ofPortunustrituberculataschallenged by different pathogens
HAN Yan-nan, WANG Li, WANG Xi-bo, ZHAO Qing-song, JIN Shan, CHEN Yin-er
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
In order to research the immune effect of different pathogen forPortunustrituberculatus, the hemolymph immune parameters including the haemocytes phagocytic index(PI), total hemocytes count (THC), respiratory burst activity, total phenoloxidase (POT) activity, serum phenoloxidase (PO) activity and serine proteases (SP) activity were evaluated inP.trituberculatasafter stimulated byVbrioalginolyticusandCandidalusitaniaewith the concentration of 107cells mL-1, and took samples on the day 1, 2, 3, 4, 5, 6 and 7 post-injection. The results indicated that the THC showed a down-up then recovered trend after stimulation, and the PI, respiratory burst, POT, serum PO and SP activities are consistant, showing a up-down and then recovered trend. The above results illustrated thatP.trituberculatusinfected by pathogen in low dosage has a significant regulating effect on the hemolymph immune indexes, but the strength and response time of regulating effect are different.
Portunustrituberculatas;Vbrioalginolyticus;Candidalusitaniae; hemolymph; immune indexes
2015-01-06;
2015-01-22
浙江省教育厅项目(Y201224126);宁波市科技创新团队(2011B81003);宁波大学学科项目(XKL11093)
韩艳楠,硕士研究生, 研究方向为水产动物病害防控,E-mail:1157144897@qq.com;
赵青松,高级实验师,主要研究方向为水产养殖及病害防控,E-mail:zhaoqingsong@nbu.edu.cn。
S945
A
2095-1736(2015)05-0036-05
doi∶10.3969/j.issn.2095-1736.2015.05.035
