水稻窄叶突变体nl(t)的遗传分析与基因定位
2015-03-22潘银林毛毕刚胡远艺郭李勤阳和华赵炳然1
潘银林, 毛毕刚, 胡远艺, 郭李勤,彭 彦, 韶 也, 阳和华, 赵炳然1,
(1. 中南大学研究生院隆平分院 杂交水稻国家重点实验室, 长沙 410125;2. 国家杂交水稻工程技术研究中心, 长沙 410125)
水稻窄叶突变体nl(t)的遗传分析与基因定位
潘银林1, 2, 毛毕刚2, 胡远艺2, 郭李勤2,彭 彦2, 韶 也2, 阳和华2, 赵炳然1,2
(1. 中南大学研究生院隆平分院 杂交水稻国家重点实验室, 长沙 410125;2. 国家杂交水稻工程技术研究中心, 长沙 410125)
研究将小粒野生稻基因组DNA通过“穗茎注射法”导入恢复系RH78后产生变异,得到突变体材料nl(t)。遗传分析表明,突变体窄叶性状是由一对隐性核基因控制的,利用分子标记将nl(t)基因定位在水稻第4号染色体长臂上RM5511和RM3843标记之间,物理距离约570 kb的范围内。为进一步研究nl(t)的功能提供参考。
水稻;窄叶;基因定位;穗茎注射法
水稻是世界上最重要的粮食作物之一,为世界上超过50%的人口提供主食,也是禾谷类作物基因组研究的模式植物[1]。水稻叶片是植株形态构建的重要因素,它生产和输出光合同化物,在作物的“源、流、库”理论中起到主要的“源”的作用,对产量有重大的影响。从20世纪60年代以来,育种家们把水稻叶片形态的改良始终贯穿于超高产理想株型的选育[2-4],超级杂交稻的选育也多遵照了袁隆平院士提出的水稻顶三叶“长、窄、直、厚、凹”的超高产株叶型形态模式[5]。因此,水稻叶片形态在育种和基础理论研究中有重要价值和意义。
水稻叶片的宽度作为叶片形态的重要指标,它受环境和遗传因素的共同调控。通常窄叶突变体的叶片变窄主要由两个原因造成,即叶脉数减少或2个叶脉间的距离降低[6-7]。遗传研究表明,水稻窄叶性状大部分是由隐性基因控制的质量性状,其中国家水稻数据中心网站(http://www.ricedata.cn/gene/)报道的窄叶基因Nal1、NAL2、nal2、nal3、nal4、nal5、Nal6、nal-7分别定位在经典遗传图的第4、11、11、12、4、4、3 和 3染色体上。此外,研究发现水稻窄叶性状也会受显性基因控制,如刘建昌等[8]在2004年报道了一个显性窄叶突变体;桑贤春等[9]用EMS诱变水稻恢复系缙恢10号得了一份由1个显性主效基因控制的窄叶突变体Dnal1,并定位于在2号染色体上。曾元生等[10]通过辐射诱变9311获得一份在苗期叶片窄且短,但成熟期与野生型无显著差异的水稻动态窄叶突变体dnl1,并定位于1号染色体。目前已报道的窄叶基因中,Nal1、NAL2和nal-7 3个基因已完成了克隆及部分基因功能的分析,其中nal1[11]主要在维管组织中表达,影响水稻生长素的极性运输,降低了叶脉及维管束的数目,同时也影响水稻节间细胞分裂;NAL2[12]编码OsWOX3A转录激活因子;nal7[13-14]与生长素生物合成相关基因的表达调控异常,导致叶片生长素浓度显著降低而引起了叶片变窄。如能够发现更多的窄叶突变体,对水稻窄叶遗传特性的深入解析将有帮助,本研究将小粒野生稻基因组DNA通过“穗茎注射法”[15-16]导入三系恢复系RH78中得到变异,经连续多代自交选育得到的一份稳定的窄叶突变体nl(t),本文对nl(t)进行了遗传分析、基因定位及基因分析,目的是为研究水稻叶片发育的分子机制提供新的种质资源,丰富控制水稻叶形基因的相关理论。
1 材料与方法
1.1 实验材料
将小粒野生稻基因组DNA采用“穗茎注射法”导入到恢复系RH78,D1代获得的一变异株自交后代出现一窄叶突变,这一突变连续多代自交,得到了一份稳定遗传的窄叶突变体材料nl(t)。亲本材料RH78是湖南杂交水稻研究中心培育的一份稳定的理想株型恢复系材料;粳稻02428来自湖南杂交水稻研究中心资源圃。
1.2 实验方法
1.2.1 F2定位群体的构建及性状调查
2013年8月,在长沙用nl(t)与02428杂交,收获F1种子,同年冬天在三亚种植 F1,收获 F2种子。2014 年5月,在长沙种植 F2群体,作为遗传分析和基因定位群体。野生型RH78、两杂交亲本nl(t)和02428及F2群体于2014年5月20日播种,6月12日移栽,单本插植,栽培密度为15 cm×20 cm。于分蘖盛期统计F2群体中正常叶与窄叶单株的分离比。成熟后随机各取RH78、两杂交亲本nl(t)和02428中间10个单株进行农艺性状调查,
1.2.2 水稻基因组DNA提取
采用2×CTAB[17]小量法提取nl(t)、02428及F2群体中窄叶个体基因组DNA,100 μL ddH2O溶解,取2 μL进行质量检测,并用Thermo Scientific*NanoDrop*2000微量紫外分光光度计进行浓度测定,并稀释成20~60 ng/μL用于PCR扩增。
1.2.3 PCR扩增及非变性聚丙烯酰胺凝胶电泳
在东胜龙(EDC-810)PCR仪上进行PCR扩增,在NCBI网站(http://www.ncbi.nlm.nih.gov/)上比对已完成测序的日本晴和9311,再根据插入缺失序列设计InDel引物,并由华大基因合成。总反应体系为10 μL,其中5.0 μL mix(Thermo Scientific Dream Taq Green PCR Master Mix 2×)、3.4 μL ddH2O、0.4 μL forward primer (10 pmol/μL)、0.4 μL reverse primer (10 pmol/μL)、0.8 μL模板DNA (50 ng/μL)。PCR反应程序为:94℃3 min;94℃30 s,58℃30 s,72℃30 s,共35个循环;72℃8 min,16℃保存。扩增产物采用8%非变性丙烯酰胺凝胶电泳,并银染显色[18],统计分析带型。
1.2.4 基因定位分析
利用分布于水稻12条染色体上的InDel分子标记,对两定位杂交亲本nl(t)和02428进行多态性分析,筛选具有多态性分子标记;随机挑选F2定位群体的10个窄叶单株构建混池,再利用已筛选得到的多态性标记进行连锁的标记筛选;用连锁标记检测F2定位群体的窄叶单株,将具有nl(t)特征带型的单株标记为A,具有02428特征带型的单株标记为B,杂合带型标记为H,利用Mapmarker3.0软件对其进行数据分析和作图。
在网站(http://www.gramene.org/)下载定位区间内窄叶基因nal1的DNA序列,并在Primer3(http://bioinfo.ut.ee/primer3-0.4.0/)设计引物,PCR检测,并送样品到铂尚生物技术有限公司进行测序。样品测序的彩图用chromas 2.0软件打开,基因序列的测序结果用序列拼接软件Contig Express打开并拼接,测序结果用DNAman 6.0软件比对,分析nl(t)与野生型间的序列差异。
2 结果与分析
2.1 窄叶突变体nl(t)的农艺性状表现
nl(t)与野生型相比,在整个生育期叶片明显变窄,约为野生型叶片宽度的一半,且其剑叶长度约为野生型的62.6%。叶片明显变窄变短,植株矮化、但穗长、每穗总粒数、结实率及千粒重都降低(如表1)。
2.2nl(t)的遗传分析
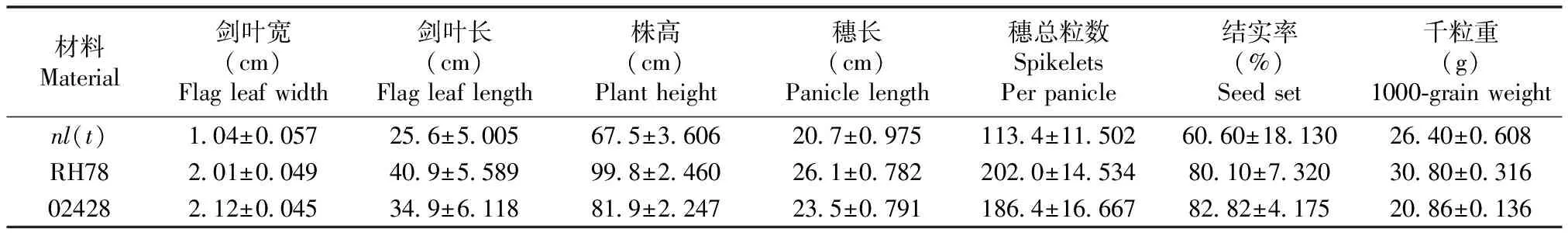
表1 nl(t)、RH78和02428的主要农艺性状比较
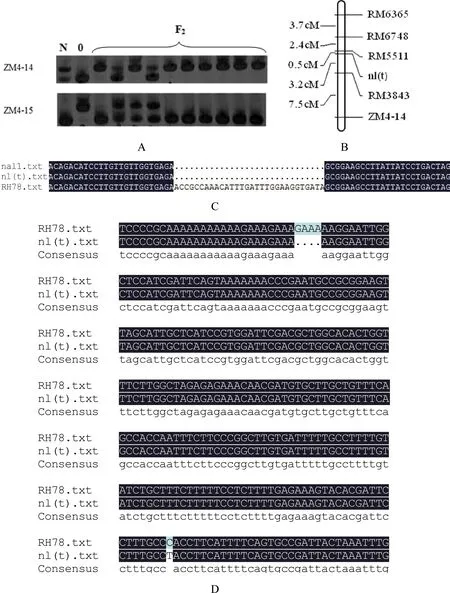
图1nl(t)在水稻第 4 号染色体上的基因定位
Fig 1 Gene mapping ofnl(t) on chromosome 4 in rice
A—分子标记ZM4-14和ZM4-15的连锁分析;N—窄叶突变体nl(t);0—杂交亲本02428;F2—杂交组合nl(t)/02428 F2群体中部分单株;B—水稻窄叶基因nl(t)在第 4 号染色体上的遗传图谱;C—RH78、窄叶突变体nl(t)与已报道的窄叶基因Nal1多重序列比对;D—RH78和窄叶突变体nl(t)序列比对。A:Linkage analysis by molecular markers ZM4-14 and ZM4-15;N:a narrow-leaf mutantnl(t);0:a hybrid parent 02428;F2:individual plants of F2 population derived from crossnl(t)/02428;B:Molecular linkage map of the rice chromosome 4 shows the location of the genenl(t);C:Multiple sequence alignment among RH78,nl(t) andNal1;D:sequence alignment amongnl(t) and RH78
2.3 窄叶基因定位
通过分布于水稻12条染色体上的225对InDel分子标记对两杂交亲本nl(t)和02428进行多态性分析,筛选得到122对具有多态性标记,占总标记的54.2%。
用已筛选到的多态性标记对F2群体中的10窄叶隐性单株及两杂交亲本进行分析,电泳结果表明,4号染色体的InDel分子标记ZM4-14和ZM4-15在10个窄叶表型的单株中分别有2株和3株单交换株,呈明显偏分离(图1A),从而确定标记ZM4-14和ZM4-15与窄叶定位基因连锁,且标记ZM4-14比ZM4-15更接近目标基因。在InDel分子标记ZM4-14附近设计加密SSR标记,并得到5对多态性引物(如表2),缩小定位范围,最终将该窄叶基因定位在RM5511和RM3843之间,且遗传距离分别为0.5cM和3.2 cM(如图1B)。
该窄叶基因的定位区间内包括2个已报道的窄叶基因nal1[11]和nal1(t)[18]。相比野生型,突变体nal1在10039 bp~10069 bp处有30 bp碱基的缺失,而突变体nal1(t) 在10039 bp处没有碱基的缺失,序列与日本晴一致。为证明nl(t)与这2个基因的关系,以日本晴的基因序列为参考,设计扩增片段包含有30 bp碱基缺失的引物(5′-CCAAACATATATGCCGCCCC-3′和5′-GGCAAATTCTGTCAGCTTTGT-3′),并扩增测序,结果发现,突变体nl(t)也在10039bp~10069 bp处有30 bp碱基的缺失(如图1C)。同时以日本晴的序列为参考,设计引物并分别对野生型和突变体nl(t) 基因组 DNA进行PCR扩增并测序,结果表明,突变体nl(t)在917 bp处有4个碱基GAAA的缺失,在1145 bp处发生了C突变为T的单碱基突变(如图1D),因此,nl(t)可能是nal1 的一个等位基因。
3 讨论
叶片是水稻进行光合作用主要器官,它的发育是植株形态构建的重要因素。叶片的细胞结构相对较简单,但其发育调控机制比较复杂。窄叶性状作为水稻超高产株叶型形态模式指标之一[5],目前,通过对nal1、nal7、nal2和nal9等的研究,对窄叶性状有了一定的认识。Nal1的等位基因qFLW4、LSCHL4可在高产育种中提高叶绿素含量和剑叶大小,改良穗型,在生产上具有潜在的利用价值[20-21]。Qi等[11]研究表明,nal1编码一个由582氨基酸组成的生化功能未知的植物特有蛋白,主要在维管组织中表达,影响水稻生长素的极性运输,导致植株叶片变窄,株高矮化。nal7[13]是水稻YUCCA基因家族成员之一,编码黄素单氧化酶,它影响生长素的生物合成,显著降低叶片IAA浓度而导致叶片变窄。NAL2[12]编码OsWOX3A转录激活因子,主要在叶片和叶鞘的大小维管束鞘及茎基部和根的维管柱中表达,影响叶片、叶舌、叶耳、叶鞘和茎等多个器官的发育。NAL9编码ATP依赖Clp蛋白酶水解亚基(ClpP),突变体nal9除了叶片变窄外,而且植株矮化、分蘖减少、苗期叶色变浅,但其作用机理还需进一步研究[22]。因此,生长素的合成与极性运输以及维管组织发育与分布都会影响水稻窄叶性状。nl(t)的序列结构与nal1相似,因此,nl(t)也很可能是影响了生长素的极性运输,导致了叶片变窄,株高变矮。在整个生育期,突变体nal1[11]叶片、株高均变窄变矮,但叶片的长度与野生型并无明显差异。但相比nal1,nl(t)叶片的宽度变得更窄,长度缩得更短,这种变化的差异是由于遗传背景差异造成的或是因为突变位点和方式的不同导致基因的表达量以及编码蛋白的结构等不同引起的,还需进一步研究。
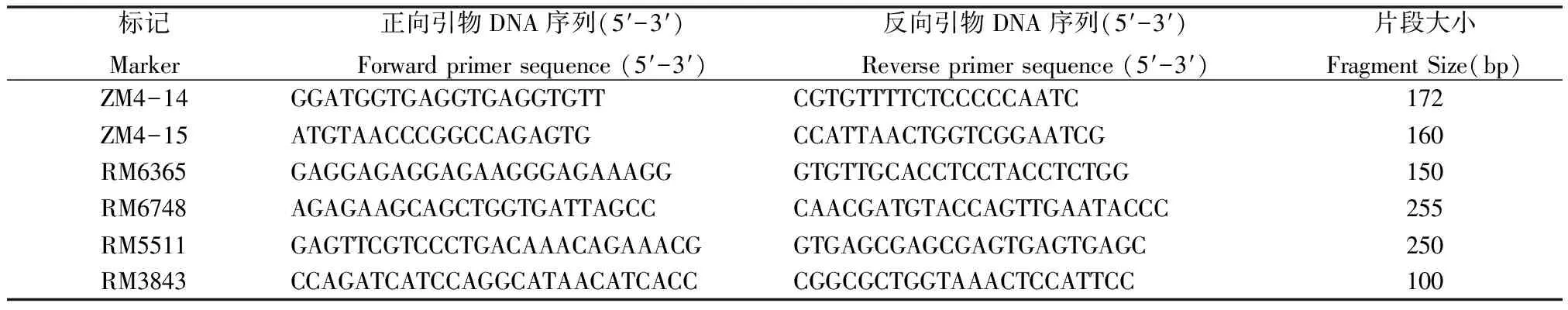
表2 多态性连锁分子标记及序列
窄叶突变体nl(t)相比野生型,其叶片明显变窄且缩短,而且植株矮化,并将nl(t)定位在水稻第 4 号染色体长臂上RM5511和RM3843标记之间,物理距离约570 kb的范围内。目前,在该定位的区间内至少有2个已报道的水稻窄叶基因nal1和nal1(t),其中nal1在第4个外显子有30 bp的碱基缺失[11],从而引起了氨基酸编码的变异,而nal1(t)在此位置并没有碱基缺失[19],经测序比对,nl(t)在此处也有30 bp的碱基缺失,表明nl(t)可能与已报道的nal1等位,但要确定这一结论还需基因沉默、转基因互补实验等进一步研究。
[1]Izawa T, Shimamoto K. Becoming a model plant: the importance of rice to plant science[J]. Trends Plant Sci, 1996(1): 95-99.
[2]Donald C. The breeding of crop ideotype[J]. Euphytica, 1968, 17: 385-403.
[3]王 兰, 龙云铭, 刘耀光. 一种用于PCR的植物基因组 DNA 快速制备方法[J].分子植物育种,2009(7): 425-428.
[4]袁隆平. 超级杂交水稻育种研究的进展[J]. 中国稻米, 2008(1):1-3.
[5]袁隆平. 杂交水稻超高产育种[J]. 杂交水稻,1997(12): 1-6.
[6]游小庆,桑贤春,赵芳明,等.水稻窄叶突变体nal7(t)的遗传分析与基因定位[J].分子植物育种,2010(8): 240-244.
[7]Wu C, Fu Y, Hu G, et al. Isolation and characterization of a rice mutant with narrow and rolled leaves[J]. Planta, 2010, 232 :313-324.
[8]刘建昌, 张为民. 一个窄叶水稻材料的特性及遗传初报[J]. 中国水稻科学, 2004, 18:577-579.
[9]桑贤春,林婷婷,何沛龙,等. 水稻显性窄叶突变体Dnal1的鉴定与基因定位[J]. 中国农业科学, 2014(09): 1819-1827.
[10]曾生元,郭旻,李敏,等. 一个水稻动态窄叶突变体的鉴定和基因定位[J]. 科学通报,2010,21:2106-2111.
[11]Qi J, Qian Q, Bu Q, et al. Mutation of the riceNarrowleaf1 gene, which encodes a novel protein, affects vein patterning and polar auxin transport[J]. Plant Physiol, 2008, 147: 1947-1959.
[12]Cho S H, Yoo S C, Zhang H, et al. The rice narrow leaf2 and narrow leaf3 loci encode WUSCHEL-related homeobox 3A (OsWOX3A) and function in leaf, spikelet, tiller and lateral root development[J]. New Phytol, 2013, 198 : 1071-1084.
[13]Cho S H, Yoo S C, Zhang H, et al.NARROWLEAF7 controls leaf shape mediated by auxin in rice[J]. Mol Genet Genom, 2008, 279: 499-507.
[14]游小庆,桑贤春,赵芳明,等.水稻窄叶突变体nal7(t)的遗传分析与基因定位[J].分子植物育种, 2010, 8(2): 240-244.
[15]Pena D L,Lorz H,Schell J.Transgenic rye plant obtained by injecting DNA into young floral tillers[J].Nature,1987, 325: 274-276.
[16]Zhao B, Xing Q H, Xia H, et al. DNA polymorphism among Yewei B,V20B,andOryzaminutaJ. S. Presl. ex C. B. Presl[J]. J Integr Plant Biol,2005, 47: 1485-1492.
[17]Rogers S O,Bendich A J. Extraction of DNA from plant tissues[J]. Plant Mol Biol Manual, 1988(6): 1-10.
[18]Sanguinetti C J, Dias N E, Simpson A J G. Rapid silver staining and recover of PCR products separated on polyacrylamide gels[J]. Biotechniques, 1994, 17: 915-919.
[19]李 娟,李东宣,甘树仙,等. 一个新的水稻窄叶突变体的遗传分析和基因定位[J]. 分子植物育种, 2011, 9(2): 143-149.
[20]Cho S H, Yoo S C, Zhang H T, et al. Rice NARROW LEAF1 regulates leaf and adventitious root development[J]. Plant Mol Biol Rep, 2014, 32: 270-281.
[21]Chen M L, Luo J, Shao G N, et al. Fine mapping of a major QTL for flag leaf width in rice, qFLW4, which might be caused by alternative splicing of NAL1[J]. Plant Cell Rep, 2011, 31: 863-872.
[22]Li W, Wu C, Hu G H, et al. Characterization and fine mapping of a novel rice narrow leaf mutant nal9[J]. J Integr Plant Biol,2013, 55: 1016-1025.
Genetic analysis and gene mapping of a narrow-leaf mutantnl(t) in rice (OryzasativaL.)
PAN Yin-lin1, 2, MAO Bi-gang2, HU Yuan-yi2, GUO Li-qin2,PENG Yan2, SHAO Ye2, YANG He-hua2, ZHAO Bing-ran1, 2
(1. State Key Laboratory of Hybrid Rice, Longping Branch of Graduate School, Central South University,Changsha 410125; 2.China National Hybrid Rice R&D Center, Changsha 410125, China)
A narrow-leaf mutantnl(t) used in this study was isolated from the progenies of an original mutant by injecting total DNA ofOryzaminutainto restorer line RH78 (OryzasativaL. ssp.indica) through the spike-stalk injection method. Genetic analysis indicated that the narrow-leaf character ofnl(t) was controlled by a recessive nuclear gene, and the putative gene was mapped between SSR markers RM5511 and RM3843 with an approximate interval of 570 kb on the long arm of chromosome 4. These results would provide significant supports for the further study of the function of theNL(t) gene.
rice;narrowleaf; gene mapping; spike-stalk injection method
2014-12-26;
2015-01-06
国家自然科学基金(31301291,31471465); 国家行业科技项目(201503308)
潘银林,硕士研究生,专业方向为作物遗传育种,E-mail:pyl445@163.com;
赵炳然,博士,研究员,研究方向为作物遗传育种,E-mail:brzhao652@hhrrc.ac.cn。
Q754; S511
B
2095-1736(2015)05-0092-04
doi∶10.3969/j.issn.2095-1736.2015.05.092
