雌二醇、双酚A和苯并[a]芘对食蚊鱼目标基因表达的影响
2015-03-22熊甜甜方展强
熊甜甜, 方展强
(华南师范大学 生命科学学院 广东省高等学校生态与环境科学重点实验室, 广州 510631)
雌二醇、双酚A和苯并[a]芘对食蚊鱼目标基因表达的影响
熊甜甜, 方展强
(华南师范大学 生命科学学院 广东省高等学校生态与环境科学重点实验室, 广州 510631)
比较雌二醇(E2)、双酚A(BPA)、苯并[a]芘(B[a]P)和他莫昔芬(TAM)暴露对食蚊鱼(Gambusiaaffinis)卵黄蛋白原基因(VTGα)、雌激素受体基因(ERα)和细胞色素P4501A基因(CYP4501A)表达的影响。结果显示,低浓度E2单独暴露诱导VTGα和ERα表达量显著上调,但高浓度E2极显著抑制VTGα、ERα和CYP4501A表达。高浓度B[a]P明显抑制VTGα表达;B[a]P对ERa表达无明显抑制作用,但致CYP4501A表达量显著上升。BPA显著上调VTGα和ERα的表达,但低浓度BPA致CYP4501A表达显著下降。B[a]P+高浓度E2联合暴露,致VTGα和ERα表达量显著提高,但B[a]P+低浓度E2联合暴露抑制ERα的表达。B[a]P+E2不同浓度组均致CYP4501A表达水平呈极显著上升; B[a]P+E2+TAM联合暴露均致VTGα、ERα和CYP4501A表达量显著或极显著增加。不同浓度组(B[a]P+BPA)均致VTGα、ERα和CYP4501A表达量显著上调;B[a]P+BPA+TAM暴露,VTGα表达量呈极显著下降,相反,均致ERα和CYP4501A的表达量显著增加。单一毒物实验与联合毒物实验的比较表明,ERα和AhR介导的生理过程机制十分复杂,通过这两个途径对外来污染物的调控跟化合物的效应浓度有关,不是单独暴露效应的简单相加或相减。另外还进行E2/BPA+B[a]P+TAM联合暴露实验,来研究TAM对ERα受体途径和AhR受体途径的影响,结果显示TAM对两个途径均有抑制作用。
内分泌干扰物;目标基因;单独及联合暴露;mRNA表达;食蚊鱼
随着进入环境的内分泌干扰物(EDCs)种类和数量的增加,动物和人类健康受到越来越严重的威胁。对这些化学物质的生物效应、环境影响和生态风险进行评价已成为环境科学一个重要的研究内容。目前,对单一化合物的内分泌干扰效应已经有较多的研究和报道[1-2],而野外水体环境通常存在多种EDCs的共同作用,尤其是外源类雌激素和抗雌激素物质共同存在的条件下,是否与抗雌激素对内源雌激素的作用一致,值得关注。水体环境中污染物种类繁多,难以用单一化合物的简单相加来表示其污染程度,少量研究已发现,两种或多种化合物的联合效应并不是各个污染物作用的加和,因此,污染物的联合毒性值得进一步研究[3]。此外,近年一些学者关注两种核受体-芳香烃受体(Aryl hydrocarbon receptor, AhR)和雌激素受体(Estrogen receptor, ER)的交叉作用在水生动物体内EDCs效应中所发挥的作用,通常认为,ERα是动物体内介导雌激素效应的重要受体,其表达受到内源或外源化合物的影响,而细胞色素P450系统中的CYP4501A与大多数环境污染物的代谢有关,且受到AhR的调控[4]。目前一些学者提出AhR-ERα途径可能在EDCs的联合效应中发挥着重要的调控作用,因此深入开展这方面的研究具有重要的学术意义。
本文以食蚊鱼作为研究对象,运用实时定量PCR技术,建立AhR和ER相关基因mRNA检测系统,以研究水生环境中内分泌干扰物对生物体的影响,并初步探究其作用机制。本实验挑选雌二醇 (Estrodiol,E2)和双酚A(BisphenolA,BPA)作为类雌激素的代表,研究不同浓度两种类雌激素在食蚊鱼体内产生的效应,通过卵黄蛋白原基因(VTGα)、雌激素受体(ERα)和细胞色素P4501A基因(CYP4501A)表达差异来解释单独作用的机制,同时探讨这两种类雌激素的代谢和转化途径。另一方面,把苯并[a]芘(Benzo[a]Pyrene,B[a]P)作为抗雌激素的代表,与外源雌激素 (E2)共同作用,研究苯并[a] 芘的抗雌激素效应,并通过ER和AhR相关基因的差异表达来探讨EDCs的雌激素效应或抗雌激素效应的机制。联合暴露实验还加入了抗雌激素物质他莫昔芬(Tamoxifen, TAM),研究其对雌激素和抗雌激素的联合作用的影响。
1 材料与方法
1.1 实验材料
食蚊鱼正常的雌雄个体鉴别及其性成熟的鉴定参照Leusch 等的方法[5]。性未成熟的食蚊鱼幼鱼,捕自华南师范大学校园内的湖泊,在实验室水族箱内驯养2周,待死亡率小于2%后区分雌、雄个体,挑选形态健康饱满、反应灵敏的雄性个体用于暴露实验。
雌二醇(E2)、双酚A(BPA)、苯并[a]芘(B[a]P)和他莫昔芬(TAM),采用高纯度的二甲基亚砜(dimethyl sulfoxide, DMSO)配制成保存液。DMSO用作对照,预实验已证明其对实验结果没有产生明显的影响。总RNA抽提试剂盒,Quant反转录酶,Taq聚合酶,RT-PCR 试剂盒,其他生化试剂均为符合实验规格要求国产试剂。
1.2 实验方法
1.2.1 染毒与制样
用E2、BPA以及B[a]P单独及联合暴露性未成熟雄性食蚊鱼。浓度组设置如表1所示。实验用水为曝气3 d的自来水,水温(23±3)℃,pH值为6.8~7.2,溶氧量大于6 mg/L,硬度约2.4度(德国度)。实验在2 500 mL烧杯中进行,每个烧杯加入2 000 mL实验液,各放入雄性食蚊鱼幼鱼12尾。采用半静态方式,自然光照,温度条件不设控制,每天换水、加药和喂食,及时吸出残饵和排泄物。每个浓度组各设置2个平行,暴露时间为7 d。肝脏取样后,用预冷的0.86%生理盐水冲洗,滤纸吸干,称重后装袋密封,放入-70℃冰箱中保存备用。
1.2.2 分子生物学测定方法
引物设计 登录NCBI网站,找到西部食蚊鱼(Gambusiaaffinis)的VTGα、ERα、CYP4501AcDNA的序列,利用Primer 3软件(http://frodo.-wit.Edu/),由生物工程(上海)公司合成需要的引物。本研究相关基因扩增引物名称及其序列见表2。
RNA制备 总RNA提取:将肝组织匀浆,加入1 mL的Isoplus RNA (RNAiso Plus)提取液(TakaRa)进行总RNA提取。RNA提取后进行基因组DNA的去除,并检测RNA浓度及其完整性,保证A260/A280的比值在1.8~2.0(TakaRa)。

表1 混合化合物暴露浓度组设置及实验结果

表2 相关基因扩增引物名称及其序列
RNA反转录成cDNA 使用TakaRa Code:DRR037 PrimScriptTMRT reagents Kit (Perfect Real Tome) 产品。RT反应液配置如下:5×(PrimeScript Buffer (2 μL), PrimeScript PT Enzyme Mix I (0.5 μL), Random 6 mers (100 μmol/L, 0.5 μL), Oligo dT Primer (50 μmol/L, 0.5 μL), Total RNA (1 μL), Rnase Free dH2O (5.5 μL),总共10 μL。反转录反应条件如下:37°C 15 min-cDNA合成),85°C 5 s(酶失活)。
实时荧光定量 使用TakaRa Code:DRR081A SYBR®Premix ExTaqTMII (2×) 10.0 μL,正反向引物(10 μmol/L)各0.8 μL,ROX References Dye I (50×) or ROX References Dye II (50×) 0.4 μL, cDNA模板2.0 μL,H2O(灭菌)6.0 μL,总共20.0 μL。按照两步法PCR扩增标准程序进行RT-PCR反应。
RT-PCR扩增结果数据的处理采用相对定量法,内参基因选用β-actin。通过标准曲线对对照样品、待测样品的目的基因及管家基因进行定量,然后根据计算公式求得相对值即为相对表达值。校正值=目的基因定量结果/管家基因定量结果;相对值=待测样品的校正值/对照样品的校正值。
1.2.3 数据统计与处理
使用SPSS16.0 统计软件对所得数据进行统计学分析。采用单因素方差分析(One way-ANOVA)法对数据进行差异性分析。用Excel 2003做柱形图。设置P<0.05 时, 表示差异显著; 当P<0.01 时, 表示差异极显著。
2 结果
2.1 E2、B[a]P单独及E2、B[a]P和TAM联合暴露VTGα、ERα和CYP4501AmRNA转录水平
外源类雌激素E2(100 ng/L)单独暴露能诱导VTGα和ERα表达量显著上调(P<0.05),分别为对照组的1.82和2.99 倍;但E2(500 ng/L)浓度调高,两者表达则受到极显著的抑制 (P<0.01),分别仅为对照组的8.17%和40.74%(图1A-柱1和柱2和图1B-柱1和柱2)。E2(100 ng/L)暴露使CYP4501A表达量呈微弱增加,为对照组的1.72倍,变化不明显(图1C-柱1);E2(500 ng/L)则极显著抑制 (P<0.01),仅为对照组的13.11%(图1C-柱2)。结果显示不同浓度E2影响VTGα及ERα表达水平;高浓度E2抑制CYP4501A表达。
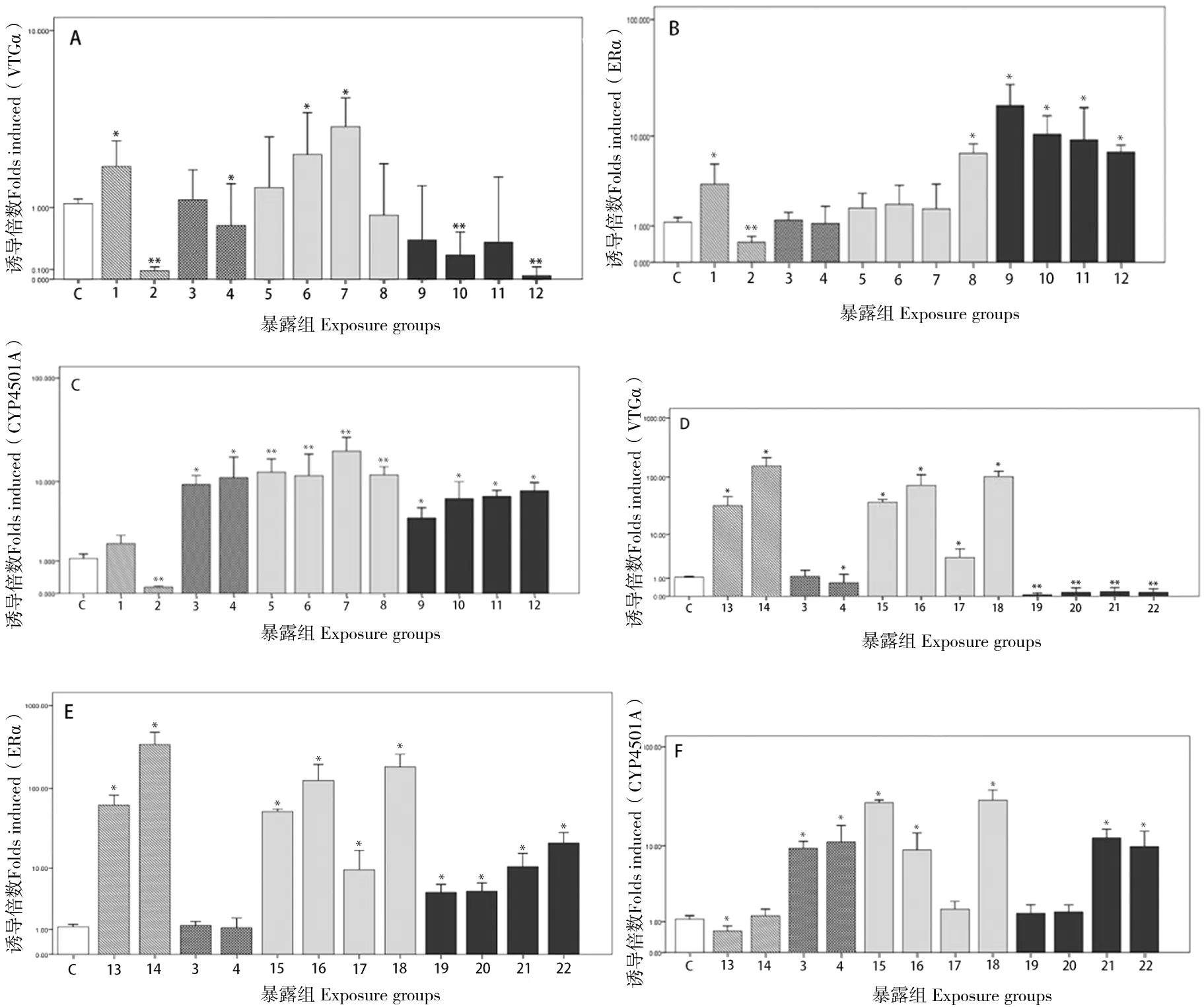
图1 E2、BPA、B[a]P和TAM单独/联合暴露对性未成熟的雄性食蚊鱼肝脏VTGα mRNA, ERα mRNA和CYP4501A mRNA表达量的影响Fig 1 Expression of VTGα mRNA, ERα mRNA and CYP4501A mRNA in liver of immature male mosquitofish exposed to E2, BPA, B[a]P and TAM in along or combination C—对照组;1~22—实验组。*—表示与空白对照组相比差异显著(P<0.05);**—表示与空白对照组相比差异极显著(P<0.01)。
抗雌激素B[a]P(50 μg/L)暴露对VTGα表达无抑制作用(图1A-柱3或图1D-柱3);但B[a]P高浓度(250 μg/L)对VTGα表达抑制明显,为对照组的63.13%(P<0.05)(图1A-柱4或图1D-柱4)。B[a]P(50 μg/L和250 μg/L)暴露对ERa表达均无明显抑制作用(图1B-柱3和柱4或图1E-柱3和柱4),但均致CYP4501A表达量显著上升(P<0.05),分别是对照组的8.40倍和9.85倍(图1C-柱3和柱4或图1F-柱3和柱4)。结果显示B[a]P明显地抑制了雌二醇诱导的雌激素效应,但上调CYP4501A的表达量。
抗雌激素B[a]P+外源类雌激素E2联合暴露,其中两种组合(B[a]P(50 μg/L)+E2(500 ng/L)和B[a]P(250 μg/L)+E2(100 ng/L))均致VTGα表达量显著提高(p<0.05)(图1A-柱6和柱7),而另外两种组合作用则不明显。仅当B[a]P(250 μg/L)+E2(500 ng/L)联合暴露时,ERα表达量才显著提高,是对照组的6.93倍,但其他3种组合对ERα表达没有明显影响(图1B-柱8)。B[a]P+E2联合暴露,各不同浓度组合组均致CYP4501AmRNA表达水平呈极显著上升(P<0.01)(图1C-柱5~8)。结果显示B[a]P+E2联合暴露总体上上调了VTGα、ERα和CYP4501A表达量。
抗雌激素B[a]P+外源类雌激素E2+抗雌激素物质TAM联合暴露,VTGα表达受到明显的抑制,其中两个组合组VTGα表达差异极显著(P<0.01)(图1C-柱10和柱12)。相反,所有不同浓度组合组均致ERα和CYP4501A的表达量显著增加(p<0.05)(图1B-柱9~12和图1C-柱9~12)。结果显示B[a]P+ E2+TAM暴露抑制VTGα表达,但上调ERα和CYP4501A的表达量。
2.2 BPA单独及B[a]P、BPA和TAM联合暴露VTGα、ERα和CYP4501AmRNA转录水平
外源类雌激素BPA(1 mg/L和5 mg/L)暴露均致VTGα和ERα表达量显著上调(P<0.05),VTGα表达水平分别为对照组的30.03和142.73倍,ERα分别为对照组的54.33和294.93倍(图1D-柱13和柱14和图1E-柱13和柱14)。低浓度BPA(1 mg/L) 致CYP4501A表达量显著下降(P<0.05),但高浓度BPA(5 mg/L)致CYP4501A表达略有上升,但差异不明显(P>0.05)(图1F-柱13和柱14)。结果显示BPA暴露上调VTGα和ERα表达量,但对CYP4501A影响不明显。
抗雌激素B[a]P+外源类雌激素BPA联合暴露,除了B[a]P(250 μg/L)+BPA(1 mg/L)组合组外,与对照组相比,所有B[a]P+BPA不同浓度组联合暴露均致VTGα、ERα和CYP4501A的表达量显著上调(P<0.05)(图1D-柱15~18、图1E-柱15~18和图1F-柱15、16和18)。结果显示B[a]P+BPA联合暴露总体上上调了VTGα、ERα和CYP4501A表达量。
抗雌激素B[a]P+外源类雌激素BPA+抗雌激素物质TAM联合暴露,VTGα的表达量与对照组相比呈极显著下降(P<0.01)(图1D-柱19~22)。相反,除了B[a]P(50 μg/L)+BPA(1 mg/L)+TAM(1 g/L)和B[a]P(50 μg/L)+BPA(5 mg/L)+TAM(1 g/L)两个组合组致其表达量差异不显著外(图1F-柱19和柱20),另外两个组合组致ERα和CYP4501A的表达量却略增加(图1E-柱19~22和图1F-柱21和柱22)。结果显示B[a]P+ BPA+TAM联合暴露致VTGα、ERα和CYP4501A的表达量呈下降趋势。
3 讨论
3.1 类雌激素E2、BPA和抗雌激素B[a]P单独暴露对VTGα、ERα和CYP4501A表达的影响
本研究中,不同浓度组类雌激素雌二醇(E2)和双酚A (BPA)分别单独暴露后雄性食蚊鱼VTGα和ERαmRNA表达量都呈显著性提高,表明E2和BPA均有较强的雌激素效应,同时也说明VTGα和ERαmRNA转录水平具有较高的灵敏性,相类似的研究结果已见报道[2,4,6]。作者推断,外源类雌激素E2和BPA都可模拟生物体的内源雌激素E2,竞争性抑制内源E2与靶器官的ERa结合,相对较高浓度的BPA还可以将E2从ERa上取代。外源E2或BPA与ERa结合后,形成配体受体复合物,与DNA结合区的DNA反应元件结合,诱导或抑制靶基因的转录,启动一系列雌激素依赖性生理生化过程。然而本实验高浓度E2(500 ng/L)组暴露时,VTGα和ERαmRNA表达量不是升高,而是显著下降,分别仅为溶剂对照组的9.10%和13.65%。因而作者认为,体内VTGα和ERα表达量具有一定阈限值,不随环境雌激素浓度增加而无限增长。推断外源雌激素与内源雌激素产生竞争性抑制作用,或者是机体对非正常生理代谢产生的物质多有反馈调控机制,过多表达的VTGαmRNA和ERαmRNA可能通过体内某些代谢途径而被降解。
关于CYP4501AmRNA的表达水平,本研究结果表明,相对较低浓度的E2(100 ng/L)暴露对雄性食蚊鱼肝脏中CYP4501AmRNA表达量没有显著影响,而高浓度E2(500 ng/L)极显著地抑制其表达,CYP4501AmRNA表达量仅为溶剂对照组的13.11%,为低浓度E2组的7.62%。与E2不同,低浓度BPA(1 mg/L)暴露使CYP4501AmRNA表达量下降,为对照组的55.62%,然而暴露浓度增加至5 mg/L时,CYP4501AmRNA表达量略为上升,为溶剂对照组的1.15倍。目前,有关E2和BPA是否影响芳香烃受体(AhR)以及CYP4501A的研究还比较少。CYP4501A属于细胞色素P450酶系超家族,受外源污染物影响,对体内毒物代谢具有重要作用,而在肝脏组织中AhR对CYP4501A的表达起重要的调控作用[7]。本实验试图通过这一线索来证实E2和BPA是否通过AhR-CYP4501A途径代谢,结果发现二者之间没有显著的相关性,因此认为E2和BPA可能通过其它方式降解,也可能低浓度的E2(100 ng/L)和高浓度BPA(5 mg/L)通过细胞色素P450酶系进行代谢。
B[a]P单独作用时,低浓度B[a]P(50 μg/L)对VTGα和ERαmRNA表达无明显作用,而浓度提高至250 μg/L时则抑制其表达(图1A-柱4或图1D-柱4)。作为AhR的激动剂,B[a]P明显抑制E2诱导的雌激素效应,抑制了ERα和VTGαmRNA表达。而两种浓度的B[a]P(50和250 μg/L)均能诱导食蚊鱼肝脏中CYP450 1AmRNA的表达量极显著升高,分别为溶剂对照组的8.40和9.85倍,与暴露浓度呈正相关,这个结果表明非极性化学物质B[a]P在生物体内被细胞色素P450依赖性的混合功能氧化酶代谢,代谢过程诱导了雄性食蚊鱼体内的CYP4501AmRNA表达上调。有研究发现0.1 μmol/L的B[a]P即可诱导CYP1A1 mRNA的表达,当提高到1 μmol/L时诱导效应已很明显,达到10 μmol/L时诱导效应最大[8]。
3.2 类雌激素E2、BPA分别和抗雌激素B[a]P联合暴露对VTGα、ERα和CYP4501A表达的影响
B[a]P+E2联合暴露时,情况较为复杂。除低浓度B[a]P(50 μg/L)和低浓度E2(100 ng/L)联合暴露时,VTGαmRNA表达量受到抑制外,其他3组VTGαmRNA表达量均显著升高。可见,在雄性食蚊鱼中,B[a]P对VTGα表达抑制作用不明显,反而有促进其表达的现象。一些学者指出,在通常情况下,B[a]P会代谢为l-OH-B[a]P、3-OH-B[a]P和9-OH-B[a]P,这些代谢产物能结合到ER上,从而诱导体内雌激素受体介导的基因(如ER和VTG)表达,在鱼类中,这可能是B[a]P诱导产生生殖毒性的一种机制[9-10]。有些学者认为,AhR激动剂能通过AhR-ERa相互作用直接诱导雌激素活性,如3-甲基胆蒽(3-Methylcholanthrene, 3MC) 能直接激活ERa[11-13]。因此推论,本实验所设置的有效浓度B[a]P很可能代谢为羟基化产物,与ERa结合,从而诱导VTG合成,表现出促雌激素效应。
B[a]P+E2联合暴露时,相对较低浓度的E2(100 ng/L)条件下,两种不同浓度的B[a]P均会导致ERαmRNA表达量显著降低,分别为低浓度E2单独暴露时的52.69%和51.56%。两种浓度B[a]P与相对较高浓度E2(500 ng/L)联合暴露时,ERαmRNA表达量均显著增加,是高浓度E2单独暴露的4.30和14.83倍。已有研究表明,B[a]P是雌激素拮抗物质,显示出抗雌激素效应,可抑制鱼体内VTG的分泌,阻碍鱼体性腺发育,并对鱼类的生长和繁殖造成危害[14]。推测ERαmRNA表达量的降低是B[a]P抗雌激素效应的表现。E2高浓度时,B[a]P对ERαmRNA表达量上调的原因可能与B[a]P对VTGαmRNA表达量的提升作用的原因一致,B[a]P很可能代谢为羟基化产物,与ERa结合,诱导ERα表达,表现出促雌激素效应。
B[a]P+E2联合暴露时,各组CYP4501AmRNA表达水平都呈极显著上调;当E2浓度相同时,随着B[a]P浓度升高,CYP4501AmRNA表达量也升高。杨秀芬等[15]的研究显示,B[a]P可明显诱导肺组织的CYP1A和CYP1A2表达;B[a]P浓度相同时,随着E2浓度升高,CYP4501AmRNA表达量逐渐下降, 这一结果表明E2能干扰B[a]P对CYP450 1A的诱导。有些研究还表明,在许多硬骨鱼的体内和体外实验中,E2显著抑制肝脏CYP1A1 mRNA转录水平和CYP1A1蛋白合成[16]。本实验结果显示,除了高浓度B[a]P(250 μg/L)与低浓度E2(100 ng/L)联合暴露组外,其他浓度组合组E2和B[a]P联合作用与相应浓度B[a]P单独暴露相比,CYP4501AmRNA表达量无明显差异。B[a]P和BPA联合暴露时,VTGαmRNA表达量和ERαmRNA表达量与相应浓度BPA单独暴露相比呈显著下降趋势,特别是高浓度B[a]P(250 μg/L)和低浓度BPA(1 mg/L)联合作用时,VTGαmRNA表达量仅为1 mg/L BPA单独暴露时的10.73%;ERαmRNA表达量仅为1 mg/L BPA单独暴露时的15.27%。这表明当BPA低浓度时,高浓度B[a]P的雌激素拮抗抑制作用更加突显出来。不同浓度B[a]P对BPA诱导的VTGαmRNA与ERαmRNA转录水平有不同程度抑制作用。
3.3 类雌激素E2、BPA分别和抗雌激素B[a]P+抗雌激素物质TAM联合暴露对VTGα、ERα和CYP4501A表达的影响
本研究中,E2+B[a]P+TAM联合暴露致3种基因表达量均发生显著变化,VTGα和CYP4501A表达均受到明显抑制,尤其VTGαmRNA的表达量与溶剂对照组相比有极显著差异;但是ERαmRNA表达量反而有增加趋势。他莫昔芬( tamoxifen, TAM) 又称为三苯氧胺, 为非甾体类雌激素受体拮抗剂。其结构与雌激素相似,故可在雌激素作用的各人体靶器官内与雌激素竞争ER,减少胞质内ER的含量,阻止细胞核内雌激素生成基因的转录和ER再合成。TAM作为E2的拮抗剂可以抑制E2的作用,也可以阻断其对自身受体ERs的上调作用。但TAM对肝细胞ER表达影响的文献较少报道[17-18]。本研究在类雌激素和抗雌激素联合暴露组中加入TAM,结果发现,当E2+B[a]P联合暴露组加入TAM后,VTGα和CYP4501A表达均受到明显抑制,特别是VTGαmRNA表达量与溶剂对照组相比有极显著差异;但是ERαmRNA的表达量与溶剂对照组和E2+B[a]P联合暴露组相比反而有增加趋势,推断可能在E2+B[a]P+TAM联合作用的条件下,TAM显示雌激素性质,不呈拮抗作用。
BPA+B[a]P+TAM联合暴露,VTGα和ERα的表达变化趋势基本一致,其表达量均受到明显抑制,尤其是VTGαmRNA表达量与BPA+B[a]P联合暴露组以及空白对照组相比均有极显著下降。除了高浓度B[a]P+低浓度BPA+ TAM暴露组的CYP4501AmRNA的表达量呈上调趋势外,其他3组CYP4501A的表达均受到明显抑制。整体上看来,BPA和B[a]P联合暴露加入TAM后,VTGα、ERα和CYP4501AmRNA的表达量为下降趋势,这表明TAM作为雌激素受体拮抗剂,与雌激素受体配体结合,阻滞雌激素的作用,可以阻断BPA对ERα表达的促进作用,降低B[a]P的代谢途径。
4 结论
单一毒物实验与联合毒物实验的比较表明,ERα和AhR介导的生理过程机制十分复杂,通过这两个途径对外来污染物的调控跟化合物的效应浓度有关,不是单独暴露效应的简单相加或相减。外源雌激素与抗雌激素的联合作用还有待进一步研究。
多种药物联合暴露的作用途径可能是多元复杂的,需要更深入地研究。可以肯定不同浓度的B[a]P对食蚊鱼的生殖内分泌干扰途径是不同的。两种以上EDCs联合暴露时,其作用途径远比单一EDC复杂;VTG、ER、CYP1A作为环境雌激素作用指标,在EDCs联合暴露评价中的实际作用还需要进一步的检验。
[1]黄 晔,任 华,孙竹筠,等.壬基酚和双酚A对雄性斑马鱼(Daniorerio)卵黄蛋白原mRNA的诱导效应[J]. 生态毒理学报, 2008, 3(3): 274-279.
[2]胡珊珊, 申秀英, 许晓路.双酚A的毒理学效应及作用机制的研究进展[J].江西科学,2006, 24(5):383-386.
[3]杨丽丽, 张 晶, 方展强.雌二醇、壬基酚、多氯联苯、镉和锌及其混合物对唐鱼的雌激素效应比较研究[J].水产学报,2011, 35(6):102-109.
[4]黄 晔. NP、BPA和B[a]P联合暴露对斑马鱼(Daniorerio)体内雌激素/抗雌激素效应的研究[M].上海:华东师范大学, 2008.
[5]Leusch F D L,Vanden Heuvel M R, Laurie A D, et al. Quantification of vitellogenin mRNA induction in mosquitofish (Gambusiaaffinis) by reverse transcription real-time polymerase chain reaction (RT-PCR) [J]. Biomarkers, 2005, 10(6): 429-438.
[6]李 云, 朱志强, 叶 勤,等. 17β-雌二醇对雄性瓦氏黄颡鱼(Pelteobagrusvachelli)的雌激素效应[J].海洋与湖沼,2009, 40(2):195-200.
[7]冷欣夫, 邱星辉.细胞色素P450酶系的结构功能与应用前景[M].北京:科学出版社,2001: 56-70.
[8]江艳艳, 罗晓星, 赵德化,等.苯并[a]芘对人胎盘绒毛膜上皮细胞中细胞色素P4501A1表达的诱导作用[J]. 研究快报,1999: 1000-2790, 06-S11-S12.
[9]Fertuck K C, Matthews J B, Zacharewski T R. Hydroxylated benzo(a)pyrene metabolites are responsible for in vitro estrogen receptormediated gene expression induced by benzo(a)pyrene,but do not elicit uterotrophic effects in vivo [J]. Toxicol Sci, 2001, 59:231-240.
[10]van Lipzig M M, Vermeulen N P, Gusinu R, et al. Formation of estrogenic metabolites of benzo[a]pyrene and chrysene by cytochrome P450 activity and their combined and supra-maximal estrogenic activity [J]. Environ Toxicol Pharm, 2005, 19(1): 41-45.
[11]Shipley J M, Waxman D J. Aryl hydrocarbon receptor-independent activation of estrogen receptor dependent transcription by 3-methylcholanthrene [J]. Toxicology and Applied Pharmacology, 2006, 213:87-97.
[12]Liu S, Abdelrahim M, Khan S, et al. Aryl hydrooarbon receptor agonists directly activate estrogen receptor alpha in MCF-7 breast cancer cells [J]. The Journal of Biological Chemistry, 2006, 387:1209-1213.
[13]Abdelrahim M, Ariazi E, Kim K, et al. 3-methylcholanthrene and other arylhydrocarbon receptor agonists directly activate estrogen receptor alpha [J]. Cancer Research, 2006, 66:2459-2467.
[14]Nicolas J M.Vitellogenesis in fish and the effects of polycyclic aromatic hydrocarbon contaminants [J].Aquatic Toxicology, 1999, 45:77-90.
[15]杨秀芬,钟正贤,廖梅春,等.蛇葡萄素与苯并芘合用对大鼠肺组织内CYP和GST基因表达的影响[J]. 中国药理学通报, 2010,26 (1) :135-136.
[16]Arukwe A, Celius T, Walther B T, et al. Effects of xenoestrogen treatment on zona radiata protein and vitellogenin expression inAtlantic salmon (Salmosalar) [J]. Aquatic Toxicology, 2000, 49:159-170.
[17]王文奇,白文坤,时昌文,等. TAM对人肝癌细胞增殖及 ER表达的影响[J].山东医药, 2007, 47(26):10-11.
[18]伍 刚,周敬安,许百男,等.雌激素和他莫昔芬对大鼠动脉血管平滑肌细胞雌激素受体及表型蛋白的影响[J]. 山东医药, 2009,499(48): 32-34.
Target gene expression inGambusiaaffinisexposed to 17β-estradiol, Bisphenol A and Benzo[a]Pyrene
XIONG Tian-tian, FANG Zhan-qiang
(Key Laboratory of Ecology and Environmental Science in Guangdong Higher Education,College of Life Sciences, South China Normal University, Guangzhou 510631, China)
This paper compares theVTGα,ERαandCYP4501Agenes expression in liver tissue of immature male mosquitofish (Gambusiaaffinis) when combined with exposure to 17β-estradiol (E2), Bisphenol A (BPA), Benzo[a]Pyrene (B[a]P) and Tamoxifen (TAM), in order to research the co-effects and sole-effects of exogenous hormone. The results showed that, when single exposure to low concentration of E2,VTGαandERαexpression was significantly up-regulated, but high concentration of E2 significantly inhibitedVTGα,ERαandCYP4501Aexpression. High concentrations of B[a]P significantly inhibitedVTGαexpression. B[a]P had no significant inhibitory effect on the expression ofERa, however, it caused a significant increase in the expression ofCYP4501A. BPA significantly up-regulatedVTGα andERαexpression, however, lower concentrations of BPA decreased significantlyCYP4501Aexpression. The joint exposure of B[a]P and high concentration E2caused a significant increase ofVTGαandERαexpression levels, but the joint exposure of B[a]P and low concentration of E2had no significant effect onERαexpression.CYP4501Aexpression levels were significantly increased when exposed to different concentrations of (B[a]P+E2) groups; when exposed to (B[a]P+E2+TAM) groups,VTGα,ERαandCYP4501Aexpression was also significantly or very significantly increased. Different concentrations of (B [a] P+BPA) groups caused a significant up-regulating ofVTGα,ERαandCYP4501Aexpression levels. When exposed to (B [a] P+BPA +TAM) groups,VTGαexpression was significantly decreased; however,ERαandCYP4501Aexpression was significantly increased. The result indicated that the mechanism ofAhR-ERαcross-talk pathway was complex, the regulation of this two pathway would be relevant to the effective concentration of chemicals. Comparing with the endocrine interferential effect induced by single chemical, the co-effect of the chemicals is related to exposure time and (or) the mixture concentration, not a simple addition of single one. We also treated the co-exposed of B[a]P and E2/BPA with TAM for the purpose of understanding the impact of Tamoxifen onAhR-ERacross-talk pathway. Generally, the results suggested that TAM inhibit the expression ofVTGα,ERαandCYP4501AmRNA.
endocrine disrupting chemicals; target gene; single-and co-exposure; mRNA expression;Gambusiaaffinis
2015-01-12;
2015-02-25
广东省科技计划项目(No.2009B030600006)
熊甜甜,硕士,研究方向为水生态毒理学;
方展强,博士生导师,主要从事动物学和水生态毒理学研究工作,E-mail: fangzhq@scnu.edu.cn。
Q355;S917.4
A
2095-1736(2015)05-0019-06
doi∶10.3969/j.issn.2095-1736.2015.05.019
