肥大细胞对重组口蹄疫病毒VP1-VP4蛋白的模式识别效应
2015-03-23李丽敏崔贝贝左玉柱王家鑫
李丽敏,王 燕,崔贝贝,林 敏,张 磊,左玉柱,王家鑫
(河北农业大学动物医学院免疫学实验室,保定 071000)
肥大细胞对重组口蹄疫病毒VP1-VP4蛋白的模式识别效应
李丽敏#,王 燕#,崔贝贝,林 敏,张 磊,左玉柱,王家鑫*
(河北农业大学动物医学院免疫学实验室,保定 071000)
为研究肥大细胞对重组口蹄疫病毒VP1-VP4蛋白的模式识别作用,将VP1-VP4蛋白负载经TLR2/TLR4抑制剂、甘露糖受体抑制剂或清道夫受体抑制剂预处理的小鼠肥大细胞系P815,在不同时间点观察其脱颗粒现象,并用ELISA检测细胞上清液中TNF-α的含量。结果显示,清道夫受体抑制剂处理组在负载VP1-VP4蛋白15和30 min时P815细胞脱颗粒数目均极显著低于重组VP1-VP4蛋白组(P<0.001)。在负载VP1-VP4蛋白24 h时,各抑制剂处理组的TNF-α含量均极显著低于VP1-VP4蛋白组(P<0.001),其中以甘露糖受体抑制剂处理组含量最低。这表明小鼠肥大细胞系P815主要通过清道夫受体识别FMDV VP1-VP4并引起脱颗粒现象的发生,而甘露糖受体和TLR2/TLR4识别FMDV VP1-VP4则是引起P815细胞分泌TNF-α的主要模式识别机制,其中以甘露糖受体的作用最强。
肥大细胞;模式识别受体;重组口蹄疫病毒VP1-VP4;脱颗粒;α-肿瘤坏死因子
肥大细胞起源于造血干细胞前体,迁移至外周组织中发育成熟,广泛分布于皮肤和黏膜等部位,与树突状细胞、巨噬细胞和NK细胞等共同组成抗感染的第一道防线。该细胞可分泌多种生物活性物质,在炎症和超敏反应过程中发挥重要作用。近来研究发现,病原体可刺激肥大细胞脱颗粒释放组胺、前列腺素、白三烯和细胞因子,从而启动固有免疫和适应性免疫[1-3]。A.L.St John等用流感病毒血凝素作抗原,以肥大细胞颗粒成分为佐剂制成的疫苗可使受免小鼠抵抗致死剂量的病毒攻击,为新型疫苗佐剂的筛选研究开辟了新途径[4]。
肥大细胞表达Toll样受体 (toll-like receptor,TLR)、NOD样受体(NOD-like receptor,NLR)、甘露糖受体(mannose receptor,MR)和清道夫受体(scavenger receptor,SR)等模式识别受体(pattern recognition receptor,PRR)。试验证明,细菌LPS和病毒结构蛋白可被肥大细胞膜表面的TLR2和TLR4识别,导致肥大细胞活化并释放TNF-α、IL-6、IL-4和IL-13[5-6]。与此相反,机体对金黄色葡萄球菌肽聚糖的细胞免疫应答虽然必须有肥大细胞的参与,但却既不依赖TLR2和TLR4,也不依赖TNF-α,提示肽聚糖可能被其他PRR识别[7]。应用模式识别受体抑制剂或特异性抗体阻断以及RNA干扰试验对鼠源肥大细胞系P815的研究发现,该细胞可通过TLR2、TLR4、NOD样受体、蛋白酶活化受体等受体识别链球菌、流感病毒和蛋白酶,并引起脱颗粒或分泌TNF-α、IL-6、IL-4、IL-12[8-11]。由于咽部是口蹄疫病毒(foot-and-mouth disease virus,FMDV)入侵机体的门户,而咽黏膜中有大量肥大细胞分布,那么肥大细胞能否以PRR识别FMDV并被激活呢?
临床研究证明,清除病毒感染不仅依赖高水平的中和抗体,而且还必须有活化CD8+T细胞参与。研究发现,口蹄疫病毒结构蛋白VP1富含T、B细胞抗原表位,既可刺激机体产生中和抗体,又可刺激机体产生对7种血清型FMDV具有交叉保护作用的CD8+T细胞应答[12],VP4亦含T、B细胞抗原表位,且在不同血清型的FMDV中高度保守,可被多种单体型MHC分子识别[13],并且研究表明树突状细胞可以通过MR和SR识别FMDV VP1-VP4蛋白[14],故本试验以重组FMDV VP1-VP4作为免疫原负载经TLR2/TLR4抑制剂OxPAPC[15]、MR抑制剂甘露聚糖[16]或SR抑制剂番泻苷B[17]预处理的小鼠肥大细胞系P815,观察其在不同时间的脱颗粒现象,检测其分泌的TNF-α,以揭示肥大细胞对口蹄疫病毒结构蛋白的模式识别作用。
1 材料与方法
1.1 材料与主要试剂
小鼠肥大细胞系P815由河北大学免疫学教研室曹志然教授惠赠。10%胎牛血清和RPMI 1640培养基购自Invitrogen公司。TLR2和TLR4抑制剂OxPAPC购自Invivogen公司,清道夫受体抑制剂番泻苷B(纯度99%)购自成都曼斯特生物科技有限公司,甘露糖受体抑制剂甘露聚糖和甲苯胺蓝购自Sigma公司,小鼠TNF-α ELISA试剂盒为eBioscience公司产品。
1.2 方法
1.2.1 重组FMDV VP1-VP4蛋白的制备 重组VP1-VP4的制备按本室报道的方法进行[18]。主要步骤如下:将阳性重组菌按1∶100的比例接种于含Amp的LB培养液中,37 ℃振荡培养至OD600 nm=0.8~1.0。加入IPTG,30 ℃振摇诱导培养5 h。离心菌液弃上清,用PBS重悬后加入上样缓冲液,离心,取上清液进行12% SDS-PAGE,回收目的蛋白VP1-VP4,保存于-20 ℃备用。
1.2.2 肥大细胞培养与负载VP1-VP4蛋白浓度的确定 将生长良好的肥大细胞P815用含10%胎牛血清的RPMI 1640培养基配成5×104·mL-1的细胞悬液,接种于放置有圆形盖玻片的12孔细胞培养板,每孔1 mL,置37 ℃、5% CO2培养箱中培养。于24 h分别用质量浓度为5、10、15和20 μg·mL-1的VP1-VP4蛋白负载,每个质量浓度和每个时相均设3个重复孔。
于负载后15、30、45和60 min用4%多聚甲醛(4 ℃)固定肥大细胞3 min,用PBS(pH 7.2)冲洗3次,然后置甲苯胺蓝染液中30 s,快速水洗,并用300 mL·L-1乙醇-PBS(pH 7.2) 分色,用光学树胶封片。在400倍放大的视野中随机取5个视野,每个视野中随机观察30个肥大细胞,分别记录体积增大和脱颗粒的肥大细胞数,以肥大细胞充分脱颗粒为活化指标[19],确定活化肥大细胞所需的最佳VP1-VP4蛋白质质量浓度。
1.2.3 肥大细胞识别VP1-VP4模式识别受体的研究 由于肥大细胞的吞噬功能较弱,并且树突状细胞可通过MR和SR识别VP1-VP4[14,18],所以我们假设TLR2、TLR4、MR和SR可能参与肥大细胞对VP1-VP4的识别。为此,在12孔细胞培养板每孔各接种5×104肥大细胞,置37 ℃、5% CO2培养箱中培养24 h后弃上清。然后加入新配制的含不同抑制剂和10%胎牛血清的RPMI 1640培养基,每个时间点每种抑制剂均设三个重复孔,其中OxPAPC、甘露聚糖和番泻苷B的浓度分别为30 μg·mL-1、3 mg·mL-1和0.23 mg·mL-1。作用1 h,按照1.2.2确定的最佳质量浓度加入VP1-VP4。上述处理组分别记为MC+OxPAPC+VP1-VP4、MC+Mannan+VP1-VP4和MC+番泻苷B+VP1-VP4,同时设只负载VP1-VP4对照组(MC+VP1-VP4)及肥大细胞空白对照组(MC)。
于负载VP1-VP4蛋白后15、30、45、60 min,固定肥大细胞,进行甲苯胺蓝染色,观察肥大细胞的形态变化与脱颗粒现象。于负载VP1-VP4后0.5、1、6、12和24 h收集肥大细胞上清液,以3 000 r·min-1的转速离心10 min,按照ELISA试剂盒说明书中的方法测定上清液中TNF-α的含量。
1.2.4 统计学分析 将上述试验所获得的数据按照Two-way ANOVA进行统计分析,所用软件为Graphpad Prism 5,以P<0.05为差异显著,以P<0.01为差异极显著,有统计学意义。
2 结 果
2.1 负载VP1-VP4蛋白剂量的确定
由于肥大细胞脱颗粒被视为其在受到免疫原(immunogen)刺激后充分活化的标志[19],故以脱颗粒为指标筛选活化肥大细胞所需负载的VP1-VP4蛋白用量。通过对甲苯胺蓝染色的肥大细胞观察发现,重组VP1-VP4可引起肥大细胞的脱颗粒(图1A)。从图1B可以看出,以15与20 μg·mL-1剂量的VP1-VP4蛋白负载肥大细胞后15 min,脱颗粒的细胞数量显著大于对照组(P<0.05或P<0.001),而5与10 μg·mL-1的剂量则不能充分诱导肥大细胞脱颗粒。然而至负载后45和60 min,小剂量的VP1-VP4蛋白也诱导了十分明显的脱颗粒现象,与空白对照组有极显著差异(P<0.001)。值得注意的是,15 μg·mL-1的VP1-VP4不仅可在第一时间引起肥大细胞脱颗粒,而且这种诱导作用呈现出随时间延长而逐渐增强的变化。与此不同,20 μg·mL-1的VP1-VP4蛋白则可迅速诱导肥大细胞脱颗粒,但此后脱颗粒作用则无明显变化,故将15 μg·mL-1剂量作为后续试验负载肥大细胞的用量。
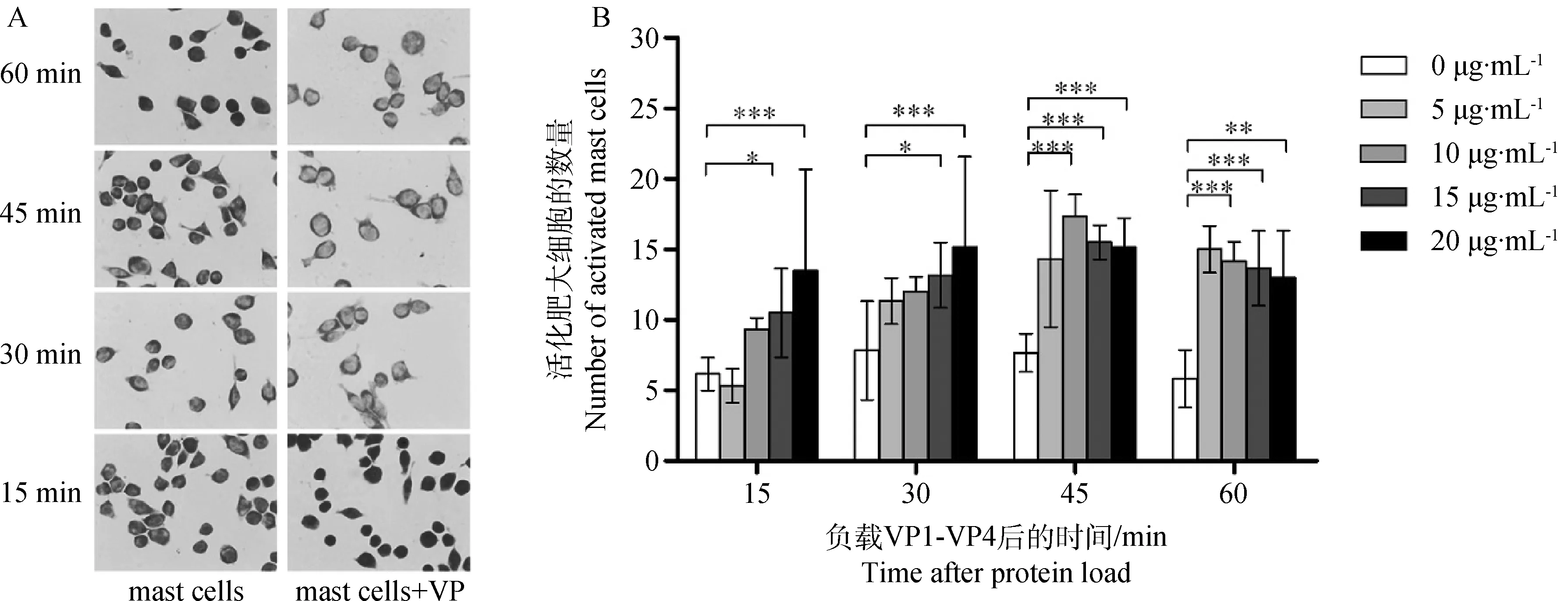
*.P<0.05;**.P<0.01;***.P<0.001图1 重组VP1-VP4蛋白刺激肥大细胞脱颗粒的剂量确定Fig.1 Titration of the dosage of recombinant VP1-VP4 protein that stimulates mast cell degranulation
2.2 肥大细胞识别VP1-VP4的模式识别受体
大量试验证明,细菌、病毒和真菌都可激活肥大细胞,根据活化肥大细胞的结构与功能变化,将活化作用分为脱颗粒和细胞因子分泌两个时相,前者发生在早期,后者通常在脱颗粒后数小时发生,其中TNF-α是最早释放的细胞因子之一[1,20]。
2.2.1 VP1-VP4负载经不同抑制剂处理的肥大细胞脱颗粒观察 上述试验证明,重组VP1-VP4蛋白可以活化肥大细胞。那么,肥大细胞是通过哪些模式识别受体识别FMDV VP1-VP4的呢?为此,用TLR2/4抑制剂、MR抑制剂和SR抑制剂阻断肥大细胞利用这四种受体对VP1-VP4的识别,观察负载VP1-VP4后肥大细胞的变化。结果显示,体积增大的细胞数目在各个时相的不同处理组间均差异不显著(P>0.05)(图2A)。但抑制SR处理组在负载蛋白质15和30 min脱颗粒的肥大细胞数目均显著低于 MC+VP1-VP4处理组(P<0.005或P<0.001)(图2B)。若以活化细胞总数(即体积增大的细胞数目与脱颗粒的细胞数目之和)为指标,抑制SR处理组在负载蛋白质15 min极显著低于MC+VP1-VP4处理组(P<0.01),其他处理组虽然有不同程度的减少,但是与MC+VP1-VP4处理组差异不显著(图2C),这表明肥大细胞在受到VP1-VP4刺激后发生脱颗粒现象主要是通过SR的模式识别所介导的。
*.P<0.05;**.P<0.01;***.P<0.001图2 VP1-VP4负载经不同抑制剂处理的肥大细胞脱颗粒状态Fig.2 The degranulation profile of mast cells triggered by VP1-VP4 after individual inhibitor treatments
2.2.2 VP1-VP4负载经不同抑制剂处理的肥大细胞分泌TNF-α的检测 业已证明,肥大细胞可合成并储存TNF-α,当其受到刺激时可迅速分泌,所以TNF-α分泌也被作为衡量肥大细胞活化的指标[5-6]。本试验为探明TLR2、TLR4、MR和SR四种模式识别受体在VP1-VP4活化肥大细胞中的作用,先用相应的抑制剂阻断这些受体,然后负载VP1-VP4,并在不同时间点收集上清液,用ELISA检测不同抑制剂处理组肥大细胞上清液中TNF-α的含量。结果显示,在0.5、1、6和12 h,四种受体抑制剂处理组与MC+VP1-VP4组及空白对照组的TNF-α含量相比差异不显著。但是在24 h,各抑制剂处理组的TNF-α含量均极显著低于MC+VP1-VP4组(P<0.001),其中以MR抑制剂处理组含量最低,几乎与空白对照组相同(图3)。此结果表明,肥大细胞可能通过MR、TLR2/TLR4和SR识别FMDV VP1-VP4,从而引起肥大细胞分泌TNF-α,其中以MR介导的模式识别作用最强。
*.P<0.05;**.P<0.01;***.P<0.001图3 不同处理组肥大细胞上清液中TNF-α的含量Fig.3 The contents of TNF-α in mast cell supernatants from every group
3 讨 论
虽然对肥大细胞在机体抗感染免疫中作用研究历史很短,但对肥大细胞在抗细菌免疫应答中的作用已经得到了广泛的认可。然而,对肥大细胞在抗病毒免疫应答中的作用却仍然了解很少[5,21]。尽管目前已经证实哺乳动物的肥大细胞可识别登革热病毒、单纯疱疹病毒、流感病毒、新城疫病毒、呼吸道合胞体病毒、仙台病毒和脑心肌炎病毒等[9,22],这些病毒或诱导肥大细胞脱颗粒,或刺激其分泌细胞因子、趋化因子和蛋白酶,但对于肥大细胞识别病毒的受体还知之甚少[5,6],而且也未见肥大细胞通过模式识别受体感知FMDV的报道。
本研究将重组FMDV VP1-VP4蛋白负载小鼠肥大细胞系P815,发现其可以引起该细胞脱颗粒(图1和图2),并在负载该蛋白质后24 h分泌TNF-α(图3),这表明FMDV VP1-VP4蛋白可以活化小鼠肥大细胞系P815,但诱导该细胞分泌TNF-α的时间却明显晚于其他病原体对肥大细胞的刺激[1,5]。由于TNF-α可促进树突状细胞的成熟,增强其抗原提呈功能,所以FMDV结构蛋白(即使用大剂量)延迟肥大细胞系P815分泌TNF-α的现象可能与灭活FMDV疫苗免疫保护诱导期长有关。值得注意的是,大剂量的VP1-VP4可以迅速激活P815,使其脱颗粒,而小剂量的VP1-VP4虽然在早期不能诱导其脱颗粒,但随着负载时间的延长,其刺激鼠源肥大细胞系P815脱颗粒的作用甚至还强于大剂量的VP1-VP4。由于活化肥大细胞所释放的生物介质是决定树突状细胞抗原提呈方向的重要因素[1,4-5],所以该研究结果可能对科学设计与正确使用口蹄疫疫苗具有一定的指导意义。
为了探明VP1-VP4活化肥大细胞的触发机制,本试验利用OxPAPC抑制TLR2和TLR4,用番泻苷B抑制清道夫受体,用甘露聚糖抑制甘露糖受体,然后负载VP1-VP4,并与正常肥大细胞进行比较,藉此明确肥大细胞识别VP1-VP4的模式识别受体。从图2可以看出,阻断SR可显著抑制肥大细胞系P815脱颗粒,但对其分泌TNF-α的抑制作用很弱(图3)。与此相反,阻断MR则对该细胞分泌TNF-α的抑制作用十分明显,而对肥大细胞系P815脱颗粒的抑制作用相对较弱。这提示SR是肥大细胞系P815识别VP1-VP4后触发脱颗粒的主要受体,而MR则是肥大细胞系P815识别VP1-VP4后触发分泌TNF-α的主要受体。然而我们注意到,虽然阻断TLR2和TLR4处理组的脱颗粒肥大细胞数量与MC+VP1-VP4处理组差异不显著,但是该组TNF-α的分泌水平却在负载蛋白质后24 h极显著低于MC+VP1-VP4处理组(图2C和图3),这提示TLR2或TLR4可能与MR协同调节肥大细胞系P815识别FMDV VP1-VP4后的TNF-α分泌过程,尽管这种抑制作用弱于MR阻断的效果。
需要指出的是,SR不仅是肥大细胞系P815识别VP1-VP4触发脱颗粒的最主要受体,而且SR对VP1-VP4的识别也可促进其分泌TNF-α,这表明SR不仅是肥大细胞的吞噬性受体,而且也是介导信号转导的模式识别受体。树突状细胞也表达SR、MR和TLR等受体,但树突状细胞通过SR和MR对口蹄疫病毒VP1-VP4的识别却可抑制其抗原提呈功能[14,18]。因此如何协调肥大细胞与树突状细胞对VP1-VP4模式识别作用之间的关系,从而有效调动二者参与对FMDV的免疫应答将是一个很值得深入研究的课题。
[1] ABRAHAM S N,ST JOHN A L.Mast cell-orchestrated immunity to pathogens[J].NatRevImmunol,2010,10(6):440-452.
[2] RODRIGUEZ A R,YU J J,GUENTZEL M N,et al.Mast cell TLR2 signaling is crucial for effective killing of Francisella tularensis[J].JImmunol,2012,188(11):5604-5611.
[3] CHOI H W,ABRAHAM S N.Mast cell mediator responses and their suppression by pathogenic and commensal microorganisms[J].MolImmunol,2015,63(1):74-79.
[4] ST JOHN A L,CHAN C Y,STAATS H F,et al.Synthetic mast-cell granules as adjuvants to promote and polarize immunity in lymph nodes[J].NatMater,2012,11(3):250-257.
[5] HAIDL I D,MARSHALL J S.Human mast cell activation with viruses and pathogen products[J].MethodsMolBiol,2015,1220:179-201.
[6] ST JOHN A L,ABRAHAM S N.Innate immunity and its regulation by mast cells[J].JImmunol,2013,190(9):4458-4463.
[7] JAWDAT D M,ROWDEN G,MARSHALL J S.Mast cells have a pivotal role in TNF-independent lymph node hypertrophy and the mobilization of Langerhans cells in response to bacterial peptidoglycan[J].JImmunol,2006,177(3):1755-1762.
[8] QIAO L Y,ZHANG H Y,WU S D,et al.Downregulation of protease activated receptor expression and cytokine production in P815 cells by RNA interference[J].BMCCellBiol,2009,10:62.
[9] LIU B,MENG D,WEI T,et al.Apoptosis and pro-inflammatory cytokine response of mast cells induced by influenza A viruses[J].PLoSOne,2014,9(6):e100109.
[10] FENG B S,HE S H,ZHENG P Y,et al.Mast cells play a crucial role in Staphylococcus aureus peptidoglycan-induced diarrhea[J].AmJPathol,2007,171(2):537-547.
[12] GUZMAN E,TAYLOR G,CHARLESTON B,et al.Induction of a cross-reactive CD8(+) T cell response following foot-and-mouth disease virus vaccination[J].JVirol,2010,84(23):12375-12384.
[13] VAN LIEROP M J,NILSSON P R,WAGENAAR J P,et al.The influence of MHC polymorphism on the selection of T-cell determinants of FMDV in cattle[J].Immunology,1995,84(1):79-85.
[14] 高云欢,李 娜,董昌海,等.清道夫受体在树突状细胞提呈口蹄疫病毒VP1-VP4抗原中的作用[J].畜牧兽医学报,2014,45(1):129-145. GAO Y H,LI N,DONG C H,et al.The role of scavenger receptors on dendritic cells in presenting VP1-VP4 antigen of foot-and-mouth disease virus to T cells[J].ActaVeterinariaetZootechniaSinica,2014,45(1):129-145.(in Chinese)
[15] STAMM L V,DRAPP R L.TLR2 and TLR4 mediate the TNFα response to Vibrio vulnificus biotype 1[J].PathogDis,2014,71(3):357-361.
[16] RAYCROFT M T,HARVEY B P,BRUCK M J,et al.Inhibition of antigen trafficking through scavenger receptor A[J].JBiolChem,2012,287(8):5310-5316.
[17] VUKMAN K V,RAVIDA,ALDRIDGE A M,et al.Mannose receptor and macrophage galactose-type lectin are involved in Bordetella pertussis mast cell interaction[J].JLeukocBiol,2013,94(3):439-448.
[18] 李 娜,李丽敏,安鹏丽,等.负载口蹄疫病毒VP1-VP4融合蛋白质的树突状细胞对T细胞的活化效应[J].中国兽医学报,2012,32(6):818-822. LI N,LI L M,AN P L,et al.T lymphocyte activation by dendritic cells pulsed with VP1-VP4 fusion protein of foot-and-mouth disease virus[J].ChineseJournalofVeterinaryScience,2012,32(6):818-822.(in Chinese)
[19] STAATS H F,KIRWAN S M,CHOI H W,et al.A mast cell degranulation screening assay for the identification of novel mast cell activating agents[J].Medchemcomm,2013,4(1):88-94.
[20] PESCHKE K,WEITZMANN A,HEGER K,et al.IκB kinase 2 is essential for IgE-induced mast cell de novo cytokine production but not for degranulation[J].CellRep,2014,8(5):1300-1307.
[21] AOKI R,KAWAMURA T,GOSHIMA F,et al.Mast cells play a key role in host defense against herpes simplex virus infection through TNF-α and IL-6 production[J].JInvestDermatol,2013,133(9):2170-2179.
[22] ST JOHN A L,RATHORE A P,YAP H,et al.Immune surveillance by mast cells during dengue infection promotes natural killer(NK) and NKT-cell recruitment and viral clearance[J].ProcNatlAcadSciUSA,2011,108(22):9190-9195.
(编辑 白永平)
The Effectiveness of Mast Cell Pattern Recognition of Recombinant VP1-VP4 of Foot-and-mouth Disease Virus
LI Li-min#,WANG Yan#,CUI Bei-bei,LIN Min,ZHANG Lei,ZUO Yu-zhu,WANG Jia-xin*
(CollegeofVeterinaryMedicine,AgriculturalUniversityofHebei,Baoding071000,China)
The objective of this study was designed to investigate the effectiveness of mast cell pattern recognition of recombinant VP1-VP4 of foot-and-mouth disease virus(FMDV).To this end,murine mast cell line P815 were pulsed with the recombinant VP1-VP4 of FMDV after inhibitors of Toll-like receptor 2/4(OxPAPC),mannose receptors(Mannan),and scavenger receptors(Sennoside B) were administered to murine mast cell line,respectively.Degranulation of P815 mast cells stained with toluidine blue was observed at the given time.And the levels of TNF-α in P815 mast cell culture supernatants were determined by ELISA at different timepoints.It was showed that the number of degranulated P815 mast cells with administration of scavenger receptor inhibitor was significantly lower than that of cells pulsed with recombinant VP1-VP4 protein at 15 min and 30 min(P<0.001).Intriguingly,the TNF-α release from the mast cell line activated by recombinant VP1-VP4 at 24 h was significantly blocked with three inhibitors(P<0.01),of which,mannan,a mannose receptor inhibitor,showed the strongest inhibition on TNF-α release.Our data indicate that murine mast cell line P815 degranulation triggered by recombinant VP1-VP4 was predominantly mediated via the recognition of scavenger receptors,while the TNF-α release from the activated mast cells was constitutively initiated with the recognition of mannose receptors,TLR2,and TLR4.Of note,recognition of recombinant VP1-VP4 through mannose receptors plays a predominant role in triggering TNF-α release from P815 mast cells activated by recombinant VP1-VP4.
mast cell;pattern recognition receptor;recombinant FMDV VP1-VP4 protein;degranulation;TNF-α
10.11843/j.issn.0366-6964.2015.09.021
2015-01-07
国家自然科学基金(31402174);河北省预防兽医学重点学科青年基金 (20130101)
李丽敏(1982-),女,河北元氏人,讲师,博士,主要从事免疫学教学与科研工作,E-mail:lilimin03@163.com;王 燕(1987-),女,河北广平人,硕士生,主要从事肥大细胞的模式识别研究,E-mail:wangyan871203@163.com。二人并列第一作者
*通信作者:王家鑫,教授,E-mail:mastwang@163.com
S852.4
A
0366-6964(2015)09-1644-06
