老龄牦牛睾丸细胞外基质相关蛋白的分布特征
2015-03-23袁莉刚朱峻峰谷来凤陈国娟
袁莉刚,朱峻峰,谷来凤,陈国娟
(甘肃农业大学动物医学院,兰州 730070 )
老龄牦牛睾丸细胞外基质相关蛋白的分布特征
袁莉刚*,朱峻峰,谷来凤,陈国娟
(甘肃农业大学动物医学院,兰州 730070 )
探索细胞外基质相关蛋白在老龄牦牛睾丸的分布特征。应用组织化学方法比较、观察9头健康老龄牦牛和10头青年牦牛睾丸组织结构特点及层黏连蛋白(LN)、Ⅳ型胶原(Col Ⅳ)和硫酸乙酰肝素糖蛋白(HSPG)的分布特征。结果显示:光镜下,老龄牦牛生精上皮部分或完全退化,生精小管固有膜及间质胶原纤维及网状纤维较青年牦牛丰富;老龄睾丸间质血管及生精小管固有膜中AB-PAS阳性反应较青年牦牛增强。数据统计表明,老龄牦牛Sertoli细胞及Leydig细胞数均明显减少,生精小管横截面积以及平均间质组织面积极显著大于青年牦牛(P<0.01)。免疫组织化学显示,LN在老龄牦牛睾丸Sertoli细胞和肌样细胞表达与青年牦牛相近,LN在生精细胞表达降低,而在Leydig细胞几乎无表达;Col Ⅳ在不同年龄牦牛睾丸组织表达位置及强弱相似,但其平均吸光度检测结果无统计学差异;老龄牦牛睾丸组织HSPG主要在Leydig细胞表达降低,平均吸光度检测统计极显著低于青年牦牛(P<0.01);同一年龄段LN 、Col Ⅳ和HSPG表达无明显差异。高原环境中,老龄牦牛生精上皮退化伴随着间质成分增加、间质面积增大、Leydig细胞及Sertoli细胞数量减少等形态学变化;睾丸组织Col Ⅳ分泌增加且胶原纤维合成增强,LN和HSPG的显著降低可能影响Leydig细胞合成分泌能力。
老龄牦牛;睾丸;层黏连蛋白;胶原蛋白;硫酸乙酰肝素糖蛋白;免疫组织化学
睾丸细胞外基质(exreacellular matrix,ECM )包括生精小管基膜和管周细胞间基质部分,含有很多细胞因子及其受体,主要包括Ⅰ型和Ⅳ型胶原、层黏连蛋白、制动素和蛋白多糖等,对生精上皮的结构和激素的支持发挥着关键作用[1-2]。研究表明,在人或动物随着年龄增加睾丸功能退化与其形态改变密切相关,如管周组织及间质组织的纤维化以及睾丸Leydig 细胞数量的下降等[3],老年人睾丸是研究生精相关蛋白质功能随年龄变化很好的模型[4],O.T.Pop等[5]对老年人睾丸的组织学定量分析表明,睾丸小叶实质的百分比随年龄有下降的趋势,生精小管内层基膜退行性变化以及间质组织中胶原纤维的数量和密度均有所增加,分析认为胶原纤维增加主要原因是ECM的退行性变化。很多关于老龄化睾丸的研究资料主要集中于人或实验动物(如大鼠、小鼠等),对于高海拔地区老龄化人或动物的研究资料却很少。高寒低氧地区,公牦牛在8、9岁以后逐渐老龄化,繁殖能力迅速减退[6],目前国内外对于老龄牦牛细胞外基质相关蛋白定位及分布特征研究尚未见报道。本研究通过特殊染色结合免疫组织化学SP法比较观察9头健康老龄牦牛和10头青年牦牛睾丸组织结构特点及ECM 重要成分Ⅳ型胶原(collagen,ColⅣ)、层黏连蛋白(laminin,LN )和硫酸乙酰肝素糖蛋白(heparan sulfate proteoglycans,HSPG)的分布特征,揭示老龄牦牛睾丸ECM与生精细胞发育的微环境、血睾屏障之间的相互关系,对于探讨高原哺乳动物的老化后生殖生理研究提供参考资料。
1 材料与方法
1.1 试验材料
1.1.1 实验动物 3、4岁牦牛睾丸10对,9~13岁牦牛睾丸9对,10、11月份在青海大通牧区通过外科去势手术采集睾丸,根据不同研究方法取样固定。
1.1.2 主要药品试剂 兔抗鼠Col Ⅳ蛋白、LN及HSPG多克隆抗体(bs-0806R、bs-0821R和bs-5072R,购自北京博奥森生物技术有限公司);免疫组化染色试剂盒(SP-9001,由美国ZYMED生产,购自北京中杉金桥生物技术有限公司);DAB显色试剂盒(ZLI-9018,北京中杉金桥生物技术有限公司)。
1.2 试验方法
1.2.1 组织化学样本制备和观察:组织样品切成1 cm×1 cm×0.6 cm大小,4%多聚甲醛磷酸盐缓冲液固定,常规石蜡包埋,切片厚5 μm ,苏木素-伊红(HE)常规染色;Masson三色染色(亮绿),胶原纤维呈现蓝绿色,细胞核呈现灰黑或灰蓝色,红细胞呈红色;Gomori银染显示网状纤维为灰色,苏木素-伊红复染后呈棕红色。AB-PAS染色(pH=2.5),苏木精复染,显示酸性黏蛋白呈蓝色,中性黏蛋白呈红色。1.2.2 免疫组化染色:采用免疫组化SP法进行染色,石蜡切片常规脱蜡,酒精梯度分化;30 g·L-1H2O2水溶液封闭过氧化物酶10 min,正常山羊血清白蛋白孵育15 min后;每张切片滴加50 μL兔多克隆抗鼠LN - IgG(稀释度1∶400),37 ℃孵育2 h,PBS振洗后每张切片滴加50 μL生物素标记山羊抗兔IgG工作液,后加50 μL辣根酶标记链霉卵白素工作液,37 ℃孵育滴加新鲜配制DAB显色液,常规脱水透明、封片。
Col Ⅳ免疫组化染色时一抗Col Ⅳ-IgG,其他操作步骤同LN。HSPG免疫组化染色时一抗为HSPG-IgG,其他操作步骤同LN;阴性对照以PBS替代兔源一抗进行染色。
1.3 数据统计

2 结 果
2.1 老龄牦牛和青年牦牛睾丸组织结构特征比较
光镜下青年牦牛睾丸生精上皮为4~8层生精细胞及Sertoli细胞构成,大量成熟精子明显分布于腔面,肌样细胞细胞核呈长索形围绕于生精小管固有膜外周,Leydig细胞成簇分布于间质组织中(图1A);间质组织内胶原纤维及网状纤维分布明显,尤以生精小管固有膜较为丰富(图1B~1C)。AB-PAS染色显示睾丸生精上皮固有膜及间质毛细血管壁呈紫红色,生精上皮管腔面精子附着处呈蓝色(图1D)。老龄牦牛生精小管部分或完全退化,生精上皮不完整,细胞层为2~5层,生殖细胞数量减少。Sertoli细胞和前细线期精母细胞存在于基膜处(图1E)。胶原纤维增加明显(图1F),网状纤维丰富(图1G),二者在间质组织分布较固有膜明显,Leydig细胞细胞核呈圆形或椭圆形,核膜清晰明显,散在于结缔组织之间。AB-PAS染色显示睾丸生精上皮Sertoli细胞着色淡,但老龄牦牛睾丸间质血管及生精小管固有膜阳性反应较青年牦牛睾丸增强(图1H)。
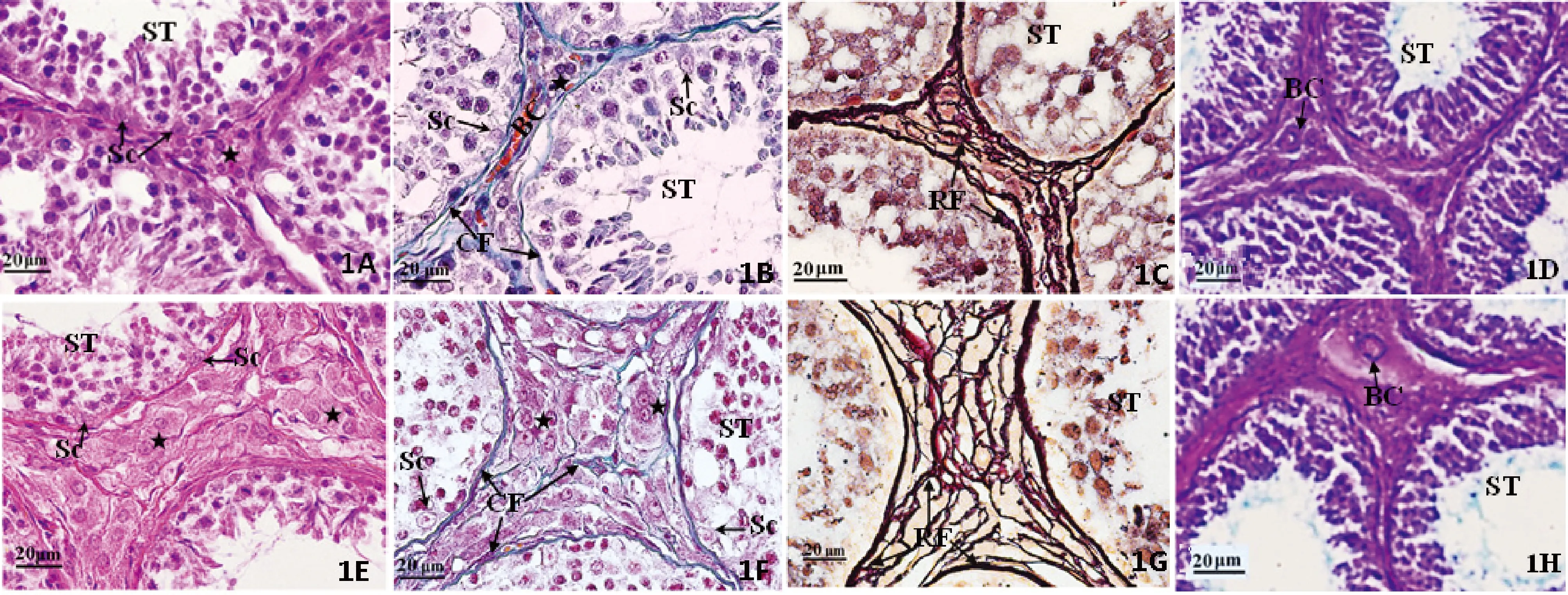
BC.毛细血管;CF.胶原纤维;RF.网状纤维;Sc. Sertoli细胞;ST.生精小管;星号示Leydig细胞(下同)。1A~1D.青年牦牛睾丸组织,标尺示20 μm;1A.生精上皮细胞层为4~7层,HE染色;1B.生精小管固有膜及间质组织内胶原纤维分布明显,Masson染色;1C. 生精小管固有膜及间质组织中网状纤维较为丰富,Gomori染色;1D. 生精小管固有膜及间质血管壁AB-PAS阳性反应明显,AB-PAS染色。1E~1H.老龄牦牛睾丸组织,1E.生精上皮细胞层为2~5层,HE染色;1F.生精小管基膜及间质组织内胶原纤维丰富,间质结缔组织较青年牦牛睾丸增加明显,Masson染色;1G. 生精小管固有膜及间质组织中网状纤维丰富;Gomori染色;1H.生精小管固有膜及间质血管壁AB-PAS阳性反应较强,AB-PAS染色BC. Blood capillaries;CF,Collagen fiber; RF. Reticular fiber; Sc. Sertoli cells; ST. Seminiferious tubule; The black star represent Leydig cells (The same as below).1A-1D.Photomicrographs of young adult yak testis, Bar=20 μm;1A.Note 4-7 layers of peritubular cells, HE staining;1B.Photomicrographs of testis parenchyma of yaks stained by Masson, there were obvious connective tissue between the seminiferous tubules;1C.Photomicrographs of seminiferous tubule of yaks stained by Gomori, showing the reticular fibers was abundant in interstitial tissue and the tutnica propria;1D.AB-PAS positive stain in seminiferous basement and blood capillary of young adult yak testis.1E-1H.Photomicrographs of aging yak testis;1E.Note 2-5 layers of peritubular cells, HE staining;1F.Photomicrographs of testis parenchyma of yaks stained by Masson, the connective tissue between the seminiferous tubules were more abundant than in the young adult yak testis;1G.Photomicrographs of Seminiferous tubule of yaks stained by Gomori, showing the reticular fibers was more abundant in interstitial tissue and the tutnica propria;1H.Compared with young adult yak testis, there were more AB-PAS positive stain in aging yak seminiferous basement and blood capillary图1 青年牦牛和老龄牦牛睾丸组织的比较Fig.1 Comparison of testis tissue between young adult and aging yak
数据统计表明,老龄牦牛睾丸Sertoli细胞及Leydig细胞数均明显低于青年牦牛,睾丸组织生精小管基膜及间质组织内胶原纤维丰富,生精小管外直径减少,生精小管横截面积显著减小及间质组织面积显著增大(表1)。
2.2 老龄牦牛与青年牦牛睾丸细胞外基质相关蛋白的分布比较
青年牦牛睾丸细胞外基质相关蛋白免疫组化显示,LN在各级生精细胞阳性表达明显(图2A,2B),Sertoli细胞和肌样细胞均呈弱阳性表达,而Leydig细胞为强阳性表达(图2C);Col Ⅳ在生精小管各级生精细胞、Sertoli细胞和肌样细胞均呈阳性表达(图2D),Leydig细胞及毛细血管表达较弱(图2E);HSPG在各级生精细胞弱表达、Leydig细胞及Sertoli细胞均为强阳性表达(图2G),而在肌样细胞弱表达(图2H);各蛋白阴性对照无表达(图2G)。
老龄牦牛睾丸细胞外基质相关蛋白免疫组化观察,LN生精上皮近官腔面生精细胞显示有阳性表达(图2H,2J),Sertoli细胞、肌样细胞为弱阳性(图2J),Leydig细胞几乎无表达(图2K);Col Ⅳ在生精小管各级生精细胞、Sertoli细胞和Leydig细胞均呈阳性表达(图2L),肌样细胞表达较弱(图2M);HSPG在各级生精细胞弱表达、Sertoli细胞及肌样细胞均为阳性表达(图2N),在Leydig细胞几乎无表达(图2O);各蛋白阴性对照无表达(图2P)。
2.3 老龄牦牛与青年牦牛睾丸细胞外基质相关蛋白的免疫组织化学检测结果对比分析
免疫组织化学图像分析结果显示,老龄牦牛睾丸组织中LN和HSPG的分布显著低于青年牦牛,不同年龄间Col Ⅳ检测结果无统计学差异;同一年龄段,LN、Col Ⅳ和HSPG在睾丸组织表达的平均吸光度相比不存在统计学差异(表2,图3)

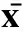

年龄AgeSertoli细胞数/个NumbersofSertolicellsLeydig细胞数/个NumbersofLeydigcells生精小管外管径/μmTheouterdiameteroftheseminiferoustubules生精小管横截面积/μm2Seminiferoustubulearea平均间质组织面积/μm2Meaningareaofinterstitialtissue青年牦牛Youngadultyaktestis28.46±5.3122.03±13.69236.93±37.8473718.59±224.928276.01±253.76老龄牦牛Agingyaktestis14.63±4.48∗13.19±8.45∗204.38±18.6546948.75±197.33∗∗16863.58±171.53∗∗

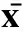

年龄Age平均吸光度AverageabsorbanceLNColⅣHSPG青年牦牛Youngadultyak0.0642±0.0046∗∗0.0517±0.00590.0769±0.0041∗∗老龄牦牛Agingyak0.0356±0.00180.0486±0.00830.0409±0.0063
3 讨 论
高原低氧环境下睾丸组织形态学发生改变其生精功能也会受到影响[7]。研究表明,缺氧对雄性生育能力的抑制不可忽视,睾丸局部血液循环中氧含量较低,可导致各种酶及蛋白降解能力降低,精子生成数量减少[8],而在老龄挪威灰鼠睾丸生精上皮形态的改变是导致类固醇生成和精子发生下降的根本原因[9]。本研究中老龄牦牛睾丸实质内睾丸组织生精小管部分或完全退化,生殖细胞数量减少,这与老年人生精小管形态变化一致,认为是生精小管渐进性退化逐渐萎缩的结构特点[10]。哺乳动物睾丸间质结缔组织构成间质内血管、淋巴管以及Leydig细胞等的组织支架。研究表明,牛睾丸间质结缔组织的胶原纤维含量随不同品种而差异明显,且结缔组织的增加与精子质量降低相关[11]。研究报道,大鼠生精小管管周的网状纤维为生殖上皮结构提供支持[12],在实验性饮酒的成年雄性大鼠生精小管管周间质组织的网状纤维缺失,导致生精小管横截面面积减小,生精上皮厚度减少,抑制精子生成[13]。本研究中与青年牦牛睾丸相比,老龄牦牛生精小管外直径减少,间质组织面积显著增大,胶原纤维明显增加,这些变化可能对老龄牦牛精子数量及质量都会产生不利影响,导致生精功能下降。但本研究中老龄牦牛睾丸间质网状纤维丰富,其对生精小管形态改变的影响有待于进一步分析。

2A~2C.LN在青年牦牛睾丸的表达;2D~2E. Col Ⅳ在青年牦牛睾丸的表达;2F~2G. HSPG在青年牦牛睾丸的表达;2H. 青年牦牛睾丸免疫组化染色阴性对照;2I~2K. LN在老龄牦牛睾丸的表达;2L~2M. Col Ⅳ在老龄牦牛睾丸的表达;2N~2O. HSPG在老龄牦牛睾丸的表达;2P.老龄牦牛睾丸免疫组化染色阴性对照2A-2C.The expression of LN in young adult yak testis;2D-2E.The expression of Col Ⅳ in young adult yak testis; 2F-2G.The expression of HSPG in young adult yak testis;2H.The control of young adult yak testis;2I-2K.The expression of LN in aging yak testis;2L-2M.The expression of Col Ⅳ in aging yak testis;2N-2O.The expression of HSPG in aging yak testis;2P.The control of aging yak testis图2 免疫组化SP染色,苏木素复染,LN、Col Ⅳ及HSPG在青年牦牛和老龄牦牛睾丸的表达Fig.2 LN,Col Ⅳ and HSPG expression in testis of young adult and aging yak by SP immunohistochemical staining,counterstain with hematoxylin
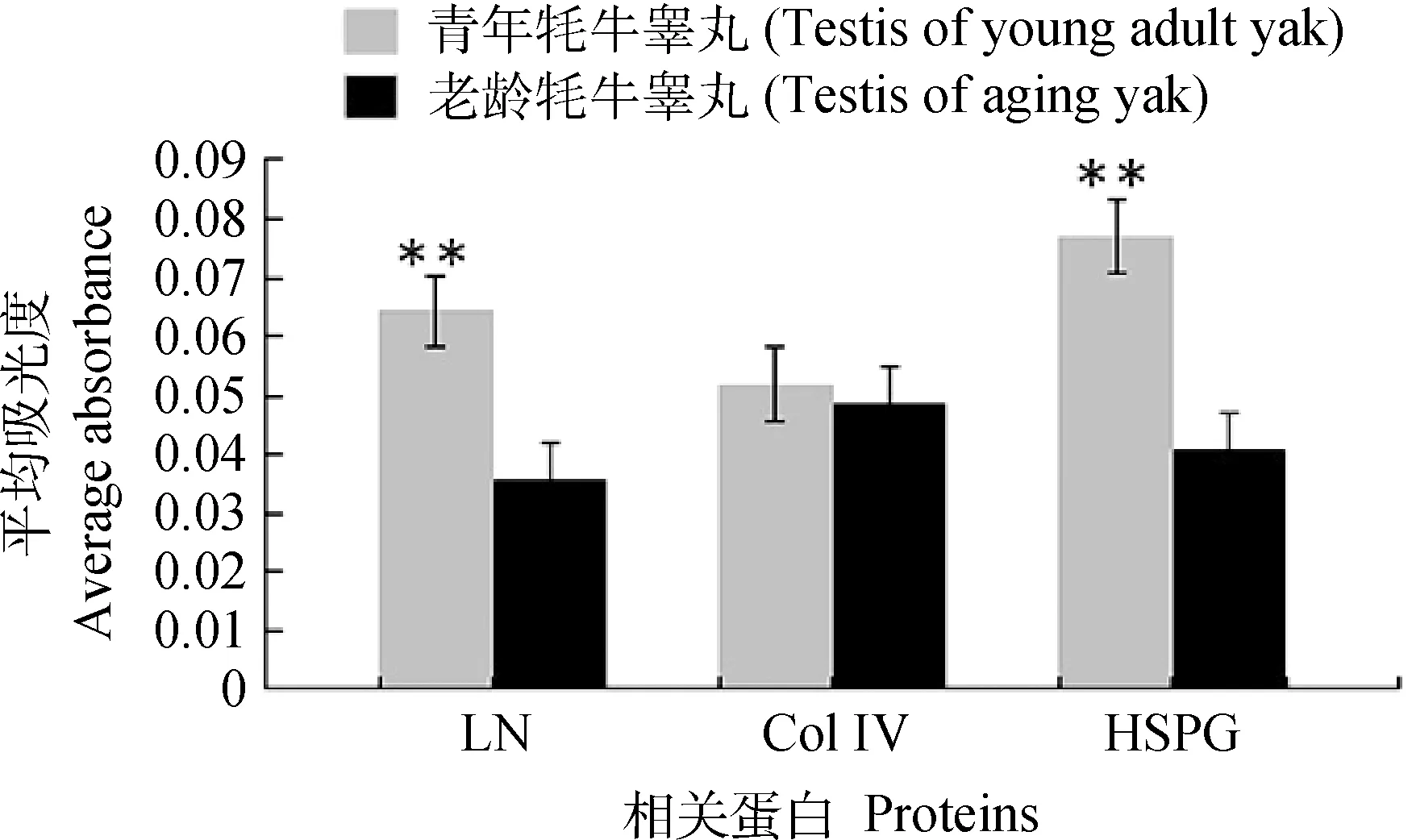
LN和 HSPG表达的平均吸光度在老龄牦牛和青年牦牛睾丸具有统计学显著差异(与老龄牦牛相比,**P<0.01)The average absorbance of LN and HSPG expression was significantly higher in testis of young adult yak (Compared with counterparts of aging yak testis, ** P<0.01)图3 LN、Col Ⅳ及HSPG在老龄牦牛和青年牦牛睾丸表达平均吸光度检测结果Fig.3 Column graph of average absorbance of LN,Col Ⅳand HSPG expression in testis of young adult and aging yak
AB-PAS阳性反应的糖原、糖蛋白以及蛋白多糖很典型地存在于结缔组织、黏液以及基膜中,睾丸生精小管基膜的基本成分(如LN)是PAS特殊反应阳性糖蛋白[14]。研究表明,短吻鳄在出生后1周至5月龄,AB-PAS阳性主要位于睾丸间质结缔组织、Leydig 细胞以及生精小管基膜,生精细胞的成熟伴随着间质组织增加,Leydig 细胞群的建立,AB-PAS阳性反应区也会增加[14];而老龄小鼠AB-PAS在睾丸 Leydig 细胞及基质中会再次出现强阳性反应性[15]。本研究中老龄牦牛睾丸间质血管及生精小管固有膜中AB-PAS阳性反应较青年牦牛增强,可能与间质组织中结缔组织合成增加相关。睾丸间质结缔组织含量的增加会引起睾丸组织纤维化,影响Leydig 细胞分泌产物输送,进而影响其对睾丸生精功能调控作用[5]。由于高原生态环境的特殊性,牦牛的发情期和生殖机能是随着季节变化的,主要表现为暖季发情。本研究中牦牛睾丸样本均为发情间期采集,因此,除去繁殖季节、温度、光照等环境因素的影响,老龄牦牛睾丸间质AB-PAS阳性反应增强可为结缔组织成分合成增加的组织学参考。
哺乳动物睾丸中,生精小管基膜是ECM 的特殊型,Sertoli细胞和发育不同阶段的生精细胞依赖于基膜的结构支持完成其生理功能。研究表明,睾丸ECM的重要成分(如Col Ⅳ、LN及HSPG等)与生精细胞的蛋白酶、蛋白酶抑制子以及TNFα等细胞因子相互作用参与调控精子发生[2]。不同种属动物睾丸基膜中的LN及Col Ⅳ在管周肌样细胞发育时出现,且在Sertoli细胞分化以及维持分化的各个阶段发挥功能[16];本研究中LN在老龄牦牛睾丸Sertoli细胞和肌样细胞表达与青年牦牛相似,提示LN在老龄牦牛睾丸Sertoli细胞形态及基膜构成仍然发挥作用,与I.Virtanen等在人的研究相一致,这也可能是有助于老龄牦牛仍然具有一定的生精能力[17]。体外研究表明,LN能够调节Leydig 细胞的合成分泌类固醇激素的能力[18];本研究中免疫组化检测结果表明老龄后睾丸LN 显著降低,且在Leydig细胞几乎无表达,提示睾丸内其含量变化可能参与调节老龄后Leydig细胞的分泌功能。
Col Ⅳ是基膜的主要胶原成分,形成结构网架,它存在于所有的基膜中,使其具有韧性和通透性[19]。牛睾丸中Col Ⅳ主要存在于基膜,且Sertoli细胞、生精细胞以及肌样细胞均可产生[20]。本研究中不同年龄牦牛睾丸组织Col Ⅳ在表达位置及强弱相似,在生精小管各级生精细胞、Sertoli细胞和肌样细胞均呈阳性表达,且Col Ⅳ平均吸光度检测结果无统计学差异,提示在不同年龄牦牛Sertoli细胞和管周肌样细胞均与合成Col Ⅳ密切相关,老龄牦牛虽然Sertoli细胞数量减少,但是其合成Col Ⅳ的能力或者并没有下降。
研究表明[21],HSPG是人类生精上皮基膜层普遍存在的重要成分,不仅能结合基膜中的LN、Ⅰ型胶原等多种成分,而且还与基膜外多种成分及细胞外多功能信号分子结合,发挥其重要功能。在体外研究表明HSPG参与调解成年大鼠Leydig细胞睾酮的产生[22];免疫组化研究证实,HSPG在成熟且高度分化的上皮细胞不表达[23]。本研究中免疫组织化学图像分析结果显示,老龄牦牛睾丸组织HSPG的分布显著低于青年牦牛,Sertoli细胞表达无明显变化,主要为Leydig细胞表达降低,提示HSPG可能间接影响Leydig细胞分泌睾酮的功能。
因此,高原环境中老龄牦牛生精上皮退化伴随着间质结缔组织成分增加、间质面积增大、Leydig细胞及Sertoli细胞数量减少等形态学数据变化;睾丸组织Col Ⅳ分泌增加且胶原纤维合成增强,LN和HSPG的显著降低可能影响Leydig细胞合成分泌能力。
[1] 宋 阳,许增禄.睾丸细胞外间质作用的研究[J].解剖学报,1997,28(2):221-223. SONG Y,XU Z L.Study on role of the testis extracellular matrix[J].ActaAnatomicaSinica,1997,28(2):221-223.(in Chinese)
[2] SIU M K,CHENG C Y.Extracellular matrix and its role in spermatogenesis[J].AdvExpMedBiol,2008,636:74-91.
[3] POULOSE N,RAJU R.Aging and injury:alterations in cellular energetics and organ function[J].AgingDis,2014,5(2):101-108.
[4] LI F,ZOU Y G,GUO W B,et al.The aged testis.A good model to find proteins involved in age-related changes of testis by proteomic analysis[J].JReprodMed,2014,59(1-2):31-38.
[5] POP O T,COTOI C G,PLEEA I E,et al.Histological and ultrastructural analysis of the seminiferous tubule wall in ageing testis[J].RomJMorpholEmbryol,2011,52(1):241-248.
[6] 阎 萍,潘和平.环境因素对牦牛繁殖性能的影响[J].畜牧与兽医,2004,36(5):15-16. YAN P,PAN H P.Environmental effects on yak reproductive performance[J].AnimalHusbandryandVeterinaryMedicine,2004,36(5):15-16.(in Chinese)
[7] MADRID E,REYES J G,HERNNDEZ B,et al.Effect of normobaric hypoxia on the testis in a murine model[J].Andrologia,2013,45(5):332-338.
[8] LIAO W,CAI M,CHEN J,et al.Hypobaric hypoxia causes deleterious effects on spermatogenesis in rats[J].Reproduction,2010,139(6):1031-1038.
[9] LEVY S,SERRE V,HERMO L,et al.The effects of aging on the seminiferous epithelium and the blood-testis barrier of the Brown Norway rat[J].JAndrol,1999,20(3):356-365.
[10] JIANG H,ZHU W J,LI J,et al.Quantitative histological analysis and ultrastructure of the aging human testis[J].IntUrolNephrol,2014,46(5):879-885.
[11] HOFLACK G,VAN DEN BROECK W,MAES D,et al.Testicular dysfunction is responsible for low sperm quality in Belgian Blue bulls[J].Theriogenology,2008,69(3):323-332.
[12] FAKOYA F A.Reticulin fibres in the tunica albuginea and peritubular tissue of seminiferous tubules of adult male Wistar rats[J].ActaHistochem,2002,104(3):279-283.
[13] FAKOYA F A,CAXTON-MARTINS E A.Morphological alterations in the seminiferous tubules of adult Wistar rats:the effects of prenatal ethanol exposure[J].FoliaMorphol(Warsz),2004,63(2):195-202.
[14] MOORE B C,HAMLIN H J,BOTTERI N L,et al.Posthatching development of Alligator mississippiensis ovary and testis[J].JMorphol,2010,271(5):580-595.
[15] TANEMURA K,KUROHMARU M,KURAMOTO K,et al.Age-related morphological changes in the testis of the BDF1 mouse[J].JVetMedSci,1993,55(5):703-710.
[16] BERKHOLTZ C B,LAI B E,WOODRUFF T K,et al.Distribution of extracellular matrix proteins type I collagen,type IV collagen,fibronectin,and laminin in mouse folliculogenesis[J].HistochemCellBiol,2006,126(5):583-592.
[17] VIRTANEN I,LOHI J,TANI T,et al.Distinct changes in the laminin composition of basement membranes in human seminiferous tubules during development and degeneration[J].AmJPathol, 1997,150(4):1421-1431.
[18] DIAZ E S,PELLIZZARI E,MERONI S,et al.Effect of extracellular matrix proteins oninvitrotestosterone production by rat Leydig cells[J].MolReprodDev,2002,61(4):493-503.
[19] HARVEY S J,PERRY J,ZHENG K,et al.Sequential expression of type IV collagen networks:testis as a model and relevance to spermatogenesis[J].AmJPathol,2006,168(5):1587-1597.
[20] GLATTAUER V,IRVING-RODGERS H F,RODGERS R J,et al.Examination of basement membrane components associated with the bovine seminiferous tubule basal lamina[J].ReprodFertilDev,2007,19(3):473-481.
[21] 姜笃银,付小兵,盛志勇.硫酸乙酰肝素糖蛋白的结构-功能多样性与相关修饰酶群作用[J].中国病理生理杂志,2005,21(5):1020-1025. JIANG D Y,FU X B,SHENG Z Y.The diversity of structure and function of heparin sulfate proteoglycans via modification of some relative enzymes[J].ChineseJournalofPathophysiology,2005,21(5):1020-1025.(in Chinese)
[22] MCFARLANE J R,LASLETT A,DE KRETSER D M,et al.Evidence that heparin binding autocrine factors modulate testosterone production by the adult rat Leydig cell[J].MolCellEndocrinol,1996,118(1-2):57-63.
[23] HAYASHI K,HAYASHI M,JALKANEN M,et al.Immunocytochemistry of cell surface heparan sulfate proteoglycan in mouse tissues.A light and electron microscopic study[J].JHistochemCytochem,1987,35(10):1079-1088.
(编辑 白永平)
Distribution of Extracellular Matrix Components in Aging Yak Testis
YUAN Li-gang*,ZHU Jun-feng,GU Lai-feng,CHEN Guo-juan
(CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
This study was conducted to characterize the structure and distribution of extracellular matrix(ECM) proteins of testis in aging yak testis.The testis from 9 aging and 10 young adult yak were prepared for distribution investigation of laminin(LN),type IV collagen(ColⅣ) and heparan sulfate proteoglycans(HSPG) by immunohistochemistry and histochemistry methods.The observations made with the light microscope showed obvious morphological changes of aging,there were partly progressive regressed in the seminiferous epithelium and the volume of interstitial tissues has further increased and abundant with collagen and reticular fiber,and also there were AB-PAS positive stain in aging yak seminiferous basement and blood capillary.Statistical data showed that the number of Sertoli cells and Leydig cells in aging yak testis were reduced obviously,but the cross-sectional area of the seminiferous tubules and average interstitial tissue areas were more larger than which in the young yak testis.Immunostaining analysis appeared that the LN was present similarity in Sertoli cells and peritubular myoid cells in the aging and young adult yak.The relative expression of LN in spermatogenic cells was decreased and almost no detected in aging yak Leydig cells(P<0.01).By contrast,the distribution of Col Ⅳ without statistical differences in yak testis at different ages.The relative expression of HSPG in the aging yak testis tissue was more lower than which in young adult yak,and the strong immunoreactivity for HSPG was seen in the Leydig cells(P<0.01).In addition,the average absorbance of LN,Col Ⅳand HSPG expression was no obvious difference between different ages.All the elements of the intralobular interstitial space may undergo degenerative changes in aging yak which live in plateau environment,the secretion of Col Ⅳ increased company with the synthesis of collagen fiber reinforced,and the distribution of ECM proteins LN and HSPG were significantly decreased may closely related with the alterations of Leydig cells′ synthesis and secretion ability.
aging yak;testis;laminin;collagenⅣ;heparan sulfate proteoglycans;immunohistochemistry
10.11843/j.issn.0366-6964.2015.09.023
2014-12-25
国家自然科学基金项目(31160488)
袁莉刚(1974-),女,甘肃陇南人,博士,教授,主要从事动物发育生物学研究
*通信作者:袁莉刚,E-mail:yuan2918@126.com,Tel:0931-7631229
S852.162
A
0366-6964(2015)09-1656-07
