羊源致病性弗氏柠檬酸杆菌的分离与鉴定
2015-03-23刘会胜赵战勤常世恺
刘会胜,赵战勤*,薛 云,薛 巧 ,汪 洋 ,常世恺,刘 媛
(1.河南科技大学动物科技学院,河南省高等学校环境与畜产品安全重点学科开放实验室,洛阳 471003; 2.河南科技大学医学技术与工程学院,微生物检验实验室,洛阳 471003)
羊源致病性弗氏柠檬酸杆菌的分离与鉴定
刘会胜1,赵战勤1*,薛 云2,薛 巧1,汪 洋1,常世恺1,刘 媛1
(1.河南科技大学动物科技学院,河南省高等学校环境与畜产品安全重点学科开放实验室,洛阳 471003; 2.河南科技大学医学技术与工程学院,微生物检验实验室,洛阳 471003)
旨在确定导致河南省某养殖场小尾寒羊细菌性感染死亡的病原。从3只不同时间发病死亡的小尾寒羊各组织脏器的病料中分离到3株细菌——LK-1、LK-2和LK-3株。经微生物自动鉴定仪鉴定和细菌16S rRNA基因序列分析,确定该致病菌为弗氏柠檬酸杆菌。小鼠毒力试验结果表明:3株细菌的LD50分别为5.0×107、6.0×107和5.8×107CFU。回归试验结果表明,经人工感染健康小尾寒羊,可复制与自然发病羊相似的症状和病理变化,且从其各组织脏器内再次分离到相同的病原菌。药敏试验结果表明,3株弗氏柠檬酸杆菌对大部分药物的抗药谱相同(17/21),且均对头孢噻肟等11种药物高度敏感。这些研究结果表明弗氏柠檬酸杆菌是该小尾寒羊致死性病例的病原菌。本文在国内外首次报道了弗氏柠檬酸杆菌对小尾寒羊具有致病性。
羊;弗氏柠檬酸杆菌;分离;药敏试验;回归试验
柠檬酸杆菌是肠杆菌科中的一种革兰阴性细菌,是人和动物肠道内的正常菌群,普遍分布在自然环境,如土壤、水、污水及食物中,是水体污染的重要细菌学指标之一[1]。根据DNA杂交试验,柠檬酸杆菌可分为11个基因种。其中,弗氏柠檬酸杆菌(Citrobacterfreundii)、科氏柠檬酸杆菌(C.koseri)和布氏柠檬酸杆菌(C.braakii)常与人和动物的感染有关。在人类,该细菌主要引起呼吸道、泌尿生殖道以及消化道感染,尤其是在婴儿、儿童及免疫功能不全的人体中,可引起脑膜炎、脑脓肿和新生儿败血症等[2]。近年来,柠檬酸杆菌已成为医院感染的常见病原菌之一。根据2008年度数据报告,柠檬酸杆菌在临床分离的肠杆菌中占第5位[3]。柠檬酸杆菌对动物致病的重要性还未能确定。但是,近年来,该菌引起鱼、鳖、虾、大鲵、螈、 蟹等水产动物感染发病[4-7]的报道较多。另外,肠外感染也可发生在实验小鼠、鸟类和爬行动物中,而且它们的排泄物中携带柠檬酸杆菌[8]。但是,柠檬酸杆菌导致哺乳动物发病的报道很少。本研究首次发现弗氏柠檬酸杆菌导致小尾寒羊感染发病的病例,且该病例中弗氏柠檬酸杆菌可以导致小尾寒羊发生败血症和急性死亡。本研究对该病原进行了系统鉴定并对其致病性进行了初步研究,为该病的致病机制及其综合防控技术研究奠定了基础。
1 材料与方法
1.1 病例描述
2014年1月,河南省某规模化小尾寒羊养殖场,突发一种致死性传染病。羔羊和成年羊均可发生,发病羊主要表现为体温升高(41~42 ℃)、精神沉郁、食欲废绝、喜卧,可视黏膜发绀,然后突然倒地,四肢震颤,发出痛苦低沉鸣叫声,常于发病后8~24 h突然死亡,病死率100%(18/18)。对病死的4只羔羊和5只成年羊进行系统剖检,均呈现典型的败血症性病理变化。主要表现为腹腔有少量积液,肺、心肌严重出血,肝、脾肿大、出血,大、小肠均出血,肾出血,脑轻度水肿。
1.2 材料与实验动物
胰蛋白大豆琼脂(Tryptic Soy Agar,TSA)和胰蛋白大豆肉汤(Tryptic Soy Broth,TSB)培养基购自美国BD公司,四季青特级新生牛血清购自浙江天杭生物科技有限公司。生化鉴定管、药敏纸片和质控标准菌株(大肠埃希菌ATCC25922,金黄色葡萄球菌ATCC25923)购自杭州天和微生物试剂有限公司。基因组提取试剂盒、TaqDNA聚合酶购自上海SANGON公司;Bact-IST型全自动微生物鉴定仪购自珠海迪尔生物工程有限公司;PCR引物由上海SANGON公司合成。6~8周龄SPF级雌性BALB/c小鼠购自中国食品药品检定研究院;3~4月龄、15~18 kg健康小尾寒羊购自河南省洛阳市散养农户。
1.3 细菌的分离与培养
无菌采取发病羊的各脏器组织,涂布于含10%新生牛血清的TSA培养皿上,37 ℃培养18~24 h后观察,挑取单菌落进行传代纯化和革兰染色、镜检。
1.4 生化试验和微生物鉴定仪的鉴定
按生化管使用说明书对不同时间分离自3个病例的3株细菌(命名为LK-1、LK-2和LK-3)进行生化试验并判定结果。同时,按厂家使用说明书对分离的3株细菌进行全自动微生物鉴定仪的鉴定。
1.5 16S rRNA基因序列的扩增和测定
1.5.1 PCR引物 用于16S rRNA基因序列扩增的引物[9]为通用引物5′-AGAGTTTGATCCTGGCTCAG-3′和5′-ACGGTTACCTTGTTACGAC-TT-3′。
1.5.2 PCR反应 按试剂盒说明书分别提取LK-1、LK-2和LK-3株的基因组为PCR模板。PCR反应体系(25 μL):10×Buffer 2.5 μL,25 mmol·L-1MgCl22 μL,2 μmol·L-1dNTPs 1 μL,10 μg·m L-1上、下游引物各1 μL,2 U·μL-1TaqDNA 聚合酶0.5 μL,无菌水16 μL,模板1 μL。PCR反应条件:94 ℃变性4 min; 94 ℃ 60 s,56 ℃ 60 s,72 ℃ 120 s,25个循环; 72 ℃延伸10 min,4 ℃保存。
1.5.3 序列测定 PCR产物由上海SANGON公司进行测序,测序结果应用BLAST在线生物学软件(http://blast.st-va.ncbi.nlm.nih.gov/Blast.cgi)进行NCBI数据库搜索比对分析。
1.6 序列分析及系统发育树的构建
通过NCBI的BLAST检索系统对LK-1、LK-2和LK-3株16S rRNA基因序列进行同源性分析,选取NCBI已报道的不同动物来源弗氏柠檬酸杆菌的16S rRNA基因序列作为内群;同时,选取柠檬酸杆菌属的沃克曼柠檬酸杆菌、吉伦柠檬酸杆菌和塞氏柠檬酸杆菌,及埃希菌族的大肠杆菌、沙门菌、志贺菌,气单胞菌属的嗜水气单胞菌作为外群。利用Clustal X2软件[10]进行多序列全局比对,利用MEGA 6.0软件[11]的Neighbour-joining方法和Kimura 2-parameter校正软件进行同源性比较并构建系统发育树,并通过1 000次的自举分析(Boostrap)进行置信度检测。
1.7 药敏试验和治疗
按标准纸片琼脂扩散法(K-B法)对分离的3株细菌进行药敏试验[12]。质控标准菌株为大肠埃希菌ATCC25922和金黄色葡萄球菌ATCC25923。
1.8 小鼠毒力试验
取细菌LK-1株的纯培养物接种于含10%新生牛血清的TSA平板上,37 ℃培养24~48 h,挑取单菌落到含10%新生牛血清的TSB液体培养基中,37 ℃、200 r·min-1摇床培养12~16 h。使用无菌PBS将培养好的菌液进行5倍比稀释3个梯度。将20只BALB/c小鼠均分为5组(4只·组-1),取上述原菌液及每个梯度稀释菌液分别对一组BALB/c小鼠进行腹腔接种(0.2 mL·只-1)。同时对原菌液进行活菌计数,确定接种的实际菌量。同时,设立1组4只小鼠接种无菌PBS为空白对照。观察、记录发病及死亡情况15 d,死亡者立即剖检,取其内脏和脑组织进行细菌分离鉴定,并根据Reed-Muench法[13]计算LD50。按照同样的方法对LK-2和LK-3株进行小鼠LD50的测定。
1.9 羊回归试验
[14]所述方法对小尾寒羊分别进行静脉和皮下途径攻毒。将3~4月龄、15~18 kg小尾寒羊5只,分为3组(2只、2只、1只)。第1组2只通过耳静脉接种[14]上述1.8中培养的LK-1株菌液2 mL(含活菌2.5×109CFU)。第2组2只通过颈部皮下接种[14]LK-1株菌液2 mL(含活菌2.5×109CFU)。第3组1只通过耳静脉接种2 mL无菌PBS为对照。观察、记录发病及死亡情况至14 d,死亡者立即剖检,取其内脏和脑组织进行细菌分离鉴定。
2 结 果
2.1 细菌分离情况
从发病死亡羊的各组织病料中均能分离出单一细菌,该细菌在含10%新生牛血清的TSA培养基上,37 ℃培养18~24 h后形成直径2~3 mm,光滑、湿润、低凸、半透明、乳白色、有光泽、边缘整齐的菌落。通过革兰染色镜检,可见菌体直径约1.0 μm、长2.0~6.0 μm,直杆,单个或成对排列的革兰阴性杆菌。与肠杆菌科的一般定义相符。对该羊场先后发病死亡的3个病例的细菌分离结果表明,在其心血、肺、肝、脾、肾、脑、小肠和淋巴结率均能分离到该细菌,这与发病死亡羊所呈现的败血症性病理变化相一致,也表明该细菌能导致羊发生严重的系统感染。
2.2 生化试验和全自动微生物鉴定仪的鉴定
生化试验结果表明,3株分离细菌LK-1、LK-2和LK-3株的生化反应谱是相同的,均为葡萄糖、麦芽糖、蔗糖、果糖、半乳糖、甘露醇、甘露糖、棉籽糖、山梨醇、β-半乳糖苷、尿素,硫化氢反应阳性。但是鸟氨酸脱羧酶、硝盐酸还原、靛基质和精氨酸脱氢酶反应均为阴性。该生化反应谱符合弗氏柠檬酸杆菌的生化特征。同时,对分离的3株细菌均进行了全自动微生物鉴定仪的鉴定。结果表明,LK-1、LK-2和LK-3株细菌经微生物鉴定仪鉴定均为弗氏柠檬酸杆菌(可能性均超过99%)。微生物鉴定仪中的生化反应项目的结果与人工操作的生化反应管的结果一致。
2.3 16S rRNA基因序列分析及系统发育树的构建
以LK-1、LK-2和LK-3株细菌的基因组为模板,使用通用引物PCR扩增获得了3个菌株的16S rRNA基因序列(1 450 bp,图1)。序列比对结果表明,LK-1和LK-3株的16S rRNA基因序列(GenBank登录号:KP068655)完全相同,两者与LK-2株在第439位碱基处不同,由G变为A。从构建的系统进化树(图2)可以看出,LK-1株与日本弗氏柠檬酸杆菌NBRC16624株(鱼肉分离株;GenBank登录号AB681088.1)聚为一簇,且置信度达98%,表明两者亲缘关系最近。与其他动物源弗氏柠檬酸杆菌的亲缘关系依次是江苏草鱼源JS株(HQ399663)、湖北大鲵源JZ01株(JN831090)、上海鲟源HD0103株(JX483809.1)、江西中华鳖源LCJY-002株(KC691177)和安徽虾源X120523株(KF156749.1)。
2.4 药敏试验
从表1可以看出,3株弗氏柠檬酸杆菌LK-1、LK-2和LK-3株对大部分药物的抗药谱相同(17/21),但3株细菌对阿莫西林、头孢克洛、链霉素和阿奇霉素4种药物的敏感性有明显差异。3株细菌对头孢噻肟等11种药物均高度敏感,对青霉素G和红霉素均耐药。

M.DL2000相对分子质量标准;1~3.LK-1、LK-2、LK-3株细菌的PCR结果;4.空白(H2O)对照M.DL2000 marker;1-3.PCR product of LK-1,LK-2,LK-3 isolate,respectively;4.Negative control (H2O)图1 LK-1、LK-2和LK-3株细菌16S rRNA基因的PCR结果Fig.1 The amplification of 16S rRNA gene fragement of LK-1,LK-2,LK-3 isolates
2.5 小鼠毒力试验
小鼠毒力试验结果表明,空白对照组小鼠均未出现任何发病症状和死亡情况。三株弗氏柠檬酸杆菌LK-1、LK-2和LK-3株腹腔攻毒的小鼠表现精神萎靡,不食或采食减少。小鼠最早于攻毒后8 h开始死亡,死亡多发生在12~24 h,攻毒3 d(72 h)后小鼠停止死亡。死亡小鼠剖检主要表现为败血症性病理变化。从死亡小鼠脑、心血、肺、肝、肠、淋巴结等组织均能分离到感染菌。根据Reed-Muench法[13]计算LK-1、LK-2和LK-3株的LD50分别为5.0×107、6.0×107和5.8×107CFU。

分支后的数字为GenBank登录号,分支点上的数字为1 000次自举分析(Boostrap)的置信度,0.01为1%的序列分歧度Numbers in parentheses represent the sequences accession number in GenBank.The number at each branch points is the percentage supported by bootstrap.Bar,1% sequence divergence图2 LK-1株16S rRNA基因的系统发育进化树Fig.2 Phylogenetic trees of Citrobacter freundii based on 16S rRNA gene sequence of LK-1 strain
2.6 羊回归试验
通过耳静脉接种弗氏柠檬酸杆菌LK-1株菌液的2只小尾寒羊(2.5×109CFU·只-1),4 h后体温均升高到41 ℃以上,精神抑郁、厌食、呼吸困难、喜卧,8 h后出现腹泻,可视黏膜发绀,四肢震颤,卧地不起等症状;分别在接种后10和18 h死亡。通过颈部皮下接种弗氏柠檬酸杆菌LK-1株菌液的2只小尾寒羊(2.5×109CFU·只-1),12 h内体温没有明显升高,但24 h后均升高到41 ℃以上,其他临床症状与耳静脉接种的羊相似,但发生过程比较缓慢;分别在接种3和5 d后死亡。接种无菌PBS的对照羊,在14 d的观察期内没有出现任何发病症状。发病死亡羊立即剖检,可见典型的败血症性病理变化。主要表现为腹腔有积水,肺、心肌严重出血,肝出血,脾肿大、严重出血,淋巴结病变不明显,大、小肠出血,肾出血,脑轻度水肿。从死亡羊的心、肝、脾、肺、脑、肠、淋巴结均能分离出与接种菌一致的细菌。
表1 弗氏柠檬酸杆菌分离株的药敏试验结果
Table 1 Drug sensitivity of 3Citrobacterfreundiiisolates to 21 drugs
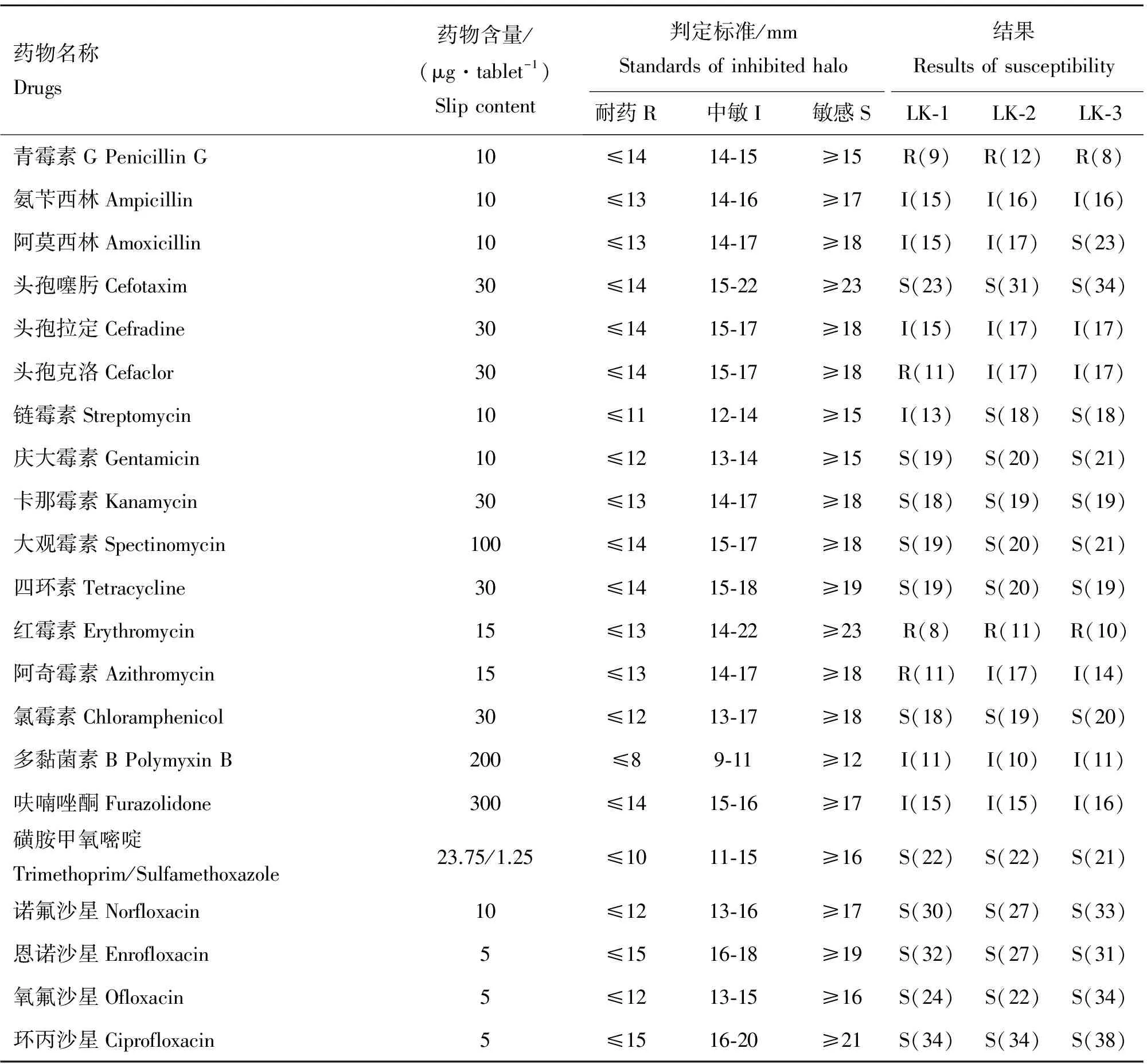
药物名称Drugs药物含量/(μg·tablet-1)Slipcontent判定标准/mmStandardsofinhibitedhalo结果Resultsofsusceptibility耐药R中敏I敏感SLK⁃1LK⁃2LK⁃3青霉素GPenicillinG10≤1414⁃15≥15R(9)R(12)R(8)氨苄西林Ampicillin10≤1314⁃16≥17I(15)I(16)I(16)阿莫西林Amoxicillin10≤1314⁃17≥18I(15)I(17)S(23)头孢噻肟Cefotaxim30≤1415⁃22≥23S(23)S(31)S(34)头孢拉定Cefradine30≤1415⁃17≥18I(15)I(17)I(17)头孢克洛Cefaclor30≤1415⁃17≥18R(11)I(17)I(17)链霉素Streptomycin10≤1112⁃14≥15I(13)S(18)S(18)庆大霉素Gentamicin10≤1213⁃14≥15S(19)S(20)S(21)卡那霉素Kanamycin30≤1314⁃17≥18S(18)S(19)S(19)大观霉素Spectinomycin100≤1415⁃17≥18S(19)S(20)S(21)四环素Tetracycline30≤1415⁃18≥19S(19)S(20)S(19)红霉素Erythromycin15≤1314⁃22≥23R(8)R(11)R(10)阿奇霉素Azithromycin15≤1314⁃17≥18R(11)I(17)I(14)氯霉素Chloramphenicol30≤1213⁃17≥18S(18)S(19)S(20)多黏菌素BPolymyxinB200≤89⁃11≥12I(11)I(10)I(11)呋喃唑酮Furazolidone300≤1415⁃16≥17I(15)I(15)I(16)磺胺甲氧嘧啶Trimethoprim/Sulfamethoxazole23.75/1.25≤1011⁃15≥16S(22)S(22)S(21)诺氟沙星Norfloxacin10≤1213⁃16≥17S(30)S(27)S(33)恩诺沙星Enrofloxacin5≤1516⁃18≥19S(32)S(27)S(31)氧氟沙星Ofloxacin5≤1213⁃15≥16S(24)S(22)S(34)环丙沙星Ciprofloxacin5≤1516⁃20≥21S(34)S(34)S(38)
R.耐药;I.中度敏感;S.高度敏感
R.Resistant;I.Moderate sensitive;S.Highly sensitive
3 讨 论
柠檬酸杆菌是肠杆菌科的一属革兰阴性短杆菌,弗氏柠檬酸杆菌为柠檬酸杆菌属中的模式种。近年来,该菌引起人与水产动物感染发病[4-7]的报道较多。另外,感染也可发生在鸟类和爬行动物[8]。但柠檬酸杆菌导致哺乳动物发病的报道很少。2000年王冬梅等报道了弗氏柠檬酸杆菌导致人和仔猪食物中毒性腹泻的病例[15]。2004年周勤等从腹泻猕猴的肛拭子中分离到了1株弗氏柠檬酸杆菌[16]。2007年雷静等从犊牛腹泻病料中分离到2株弗氏柠檬酸杆菌[17]。2008年孙洋等报道该菌可导致东北虎的出血性腹泻病[18]。但是,这些病例均是柠檬酸杆菌相关的腹泻病例。本研究中,病羊表现为发病过程急且往往以死亡告终,剖检可见以多系统出血为特征的败血症性病理变化,从各个组织脏器中均能分离到较纯的弗氏柠檬酸杆菌,这表明该菌可以导致小尾寒羊发生严重的系统感染,而不仅局限于肠道感染。羊回归试验结果也表明,经人工感染健康小尾寒羊,可复制与自然发病羊相似的症状和病理变化,且从感染病羊各组织脏器中再次分离到相同的病原菌。
本研究对分离到的3株细菌同时进行了生化鉴定和全自动微生物鉴定分析仪的鉴定,发现后者能对微生物进行快速、准确的鉴定,显著优于常规的生化试验鉴定方法。本研究中,从3个死亡羊分离的LK-1、LK-2和LK-3株细菌经全自动微生物鉴定仪鉴定均为弗氏柠檬酸杆菌(可能性均超过99%)。进一步的系统进化树分析结果表明,相比于中国的5个水产动物分离株,LK-1株与日本鱼肉源的NBRC16624株亲缘关系更近,这可能暗示羊源LK-1株不是来源于我国水产动物的跨种传播。药敏试验结果表明,分离的3株弗氏柠檬酸杆菌对大部分药物的抗药谱相同(17/21),但对其中的4种药物有明显差异。3株细菌对头孢噻肟等11种抗生素均高度敏感,临床上可把这些药物作为治疗该病的首选药物。虽然3株弗氏柠檬酸杆菌是同一发病群体分离的同种细菌,但其对阿莫西林、头孢克洛、链霉素和阿奇霉素4种药物的敏感性却有明显差别,这可能暗示着弗氏柠檬酸杆菌针对这些药物能快速产生耐药性。
近几年,规模化养羊业迅速发展,但其疫病防控技术相对滞后,导致新发和再现性细菌传染病的不断出现和流行。本研究首次报道从小尾寒羊的致死性病例中分离到弗氏柠檬酸杆菌,并对其致病性和药物敏感性进行了初步探讨,为该病的防治及快速诊断试剂和高效疫苗的研制、开发奠定基础。
参考文献(References):
[2] PLAKKAL N,SORAISHAM A S,AMIN H.Citrobacterfreundiibrain abscess in a preterm infant:a case report and literature review[J].PediatrNeonatol,2013,54(2):137-140.
[3] 窦红涛,谢秀丽,张小江,等.Mohnarin 2008年度报告:肠杆菌科细菌耐药监测[J].中国抗生素杂志,2010,35(7):556-564.
DOU H T,XIE X L,ZHANG X J,et al.2008 mohnarin report:results of enterobacteriaceae resistance[J].ChineseJournalofAntibiotics,2010,35(7):556-564.(in Chinese)
[4] AUSTIN B,STOBIE M,ROBERTSON P A W.Citrobacterfreundii:the cause of gastro-enterit is leading to progressive low level mortalities in farmed rainbow trout,Oncorhynchus mykiss Walbaum,in Scotland[J].BullEurAssocFishPathol,1992,12:166-167.
[5] 林启存,朱丽敏,李忠全,等.中华鳖弗氏柠檬酸杆菌败血症病原分离鉴定与药敏试验[J].水产科学,2008,27(1):42-43.
LIN Q C,ZHU L M,LI Z Q,et al.Isolation,determination and antimicrobial susceptibility test of theCitrobacterfreundiisepticemia from soft shelled turtle trionyx sinensis[J].FisheriesScience,2008,27(1):42-43.(in Chinese)
[6] 沈锦玉,顾志敏,潘晓艺,等.红螯螯虾弗氏柠檬酸杆菌病病原的分离与鉴定[J].中国水产科学,2005,12(2):197-200.
SHEN J Y,GU Z M,PAN X Y,et al.Isolation and identification ofCitrobacterfreundiifromCheraxquadricarinatus[J].JournalofFisherySciencesofChina,2005,12(2):197-200.(in Chinese)
[7] 高正勇,曾令兵,孟 彦,等.患病大鲵中弗氏柠檬酸杆菌的分离与鉴定[J].微生物学报,2012,52(2):169-176.
GAO Z Y,ZENG L B,MENG Y,et al.Isolation and identification ofCitrobacterfreundiifrom diseased giant salamander,Andriasdavidianus[J].ActaMicrobiologicaSinica,2012,52(2):169-176.(in Chinese)
[8] LUPERCHIO S A,SCHAUER D B.Molecular pathogenesis ofCitrobacterrodentiumand transmissible murine colonic hyperplasia[J].MicrobesInfect,2001,3(4):333-340.
[9] BOCHNER B R.New technologies to assess genotype-phenotype relationships[J].NatRevGenet,2003,4(4):309-314.
[10] THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].NucleicAcidsRes,1997,25(24):4876-4882.
[11] SAITOU N,NEI M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].MolBiolEvol,1987,4(4):406-425.
[12] 陆承平.兽医微生物学[M].4版,北京:中国农业出版社,2007:199-384.
LU C P.Veterinary microbiology[M].4rd edition,Beijing:China Agriculture Press,2007:199-384.(in Chinese)
[13] REED L J,MUENCH H.A simple method of estimating fifty percent endpoints[J].AmJHyg,1938,27(3):493-497.
[14] 农业部兽用生物制品规程委员会.中华人民共和国兽用生物制品规程(2000年版)[M].北京:化学工业出版社,2000:34-37.
MINISTRY O A.Procedures of veterinary biological products of the People’s Republic of China[M].Beijing:Chemical Industry Press,2000:34-37.(in Chinese)
[15] 王冬梅,穆青辉,程连青,等.费劳地柠檬酸杆菌致人畜腹泻的调查[J].中国人兽共患病杂志,2000,16(1):112.
WANG D M,MU Q H,CHENG L Q,et al.Survey of diarrhea of humans and animals caused by Citrobacter freundii[J].ChineseJournalofZoonoses,2000,16(1):112.(in Chinese)
[16] 周 勤,郭光远.弗劳地枸橼酸杆菌引起的猕猴腹泻[J].上海实验动物科学,2004,24(1):39-40.
ZHOU Q,GUO G Y.Identification ofCitrobacterfreundiicaused diarrhea in rhesus monkey[J].ShanghaiLaboratoryAnimalScience,2004,24(1):39-40.(in Chinese)
[17] 雷 静,练耕宁,牟 平,等.从犊牛腹泻病料中分离到两株弗劳地枸橼酸盐杆菌的报告[J].中国奶牛,2007(7):33-34.
LEI J,LIAN G N,MOU P,et al.Identification ofCitrobacterfreundiifrom diarrhea calf[J].ChinaDairyCattle,2007(7):33-34.(in Chinese)
[18] 孙 洋,郭学军,周 博,等.东北虎出血性腹泻病原分离与鉴定[J].中国兽医杂志,2008,44(9):89-90.
SUN Y,GUO X J,ZHOU B,et al.Isolation and identification ofCitrobacterfreundiifrom a hemorrhagic diarrhea east-northern tiger[J].ChineseJournalofVeterinaryMedicine,2008,44(9):89-90.(in Chinese)
(编辑 白永平)
Isolation and Identification ofCitrobacterfreundiifrom the Diseased Small Tail Han Sheep
LIU Hui-sheng1,ZHAO Zhan-qin1*,XUE Yun2,XUE Qiao1, WANG Yang1,CHANG Shi-kai1,LIU Yuan1
(1.LabofVeterinaryMicrobiology,CollegeofAnimalScienceandTechnology,HenanUniversityofScienceandTechnology,Luoyang471003,China;2.LabofMedicalEngineering,CollegeofMedicalTechnologyandEngineering,HenanUniversityofScienceandTechnology,Luoyang471003,China)
To determine the pathogenic bacterium infecting the small tail Han Sheep,three strains,named LK-1,LK-2 and LK-3,were isolated from the heart,liver,spleen,lungs,kidney and intestines of three dead cases on a sheep farm in Henan province.Identification by the Biolog Microbial Identification System,and further 16S rRNA sequence and phylogenetic analysis demonstrated that the three isolates wereCitrobacterfreundii.Infection with the bacterial suspension to the healthy small tail Han Sheep could reproduce the diseased symptoms as occurred naturally and the same bacterium could be recovered from these infected sheep.Three isolates also have certain pathogenicity to the BALB/c mice,with the lethal doses of 5.0×107,6.0×107,5.8×107CFU,respectively.The susceptibility test to antibiotics demonstrated that three isolates LK-1,LK-2 and LK-3 were susceptible to 14 drugs,including cefotaxime,gentamicin,tetracycline,chloramphenicol,enrofloxacin,etc.Three isolates have similar antimicrobial resistance profiles to 17 of 21 drugs in this study.But they have different profiles to 4 drugs,including amoxicillin,cefaclor,streptomycin and azithromycin.In this study,we reported the pathogenicity on Small Tail Han sheep ofCitrobacterfreundiiat home and abroadfor the first time.Citrobacterfreundiiis the pathogen of the dead small tail Han Sheep cases.
sheep;Citrobacterfreundii;isolation;antibiotic susceptibility test;regression test
10.11843/j.issn.0366-6964.2015.09.014
2015-01-09
国家自然科学基金项目(31302106);河南省科技攻关计划项目(132300410279)
刘会胜(1990-),男,河南桐柏人,硕士生,主要从事动物病原微生物学研究
*通信作者:赵战勤,博士,副教授,E-mail:zhaozhanqin@126.com,Tel:0379-64282341
S852.612
A
0366-6964(2015)09-1593-07
