狐狸Agouti基因SNPs筛查及其与毛色关联性分析
2015-03-23李英杰刘铮铸巩元芳徐桂利唐家明段玲欣刘谢荣郭秀玲陆奇玉
李英杰,刘铮铸*,巩元芳*,徐桂利,张 磊,唐家明, 段玲欣,刘谢荣,郭秀玲,陆奇玉
(1.河北科技师范学院动物科技学院,秦皇岛 066004;2.河北昌黎县畜牧发展局,昌黎 066600)
狐狸Agouti基因SNPs筛查及其与毛色关联性分析
李英杰1,刘铮铸1*,巩元芳1*,徐桂利1,张 磊1,唐家明1, 段玲欣1,刘谢荣1,郭秀玲2,陆奇玉2
(1.河北科技师范学院动物科技学院,秦皇岛 066004;2.河北昌黎县畜牧发展局,昌黎 066600)
旨在探究狐狸刺豚鼠基因(Agouti)多态性及其与狐狸被毛颜色之间的关系。本研究采用PCR和直接测序的方法对中国5个狐种58只狐狸的Agouti基因部分序列进行了SNPs筛查和单倍型分析。结果表明,在已测序的58只狐狸中首次发现6个SNPs(g.269G>T、g.295C>T、g.325T>G、g.518G>A、g.608C>A和g.846G>A),它们全部存在于内含子2上。狐属的所有个体(25只)在6个位点全部为纯合子基因型,依次为GG、CC、TT、GG、CC和GG型,而北极狐属的所有个体(33只)在这6个位点则均为另一种纯合子基因型,依次为TT、TT、GG、AA、AA和AA型。6个SNPs形成两种单倍型:单倍型Ⅰ(H1:GCTGCG)和单倍型Ⅱ(H2:TTGAAA),分布频率分别为42.1%和57.9%。单倍型Ⅰ(H1)分布于狐属3个狐种的所有受试个体中,单倍型Ⅱ(H2)分布于北极狐属两个狐种的所有受试个体中。进一步分析没有发现6个SNPs及其单倍型与狐狸毛色的明显关联性,但推测它们是区分狐属和北极狐属的重要功能位点和重要单倍型。
狐狸;Agouti基因;SNPs;单倍型;毛色
狐狸在动物分类学上属于哺乳纲、食肉目、犬科动物。世界上人工饲养的狐狸主要有赤狐、银黑狐和北极狐3个种,它们分属两个不同的属:即狐属(Vulpesvulpe)和北极狐属(Alopexlagopus)[1]。狐属中的赤狐为原始种,后突变出银黑狐,赤狐和银黑狐又突变出更多毛色各异的其他色型狐,统称狐属彩狐。北极狐属中的蓝狐为原始种,后突变出白色北极狐和其它色型的北极狐,统称北极狐属彩狐[2]。
Agouti基因是调控动物毛色的重要功能基因之一。该基因通常编码Agouti信号蛋白(ASIP),和促黑色素细胞素(MSH)竞争黑素皮质素受体(MC1R),黑色素细胞刺激素受体功能丢失时,黑素皮质素受体则与Agouti信号蛋白结合,促使伪黑色素的形成,使皮毛表现为黄色或红色。不同物种的Agouti基因及Agouti信号蛋白有较高的同源性,大部分动物的Agouti基因含有4个外显子,其编码的Agouti信号蛋白由131~133个氨基酸组成。近年来,有关人、鼠Agouti基因的研究较多[3-6],另外,国内外众多学者对牛[7]、马[8]、猪[9]、山羊[10-12]和家犬[13]的Agouti基因也做了大量研究,并已证实Agouti基因与毛色相关,但是目前对狐狸Agouti基因的相关研究相对比较薄弱。本研究以两个狐属(狐属、北极狐属)中的5个狐种共计58只狐狸为研究对象,采用PCR和直接测序的方法对这58只不同毛色狐狸Agouti基因的部分序列(包括完整外显子2、完整内含子2和部分外显子3)进行单核苷酸多态性(SNPs)检测,并进一步对其形成的单倍型进行分析,为将来探索狐狸毛色形成的深层次研究奠定理论基础。
1 材料与方法
1.1 材料
本研究所用58只成年狐狸来自河北省秦皇岛市昌黎县金岛“狐、貉、貂育种场”,其中赤狐16只、银黑狐2只、白银狐7只、北极蓝狐19只和北极白狐14只。所用样品为狐狸的皮肤组织,皮肤组织取好后迅速投入液氮中,随后保存于-20 ℃冰箱中,备用。
1.2 基因组DNA提取
基因组DNA的提取采用传统的酚-氯仿抽提法[14],TE溶解,-20 ℃冻存备用。
1.3 引物设计和PCR扩增
根据GenBank 数据库中收录的家犬Agouti基因序列(序列号:NC_006606)设计扩增产物为1 497 bp的1对引物,上游:5′-GCCTGACTGCCTTT-TCTGTT-3′,下游:5′-TCTTCTTTTCCGCCTC-TTTTCT-3′,引物送上海生工生物工程技术服务有限公司合成。PCR 扩增反应体积为50 μL,其中2.5 mmol·L-1dNTPs 4 μL,10×Buffer(含Mg2+)5 μL,浓度为10 mmol·L-1的上、下游引物各1 μL,TaqDNA聚合酶(5 U·μL-1)0.5 μL,DNA模板1.5 μL(75 ng·μL-1),加灭菌三蒸水至50 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸2 min,34 个循环;72 ℃延伸10 min。每次反应设不含模板的空白对照,扩增产物在1.5%琼脂糖凝胶电泳后,在自动成像仪上检测图像。
1.4 PCR产物回收、测序
将扩增产物(浓度约100 ng)回收纯化后,送上海生工生物工程技术服务有限公司进行测序。
1.5 序列分析
将测序所得序列用BioEdit(7.0.1.1)和DNAMAN(5.2.2.0)软件进行比对及相似性分析,并用SHEsis软件[15]对突变位点进行单倍型分析。
2 结 果
2.1 PCR扩增结果
对受试狐狸Agouti基因外显子2 、内含子2和部分外显子3的目标片段经PCR扩增和琼脂糖凝胶电泳检测后,得到与目标片段(1 497 bp)基本吻合的特异性条带(图1)。
2.2 狐狸Agouti基因单核苷酸多态检测
58只狐狸Agouti基因PCR产物送上海生工生物技术服务有限公司测序后,所得序列用BioEdit(Version 7.0.1.1)和DNAMAN(5.2.2.0)软件仔细比对后,外显子2和外显子3区域没有发现任何突变位点,说明狐狸Agouti基因的外显子区域是非常保守的,但在内含子2区域的269、295、325、518、608和846 bp处分别发现1个突变位点(SNPs),即g.269G>T、g.295C>T、g.325T>G、g.518G>A、g.608C>A和g.846G>A(图2)。进一步分析发现狐属中的赤狐、银黑狐和白银狐3个狐种的所有个体(25只)在以上6个位点处全部为纯合子基因型,依次为GG、CC、TT、GG、CC和GG型,而北极狐属中的北极蓝狐和北极白狐两个狐种的所有个体(33只)在这些位点处则均为另一种纯合子基因型,依次为TT、TT、GG、AA、AA和AA型。

1~10.PCR产物;M.DNA marker DL 20001-10.PCR products;M.DNA marker DL 2000图1 狐狸Agouti基因部分序列电泳图Fig.1 Agarose gel electrophoretogram of fox Agouti PCR products(1 497 bp)
2.3 狐狸Agouti基因单倍型分析
利用SHEsis(http://analysis.bio-x.cn/myAnalysis.php)在线软件对狐狸Agouti基因内含子2的6个SNPs进行了单倍型构建,共获得两种单倍型:H1和H2,其分布频率分别为42.1%和57.9%(表1)。如果位点间无连锁,理论上6个突变位点应产生64(26)种单倍型,而在本研究利用软件仅检测到两种单倍型,说明这些位点间可能处于紧密连锁不平衡状态。
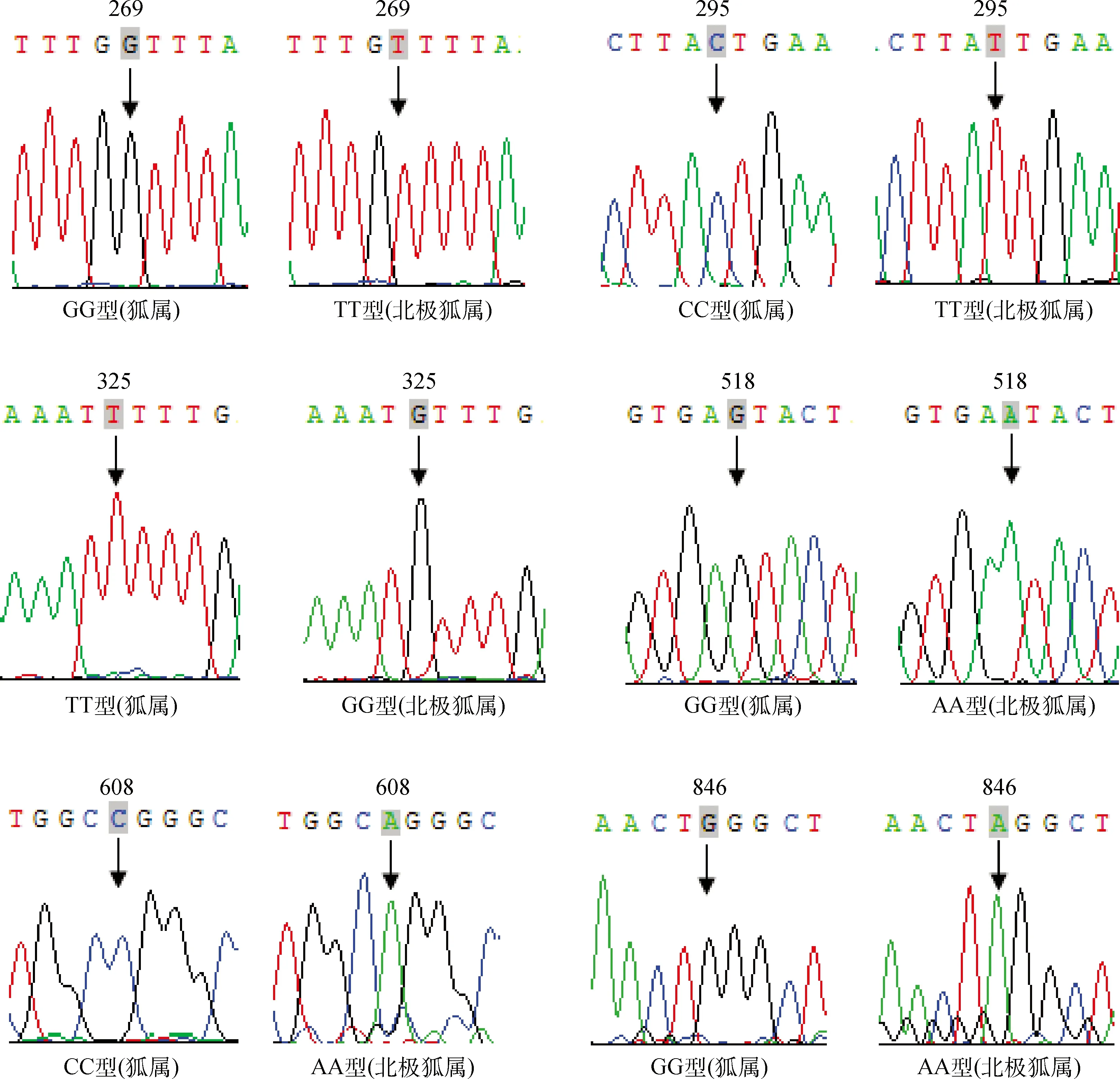
图2 狐狸Agouti基因内含子2的6个突变位点Fig.2 Six mutation sites of the fox Agouti gene intron 2
表1 狐狸Agouti基因内含子2 的单倍型及其频率
Table 1 Haplotype frequencies ofAgoutigene intron 2 covering the 6 polymorphic sites in foxes

单倍型种类Haplotypes单倍型序列Sequences单倍型频率/%FrequenciesH1GCTGCG42.1H2TTGAAA57.9
2.4 各基因型和单倍型在狐狸种间和种内的分布
各单倍型和基因型在受试狐狸种间和种内的分布见表2。表2 表明,狐属中的3个狐种:赤狐、银黑狐和白银狐的所有个体均为纯合子1,且均为单倍型Ⅰ(H1),北极狐属中的北极蓝狐和北极白狐的所有个体均为纯合子2,且均为单倍型Ⅱ(H2)。基因型和单倍型与毛色均没有明显的关联性。
表2 基因型和单倍型在受试狐狸群体间的分布
Table 2 The distribution of genotypes and haplotypes in 5 fox populations

狐狸Fox单倍型Haplotypes基因型GenotypesH1H2纯合子1Homozygous1纯合子2Homozygous2杂合子Heterozygotes狐属Vulpesvulpes赤狐(红色)Redfox1601600银黑狐(黑色,掺杂白色针毛)Silverfox20200白银狐(白色)Whitesilverfox70700北极狐属Alopexlagopus北极蓝狐(浅蓝色)Arcticbluefox0190190北极白狐(白色)Arcticwhitefox0140140
3 讨 论
本研究利用PCR扩增和直接测序的方法对两个狐属5个狐种58只狐狸Agouti基因外显子2、内含子2和部分外显子3序列进行了单核苷酸多态性检测,在外显子2和外显子3区域均没有发现SNPs,而在内含子2区域则发现6个SNPs,这6个SNPs是本研究首次从狐狸Agouti基因上发现的。利用在线软件6个SNPs构建了两种单倍型,发现狐属3个狐种(赤狐、银黑狐和白银狐)25个个体均属于单倍型Ⅰ(H1),均为纯合子基因型,北极狐属2个狐种(北极蓝狐和北极白狐)33个个体均属于单倍型Ⅱ(H2),均为另一种纯合子基因型。推测这6个SNPs和构建的两种单倍型均是区分狐属和北极狐属的主要功能位点和主要单倍型。本研究所用狐属中的赤狐被毛颜色呈火红、红棕或灰红,四肢及耳背呈黑褐;银黑狐基本毛色是黑色,全身被毛均匀,掺杂白色针毛;白银狐全身被毛白色,耳背有黑斑,鼻头呈黑色。北极狐属中的北极蓝狐全身呈浅蓝色,夏季颜色较深,冬季颜色变浅,而北极白狐则全身被毛呈白色。本研究筛查到的6个SNPs和两种单倍型与狐狸的毛色并没有明显的关联性,推测狐狸的毛色可能是由多个基因共同调控的。本研究筛查到的6个SNPs均位于狐狸Agouti基因的内含子2上,而内含子是真核基因的非编码区,可被转录,在mRNA加工过程中被剪切掉,故在进化过程中是丧失功能的基因部分。但内含子的剪接增加了mRNA在核内的稳定性,导致在细胞质中积累更多成熟的mRNA[16]。有研究表明,内含子可能与基因的表达调控有关,内含子对某些基因的特异性表达是必不可少的,如:猪MyHC(Myosin heavy chain)基因内含子中含有一个重要的转录调控元件,可以通过调控转录的起始来增强基因的表达[17]。推测狐狸Agouti基因内含子2可能也存在某些调控元件,但是该基因的内含子序列是否是该基因表达转录所必需的,以及本试验中发现的突变是否会引起Agouti基因表达的变化,还需进一步深入研究证实。
4 结 论
本研究采用PCR和直接测序法首次在狐狸Agouti基因内含子2发现6个SNPs(g.269G>T、g.295C>T、g.325T>G、g.518G>A、g.608C>A和g.846G>A)。狐属中的所有个体在6个位点依次为GG、CC、TT、GG、CC和GG基因型,北极狐属中的所有个体在6个位点则依次为TT、TT、GG、AA、AA和AA基因型。6个SNPs形成Ⅰ(H1:GCTGCG)和Ⅱ(H2:TTGAAA)两种单倍型,其中单倍型Ⅰ(H1)分布于狐属3个狐种的所有受试个体中,单倍型Ⅱ(H2)分布于北极狐属2个狐种的所有受试个体中,但没有发现6个SNPs及其单倍型与毛色的明显关联性,推测它们是区分狐属和北极狐属的重要功能位点和重要单倍型。本研究为将来探索狐狸毛色形成的深层次研究奠定了较好的理论基础。
[1] 王振勇,刘建柱.特种经济动物疾病学[M].北京:中国农业出版社,2009. WANG Z Y,LIU J Z.Disease science of special economic animal[M].Beijing:China Agriculture Press,2009.(in Chinese)
[2] 佟煜仁,张志明.毛皮动物毛色遗传及繁育新技术[M].北京:金盾出版社,2009. TONG Y R,ZHANG Z M.New technology for coat color genetics and breeding of fur animal[M].Beijing:Jindun Press,2009.(in Chinese)
[3] KWON H Y,BULTMAN S I,LOFTIER C,et al.Molecular structure chromosomal mapping of the human Homolog of the agouti gene[J].ProcNatlAcadSciUSA,1994,91(21):9760-9764.
[4] KANETSKY P A,SWOYER J,PANOSSIAN S,et al.A Polymorphism in the agouti signaling protein gene is associated with human pigmentation[J].AmJHumGenet,2002,70(3):770-775.
[5] VOISEY J,VAN DAAL A.Agouti:from mouse to man,from skin to fat[J].PigmentCellRes,2002,15(1):10-18.
[6] MILTENBERGER R J,MYNATT R L,BRACE B D,et al.An agouti mutation lacking the basic domain induces yellow pigmentation but not obesity in transgenic mice[J].ProcNatlAcadSciUSA,1999,96(15):8579-8584.
[7] ROYO L J,ALVAREZ I,FERNNDEZ I,et al.The coding sequence of the ASIP gene is identical in nine wild-type coloured cattle breeds[J].JAnimBreedGenet,2005,122(5):357-360.
[8] RIEDER S,TAOURIT S,MARIAT D,et al.Mutations in the agouti(ASIP),the extension(MC1R),and the brown(TYRP1) loci and their association to coat color phenotypes in horses(Equuscaballus)[J].MammGenome,2001,12(6):450-455.
[9] LEEB T,DOPPE A,KRIEGESMANN B,et al.Genomic structure and nucleotide polymorphisms of the porcine agouti signalling protein gene(ASIP)[J].AnimGenet,2000,31(5):335-336.
[10] 唐春娟,李祥龙,周荣艳,等.山羊Agouti基因第1 内含子T128 缺失在中国主要地方山羊品种中的变异[J].畜牧兽医学报,2009,40(3):320-326. TANG C J, LI X L,ZHOU R Y,et al.Study on genetic diversity of T128 del inAgoutigene intron 1 in Chinese main indigenous goat breeds[J].ActaVeterinariaetZootechnicaSinica,2009,40(3):320-326.(in Chinese)[11] LI X L,ZHAO J W,TANG C J,et al.Sequencing of part of the goat agouti gene and SNP identification[J].BiochemGenet,2010,48(1-2):152-156.
[12] 张 天,张丽英,李祥龙,等.不同毛色山羊皮肤组织Agouti基因mRNA及其编码ASIP差异表达研究[J].畜牧兽医学报,2014,45(12):1932-1938. ZHANG T,ZHANG L Y,LI X L,et al.Study on differential expression ofAgoutigene mRNA and encoding ASIP in goat skin with different coat color[J].ActaVeterinariaetZootechnicaSinica,2014,45(12):1932-1938.(in Chinese)
[13] BERRYERE T G,KERNS J A,BARSH G S,et al.Association of an Agouti allele with fawn or sable coat color in domestic dogs[J].MammalGenome,2005,16(4):262-272.
[14] SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning[M].NewYork:Cold Spring Habor Laboratory Press,1989.
[15] SHI Y Y,HE L.SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].CellRes,2005,15(2):97-98.
[16] 张钦宪,何丽娅,李平法.医学分子生物学[M].郑州:郑州大学出版社,2003. ZHANG Q X,HE L Y,LI P F.Medical molecular biology[M].Zhengzhou:Zhengzhou University Press,2003.(in Chinese)
[17] CHANG K C.Critical regulatory domains in intron 2 of a porcine sarcomericmyosin heavy chain gene[J].JMuscleResCellMotil,2000,21(5):451-461.
(编辑 程金华)
SNPs Detection ofAgoutiGene and Its Associations with Coat Color in Fox
LI Ying-jie1,LIU Zheng-zhu1*,GONG Yuan-fang1*,XU Gui-li1,ZHANG Lei1, TANG Jia-ming1,DUAN Ling-xin1,LIU Xie-rong1,GUO Xiu-ling2,LU Qi-yu2
(1.CollegeofAnimalScienceandTechnology,HebeiNormalUniversityofScience&Technology,Qinhuangdao066004,China;2.AnimalHusbandryDevelopmentBureauofChangliCountyofHebeiProvince,Changli066600,China)
In present study,to investigate the relationship between polymorphism ofAgoutigene and coat color in fox,the whole exon 2,whole intron 2 and partial exon 3 sequence of theAgoutigene were sequenced from 58 fox samples,belonging to 5 species of 2 genera.A total of 6 SNPs(g.269G>T,g.295C>T,g.325T>G,g.518G>A,g.608C>A and g.846G>A) in intron 2 were detected firstly,revealing high genetic diversity.All individuals(n=25) ofVulpesvulpewere homozygous at the 6 sites,and the genotype were in order of GG,CC,TT,GG,CC and GG.All individuals(n=33)Alopexlagopuswere another homozygous at the 6 sites,and the genotype were in order of TT,TT,GG,AA,AA and AA.Total 2 haplotypes(H1:GCTGCG and H2:TTGAAA) were found at the 6 mutation sites and their frequencies were 42.1% and 57.9%,respectively.H1 was widely distributed in all tested individuals ofVulpesvulpes,but H2 was widely distributed in all tested individuals ofAlopexlagopus.Further analysis showed that the detected SNPs and haplotypes were not significant relation to coat color,but speculated that they may be the important functional sites and haplotypes to distinguishVulpesvulpeandAlopexlagopus.
fox;Agoutigene;SNPs;haplotype;coat color
10.11843/j.issn.0366-6964.2015.09.028
2015-01-23
国家自然科学基金(31040048;31272412);河北省高等学校创新团队领军人才培育计划(LJRC004);河北省自然科学基金(C2013407101)
李英杰(1983-),男,河南周口人,硕士生,主要从事动物遗传育种研究,E-mail:15810454825@126.com
*通信作者:巩元芳,教授,E-mail:gongyuanfang_2004@163.com;刘铮铸,教授,E-mail:liuzhengzhu@163.com
S813.3
A
0366-6964(2015)09-1692-05
