猴头菇多糖对呼肠孤病毒感染番鸭肠道黏膜免疫及抗氧化能力的影响
2015-03-22黄丽娜姜慧慧张叶飞吴宝成吴异健黄一帆
黄丽娜,姜慧慧,王 洁,高 婷,张叶飞,吴宝成,吴异健*,黄一帆*
(1.福建农林大学动物科学学院,福州 350002;2.中西兽医结合与动物保健福建省高校重点实验室,福州 350002)
猴头菇多糖对呼肠孤病毒感染番鸭肠道黏膜免疫及抗氧化能力的影响
黄丽娜1,2,姜慧慧1,2,王 洁1,高 婷1,张叶飞1,吴宝成1,2,吴异健1,2*,黄一帆1,2*
(1.福建农林大学动物科学学院,福州 350002;2.中西兽医结合与动物保健福建省高校重点实验室,福州 350002)
旨在研究猴头菇多糖对感染番鸭呼肠孤病毒(MDRV)雏鸭肠道黏膜免疫和抗氧化能力的影响。通过建立模拟MDRV自然感染发病模型,将200只1日龄健康雏番鸭随机分为空白对照组、猴头菇多糖对照组、同居感染对照组和猴头菇多糖预防组。各试验组番鸭在同居感染后第1、3、6、10、15、21天,采集样品测定各指标。结果显示,猴头菇多糖能够不同程度促进感染呼肠孤病毒雏番鸭肠道SIgA、IFN-γ、IL-4的分泌,具有维持肠道黏膜免疫平衡的作用;且显著(P<0.05)提高SOD活性和GSH含量,降低了MDA含量,具有提高机体抗氧化酶活性、清除体内自由基、抑制脂质过氧化的作用。结果表明,猴头菇多糖对雏番鸭肠道黏膜免疫具有较显著的调节作用,且能提高机体抗氧化能力,有效减轻呼肠孤病毒对其肠道屏障功能的损伤。
番鸭呼肠孤病毒;猴头菇多糖;黏膜免疫;抗氧化能力
自1997年以来,呼肠孤病毒(muscovy duck reovirus,MDRV)在广东、福建、浙江、广西等地的番鸭饲养区流行。患病雏鸭表现为精神委顿,食欲减少以至废绝,羽毛蓬松,无光泽,缩颈,挤堆,软脚,多蹲伏,常出现腹泻,排白色或绿色带有黏液的稀粪,耐过鸭生长发育受阻。本课题组研究发现[1],MDRV可导致雏番鸭的肠道出现不同程度的炎症和损伤,肠黏膜充血、出血或有大小不等的坏死小点,部分病鸭小肠淋巴环带明显肿胀等。猴头菇多糖(Hericiumerinaceuspolysaccharide,HEP)是从猴头菇子实体、菌丝体及菌丝发酵液中分离得到的真菌多糖,是猴头菇中最主要活性物质之一。有研究发现[2],HEP是一个良好的免疫功能增强剂和一种良好的抗氧化物质。本课题组的预试验及前期研究[3-4]显示,人工攻毒感染MDRV的番鸭死亡率为90%,在HEP的干预下,其死亡率降为50%;同居感染MDRV的番鸭死亡率为53.3%,而HEP预防组的死亡率为12%,且HEP预防组出现相应临床症状的时间比病毒对照组迟,说明HEP对MDRV具有较好的防治作用。因此本试验拟通过比较分析HEP对MDRV感染雏番鸭肠道SIgA、IFN-γ、IL-4、MDA、SOD、GSH等指标的影响,进一步探讨MDRV对雏番鸭肠道黏膜免疫及自由基的产生和清除的影响,及添加猴头菇多糖对其免疫功能和抗氧化功能的改善作用。
1 材料与方法
1.1 病毒株及实验动物
番鸭呼肠孤病毒为福建农林大学动物科学院预防兽医学实验室保存的YB分离株。试验用1日龄健康雏番鸭来源于福建莆田无呼肠孤病毒感染某番鸭场。
1.2 试验中药
猴头菇多糖(含量40%)购自于上海康舟真菌多糖有限公司。
1.3 试验分组
将200只1日龄健康雏番鸭随机分为空白对照组(BCG)、猴头菇多糖对照组(HCG)、同居感染对照组(CICG)、猴头菇多糖预防组(HPG),每组50只。BCG、HCG与CICG、HPG独立分开饲养管理。另取40只2日龄健康雏番鸭每只腿部肌肉注射10倍稀释的YB株病毒液0.4 mL,并剪尾羽做好标记,独立分开饲养管理。攻毒3 d后,分别取20只加入到CICG和HPG进行同居感染,此时记为同居感染第0天。HCG和HPG从1日龄起通过饮水口服猴头菇多糖,添加量为0.2 g·L-1(此添加量为本课题组前面研究获得[3]),直至整个试验期结束。所有试验番鸭饲喂雏鸭全价饲料,自由饮水采食。
1.4 试验番鸭的样本采集及处理
同居感染后第1天,随机从BCG、HCG、CICG及HPG中分别取6只番鸭心脏采血处死,取两段适量十二指肠于预冷的灭菌PBS缓冲液洗净,用滤纸吸干。取其中一段称重,置于2 mL样品管中,加预冷生理盐水1 mL,然后在100 ℃水浴中煮沸10 min,匀浆;4 ℃ 3 000 r·min-1离心15 min,取上清,-20 ℃保存,用于测定IL-4、IFN-γ的含量。另一段纵向剖开,用载玻片轻刮小肠黏膜,置于1.5 mL 灭菌Eppdeffer管中,称重,加预冷生理盐水1 mL,同上操作,用于测定SIgA、GSH、MDA的含量及SOD活性。此后,各试验组番鸭在同居感染后第3、6、10、15、21天分别随机取6只番鸭同上处理取样。
1.5 免疫指标和抗氧化指标的检测
分泌型免疫球蛋白A(SIgA)、IL-4、IFN-γ含量的测定,利用放射性免疫(RIA)的方法;超氧化物歧化酶(SOD)活性、还原型谷胱甘肽(GSH)含量和丙二醛(MDA)含量的检测,利用比色法;以上操作均按照北京华英生物技术研究所试剂盒说明书的操作要求进行。
1.6 数据处理
不同同居感染时间各试验组番鸭肠道组织及黏膜各指标数据均用“平均数±标准差”表示,试验数据用SPSS 17.0进行单因素方差分析,用LSD多重比较法对数据进行显著性检验,显著性水平设为P<0.05。
2 结 果
2.1 猴头菇多糖对MDRV感染雏番鸭肠道免疫指标的影响
由表1可知,雏番鸭感染呼肠孤病毒后,与BCG(空白对照组)相比较,其肠道分泌SIgA的水平分别降低了33.73%、43.56%、48.78%、58.12%、52.78%、48.79%,差异显著(P<0.05)或极显著(P<0.01)。HCG(猴头菇多糖对照组)、HPG(猴头菇多糖预防组)与BCG相比,其肠道分泌SIgA的水平差异均不显著(P>0.05)。HPG与HCG相比较,同居感染后第10天时,其肠道分泌SIgA的水平差异显著(P<0.05)外,其余各时间点均差异不显著(P>0.05)。HPG与CICG(同居感染对照组)相比,其肠道分泌SIgA的水平分别提高了59.73%、101.39%、112.09%、126.71%、96.89%、87.94%,差异均显著(P<0.05)或极显著(P<0.01)。 HCG与CICG相比,其肠道分泌SIgA的水平差异均极显著(P<0.01)。
由表2可知, CICG番鸭肠道IFN-γ分泌量,在同居感染后第3、6、15天时,显著(P<0.05)或极显著(P<0.01)低于BCG。BCG、HPG与HCG相比,整个试验期内其肠道IFN-γ分泌量均差异不显著(P>0.05)。HPG与BCG相比,仅在同居感染后第3天时, IFN-γ分泌量显著(P<0.05)较其低。HCG与CICG相比,在同居感染后第3、6、15天时,IFN-γ分泌量显著(P<0.05)或极显著(P<0.01)较其高。HPG与CICG相比较,在同居感染后第3、6、21天时,IFN-γ分泌量差异显著(P<0.05)或极显著(P<0.01)。
表1 试验番鸭肠黏膜SIgA含量的变化

Table 1 Changes of the intestinal mucosal SIgA content in experimental ducklings ng·mg-1
同行数据肩标不同小写字母者表示差异显著(0.01
The data in the same column,different superscript lowercase letters show significant difference(0.01
表2 试验番鸭肠道组织IFN-γ含量的变化

Table 2 Changes of the intestinal tissue IFN-γ content in experimental ducklings pg·mg-1
由表3可知,在试验期内,同居感染后第1、3、6天时,CICG番鸭肠道IL-4分泌水平均比其余3组低,但均差异不显著(P>0.05)。同居感染后第10天时,CICG番鸭肠道IL-4分泌水平显著(P<0.05)或极显著(P<0.01)低于其余3组。同居感染后第15天时,CICG肠道IL-4分泌水平极显著(P<0.01)低于HCG,且HCG均高于BCG和HPG ,差异显著(P<0.05)。同居感染后第21天时,除HPG显著(P<0.05)高于CICG外,其余各组均差异不显著(P>0.05)。
表3 试验番鸭肠黏膜IL-4含量的变
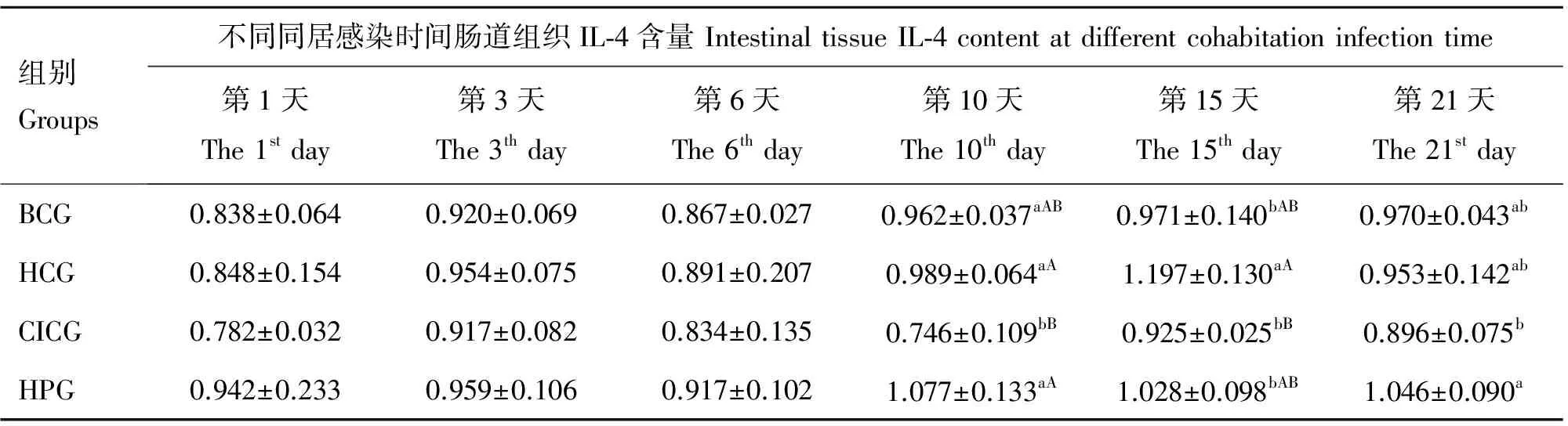
Table 3 Changes of the intestinal tissue IL-4 content in experimental ducklings pg·mg-1
2.2 猴头菇多糖对MDRV感染雏番鸭肠黏膜抗氧化指标的影响
由表4可知,整个试验期内,CICG番鸭肠黏膜MDA含量均较其他3组高,与BCG相比,在同居感染后第3、10、21天时,出现显著(P<0.05)差异;与HCG相比,在同居感染后第1、10天时,差异不显著(P>0.05)外,其余各时间点均差异显著(P<0.05)或极显著(P<0.01);与HPG相比,在同居感染后第10天时,开始出现显著性(P<0.05)差异。BCG与HCG相比,仅在同居感染后第15天时,出现显著(P<0.05)变化。HPG与BCG、HCG相比,在同居感染后各个时间点差异均不显著(P>0.05)。
表4 试验番鸭肠黏膜MDA含量的变化

Table 4 Changes of the intestinal mucosal MDA content in experimental ducklings nmol·mg-1
由表5可知,雏番鸭在同居感染MDRV后,其肠黏膜SOD活性呈现波动式变化,但均比对照组低,仅在同居感染后第10天时,出现显著(P<0.05)低于BCG。与HCG相比,CICG肠黏膜SOD活性,除同居感染后1、6天时,与其差异不显著(P>0.05)外,其余各时间点均显著(P<0.05)或极显著(P<0.01)较其低。与HPG相比,CICG组肠黏膜SOD活性,在同居感染后第1、3、10天时,显著(P<0.05)或极显著(P<0.01)低于前者,其余各时间点虽也较其低,但差异不显著(P>0.05)。BCG与HCG相比,除同居感染后第10 天时,显著(P<0.05)低于HCG外,其余各时间点均差异不显著(P>0.05)。HPG番鸭肠黏膜SOD活性,在同居感染后各个时间点与HCG、BCG差异均不显著(P>0.05)。
表5 试验番鸭肠黏膜SOD活性的变化

Table 5 Changes of the intestinal mucosal SOD activity in experimental ducklings U·g-1
由表6可知,雏番鸭感染MDRV后,肠黏膜GSH含量先降低后急骤升高又降低波动变化,感染后期则缓慢升高,但均低于对照组,在同居感染后第1、10天时,显著(P<0.05)或极显著(P<0.01)低于BCG及HPG组。与HCG组相比,CICG组肠黏膜GSH含量变化除在同居感染后第3、6天时与其差异不显著(P>0.05)外,其余各时间点均显著(P<0.05)或极显著(P<0.01)较其低。而BCG、HCG及HPG,分别在同居感染后各个时间点均差异不显著(P>0.05)。
表6 试验番鸭肠黏膜GSH含量的变化
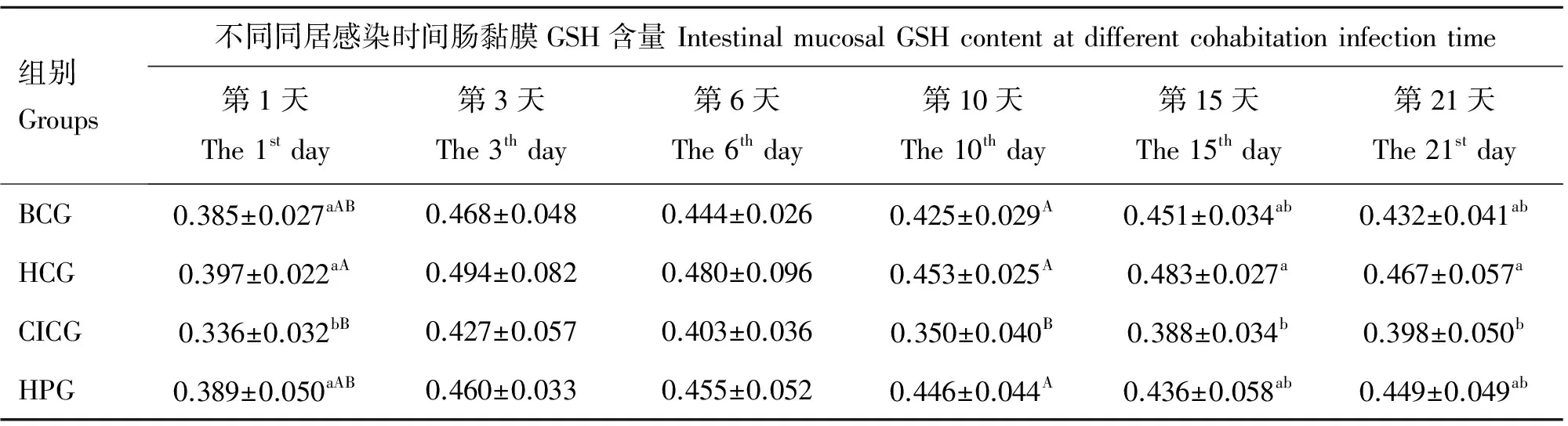
Table 6 Changes of the intestinal mucosal GSH content in experimental ducklings μmol·g-1
3 讨 论
肠道作为重要的营养吸收部位,又作为一个初级免疫器官,包含了机体70%~80%的淋巴组织[5]。有研究结果表明[6~9],MDRV可导致番鸭免疫功能下降,且对其黏膜免疫有损害作用,能使其呼吸道和消化道黏膜局部的细胞免疫功能降低,人工感染番鸭呼肠孤病毒后24 h,能从肠道、肝、大脑中最先检测到病毒抗原,说明番鸭呼肠孤病毒能导致番鸭严重的黏膜免疫功能损伤。
黏膜免疫功能中起中心作用的是SIgA,SIgA是黏膜免疫应答过程中的主要效应因子。SIgA被认为是参与抵御病原微生物黏附并侵入到黏膜的第一道屏障[10]。本试验结果显示,感染番鸭呼肠孤病毒后,其肠黏膜SIgA分泌水平明显降低,说明MDRV会导致番鸭肠黏膜免疫功能降低,而添加一定量的猴头菇多糖能够显著提高肠道SIgA分泌水平,增强其肠道黏膜免疫功能,显著减少MDRV对雏番鸭机体的损伤。
IFN-γ是Th1细胞的典型代表,可干扰病毒复制,能特异性杀伤病毒感染细胞,在细胞免疫过程中起重要调节作用[11]。IL-4是Th2细胞典型代表,其可促进肥大细胞、T淋巴细胞和B淋巴细胞的增殖和分化,对SIgA的形成过程也具有重要作用[12]。本试验结果显示,雏番鸭同居感染MDRV的早期,其肠道组织IFN-γ的分泌量便开始出现显著下降,同居感染后第6天时,达到最低值,此后开始逐渐升高,但仍低于对照组;且其肠道组织IL-4分泌水平低于对照组,在同居感染后第10天时,达到最低值,呈现波动性变化。可见,MDRV可导致雏番鸭机体的细胞免疫和体液免疫的平衡被破坏,也阻碍了SIgA的形成和分泌,造成机体的免疫抑制,与王全溪等[13]的研究结论相一致。而猴头菇多糖可以明显提高感染MDRV雏番鸭肠道组织IFN-γ的分泌水平,并使其IL-4的分泌水平保持动态平衡,说明HEP对IFN-γ、IL-4均有显著的调节作用,能提高机体抗病毒能力,减少继发感染及多重感染发生的机会,减轻MDRV对雏番鸭肠道黏膜免疫功能的损伤,具有显著的治疗作用。
氧自由基的化学性质是很活跃的,能够攻击细胞膜上的脂肪酸产生过氧化物;过多的活性氧自由基会导致机体正常细胞和组织的损坏。MDA可引起黏膜损伤和激活补体系统,使巨噬细胞释放大量炎症介质[14],能反映机体脂质过氧化的程度,间接地反映出细胞损伤的程度。SOD是生物体内重要的抗氧化酶,可清除超氧阴离子自由基,发挥抗炎作用,反映机体清除氧自由基能力。GSH作为一个有效的自由基清除剂与SOD有协同作用,在抗氧化防御中起重要作用。本试验结果显示,雏番鸭感染MDRV后,其肠黏膜的MDA含量显著升高,SOD活性及GSH含量显著降低。有研究显示,脂质过氧化水平越高,淋巴细胞DNA损伤率越高,进而抑制机体免疫功能[15],提示MDRV可能使肠道受到过量氧自由基的攻击,引起肠道损伤及肠黏膜通透性升高,导致肠道功能异常及继发或混合感染,引起免疫抑制,但其作用机制需作进一步研究。添加HEP可显著降低雏番鸭肠黏膜MDA含量,提高其SOD活性和GSH含量,说明HEP能够显著提高肠道抗氧化能力,减弱脂质过氧化作用,有效减轻MDRV对雏番鸭肠道黏膜的损伤。Z.H.Han等[16]研究结果反映了HEP可以显著减少实验动物的脂质过氧化水平和增加抗氧化物酶活性,本试验验证了这一结论。
4 结 论
猴头菇多糖能较显著(P<0.05)地调节雏番鸭肠道黏膜免疫,提高抗氧化能力,降低脂质过氧化水平,对感染MDRV雏番鸭肠道免疫功能及抗氧化功能具有较好的保护作用。但猴头菇多糖对MDRV感染番鸭肠道黏膜免疫及抗氧化能力的具体调节途径及机制有待深入研究。
[1] 吴宝成,姚金水,陈家祥,等.呼肠孤病毒B3分离株感染番鸭的病理组织学研究[J].福建农业大学学报,2001,30(4):514- 517. WU B C,YAO J S,CHEN J X,et al.Pathology of infection with reovirus isolate B3in Muscovy ducks[J].JournalofFujianAgriculturalUniversity,2001,30(4):514-517.(in Chinese)
[2] SU X Y,WANG Z Y,LIU J R.Invitroandinvivoantioxidant activity of Pinus koraiensis seed extract containing phenolic compounds[J].FoodChem,2009,117(4):681-686.
[3] 陈艺娟,吴异健,黄一帆,等.猴头菇多糖对呼肠孤病毒感染番鸭组织病变及细胞凋亡的影响[J].中国预防兽医学报,2010,32(1):14-18. CHEN Y J,WU Y J,HUANG Y F,et al.Effects ofHericiumerinaceuspolysaccharide on reovirus-induced tissue necrosis and apoptosis in Muscovy ducks[J].ChineseJournalofPreventiveVeterinaryMedicine,2010,32(1):14-18.(in Chinese)
[4] 吴异健.两种中药多糖对呼肠孤病毒感染番鸭的免疫调节作用[D].福州:福建农林大学,2010. WU Y J.Immunoregulating effects of two Chinese herbal polysaceharides on muscovy duck infecting of MDRV[D].Fuzhou:Fujian Agriculture and Forestry University,2010.(in Chinese)
[5] JONKER M A,HERMSEN J L,SANO Y,et al.Small intestine mucosal immune system response to injury and the impact of parenteral nutrition[J].Surgery,2012,151(2):278-286.
[6] HEFFELS-REDMANN U,MULLER H,KALETA E F.Structural and biological characteristics of reoviruses isolated from Muscovy ducks(Cairina moschata)[J].AvianPathol,1992,21(3):481-491.
[7] KUNTZ-SIMON G,BLANCHARD P,CHERBONNEL M,et al.Baculovirus-expressed muscovy duck reovirus σC protein induces serum neutralizing antibodies and protection against challenge[J].Vaccine,2002,20(25-26):3113-3122.
[8] 包汉勋,祁保民,尚迎辉.免疫组化法检测番鸭呼肠孤病毒在番鸭体内的分布[J].中国畜牧兽医,2009,36(4):43-46. BAO H X,QI B M,SHANG Y H.Distribution of muscovy duck reovirus in muscovy ducks detected by immunohistochemical method[J].ChinaAnimalHusbandry&VeterinaryMedicine,2009,36(4):43-46.(in Chinese)
[9] 卢玉葵,马春全,孔小明,等.番鸭感染呼肠孤病毒后免疫器官组织TANAE+细胞数量的变化[J].黑龙江畜牧兽医,2007(3):66-67. LU Y K,MA C Q,KONG X M,et al.Changes in the number of TANAE+cells in immune organs after Muscovy duck reovirus infection[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2007(3):66-67.(in Chinese)
[10] KINNEBREW M A,PAMER E G.Innate immune signaling in defense against intestinal microbes[J].ImmunolRev,2012,245(1):113-131.
[11] VAN REETH K,VAN GUCHT S,PENSAERT M.Correlations between lung proinflammatory cytokine levels,virus replication,and disease after swine influenza virus challenge of vaccination-immune pigs[J].ViralImmunol,2002,15(4):583-594.
[12] SAWAI T,GOLDSTONE N,DRONGOWSKI R A,et al.Effect of secretory immunoglobulin A on bacterial translocation in an enterocyte-lymphocyte co-culture model[J].PediatrSurgInt,2001,17(4):275-279.
[13] 王全溪,吴宝成,李国平.番鸭呼肠孤病毒诱导免疫抑制机制的初步研究[J].中国兽医科学,2009,39(9):769-773. WANG Q X,WU B C,LI G P.Mechanism of immunosuppression induced by Muscovy duck reovirus[J].ChineseVeterinaryScience,2009,39(9):769-773.(in Chinese)
[14] 王艳萍,祁克宗,涂 健,等.内毒素对仔鸡血浆SOD活性及MDA水平的影响[J].动物医学进展,2006,27(5):63-65. WANG Y P,QI K Z,TU J,et al.Effects of SOD activities and MDA level about lipopolysaccharide in the plasma of chickens[J].ProgressinVeterinaryMedicine,2006,27(5):63-65.(in Chinese)
[15] 刘继文,袁 芳,连玉龙,等.慢性应激对大鼠免疫功能损伤机制的实验研究[J].环境与职业医学,2007,24(6):599-602. LIU J W,YUAN F,LIAN Y L,et al.Experimental study on the mechanism of chronie stress on immune function damage of rat[J].JournalofEnvironmental&OccupationalMedicine,2007,24(6):599-602.(in Chinese)
[16] HAN Z H,YE J M,WANG G F.Evaluation ofinvivoantioxidant activity ofHericiumerinaceuspolysaccharides[J].IntJBiolMacromol,2013,52:66-71.
(编辑 白永平)
Effects ofHericiumerinaceusPolysaccharide on Intestinal Mucosal Immune and Antioxidant Capacity of Muscovy Ducks Infected with Reovirus
HUANG Li-na1,2,JIANG Hui-hui1,2,WANG Jie1,GAO Ting1,ZHANG Ye-fei1, WU Bao-cheng1,2,WU Yi-jian1,2*,HUANG Yi-fan1,2*
(1.CollegeofAnimalScience,FujianAgricultureandForestryUniversity,Fuzhou350002,China; 2.UniversityKeyLabforIntegratedChineseTraditionalandWesternVeterinaryMedicineandAnimalHealthcareinFujianProvince,Fuzhou350002,China)
The aim of this study was to reveal the effect ofHericiumerinaceuspolysaccharide(HEP) on the intestinal mucosal immune and antioxidant capacity of ducklings which were infected with muscovy duck reovirus(MDRV).Through the establishment of simulation model which was similar with MDRV natural infection,200 of 1-day-old healthy ducklings were randomly divided into blank control group,HEP control group,cohabitation infected control group and HEP prevention group.The samples from ducklings in each experimental group were collected and determined in the first day,the third day,the sixth day,the tenth day,the fifteenth day and the twenty-first day after cohabitation infection.The results showed that,HEP could promote the secretion of SIgA,IFN-γ and IL-4 on intestinal of infected MDRV ducklings in different degree,also with the maintenance of intestinal mucosal immune balanced effect,and increased SOD activity and GSH content,decreased the content of MDA significantly,it turned out to have the function of improving antioxidase activity,removing free radicals and inhibiting lipid peroxidation.These results indicated that HEP had certain effect on regulating intestinal mucosal immunity of the ducklings and also improving the ability of anti-oxidation,reducing the intestinal barrier function which was damaged by MDRV effectively.
muscovy duck reovirus;Hericiumerinaceuspolysaccharide;mucosal immunity;antioxidation
10.11843/j.issn.0366-6964.2015.09.025
2014-12-24
国家自然科学基金项目(31372474);福建省自然科学基金项目(2012J01067)
黄丽娜(1990-),女,福建南安人,硕士生,主要从事中兽药药理学研究,E-mail:hln0990@163.com
*通信作者:吴异健,副教授,E-mail:nldwyj@163.com;黄一帆,教授,E-mail:zjhyfang@163.com
S859.7
A
0366-6964(2015)09-1671-07
