金川多肋牦牛Hoxa6和Hoxa10基因甲基化与mRNA差异表达研究
2015-03-22熊显荣兰道亮字向东李善蓉杨建梅
熊显荣,张 雁,兰道亮,李 键*,字向东,李善蓉,杨建梅
(1.西南民族大学生命科学与技术学院,成都 610041;2.西南民族大学青藏高原研究院,成都 610041; 3.金川县兽医畜牧局,金川 624100)
金川多肋牦牛Hoxa6和Hoxa10基因甲基化与mRNA差异表达研究
熊显荣1#,张 雁1#,兰道亮2,李 键2*,字向东1,李善蓉3,杨建梅3
(1.西南民族大学生命科学与技术学院,成都 610041;2.西南民族大学青藏高原研究院,成都 610041; 3.金川县兽医畜牧局,金川 624100)
本研究旨在通过检测金川多肋牦牛与普通牦牛中Hoxa6和Hoxa10基因的转录水平和启动子区甲基化状态,为揭示Hox基因在金川多肋牦牛多1对肋骨性状形成中的转录调控机制奠定基础。通过实时荧光定量PCR技术检测Hoxa6和Hoxa10基因在多肋牦牛和普通牦牛中的mRNA表达水平,同时采用重亚硫酸盐测序PCR(Bisulfite-sequencing PCR,BSP)法对Hoxa6和Hoxa10启动子区进行甲基化修饰与克隆测序,分析甲基化状态。结果显示,多肋牦牛中Hoxa6基因表达量显著高于普通牦牛(P<0.05),而Hoxa10基因表达量显著低于普通牦牛(P<0.05)。Hoxa6启动子区域的CpG2,在普通牦牛中的DNA甲基化显著高于多肋牦牛(P<0.05),尤其是第3、4、8、20和21位CpG位点;Hoxa10启动子区域的CpG1在普通牦牛中的DNA甲基化状态显著低于多肋牦牛(P<0.05),普通牦牛的第9和12位CpG位点几乎未甲基化。多肋牦牛中Hoxa10高甲基化在一定程度上抑制了Hoxa10基因的表达,Hoxa6低甲基化水平促进了Hoxa6基因的表达。启动子区域的甲基化在一定程度上影响Hox基因的转录调控,且与多肋性状的形成可能存在一定的联系。
牦牛;Hox基因;甲基化;表达
牦牛(Bosgrunniens)是主要分布于中国青藏高原及其毗邻地区的一个特有且珍贵的畜种,其对高寒草地生态环境具有良好的适应能力,能在低氧、严寒、强紫外线辐射的高原恶劣环境条件下生存和繁衍后代,并为当地牧民提供乳、肉等畜产品、作为运输工具等生产和生活必需品,是当地牧民的主要经济来源[1]。此外,在遗传上也是一个极为宝贵的基因库。目前,依据牦牛的起源地、外貌、形态结构、生产性能、线粒体DNA以及所处地理环境特点,已认定了大通牦牛、天祝牦牛、九龙牦牛、麦洼牦牛等多个地方品种[2]。金川多肋牦牛主要分布于四川省阿坝藏族羌族自治州金川县,拥有15对肋骨,比普通牦牛多1对肋骨,而且具有产肉、产奶量高,性成熟早、繁殖性能高、遗传稳定、抗逆性强等优良生产性能和生物学特性[3]。因此,开展金川多肋牦牛遗传资源的保护与开发具有重要的经济和科学价值,研究其生长发育及其调控机理对充分发挥优良特性和促进牧区发展具有重要意义。
肋骨数与生产性、抗逆性等密切相关,在多椎骨蒙古羊的研究中也有报道[4]。研究表明,蒙古羊的多椎骨形成与Hox簇(Homeobox)基因有关。Hox簇基因最早在果蝇中发现[5],是一类专门调控生物体形发育的基因,进化上相对保守,决定着动物的体节与椎骨的位置、形态和数量[6]。大多数脊椎动物的Hox基因有4个连锁群,即Hoxa、Hoxb、Hoxc、Hoxd,分别位于第7、17、2、12 号染色体上,各自有 13个基因位点[7]。M.Kmita等研究表明,Hoxa和Hoxd 在调节躯体形成中起重要作用,而Hoxb和Hoxc只起细微调节作用[8]。哺乳类动物的细胞分化高度复杂,因此需要4个Hox基因簇以不同形式产生足够种类的Hox基因组合,但是Hox基因的功能在多大程度上依赖于这种组合仍不确定[9-10]。Hox基因的突变会导致动物脊椎的数量或在不同位置椎骨形态发生变异。小鼠的Hox8突变可导致胸椎增加一枚,并且肋骨多长1对[11-12];赵静等研究乌珠穆沁旗蒙古羊时发现,多胸椎蒙古羊的Hoxc8基因表达异常[4]。以上研究结果表明,Hox家簇基因与哺乳动物的体轴骨架以及附属骨的形成息息相关。此外,以小鼠为模式动物,将Hoxa10基因敲除后发现,腰椎骨消失且肋骨一直延伸到尾椎骨。同时,Hoxa10发生变异后,小鼠的肋骨数也由13对增加到14对,且骶骨的形成过程也发生改变[13]。D.Kostic等研究显示,杂合的Hoxa6小鼠的椎骨形成异常[14]。然而,有关金川多肋牦牛的形成机制和分子机理至今仍未弄清楚。
DNA甲基化是DNA在复制后由DNA甲基转移酶(DNA methyl-transferase,Dnmt)催化,将S-腺苷甲硫氨酸的甲基转移到胞嘧啶第5位C上而形成5-甲基胞嘧啶(5-mC)。在基因组DNA序列没有发生改变的情况下,基因表达发生改变且可以遗传,导致可遗传的表型变化[15]。DNA甲基化与生物体内重要基因的表达调节有紧密联系,目前研究结果表明,DNA甲基化一般与基因的表达呈负相关,启动子区的高甲基化与基因的表达呈负相关,结构基因内部的甲基化与基因表达也存在着一定的负相关,而启动子区低甲基化与转录活性正相关[16]。
因此,本研究以金川多肋牦牛为研究对象,采用实时荧光定量PCR(qRT-PCR)技术检测Hoxa6和Hoxa10基因在金川多肋牦牛(15对)及普通牦牛(14对)中的表达差异;利用重亚硫酸氢盐测序法(Bisulfite-sequencing PCR,BSP)检测金川多肋牦牛中Hoxa6和Hoxa10基因的甲基化状态,从表观遗传学角度分析Hoxa6和Hoxa10基因与金川多肋牦牛的联系。旨在为进一步揭示Hox基因对金川多肋牦牛生长发育、胚胎骨骼发育等的作用,以及建立有效可靠的分子标记等提供理论依据。
1 材料与方法
1.1 主要试剂与仪器
DNA提取试剂盒购自Omega公司;胶回收及质粒提取试剂盒购自Axygen公司;Trizol 购自Invitrogen公司;基因组DNA修饰试剂盒购自Gepigentek公司;荧光实时定量PCR仪、电泳仪、琼脂糖凝胶成像系统均购自美国Bio-Rad公司;引物由上海英骏公司合成。
1.2 试验动物
牦牛组织样品均采集于四川省阿坝州金川县,试验动物为健康的空怀期成年母牦牛(3岁左右),屠宰后立即采集普通牦牛和多肋牦牛(各5头)的血液和组织。采集的血液样本置于RNA保护液中保存,组织样品立即置于液氮中保存,用于提取基因组DNA和总RNA。
1.3 基因组DNA的提取
参照说明书,用Tissue DNA Kit(Omega)提取多肋牦牛和普通牦牛基因组DNA,-80 ℃保存备用。
1.4 总RNA的提取及反转录
利用Trizol试剂盒提取血液、肾和肺组织样本的总RNA。并用RNase-free的DNase I处理,以去除DNA污染。RNA的质量和含量通过Nanodrop ND-1000检测吸光度A260 nm/A280 nm进行测定,完整性通过1.5%(w/v) 凝胶电泳进行检测。取2 μL(1 μg·μL-1)RNA,0.5 μL M-MLV反转录酶,0.5 μL oligo(dT)18,2 μL Buffer,及DEPC水至10 μL,反转录成cDNA。
1.5 qRT-PCR 定量分析Hoxa6和Hoxa10表达
本试验以Hoxa6和Hoxa10为研究对象,以管家基因GAPDH为内参分析目的基因的相对表达水平。根据本课题组前期获得的RNA序列,用Primer 5.0进行引物设计,引物均需跨内含子设计,具体引物序列见表1。采用SYBR Green Ⅱ荧光定量PCR法分析多肋牦牛与普通牦牛Hoxa6和Hoxa10基因的mRNA相对表达丰度。所有反应均重复3次,20 μL反应体系:10 μL 2×SYBR Green premix,上、下游引物各0.8 μL(10 pmol·mL-1),模板2 μL 以及DEPC水6.4 μL。反应条件:95 ℃ 30 s;95 ℃ 10 s,最佳Tm 10 s,72 ℃ 10 s,共40个循环。65~95 ℃每隔 0.5 ℃读板一次,绘制熔解曲线。分析各基因的熔解曲线并电泳鉴定PCR产物。结果采用2-△△Ct法对目的基因mRNA表达水平进行相对定量分析。
1.6Hoxa6和Hoxa10基因5′端序列的克隆
根据NCBI数据库中已公布牛的Hoxa6(NW_005394721.1)和Hoxa10(NW_005394721.1)基因DNA序列,对目的基因转录起始位点(Transcription start sites,TSS)上游2 000 bp设计两对引物Hoxa6-p和Hoxa10-p,进行PCR扩增。将PCR产物连接到pMD19-T Vector(TaKaRa)载体上,并转化到感受态细胞DH5α。挑取单克隆进行菌液PCR鉴定,阳性克隆送华大基因公司测序。
1.7 CpG岛的预测与引物设计
对目的基因Hoxa6和Hoxa10转录起始位点(TSS,+1)前后的序列(-2 000~+2 000 bp)进行甲基化CpG岛的预测,预测结果见图1。在Hoxa6启动子区域选择一段长205 bp的CpG2作为研究对象,该区域有21个CpG位点;在Hoxa10启动子区域选择一段长177 bp的CpG1作为研究对象,该区域有15个CpG位点;上面一排为目的基因原序列,下面一排为重亚硫酸氢盐处理后的序列,可见下面一排序列中除CpG位点外的C都转化为了T,方框区域为引物,具体见图1。
1.8 DNA 的重亚硫酸盐处理
采用甲基化试剂盒对DNA进行修饰,详细步骤参见试剂盒说明书,获得修饰后的DNA。取修饰后DNA作为模板进行BSP扩增反应,PCR反应体系为50 μL:Zymo TaqTMPremix 25 μL,上、下游引物各1 μL(10 μmol·L-1),模板4 μL,ddH2O 19 μL。反应程序:94 ℃ 3 min;94 ℃ 30 s,最佳Tm 40 s,72 ℃ 30 s,35个循环;72 ℃ 7 min;4 ℃ 30 min。将PCR产物连接到pMD19-T Vector载体,并转化到DH5α感受态细胞。从平板上随机挑取单克隆进行菌液PCR鉴定,每个转化板至少挑10个阳性克隆送华大基因公司测序。测序结果通过Bioanalyzer软件进行处理与分析。
表1 引物序列及 PCR反应条件
Table 1 Primer sequences and PCR reaction conditions

名称Name引物序列(5′⁃3′)Primersequence位置/bpPosition产物长度/bpProductsize退火温度/℃AnnealingtemperatureHoxa6⁃pF:CTGTCATCTGATGGCGTTGTR:CTGCAGGACTGTGATTTGTTGT-2069~-2050-14~-35205657Hoxa10⁃pF:TATGGGCTGCAGAGCTGCR:CAGTTGGCTGCGTTTTCG-1980~-196310~-8199057Hoxa6⁃qF:GGCAGTGGCAAACAGAGGR:CAGGTAGCGGTTGAAGTGG293~310559~54126758Hoxa10⁃qF:GCCTTTGTTCGCTTCTGATTR:GCGTCTGGTGCTTGGTGTA19~218492~47429457Gapdh⁃qF:TGGTGCTGAGTATGTGGTGGR:TCTTCTGGGTGGCAGTGATG373~392662~64329059Hoxa6⁃BF:GTAAAAGGGAAGGAGTAAAGAGR:AAATTACAAACAACCCCCAATC-405~-384-201~-22220554.6Hoxa10⁃BF:GTAGAATATTAAAGAGGAGAGR:CCCTTAATAATACCATAAACC-1695~-1675-1519~-153917753.4
p.RT-PCR;q.qRT-PCR;B.BSP
p,q and B represent RT-PCR,qRT-PCR and BSP,respectively
1.9 统计与分析
所有组别的试验都至少重复3次。试验数据采用SPSS 19.0软件进行分析。mRNA相对表达丰度等采用ANOVA方差分析和Tukey′s LSD检验,所有结果当P<0.05时表示差异有统计学意义。所有数据均采用“平均值±标准误(mean±SEM)”表示。
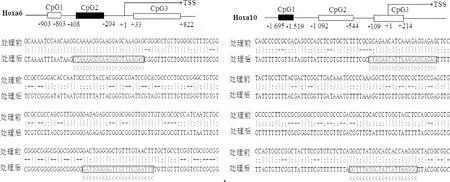
图1 Hoxa6和Hoxa10结构及BSP扩增区域示意图Fig.1 The schematic diagram of Hoxa6 and Hoxa10 and the regions amplified by BSP
2 结 果
2.1 牦牛Hoxa6和Hoxa10基因 5′端序列特征
以黄牛Hoxa6 (NW_005394721.1)和Hoxa10(NW_005394721.1)基因DNA序列为参照设计引物,分别扩增5′端序列,电泳图谱如图2(泳道1、2) 所示。经过克隆测序和序列分析获得了牦牛Hoxa6和Hoxa10 转录起始位点上游部分序列,总长分别为 2 056和1 990 bp,经BLAST分析,与黄牛序列的同源性为97.5%和96.4%。牦牛Hoxa6转录起始位点上游部分序列中A、T、G、C等4种碱基的含量分别为 23.2%、24.4%、26.1%和 26.3%,其中A+T含量(47.6%)小于G+C含量(52.4%)。牦牛Hoxa10转录起始位点上游部分序列中A、T、G、C等4种碱基的含量分别为24.6%、23.7%、27.0%和 24.7%,其中A+T含量(48.3%)小于G+C含量(51.7%)。
2.2Hoxa6和Hoxa10基因 mRNA表达水平
荧光定量的扩增曲线和熔解曲线见图3。结果表明,Hoxa6在多肋牦牛中表达量显著高于普通牦牛(P<0.05),其中在多肋牦牛的肾中表达量最高。然而,Hoxa10在普通牦牛中表达量显著高于多肋牦牛(P<0.05),其中在普通牦牛的肺组织中表达量最高,其次是血液(图4)。

M1、M2均表示DNA 相对分子质量标准;1.Hoxa6 5′端;2.Hoxa10 5′端;3~12.重亚硫酸盐处理后的Hoxa6(上)和 Hoxa10(下)亚克隆菌液PCR产物M1 and M2 represent DNA markers;1 and 2 represent the 5′flanking of Hoxa6 and Hoxa10,respectively;3 to 12 represent the subcloning bacteria PCR products of Hoxa6 and Hoxa10 after bisulfite treatment图2 PCR扩增片段琼脂糖电泳Fig.2 Representative gel photograph of PCR-amplified fragments

图3 qRT-PCR的扩增曲线和熔解曲线Fig.3 The amplification and melt curves of qRT-PCR
2.3Hoxa6和Hoxa10基因甲基化水平
经菌液PCR鉴定,阳性克隆(图2,2~12泳道)进行测序。BSP结果显示,Hoxa6启动子区域的CpG2在普通牦牛血液中DNA甲基化状态(34.76%,73/210)显著高于多肋牦牛(17.14%,36/210)(P<0.05),尤其是第3、4、8、20和21 位CpG位点。Hoxa10启动子区域的CpG1在普通牦牛血液中DNA甲基化状态(22.0%,33/150)显著低于多肋牦牛(38.0%,57/150)(P<0.05),普通牦牛的第9和12位CpG位点几乎未甲基化,而在多肋牦牛中甲基化程度较高(图5)。
3 讨 论
金川多肋牦牛的多肋性状具有巨大的应用价值和科学研究意义,但是迄今为止仍未揭开多肋的形成机制以及表观遗传。本研究从表观遗传和基因表达角度探索金川多肋牦牛的分子发育遗传机制。结果表明,Hoxa6和Hoxa10在多肋牦牛和普通牦牛之间呈拮抗式表达,而启动子区域甲基化状态刚好相反。
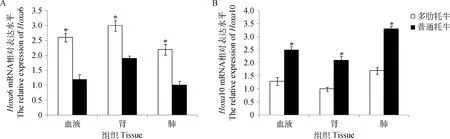
*.表示差异显著*.Represents significant difference图4 多肋牦牛与普通牦牛组织Hoxa6和Hoxa10基因的表达水平Fig.4 Hoxa6 and Hoxa10 mRNA expression differences between multi-costa and common yaks

(A).Hoxa6和Hoxa10的BSP测序结果图:每行代表一个克隆,黑圈代表甲基化的 CpG 位点,白圈代表未被甲基化的 CpG 位点。(B).Hoxa6和Hoxa10甲基化统计图:不同字母(a和b)表示差异显著(A).Bisulfite sequencing results for multi-costa and common yaks:Each line represents an individual bacterial clone which was sequenced;Filled circles indicate methylated CpG sites;Open circles indicate unmethylated CpG sites.(B).Methylation charts of Hoxa6 and Hoxa10:Different letters(a and b) indicate significant differences图5 多肋牦牛与普通牦牛血液中 Hoxa6和Hoxa10的甲基化状态Fig.5 Hoxa6 and Hoxa10 methylation state in blood of multi-costa and common yaks
Hox基因与脊椎动物体轴骨发生及其基因调控机理是从果蝇开始研究的[5]。Hox基因表达模式的建立和维持具有复杂的调控机制,沿染色体的排列顺序与沿胚胎前后轴的表达之间存在空间和时间上的共线性关系[17]。Hox基因家簇成员与椎骨形成之间的联系已陆续的得到研究。利用基因敲除法改变Hox基因的DNA分子的碱基序列,可揭示Hox家簇基因的突变导致动物脊椎不同位置椎骨形态与数量的变异[18-19]。本研究结果显示,Hoxa6与Hoxa10的表达呈负相关,与T.Vinagre等研究结果一致,Hoxa6和Hoxa10的表达改变,使小鼠出现了肋骨增加或抑制肋骨发育的现象[17]。Hoxa10是通过调控胸廓区域来规划少了肋骨之后的腰区布局。D.M.Wellik等研究表明,Hoxa10是哺乳动物骨架形成必不可少的基因之一,减少Hoxa10的表达可使小鼠无法形成肋骨[20]。因此推测,Hoxa10表达量的增加可能是金川牦牛形成多肋的原因之一。此外,Hoxa6与Hoxa10的相互作用也有可能使多肋性状出现。研究表明,Hoxa10和Hoxa6是通过Myf5/Myf6介导的FGF和PDGF信号通路而相互作用的,Myf5/Myf6是通过影响Hoxa10和Hoxa6的表达来控制骨架的形成和肋骨数[17]。然而,是否由于Hoxa10和Hoxa6异常表达引起的金川牦牛多肋现象需进一步深入研究,通过构建敲除细胞系或建立敲除模型验证Hox基因与金川多肋牦牛的相关性。
DNA甲基化是基因组主要表观遗传修饰方式之一,通常参与转录调节,并且已知靶序列5′端调控区的超甲基化可能与表达抑制相关,即甲基化程度越高,表达活性越低[21]。CpG岛的超甲基化往往会改变基因的表达模式,导致基因的转录失活[22-23]。本研究结果表明,金川多肋牦牛Hoxa10的甲基化程度显著高于普通牦牛,这种超甲基化很可能使控制肋骨的基因表达发生异常,因此导致多肋性状的出现。此外,Hoxa6在多肋牦牛中的甲基化水平显著低于普通牦牛,很可能进一步促进肋骨形成基因的转录。D.Kostic等用基因敲除试验表明鼠的Hox6突变可使胸椎增加一个,随之肋骨也多生一对[14]。Hox11突变则导致鼠的椎骨增加一枚[24]。N.Di-Poi等发现,生长分化因子(GDF)基因可能是Hox8基因上游的调控基因,鼠GDF基因的突变杂合子有 14对肋骨,而突变纯合子的胸椎多达 l8 对肋骨,这表明调节主轴骨前后形态的基因不仅仅与Hox基因有关,与其上游调控区域也密切联系[25]。因此,推测DNA甲基化抑制了Hoxa10基因的表达,以及低甲基化促进了Hoxa6基因的表达,从而使得金川多肋牦牛肋骨数增加一对,而这其中的具体机制还有待于进一步深入研究与验证。
本研究中,通过初步分析Hoxa6和Hoxa10基因之间的相互平衡关系来探讨金川多肋牦牛的多肋生物学现象形成机制。前期大量研究证实了Hoxa6和Hoxa10基因分别与腰区和骶区骨骼形成之间的相关性[17]。本研究结果表明,Hoxa6基因促进椎骨和肋骨的形成,而Hoxa10基因的作用相反。在蒙古羊的研究中发现了明显的多椎骨现象,且证明与Hox家簇基因有密切联系[4]。在金川牦牛的屠宰试验中,我们也发现了类似的生物学现象,有部分牦牛的第15对肋骨只有一侧有,另一侧没有,或者两侧的肋骨发育不完全,只有半截。是否由于Hox基因调控椎骨的发育和形成,而间接性的支配肋骨的生长发育还有待进一步挖掘。
4 结 论
本研究利用重亚硫酸氢盐测序法和实时荧光定量法对Hoxa6和Hoxa10基因在多肋牦牛和普通牦牛中的表达和甲基化水平进行了研究。结果显示,普通牦牛Hoxa6基因的甲基化水平极显著高于多肋牦牛,且mRNA 表达水平低于多肋牦牛;多肋牦牛Hoxa10基因的甲基化水平极显著高于普通牦牛,且mRNA 表达水平低于普通牦牛;说明金川多肋牦牛的Hoxa6和Hoxa10基因可能是通过改变DNA甲基化及其mRNA表达来调控肋骨的形成过程。
[1] QIU Q,ZHANG G J,MA T,et al.The yak genome and adaptation to life at high altitude[J].NatGenet,2012,44:946-949.
[2] WANG Z,SHEN X,LIU B,et al.Phylogeographical analyses of domestic and wild yaks based on mitochondrial DNA:new data and reappraisal[J].JBiogeogr,2010,37:2332-2344.
[3] 李 强,傅昌秀,文勇立,等.金川多肋牦牛体尺和屠宰性状测定及其相关性分析[J].中国草食动物科学,2012(2):18-20.
LI Q,FU C X,WEN Y L,et al.Determine body size and carcass traits of multi-costa properties of Jinchuan yak and correlation analysis[J].ChinaHerbivoreScience,2012(2):18-20.(in Chinese)
[4] ZHAO J,ZHANG L L.The differences of CpG distribution in Hoxc8 among the sheep breeds[C].San Diego:Plant and Animal Genome Conference,2011:15-19.[5] LEWIS E B.A gene complex controlling segmentation in Drosophila[J].Nature,1978,276:565-570.
[6] SIMONA S,BOORE J L,MEYER A.Evolutionary conservation of regulatory elements in vertebrate Hox gene clusters[J].GenomeRes,2003,13(3):1111-1122.
[7] MACGINNIS W,KRUMLAUF R.Homeobox genes and axial patterning[J].Cell,1992,68:283-302.
[8] KMITA M,DUBOULE D,TARCHINI B.Hox genes and limb morphogenesis[J].DevBiol,2007,306(1):288-289.
[9] ZAKANY J,DUBOULE D.The role of Hox genes during vertebrate limb development[J].CurrOpinGenetDev,2007,17(4):359-366.
[10] GIORDANI J,BAJARD L,DEMIGNON J,et al.Six proteins regulate the activation of Myf5 expression in embryonic mouse limbs[J].ProcNatlAcadSci,2007,104:11310-11315.
[11] KONDRASHOV N,PUSIC A,STUMPF C R,et al.Ribosome-mediated specificity in Hox mRNA translation and vertebrate tissue patterning[J].Cell,2011,3(28):383-397.
[12] YOUNG T,ROWLAND J E,DE VEN C,et al.Cdx and Hox genes differentially regulate posterior axial growth in mammalian embryos[J].DevCell,2009,17(4):516-526.
[13] WELLIK D M,CAPECCHI M R.Hox10 and Hox11 genes are required to globally pattern the mammalian skeleton[J].Science,2003,301:363-367.
[14] KOSTIC D,CAPECCHI M R.Tageted disruptions of the murine Hoxa-4 and Hoxa-6 genes result in homeotic transformation of components of the vertebral column[J].MechDev,1994(4):231-247.
[15] JONES P A,TAKAI D.The role of DNA methylation in mammalian epigenetics[J].Science,2001,293(5532):1068-1070.
[16] VAISSIERE T,SAWAN C,HERCEG Z.Epigenetic interplay between histone modifications and DNA methylation in gene silencing[J].MutatRes,2008,659:40-48.
[17] VINAGRE T,MONCAUT N,CARAPUCO M,et al.Evidence for a Myotomal Hox/Myf cascade governing nonautonomous control of rib specification within global vertebral domains[J].DevCell,2010,2(11):655-661.
[18] MALLO M,WELLIK D M,DESCHAMPS J.Hox genes and regional patterning of the vertebrate body plan[J].DevBiol,2010,344(1):7-15.
[19] IIMURA T,DENANS N,POURQUIE O.Establishment of Hox vertebral identities in the embryonic spine precursors[J].CurrTopDevBiol,2009,88:201-234.
[20] WELLIK D M,CAPECCHI M R.Hox10 and Hox11 Genes are required to globally pattern the mammalian skeleton[J].Science,2003,301:363-367.
[21] JIANG H,SUN B,WANG W C,et al.Activation of paternally expressed imprinted genes in newly derived germline-competent mouse parthenogenetic embryonic stem cell lines[J].CellRes,2007(17):792-803.
[22] JACINTO F V,BALLEATAR E,ESTELLER M.Methyl-DNA immunoprecipitation(MeDIP):hunting down the DNA methylome[J].Biotechniques,2008,44(1):35-39.
[23] GABORY A,RIPOCHE M A,LE D A,et al.H19 acts as a trans regulator of the imprinted gene network controlling growth in mice[J].Development,2009,136:3413-3421.
[24] DESCHAMPS J,VAN NES J.Developmental regulation of the Hox genes during axial morphogenesis in the mouse[J].Development,2005,132:2931-2942.
[25] DI-POI N,MONTOYA-BURGOS J I,MILLER H,et al.Changes in Hox genes’ structure and function during the evolution of the squamate body plan[J].Nature,2010,464:99-103.
(编辑 郭云雁)
Differences ofHoxa6 andHoxa10 Methylation Status and mRNA Expression in Multi-costa Properties of Jinchuan Yak
XIONG Xian-rong1#,ZHANG Yan1#,LAN Dao-liang2,LI Jian2*,ZI Xiang-dong1, LI Shan-rong3,YANG Jian-mei3
(1.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China; 2.InstituteofQinghai-TibetanPlateau,SouthwestUniversityforNationalities,Chengdu610041,China; 3.AnimalHusbandryandVeterinarianBureauofJinchuan,Jinchuan624100,China)
The transcription level and methylation in promoter regions ofHoxa6 andHoxa10 genes in multi-costa properties and common yak were investigated to explore the mechanism of transcriptional regulation ofHoxgene in the process of multi-costa properties.The mRNA expression leves ofHoxa6 andHoxa10 genes in multi-costa properties and common yak were detected by real-time fluorescence quantitative PCR(qRT-PCR),and the methylation ofHoxa6 andHoxa10 genes promoter regions were analyzed by bisulfite-sequencing PCR(BSP),which included modifying,cloning and sequencing the promoter regions.The results showed that the expression level ofHoxa6 gene was significantly higher in multi-costa properties yak than that in common yak(P<0.05),while the expression level ofHoxa10 gene was significantly lower in multi-costa properties yak(P<0.05).The methylation status of CpG2 island in theHoxa6 promoter region was significantly different between multi-costa properties and common yak,especially on No.3,4,8,20 and 21 CpG sites.However,the methylation status of CpG1 island in theHoxa10 promoter region was significantly higher in multi-costa properties yak than that in common yak(P<0.05),and there was almost no methylation on No.9 and 12 CpG sites in common yak.All above results suggested that the high DNA hypermethylation ofHoxa10 gene in multi-costa properties yak inhibited the expression ofHoxa10 gene in a certain degree,and the low DNA hypomethylation ofHoxa6 gene enhanced the expression ofHoxa6 gene.It was concluded that methylation inHoxpromoter regions may have some influence on transcription regulation ofHoxgenes,and there may be some correlation with the formation of multi-costa properties.
yak;Hoxgene;methylation;expression
10.11843/j.issn.0366-6964.2015.09.007
2014-11-02
国家科技支撑计划(2012BAD13B06);四川省科技支撑计划(2014NZ0114);西南民族大学牦牛创新团队资助(13CXTD01)
熊显荣(1984-),男,江西赣州人,硕士,主要从事牦牛细胞生物学和发育生物学研究,E-mail:xianrongxiong@163.com;张 雁(1990-),女,吉林长春人,硕士,主要从事牦牛遗传育种研究,E-mail:150115439@qq.com。二者共同并列为第一作者
*通信作者:李 键,教授,博士生导师,主要从事牦牛细胞生物学和发育生物学研究,E-mail:jianli_1967@163.com
S823.85;S813.3
A
0366-6964(2015)09-1532-08
