细粒棘球绦虫三磷酸甘油醛脱氢酶基因的克隆、表达及其分子特征的生物信息学分析
2015-03-22王家海胡丹丹钟秀琴宋星桔古小彬杨光友
王家海,王 凝,胡丹丹,钟秀琴,宋星桔,古小彬,汪 涛,杨光友*
(1.四川农业大学动物医学院,雅安 625014;2.四川省渠县动物疫病预防控制中心,渠县 635200)
细粒棘球绦虫三磷酸甘油醛脱氢酶基因的克隆、表达及其分子特征的生物信息学分析
王家海1,2,王 凝1,胡丹丹1,钟秀琴1,宋星桔1,古小彬1,汪 涛1,杨光友1*
(1.四川农业大学动物医学院,雅安 625014;2.四川省渠县动物疫病预防控制中心,渠县 635200)
三磷酸甘油醛脱氢酶(GAPDH)是糖酵解途径中的关键酶,现已发现该酶可作为一些寄生虫的疫苗候选分子和药物靶标。然而,有关绦虫三磷酸甘油醛脱氢酶的研究报道较少。为探究细粒棘球绦虫GAPDH(EgGAPDH)的分子特征与应用价值,克隆细粒棘球绦虫的GAPDH基因,并以生物信息学方法对其进行系统的分析。结果显示:EgGAPDH基因全长1 011 bp,编码336个氨基酸。EgGAPDH是由4个结构相同的单体蛋白(O、P、Q、R)组成的一个同源四聚体,每个单体蛋白质含有3个活性中心,即NAD+绑定区域(aa 4-151 和aa 315-336)、催化结合区域(aa 156-314)和一个酶活性位点(aa 149-156)。通过对EgGAPDH的氨基酸序列的抗原表位预测得到了16个B细胞抗原表位和9个T细胞结合位点;Western blot显示原核表达的重组EgGAPDH能与感染细粒棘球蚴的小鼠血清发生特异性结合;以纯化的重组EgGAPDH蛋白为抗原通过ELISA法检测17份细粒棘球蚴小鼠阳性血清,阳性检出率为100%。试验结果表明:成功克隆并表达细粒棘球绦虫的EgGAPDH基因,EgGAPDH蛋白具有3个酶功能区域和多个免疫结合位点,Western blot和ELISA结果显示,该蛋白质可能具有作为抗细粒棘球蚴的药物靶标和疫苗候选分子的潜力。
细粒棘球绦虫;3-磷酸甘油醛脱氢酶(GAPDH);分子特征
细粒棘球绦虫(Echinococcusgranulosus)的中绦期幼虫——细粒棘球蚴寄生于动物(绵羊、山羊、牦牛、黄牛和水牛等)和人的肝、肺及其他器官内而引起细粒棘球蚴病/囊型包虫病(cystic hydatid disease/ cystic echinococcosis)[1-4]。本病是一种呈世界性分布的人兽共患寄生虫病[5],已被列为我国《国家中长期动物疫病防治规划》(2012—2020年)优先防治和重点防范的动物疫病。
手术是被认为根除包虫病较为有效的手段,然而,由于经济因素和环境条件等的限制,药物治疗是针对大多数动物包虫病较为合理的方式[6]。现有研究资料表明,抗蠕虫药物对细粒棘球蚴的作用效果较低[1],因此,寻找针对细粒棘球蚴的新药物靶标是包虫病防治研究中的一个重要方向。同时,疫苗的研发和应用被认为是控制囊型包虫病最有效的策略之一。到目前为止,细粒棘球绦虫仅有六钩蚴抗原Eg95被成功开发为进入生产应用的疫苗[7]。同时,有研究表明, Eg95疫苗对不同基因型和不同地区的细粒棘球绦虫的免疫效果存在一定的差异[8-9]。因此,筛选对不同地理株和不同基因型的细粒棘球绦虫均具有优良免疫效果的疫苗候选分子也是非常必要的。
三磷酸甘油醛脱氢酶(GAPDH)是糖酵解途径中的一个关键酶,催化3-磷酸甘油醛转变为1,3-二磷酸甘油醛,同时以NAD+为受氢体生成NADH。棘球属绦虫同其他寄生虫一样,糖酵解是其获得能量的主要方式[10-11]。目前对细粒棘球绦虫的糖酵解途径和EgGAPDH尚无研究报道。在本研究中作者进行了细粒棘球绦虫GAPDH基因的克隆与原核表达,通过生物信息学分析、Western blot和ELISA等探讨了细粒棘球绦虫GAPDH蛋白作为包虫病疫苗候选抗原及药物靶标的可能性,同时研究结果将有助于深入了解细粒棘球绦虫的生长发育机理,并为包虫病疫苗候选抗原及药物靶标的深入研究奠定基础。
1 材料与方法
1.1 RNA提取及逆转录
采用RNA试剂盒(Thermo公司 K-002200-C1-100)提取细粒棘球蚴包囊中的原头蚴(获自四川省包虫病患者经手术切除的包囊)的总RNA,按Fermentss反转录试剂盒(Thermo公司 K1621)操作步骤将RNA逆转录成cDNA。保存于-70 ℃冰箱备用。
1.2EgGAPDH基因克隆及序列分析
以细粒棘球绦虫基因组的GAPDH基因(www.genedb.org)为模板,设计一对特异性引物,P1(5′-CGCGGATCCATGAAGCCCCAGGTCGG-3′)和P2(5′-AAGCTTTCAAGCAGTAATTACTTGACAGGG-3′),上游引物添加酶切位点BamHⅠ,下游引物添加酶切位点HindⅢ。
以原头蚴cDNA为模板,采用25 μL体系进行PCR扩增,条件:95 ℃ 5 min,35个扩增循环(95 ℃ 45 s,50 ℃ 50 s,72 ℃ 50 s), 72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳回收,按pMD-T19载体试剂盒说明书(TaKaRa)的方法进行连接,且转化入DH5α感受态细胞,经培养后将菌液涂布于含0.1 mg·mL-1氨苄青霉素的LB固体培养基,37 ℃培养14~16 h;以上述P1、P2为引物经PCR筛选出阳性克隆菌,将阳性单克隆菌送往英潍捷基生物技术有限公司测序,测序正确的菌命名为pMD-T19-GAPDH。
将测序得到的核苷酸序列翻译成氨基酸序列后,应用NCBI中的BlastP (http://www.ncbi.nlm.nih.gov/BLAST)搜寻氨基酸同源序列,并运用Clustal X 2.0[12]进行序列同源联配,用DNAStar软件中的MegAlign程序进行氨基酸序列相似性分析。运用PhyML3.1[13]软件分析NCBI搜索得到的同源氨基酸序列且构建ML系统发育树。运用ProtParam (http://ca.expasy.org/tools/protparam/html)软件预测EgGAPDH的相对分子质量、等电点和稳定性;MotifScan (http://myhits.isb-sib.ch/cgi-bin/motif_scan)分析翻译后的修饰位点;InterPro Scan (http://www.ebi.ac.uk/InterProScan/)预测酶的功能区域和活性位点;TMpred (http://www.ch.embnet.org/software/TMPRED_form.html)预测跨膜区域。采用DNAStar 和 BepiPred 1.0 Server (http://www.cbs.dtu.dk/services/BepiPred/)软件预测EgGAPDH的线性B细胞表位;应用NetCTL 1.2 Server (http://www.cbs.dtu.dk/services/NetCTL/)软件分析EgGAPDH的T细胞结合位点。采用Predictprotein (http://www.predictprotein.org/)预测EgGAPDH的二级结构。采用Swiss-Model Workspace[14]对EgGAPDH进行同源性分子建模,并采用PROCHECK[15]软件对3维模型进行检验。
1.3 重组质粒的构建及鉴定
用BamHⅠ和HindⅢ分别酶切PMD-T19-GAPDH阳性质粒和pET32a(+)载体质粒,将酶切后的片段经胶回收后,按《分子克隆实验指南》的方法连接且转化大肠杆菌BL21。采用BamHⅠ和HindⅢ双酶切鉴定出阳性克隆菌,并将鉴定正确的菌株送往英潍捷基生物技术有限公司测序,测序正确的菌命名为pET32a-GAPDH。
1.4 EgGAPDH重组蛋白质的诱导表达及纯化
将pET32a-GAPDH重组菌接种于含0.1 mg·mL-1氨苄青霉素的 LB液体培养基中,37 ℃培养过夜。按1%的比例接种于100 mL LB液体培养基中,于37 ℃振荡培养至菌液OD600 nm=0.5~1.0,加入IPTG至终浓度为1 mmol·L-1,继续振荡培养4 h后,4 ℃ 10 000 r·min-1离心10 min,弃上清,收集细菌沉淀。用Tris-HCl(50 mmol·L-1,pH8.5)悬菌,对诱导后收集的菌悬液进行超声处理,离心后分别取上清和沉淀进行SDS-PAGE确定重组蛋白质的表达形式。将大量表达的蛋白质按照BIORAD公司的ProfinityTMIMAC Resins纯化蛋白质说明书对蛋白质进行Ni2+亲和层析(FPLC)过柱纯化,纯化后的蛋白质用SDS-PAGE进行检测。
1.5 小鼠血清的制备
阳性血清:取4~5周龄的健康雄性昆明小白鼠17只,按5 000原头蚴·只-1的剂量给小鼠腹腔攻虫。9个月后,解剖收集包囊确认阳性后采血制备血清。
阴性血清:采集13只4~5周龄的健康雄性昆明小白鼠血液,制备血清。
1.6 rEgGAPDH的Western blot分析
Western blot分析参考H.Towbin等的方法进行[16]。纯化的rEgGAPDH经SDS-AGE分离并电转移至硝酸纤维素膜。以5%脱脂奶粉封闭2 h,以1.5制备的小鼠阳性血清(1∶500稀释)室温孵化2 h,PBST洗3次,以1∶3 000稀释羊抗鼠IgG-HRP(BIORAD公司)室温孵化1 h,经PBST洗涤3次,加底物4-氯-1-萘酚显色并拍照。
1.7 rEgGAPDH的ELISA分析
用0.05 mol·L-1pH 9.6 碳酸盐缓冲液将“1.4”纯化的蛋白质稀释作为包被抗原,稀释质量浓度为0.16、0.08、0.04和0.02 μg·μL-1个梯度。向96孔的ELISA板滴加包被抗原100 μL·孔-1,37 ℃温箱孵育2 h后,4 ℃过夜包被;次日将ELISA板甩干,用PBST洗涤3次,5 min·次-1,每孔加入100 μL含5% 脱脂奶粉的封闭液37 ℃封闭2 h,甩干;用PBST洗涤3次,将1.5制备的标准阴性、阳性小鼠血清用PBS依次作1∶50、1∶100、1∶200、1∶400共4个梯度做ELISA方阵滴定,100 μL·孔-1,37 ℃作用1 h;甩干,用PBST洗涤3次后加入1∶3 000稀释羊抗鼠IgG-HRP (BIORAD),100 μL·孔-1,37 ℃ 1 h ;同上甩干后用PBST洗涤3次,每孔加入100 μL的TMB底物显色液,37 ℃避光反应20 min,每孔加入2 mol·L-1H2SO4100 μL终止反应,用酶标仪(Thermo公司)于450 nm处测定OD450 nm。P/N值最大时的抗原包被量和血清稀释倍数为最佳工作浓度。

2 结 果
2.1 EgGAPDH序列分析
从细粒棘球绦虫的原头蚴cDNA中经RT-PCR扩增得到约1 011bp的基因片段(图1)。测序得到的序列长度为1 011bp(GenBankNo.KF894802),该基因编码1个336个氨基酸的多肽,蛋白质理论相对分子质量为36.15ku,PI为8.44。通过BLAST搜索和ClustalX序列对比显示,EgGAPDH氨基酸序列与多房棘球绦虫、猪带绦虫、膜壳绦虫、猬迭宫绦虫、人、绵羊、牦牛的GAPDH相似性分别为97%、92%、72%、82%、75%、74%、74%。其中,与多房棘球绦虫的相似性最高。

1~3.EgGAPDH的PCR产物;4.DL2000 DNA相对分子质量标准1-3.PCR product of EgGAPDH;4.DL2000 DNA marker图1 EgGAPDH基因PCR扩增Fig.1 PCR products of EgGAPDH gene
以不同种属寄生虫和哺乳动物(宿主)的GAPDH氨基酸序列为参考序列,采用最大似然法构建的ML系统发育树显示(图2),吸虫、绦虫、线虫各聚集成独立的分支,然后集合成一簇,哺乳动物聚集在另一簇上,而原虫并没有聚集成一支,分布较散。
2.2 EgGAPDH生物信息学分析
分析预测显示,EgGAPDH的不稳定指数、脂溶性指数和亲水性指数分别为21.5、87.05、0.018,说明EgGAPDH为一个稳定的疏水蛋白。采用Motifscan预测发现了4个N-糖基化位点(aa 101-104、aa 148-151、aa 238-241和 aa 304-307),2个酪蛋白激酶Ⅱ磷酸化位点 (aa 102-105 和 aa 240-243),4个N-肉豆蔻酰化位点(aa 99-104、aa 168-173、aa 211-216和 aa 300-305),6个蛋白激酶C磷酸化位点(aa 70-72、aa 142-144、aa 183-185、aa 191-193、aa 245-247和 aa 321-323),和1个酪氨酸激酶磷酸化位点(aa 323-330)。InterPro软件显示EgGAPDH的NAD+绑定区域位于aa 4-151和aa 315-336,甘油醛-3磷酸结合区位于aa 156-314,3-磷酸甘油全脱氢酶活性位点位于aa 149-156。经TMpred未检测到EgGAPDH存在跨膜区域。该蛋白质有16个B细胞线性结合位点和9个T细胞结合位点。该蛋白质的氨基酸序列和特征位点见图3。
采用人的GAPDH(PDB ID:1u8f)、家兔GAPDH(PDB ID:1j0x)和马来丝虫的GAPDH (PDB ID:4k9d)作为主要的模型,构建出的EgGAPDH 3维模型,如图4所示。该模型由4个同源单体蛋白O、P、Q、R构成的呈222对称四聚体。
2.3 EgGAPDH重组蛋白表达纯化及鉴定
pET32a-GAPDH重组菌转入BL21大肠杆菌中诱导表达,重组融合蛋白质经过柱纯化后,SDS-PAGE电泳分析得到1条大约55 ku的蛋白质条带(图5a)。
Western blot鉴定出现了一条明显的特异性条带(图5b),说明EgGAPDH能与染细粒棘球蚴的小鼠血清发生特异性结合,揭示该蛋白质具有良好的免疫原性。
2.4 EgGAPDH重组蛋白质ELISA分析
ELISA方阵试验结果确定EgGAPDH的最佳包被量为0.02 μg·μL-1,血清最佳稀释倍数为1∶200时,P/N=7.380最大(标准阳性血清OD450 nm/标准阴性血清OD450 nm>2.1,阳性血清OD450 nm为1.203,阴性血清OD450 nm为0.163)。

3 讨 论
3.1EgGAPDH的特征
我们从细粒棘球绦虫原头蚴的cDNA中克隆得到了一条1 011bp的基因片段,该片段长度与GAPDH基因的长度相近,编码336个氨基酸,且预测相对分子质量为36.15ku,与GAPDH的相对分子质量相近,说明该基因为EgGAPDH基因。其氨基酸序列与带科绦虫(多房棘球绦虫、猪带绦虫)的GAPDH序列相似性都在90%以上,而与脊椎动物(人、绵羊、牦牛)的相似性为70%左右,提示所克隆的GAPDH基因并未受到宿主的组织污染。利用最大似然法,对GAPDH氨基酸序列构建系统发育树,结果显示,细粒棘球绦虫与多房棘球绦虫的亲缘关系最近,与它们为同一属的绦虫相吻合。且ML树显示,各个物种按其种属进行聚集,说明GAPDH较强的稳定性,保守性较高。SDS-PAGE电泳分析显示,融合蛋白质相对分子质量约为55 ku,减去His-Tag,得到EgGAPDH分子大小约为37 ku,这与其他学者对GAPDH相对分子质量的研究[19-20]相吻合。
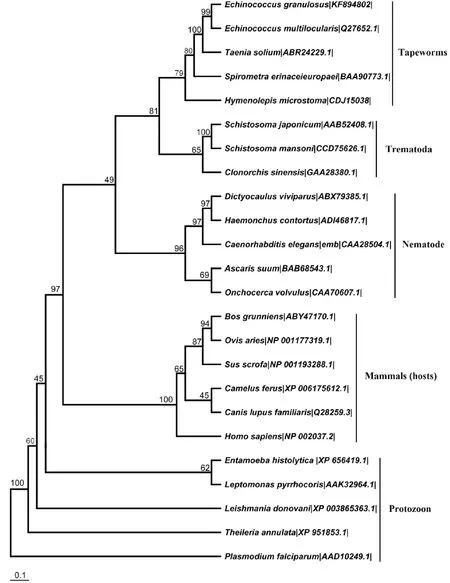
图2 GAPDH系统进化树(ML树)Fig.2 Phylogram tree analysis of GAPDH (ML tree)
3.2 EgGAPDH作为药物靶标潜能
近年来,研究表明参与寄生虫代谢途径中的重要蛋白质可作为抗寄生虫的药物靶标[21-24]。通过同源性建模和一系列的生物信息学分析,我们发现EgGAPDH具有广泛的功能区域,即NAD+绑定区(aa 4-151、aa 315-336)、甘油醛-3-磷酸结合区(aa 156-314)和酶活性位点(aa 149-156),且在NAD+绑定区与甘油醛-3-磷酸结合区的序列与宿主序列存在较大的差异。利用EgGAPDH的功能区域设计开发一类新的特异性的药物,能选择性地抑制EgGAPDH的活性,导致其代谢异常,最终达到杀灭该寄生虫的目的。目前,GAPDH作为抗寄生虫的药物靶标已经在疟原虫属(Plasmodiumspp.)[25]、克氏锥虫(Trypanosomacruzi)[26-27]、布氏锥虫(Trypanosomabrucei)[28]、组织阿米巴原虫(Entamoebahistolytica)[29]和利什曼虫(Leishmania)[30]得到了证实。为此,我们推测EgGAPDH可作为抗细粒棘球绦虫的药物靶标。

Eg.细粒棘球绦虫;Sp.绵羊;Hm.人类;框.活性位点;黄色下划线.T细胞结合位点;红色下划线.线性B细胞结合为点Eg.Echinococcus granulosus; Sp.Sheep (Ovis aries);Hm.Human (Homo sapiens).Frame.Active site; Yellow underlining.Cytotoxic T lymphocyte epitopes;Red underlining.Linear B cell epitopes图3 EgGAPDH基因编码区的特征Fig.3 Characteristics of Coding region in EgGAPDH

图4 EgGAPDH的三维模型Fig.4 Three-dimensional model of EgGAPDH

M.蛋白质相对分子质量标准;1.加IPTG的 pET-32a(+)空载体;2.未加IPTG的pET-32a(+)-EgGAPDH表达载体;3.未纯化的表达产物;4.纯化后的表达蛋白质;A.纯化蛋白质加阴性血清;B.纯化蛋白质加阳性血清;C.空载加阳性血清;D.蛋白质预染相对分子质量标准M.Protein molecular marker;1.pET-32a(+) expression with IPTG;2.pET-32a(+)-EgGAPDH expression without IPTG; 3.pET-32a(+)-EgGAPDH expression with IPTG;4.Purified of EgGAPDH;A.EgGAPDH probed with healthy mice sera;B.EgGAPDH probed with infected mice sera; C.pET-32a(+) expressionprobed with infected mice sera;D.Protein molecular marker图5 EgGAPDH蛋白及纯化产物的SDS-PAGE鉴定(a)及Western blot分析(b)Fig.5 SDS-PAGE (a) and Western blot (b) of EgGAPDH
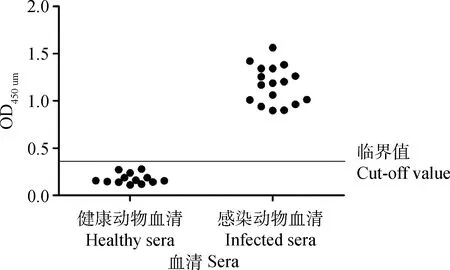
图6 重组蛋白EgGAPDH的ELISA分析Fig.6 ELISA analysis of recombinant EgGAPDH protein
3.3 EgGAPDH的候选疫苗潜能
研究表明,GAPDH是化脓性链球菌(Streptococcuspyogenes)、肺炎链球菌(S.pneumoniae)和无乳链球菌(S.agalactiae)等细菌的表面蛋白[31-33],是这些链球菌主要的致病抗原[34-35]。当血吸虫受到宿主免疫攻击时,GAPDH大量集聚在该虫的表面,提示GAPDH可以作为抗血吸虫的候选疫苗[36-38]。此外,GAPDH也是阴道毛滴虫的一个表面抗原,在其致病性上起到了重要的作用[39]。V.Müller-Schollenberger等以多房棘球绦虫的GAPDH免疫小鼠后,检测到小鼠产生了T细胞免疫应答[40]。这些研究表明,GAPDH广泛存在于病原微生物的表面,可作为抗病原的一个候选疫苗抗原。我们预测得到了16个线性B细胞结合位点和9个T细胞免疫位点,且这些免疫位点多存在于细粒棘球绦虫三磷酸甘油醛脱氢酶氨基酸序列与宿主序列差异较大的区域,因此推测EgGAPDH可以引发宿主的体液免疫和细胞免疫应答。同时,重组EgGAPDH能与人工感染细粒棘球蚴的小鼠血清发生特异性结合,且以EgGAPDH重组蛋白质为抗原对人工感染细粒棘球蚴的小鼠血清ELISA检测结果也说明EgGAPDH具有较好的免疫原性,可能具备作为抗细粒棘球蚴候选疫苗分子的潜力。
4 结 论
成功克隆表达细粒棘球绦虫三磷酸甘油醛脱氢酶基因,并对其生物特征进行生物信息学分析。EgGAPDH具有三个活性中心,即NAD+绑定区、甘油醛-3-磷酸结合区和酶活性位点,同时具有16个线性B细胞结合位点和9个T细胞免疫位点。生物信息学分析推测该蛋白质可作为抗细粒棘球蚴的药物靶标,Western blot和ELISA结果亦显示该蛋白质可能具有作为抗细粒棘球蚴疫苗候选分子的潜力。
[1] CRAIG P S,MCMANUS D P,LIGHTOWLERS M W,et al.Prevention and control of cystic echinococcosis[J].LancetInfectDis,2007,7(6):385-394.
[2] MCMANUS D P,ZHANG W,LI J,et al.Echinococcosis[J].Lancet,2003,362(9392):1295-1304.
[3] ECKERT J,DEPLAZES P.Biological,epidemiological,and clinical aspects of echinococcosis,a zoonosis of increasing concern[J].ClinMicrobiolRev,2004,17(1):107-135.
[4] ZHENG H,ZHANG W,ZHANG L,et al.The genome of the hydatid tapewormEchinococcusgranulosus[J].NatGenet,2013,45(10):1168-1175.
[5] MORO P,SCHANTZ P M.Echinococcosis:a review[J].IntJInfectDis,2009,13(2):125-133.
[6] LI Y,XU H,CHEN J,et al.Gene cloning,expression,and localization of antigen 5 in the life cycle ofEchinococcusgranulosus[J].ParasitolRes,2012,110(6):2315-2323.
[7] LIGHTOWLERS M W.Cestode vaccines:origins,current status and future prospects[J].Parasitology,2006,133(Suppl):S27-S42.
[8] HAAG K L,GOTTSTEIN B,AYALA F J.The EG95 antigen ofEchinococcusspp.contains positively selected amino acids,which may influence host specificity and vaccine efficacy[J].PLoSOne,2009,4(4):e5362.
[9] ALVAREZ ROJAS C A,GAUCI C G,LIGHTOWLERS M W.Antigenic differences between the EG95-related proteins fromEchinococcusgranulosusG1 and G6 genotypes:implications for vaccination[J].ParasiteImmunol,2013,35(2):99-102.
[10] MCMANUS D,SMYTH J D.Intermediary carbohydrate metabolism in protoscoleces ofEchinococcusgranulosus(horse and sheep strains) andE.multilocularis[J].Parasitology,1982,84(2):351-366.
[11] MATSUMOTO J,SAKAMOTO K,SHINJYO N,et al.Anaerobic NADH-fumarate reductase system is predominant in the respiratory chain ofEchinococcusmultilocularis,providing a novel target for the chemotherapy of alveolar echinococcosis[J].AntimicrobAgentsChemother,2008,52(1):164-170.
[12] LARKIN M A,BLACKSHIELDS G,BROWN N P,et al.Clustal W and Clustal X version 2.0[J].Bioinformatics,2007,23(21):2947-2948.
[13] GUINDON S,DUFAYARD J F,LEFORT V,et al.New algorithms and methods to estimate maximum-likelihood phylogenies:assessing the performance of PhyML 3.0[J].SystBiol,2010,59(3):307-321.
[14] ARNOLD K,BORDOLI L,KOPP J,et al.The SWISS-MODEL workspace:a web-based environment for protein structure homology modelling[J].Bioinformatics,2006,22(2):195-201.
[15] LASKOWSKI R A,MACARTHUR M W,MOSS D S,et al.PROCHECK:a program to check the stereochemical quality of protein structures[J].JAppCrystallogr,1993,26(2):283-291.
[16] TOWBIN H,STAEHELIN T,GORDON J.Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets:procedure and some applications[J].ProcNatlAcadSciUSA,1979,76(9):4350-4354.
[17] NORUSIS M.SPSS 16.0 guide to data analysis[M].Prentice Hall Press,2008.
[18] JIN Y,ANVAROV K,KHAJIBAEV A,et al.Serodiagnosis of echinococcosis by ELISA using cystic fluid from Uzbekistan sheep[J].KoreanJParasitol,2013,51(3):313-317.
[19] ENGEL M,SEIFERT M,THEISINGER B,et al.Glyceraldehyde-3-phosphate dehydrogenase and Nm23-H1/nucleoside diphosphate kinase A.Two old enzymes combine for the novel Nm23 protein phosphotransferase function[J].JBiolChem,1998,273(32):20058-20065.
[20] ROITEL O,VACHETTE P,AZZA S,et al.P but not R-axis interface is involved in cooperative binding of NAD on tetrameric phosphorylating glyceraldehyde-3-phosphate dehydrogenase fromBacillusstearothermophilus[J].JMolBiol,2003,326(5):1513-1522.
[21] KUNTZ A N,DAVIOUD-CHARVET E,SAYED A A,et al.Thioredoxin glutathione reductase fromSchistosomamansoni:an essential parasite enzyme and a key drug target[J].PLoSMed,2007,4(6):e206.
[22] PRICE H P,MENON M R,PANETHYMITAKI C,et al.Myristoyl-CoA:protein N-myristoyltransferase,an essential enzyme and potential drug target in kinetoplastid parasites[J].JBiolChem,2003,278(9):7206-7214.
[23] HARWALDT P,RAHLFS S,BECKER K.Glutathione S-transferase of the malarial parasite Plasmodium falciparum:characterization of a potential drug target[J].BiolChem,2002,383(5):821-830.
[24] KHALAF N B,DE MUYLDER G,LOUZIR H,et al.Leishmaniamajor protein disulfide isomerase as a drug target:enzymatic and functional characterization[J].ParasitolRes,2012,110(5):1911-1917.
[25] AKINYI S,GAONA J,MEYER E V,et al.Phylogenetic and structural information on glyceraldehyde-3-phosphate dehydrogenase (G3PDH) in Plasmodium provides functional insights[J].InfectGenetEvol,2008,8(2):205-212.

[27] FREITAS R F,PROKOPCZYK I M,ZOTTIS A,et al.Discovery of novelTrypanosomacruziglyceraldehyde-3-phosphate dehydrogenase inhibitors[J].BioorgMedChem,2009,17(6):2476-2482.
[28] VERLINDE C L,CALLENS M,VAN CALENBERGH S,et al.Selective inhibition of trypanosomal glyceraldehyde-3-phosphate dehydrogenase by protein structure-based design:toward new drugs for the treatment of sleeping sickness[J].JMedChem,1994,37(21):3605-3613.
[29] SINGH S,MALIK B K,SHARMA D K.Molecular modeling and docking analysis of Entamoeba histolytica glyceraldehyde-3 phosphate dehydrogenase,a potential target enzyme for anti-protozoal drug development[J].ChemBioDrugDes,2008,71(6):554-562.
[30] SURESH S,BRESSI J C,KENNEDY K J,et al.Conformational changes inLeishmaniamexicanaglyceraldehyde-3-phosphate dehydrogenase induced by designed inhibitors[J].JMolBiol,2001,309(2):423-435.
[31] BERGMANN S,ROHDE M,HAMMERSCHMIDT S.Glyceraldehyde-3-phosphate dehydrogenase ofStreptococcuspneumoniaeis a surface-displayed plasminogen-binding protein[J].InfectImmun,2004,72(4):2416-2419.
[32] MADUREIRA P,BAPTISTA M,VIEIRA M,et al.StreptococcusagalactiaeGAPDH is a virulence-associated immunomodulatory protein[J].JImmunol,2007,178(3):1379-1387.
[33] MOLINARI G,TALAY S R,VALENTIN-WEIGAND P,et al.The fibronectin-binding protein ofStreptococcuspyogenes,SfbI,is involved in the internalization of group A streptococci by epithelial cells[J].InfectImmun,1997,65(4):1357-1363.
[34] EGEA L,AGUILERA L,GIMÉ NEZ R,et al.Role of secreted glyceraldehyde-3-phosphate dehydrogenase in the infection mechanism of enterohemorrhagic and enteropathogenic Escherichia coli:Interaction of the extracellular enzyme with human plasminogen and fibrinogen[J].IntJBiochemCellBiol,2007,39(6):1190-1203.
[35] GOZALBO D,GIL-NAVARRO I,AZORN I,et al.The cell wall-associated glyceraldehyde-3-phosphate dehydrogenase of Candida albicans is also a fibronectin and laminin binding protein[J].InfectImmun,1998,66(5):2052-2059.
[36] MARTIN W,BRINKMANN H,SAVONNA C,et al.Evidence for a chimeric nature of nuclear genomes:eubacterial origin of eukaryotic glyceraldehyde-3-phosphate dehydrogenase genes[J].ProcNatlAcadSciUSA,1993,90(18):8692-8696.
[37] WAINE G J,BECKER M,YANG W,et al.Cloning,molecular characterization,and functional activity ofSchistosomajaponicumglyceraldehyde-3-phosphate dehydrogenase,a putative vaccine candidate against schistosomiasis japonica[J].InfectImmun,1993,61(11):4716-4723.
[38] WAINE G J,YANG W,SCOTT J C,et al.DNA-based vaccination usingSchistosomajaponicum(Asian blood-fluke) genes[J].Vaccine,1997,15(8):846-848.
[39] LAMA A,KUCKNOOR A,MUNDODI V,et al.Glyceraldehyde-3-phosphate dehydrogenase is a surface-associated,fibronectin-binding protein ofTrichomonasvaginalis[J].InfectImmun,2009,77(7):2703-2711.
[40] MÜLLER-SCHOLLENBERGER V,BEYER W,SCHNITZLER P,et al.Immunisation with Salmonella typhimurium-delivered glyceraldehyde-3-phosphate dehydrogenase protects mice against challenge infection withEchinococcusmultiloculariseggs[J].IntJParasitol,2001,31(13):1441-1449.
(编辑 白永平)
Cloning,Expression and Bioinformatical Analysis ofEchinococcusgranulosusGlyceraldehyde-3-phosphate Dehydrogenase Gene
WANG Jia-hai1,2,WANG Ning1,HU Dan-dan1,ZHONG Xiu-qin1,SONG Xing-ju1, GU Xiao-bin1,WANG Tao1,YANG Guang-you1*
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Ya′an625014,China; 2.PreventiveandControlCentreofQuCountyofSichuanProvine,QuCounty635200,China)
As a key enzyme in the glycolytic pathway,glyceraldehyde-3-phosphate dehydrogenase (GAPDH) has wide applications (vaccine candidate and drug target) against some parasites,but until now,few studies have been carried out in tapeworms.In order to determine its molecular character and practical value,EchinococcusgranulosusGAPDH(EgGAPDH) was cloned,expressed and analyzed.TheEgGAPDHgene isolated fromE.granulosuscDNA was 1 011 bp in length,encoding 336 amino acids.The quaternary structure of this protein consisted of four chemically identical subunits,O,P,Q,and R.Each subunit consisted of an NAD+-binding domain (residues 4-151 and 315-336),a catalytic domain (residues 156-314) and one enzymeactivesite (residues 149-156).Recombinant EgGAPDH was expressed and purified fromEscherichiacoli.Specific immunogenicity of EgGAPDH was shown by Western blot,ELISA analysis,and epitope prediction (16 B cell epitopes and 9 cytotoxic T lymphocyte epitopes).EgGAPDHgene was successfully amplified,cloned and expressed,EgGAPDH has three functional areas and a number of epitope prediction,combing with the results of Western blot and ELISA,it may be serve as a vaccine candidate and drug target against larval ofE.granulosus.
Echinococcusgranulosus;glyceraldehyde-3-phosphate dehydrogenase (GAPDH);molecular characterization
10.11843/j.issn.0366-6964.2015.09.019
2014-12-19
四川农业大学学科建设双支计划项目(Sc-0357);四川省支撑计划项目(2015NZ0041)
王家海(1989-),四川达州人,硕士,主要从事动物寄生虫病学研究,E-mail:wangjiahai1989@163.com
*通信作者:杨光友,教授,博士生导师,主要从事动物寄生虫病学研究,E-mail:guangyou1963@aliyun.com
S852.734
A
0366-6964(2015)09-1629-09
