慢性HBV 感染者HBV 前C 区/基本核心启动子区基因突变与临床应用
2015-03-20
湖北省中医院检验科(湖北 武汉,430074)
自1989年Carman[1]首次发现HBV前C 区1896 位点的变异可形成HBeAg(-)的CHB之后,Okamoto等[2]研究发现BCP区变异也可形成HBeAg(-)CHB。国内外对PreC 区/BCP 区变异的分子结构、生物学改变及对疾病的影响等方面进行了一系列研究[3,4]。近年来,HBV PreC 区/BCP 区变异研究也出现新的进展[5],为了解慢性HBV 感染者HBV PreC 区变异与HBV复制关系,我们对慢性HBV感染者进行研究,探讨其HBV PreC区/BCP 区基因突变与其病程进展的相关性。
1 资料与方法
1.1 研究对象 我院2010年10月至2013年6月住院患者。其中AsC组63例(男42例,年龄28~68岁;女21例,年龄24~65岁);CHB 组82例(男68例,年龄32~71岁;女14例,年龄25~68岁);CHB-LC组20例(男15例,年龄45~76岁;女5例,年龄46~67岁)。所有病例诊断均符合2010年《慢性乙型肝炎防治指南》诊断标准[5],此前受试者均未核苷类药物、干扰素抗病毒和免疫调节治疗,排除甲、丙、丁、戊型肝炎病毒感染及酒精、药物和自身免疫性肝病。
1.2 方法
1.2.1 检测项目及试剂 ①血生化检测:各观察组患者均检测血清AST、ALT、TP、Alb、A/G 比值、AFP 和TBA(总胆汁酸)。由宁波美康科技有限公司提供相应试剂盒。仪器为美国产雅培C-8000 全自动生化分析仪。②外周血清HBV DNA 含量的测定:收集患者血清,-70℃冻存至检。采用荧光定量PCR 法(FQ-PCR)检测患者血清HBV DNA含量,使用上海宏石全自动基因扩增仪,试剂盒由武汉百泰基因有限公司生产,试剂盒的最低检出限度为500 IU/ml,线性范围5.0×102~1.0×108IU/ml。③HBeAg 检测:用于评价HBV PreC 区/BCP 区基因突变在临床上的应用价值。HBeAg 检测试剂盒由北京万泰药业股份有限公司生产。④HBV PreC 区/BCP 区基因突变:采用FQ-PCR 法检测患者血清HBV PreC 区1896 位点突变和BCP 区1762/1764 双位点突变。试剂为武汉百泰基因有限公司生产。仪器为上海宏基因扩增仪。
1.2.2 统计学方法 数据采用SPSS 15.0 统计软件包进行分析处理,计量资料组间比较采用t检验,计数资料组间比较采用2检验。
2 结果
2.1 3组患者血生化检测结果 见表1。由表1可见,与AsC组比较:CHB 组、CHB-LC 组患者血清ALT、AST、AFP、TBA 水平升高,差异有显著性意义(P<0.01),呈显著正相关;而TP、Alb、A/G 水平降低,差异有显著性意义(P<0.05),呈负相关。
表1 3组患者血生化指标检测结果比较()
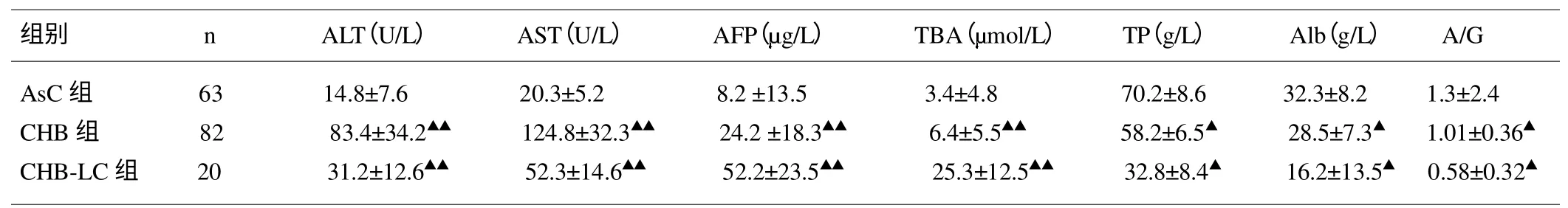
表1 3组患者血生化指标检测结果比较()
与AsC 组比较,▲ P<0.05,▲▲P<0.01
2.2 3 组患者外周血清HBVDNA 含量和HBeAg 定性检测结果 见表2。由表2 可看出,HBeAg(-)可出现在慢性HBV 感染的不同病程,HBeAg(-)患者存在病毒复制。

表2 3 组患者HBV DNA 和HBeAg 检测结果
2.3 HBV PreC 区/BCP 区基因突变检测结果
2.3.1 HBeAg(+)组与HBeAg(-)组BCP 区与PreC 区突变分析 见表3。

表3 HBeAg(+)组HBeAg(-)组中BCP 区1762+1764 和PreC 区1896 突变分布[n(%)]
由表3 可见,HBeAg(+)组样本中,BCP区的突变率均高于PreC区突变率,差异有显著性意义(2=11.14,P<0.001);HBeAg(-)组样本中,BCP 区的突变率均高于PreC 区突变率,差异有显著性意义(2=37.8,P<0.001)。
2.3.2 慢性HBV 感染不同临床类型患者PreC 区/BCP 区变异的结果 见表4。

表4 HBV Pre C 区/BCP 区变异与不同临床类型感染者的关系[n(%)]
由表4 可见,AsC 组、CHB 组、CHB-LD 组PreC 区1896、BCP 区1762/1764 变异率依次升高。与AsC 组比较:CHB 组PreC 区l896、BCP 区1762/1764 变异率升高,差异有显著性意义,P<0.05;而CHB-LC 组差异有非常显著性意义,P<0.01。
3 讨论
HBV 属嗜肝DNA病毒,其基因组长约3.2 kb,为部分双链环状DNA。HBV基因组主要包括4个开放读码框(ORF)分别位于S 区、C 区、P 区、X 区。PreC 区及C区位于同一个ORF 内,它们编码两种转录:前基因组RNA(pgRNA)和前C 区mRNA。HBV Pre C 区编码前C 信号肽,引导HBeAg 前体至内质网,通过细胞分泌器加工处理后形成成熟的HBeAg 从肝细胞分泌出去;1862 位点G—T 的置换导致病毒前核心蛋白氨基酸密码子的改变,变为终止密码子,从而阻断了HBeAg 的产生[6]。BCP是HBV复制的关键性调控因子,调控HBV 前C 基因组mRNA和前基因组mRNA转录;BCP 区的双突变(1762,1764)可使3’端茎环结构发生改变,稳定性增强,促进病毒转录的发生和复制[7],因此BCP 区的变异被视为影响病毒复制、HBeAg 表达的主要因素之一[8]。同時BCP 中的双突变可能与活动性肝炎、肝硬化(LC)、原发性肝癌(HCC)相关[9]。
慢性HBV感染者病情轻重是由宿主和病毒两方面所决定,许多研究都显示C 基因变异与肝炎活动及严重性有关[10]。目前认为,有PreC 区变异的抗-HBe 阳性进展性肝炎(atypical type),这类患者HBeAg(-),HBVDNA(+),多有PreC区终止码变异。当HBV PreC 区1896 G→A 变异后,使末端产生翻译终止密码子TAG,导致HBeAg 前体蛋白的合成中断,造成HBeAg 减少或消失,但病毒本身复制不受影响。BCP 区的1762 位A→T 与1764 位G→A 双变异可能引起严重慢性肝脏疾病[11]。
国内外学者在研究HBV Pre C 区/BCP 区基因突变多采用患者血清HBV DNA 提取、纯化、测序、巢式PCR 扩增、限制性基因多态性片段确定基因位点突变,由于操作繁琐,难于在临床上推广应用。我们采用武汉百泰基因有限公司生产的HBV Pre C 区1896 位点基因突变、BCP 区1762/1764 位点基因突变试剂盒,简便、快速、准确应用于临床。我们对慢性HBV 感染者中AsC 63例、CHB 82例、CHB-LC 20例进行分析,血清生化指标在慢性HBV 感染者病程进展中呈现相关性。其中ALT、AST、AFP、TBA水平升高,差异有显著性意义(P<0.01),呈显著正相关;而TP、Alb、A/G水平降低,差异有显著性意义(P<0.05),呈负相关。与国內外报道相符。
AsC 组、CHB 组、CHB-LC 组HBV DNA 含量以及HBeAg检测结果及HBeAg(+)组样本中,BCP区的突变率均高于PreC区突变率,差异有显著性意义(P<0.05);HBeAg(-)组样本中,BCP 区的突变率均高于PreC 区突变率,差异有非常显著性意义(P<0.01)。提示HBeAg(-)慢性HBV 感染患者需要谨防HBV 复制的危险性。
PreC 区、BCP 区变异在AsC 组、CHB 组、CHB-LC 组发生率依次增高,不仅提示PreC区、BCP区变异可以预测慢性HBV感染者病情的发生发展程度,还可能出现肝脏恶变的可能性[12]。
随着对HBV 基因型研究的深入,人们发现其基因型与基因变异之间似乎存在一定的相关性。例如A、F 基因型的HBV不易发生Pre C 区1896 突变,而其他基因型该位点的突变率较高。一些学者研究认为B 基因型HBV 的Pre C 区1896 位点较C 基因型更容易发生G→A 的突变,C 基因型感染者BCP 区双突变率较B 基因型感染者高。即BCP 区突变率高与C 基因型分布多有关[13]。尽管近年来对HBV PreC 区、BCP 区基因变异的研究已经较为广泛和深入,但HBV S 区、C 区、P 区、X 区也会出现基因突变,会影响慢性HBV感染者人群病程的变化;不同种族对基因突变的易感性也不同;患者自身免疫力,生存环境也会影响此类患者的病程。要对我国慢性HBV 感染人群监控,值得全社会去共同关心[14]。
[1]Carman WF,Jalyan MR,Hadziyannis S,et a1.Mutation preventing formation of hepatitis B e antigen in patients with chronic hepatitis B infection[J].Lancet,1989,2(8663):588-590.
[2]Okamoto H,Tsuda F,Akahane Y,et a1.Hepatitis B virus with mutations in the e antigen-negative phenotype in carriers with e antibody to e antigen[J].Virol,1994,68(12):8102-8110.
[3]Tong MJ,Blatt LM,Kao JH,et a1.Basal core promoter T1762/A1764 and precore A1896 gene mutations in hepatitis B surface antigen-positive hepatocellular carcinoma:a comparison with chronic carriers[J].Liver Int,2007,27(10):1356-1363.
[4]白丽,王琳,徐东平.234例慢性乙型肝炎患者HBV 前C/BCP 区突变分析[J].实用肝脏病杂志,2009,12(1):14-16.
[5]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华内科杂志,2011,2:168-179.
[6]Hou JL,Lin YL,Waters J,et a1.Detection and significance of a G1862T variant of hepatitis B virus in Chinese patients with fulminant hepatitis[J].J Gen Virol,2002,83(9):2291-2298.
[7]Jammeh S,Tavner F,Watson R,et a1.Effect of basal core promoter and pre-core mutations on hepatitis B vires replication[J].J GenVirol,2008,89(4):901-909.
[8]Parekh S,Zoulim F,Ahn SH,et a1.Genuine replication,virionsecretion,and e antigen expression of naturally occurring hepatitis B viruscore promoter mutants[J].J Virol,2003,77(12):6601-6612.
[9]Hunt CM,McGill JM,Mien MJ,et a1.Clinical relevance of hepatitis B viral mntations[J].Hepatology,2000,3I(5):1037-1044.
[10]Kawabe N,Hashimoto S,Harata M,et a1.The loss of HBeAg without precore mutation results in lower HBV DNA levels and ALT levels in chronic hepatitis B virus infection[J].J Gastraenterol,2009,44:751-756.
[11]Yin J,Xie J,Liu S,et a1.Association between the various mutations in viral core promoter region to different stages of hepatitis B,ranging of asymptomatic carrier state to hepatocellular carcinoma[J].Am J Gastroenterol.2011,106:81-92.
[12]高春芳,吴孟超.乙型肝炎病毒感染标志物的检测现状和思考[J].中华检验医学杂志,2015,38(3):145-147.
[13]Zhand S,Karami C,Adli AH et al:Correlation between hepatitis B G1896A precore mutations and HBeAg in chronic HBV patients[J].Jundishapur J Microbiol,2015,8(2):e17126-e17129.
[14]Croagh CM,Desmond PV,et a1。Genotypes and variants chronic hepatitis B :A review of epidemiology and clinical relevance[J].World J Haptol,2015,7(3):289-303.
