内耳显影对迟发性膜迷路积水诊断的意义△
2015-03-16吴倩如张国明赵梦龙沙炎戴春富
吴倩如 张国明 赵梦龙 沙炎 戴春富
内耳显影对迟发性膜迷路积水诊断的意义△
吴倩如1张国明2赵梦龙3沙炎3戴春富1
目的 明确鼓室内钆造影剂注射后内耳显影对迟发性膜迷路积水(delayed endolymphatic hydrops,DEH)诊断的临床价值,探讨迟发性膜迷路积水的病理机制。方法 10例DEH患者行双鼓室钆造影剂注射24小时后行三维快速液体衰减反转恢复(three dimensional fluid-attenuated inversion recovery,3D-FLAIR)序列和三维实时反转恢复(three dimensional real inversion recovery,3D-real IR)序列扫描成像,分析患者内淋巴积水的范围及严重程度。结果 10例DEH患者中9例为同侧型,1例为对侧型,均显示单侧或双侧内淋巴积水征象,其中9例同侧型DEH患者中仅1例(11.1%)患侧耳前庭内淋巴显示轻度积水,其余8例(88.9%)均显示患侧前庭内淋巴重度积水;8例(88.9%)同侧型DEH患者患侧耳蜗内淋巴积水,而1例(11.1%)同侧型DEH患者患侧耳蜗内淋巴无积水,9例同侧DEH患者对侧耳均未见前庭、耳蜗内淋巴积水。1例对侧型DEH患者的双侧前庭内淋巴重度积水,右侧耳蜗内淋巴轻度积水,而左侧耳蜗未见积水。结论 内淋巴积水是DEH的主要病理因素,鼓室内钆注射后内耳显影能直观地反映出DEH患者内淋巴积水的范围及严重程度。
迟发性膜迷路积水; 内耳显影; 鼓室内注射
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20141231.1128.001.html
迟发性膜迷路积水(delayed endolymphatic hydrops,DEH)是一种不同于梅尼埃病,但又可出现类似于梅尼埃病症状的独立疾病,于1971年首先被Kamei[1]发现,经Nadol[2]和Wolfson[3]进一步证实后,最终于1987年由Schuknecht[4]对其进行命名、定义、分类,并对其病因和病理改变等进行了阐述。DEH分为同侧型和对侧型,主要临床表现为一侧耳先出现极重度感音神经性聋,经一段潜伏期后同侧耳出现类似于梅尼埃病的发作性眩晕(同侧型)或对侧出现耳波动性听力下降伴或不伴有类似于梅尼埃病的发作性眩晕(对侧型),此潜伏期可为1至74年不等[5]。
Nakashima等[6]于2007年首次通过鼓室内注射钆造影剂后应用三维快速液体衰减反转恢复(three dimensional fluid-attenuated inversion recovery,3D-FLAIR)序列MRI成功观察到梅尼埃患者内耳内淋巴积水,之后于2009年[7]经鼓室内注射钆造影剂后运用三维实时反转恢复(three dimensional real inversion recovery,3D-real IR)序列MRI能更清晰的显示梅尼埃病患者内耳内淋巴积水情况;内淋巴积水除了是梅尼埃病的病理基础,也是DEH复杂的病理过程中的一部分[8],甚至可能是引起患者听力下降和前庭症状的最重要的潜在病理因素[9]。因此,本研究应用双鼓室内注射钆造影剂后3D-FLAIR和3D-real IR两种序列的MRI观察DEH患者内淋巴积水范围及程度,以探讨其在DEH诊断中的临床价值。
1 资料与方法
1.1 DHE诊断标准[10]同侧型DEH的诊断标准:①一侧耳先出现极重度的听力下降,经历一段潜伏期以后出现类似于梅尼埃病的发作性眩晕,但对侧耳不出现波动性的听力下降;②排除中枢神经系统的损伤、前庭神经肿瘤以及其他耳蜗前庭疾病。对侧型DEH的诊断标准:①一侧耳先出现极重度的听力下降,经历一段潜伏期以后对侧耳出现波动性的听力下降,伴或不伴有类似于梅尼埃病的发作性眩晕;②排除中枢神经系统的损伤、前庭神经肿瘤以及其他耳蜗前庭疾病。
1.2 研究对象 2013年7月至2014年5月经复旦大学附属眼耳鼻咽喉科医院耳神经颅底外科确诊的10例DEH患者为研究对象,男女之比为1:1,年龄16~67岁,平均37.10±15.31岁;其中,9例患者为同侧型DEH(表1,1~9号患者),男女之比为5:4,患耳左右侧别比为5:4,患耳初始听力下降的发病年龄多在儿童期,仅1例为中年时期。眩晕发病基本集中在中年时期;1例22岁女性患者被诊断为对侧型DEH(表1,10号患者),其左耳于15岁时出现重度感音神经性聋,5年后出现右耳波动性听力下降伴发作性眩晕。所有患者均行纯音听阈测试,其中9例患者同时行冷热水试验及前庭诱发肌源性电位检查。
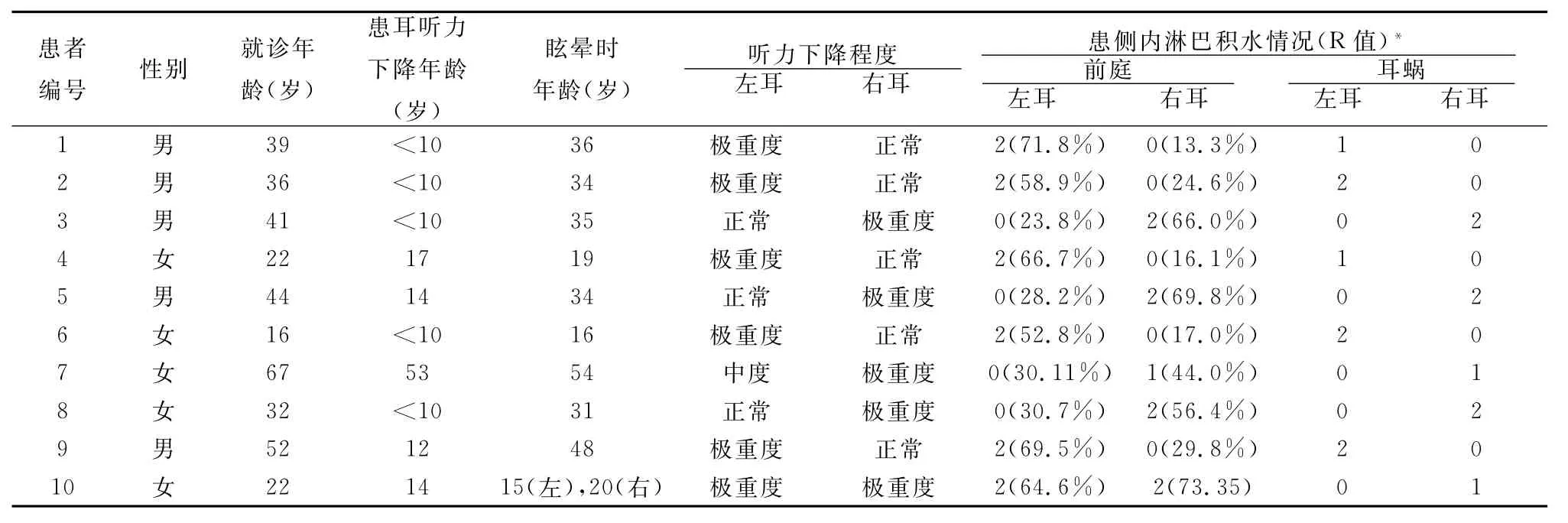
表1 10例DEH患者的病史资料
1.3 影像学检查方法
1.3.1 内耳MRI扫描 患者签署知情同意书后,在耳内镜下经鼓膜将稀释好(用生理盐水按照1:7稀释)的钆喷酸葡胺造影剂注入双鼓室,24小时后使用3.0T磁共振扫描仪和32通道头线圈或8通道耳表面线圈对所有患者分别进行耳部轴位3DFLAIR和3D-real IR序列扫描(西门子,Verio)。3D-FLAIR序列参数为TR 6 000 ms,TE 387 ms,TI 2 100 ms,分辨率0.7 mm×0.7 mm×0.6 mm,回波链长度173,FOV 220 mm×220 mm。3D-real IR序列参数为TR 9 000 ms,TE 181 ms,TI 1 730 ms,分辨率0.4 mm×0.4 mm×0.8 mm,FOV 160 mm×160 mm。
1.3.2 内淋巴积水的影像学评估方法 鼓室内钆造影剂通过前庭窗和圆窗渗透弥散进入耳蜗、前庭和半规管的外淋巴,钆造影剂未能通过血迷路屏障进入内淋巴,故MRI图像可见钆造影剂在外淋巴间隙的显影,而内淋巴区处于暗区。如果内耳终末器官内淋巴积水,内淋巴挤压该处外淋巴间隙,使该处钆造影剂显示外淋巴间隙减小甚至消失,故在MRI图像上外淋巴增强影缩小或消失,而相应的内淋巴暗区相对增大,以评估内耳积水范围及程度。
根据内淋巴暗区在MRI图像上的范围可分析其内淋巴积水的严重程度,2009年Nakashima等[11]提出前庭和耳蜗内淋巴积水程度的3级影像学评估标准,积水分为无积水、轻度积水和重度积水。前庭积水程度根据前庭内淋巴间隙面积占该侧前庭总面积(即:内、外淋巴间隙面积的总和)的比值R,利用Photoshop CS5画出内外淋巴间隙并且计算R值,R≤1/3为无积水,1/3<R≤1/2为轻度积水,R>1/2为重度积水;耳蜗积水程度根据耳蜗的前庭膜有无移位,无积水即前庭膜无移位,轻度积水则前庭膜有移位但中阶面积不大于前庭阶,重度积水则耳蜗的中阶面积明显大于前庭阶。
2 结果
2.1 纯音听阈测试结果 9例同侧型DEH患者的患耳均为极重度感音神经性聋,0.5、1、2 k Hz的平均听阈均大于90 dB HL,1例同侧型DEH患者的对侧耳出现中度听力下降,以2 k Hz以上高频听力下降为主,其余8例患者的对侧耳听力正常。1例对侧型DEH患者纯音听阈测试示双侧耳均为极重度感音神经性聋。
2.2 冷热水试验结果 经冷热水试验测试的8例同侧型DEH患者中6例(75.0%)患者双侧半规管功能不对称且患侧减弱,剩余2例(25.0%)双侧半规管功能对称。1例对侧型DEH患者的冷热水试验结果示双侧半规管功能不对称,左侧减弱,无优势偏向。
2.3 前庭诱发肌源性电位(vestibular-evoked myogenic potential,VEMP)结果 9例患者行颈肌前庭诱发肌源性电位(cervical vestibular-evoked myogenic potential,c VEMP)检查,结果显示,患侧球囊前庭下通路异常(无反应、反应阈增高或潜伏期延长等)4例(44.44%),双侧球囊前庭下通路均出现异常4例(44.44%),1例(11.11%)患者仅对侧耳显示球囊前庭下通路异常。眼肌前庭诱发肌源性电位(ocular vestibular-evoked myogenic potential,o VEMP)检查显示,2例(22.22%)患者仅患侧椭圆囊前庭上通路异常(无反应、反应域增高或潜伏期延长等),6例患者(66.67%)双侧椭圆囊前庭上通路均出现异常,1例(11.11%)患者对侧耳显示椭圆囊前庭上通路异常。
2.4 影像学检查结果 经双鼓室钆造影剂注射后颞骨MRI轴位3D-FLAIR和3D-real IR序列扫描结果显示所有DEH患者均存在内淋巴积水。9例(100%)同侧型DEH患者均显示患侧内淋巴积水,其中,8例(88.9%)同侧型DEH患者患侧前庭内淋巴重度积水,1例(11.1%)前庭内淋巴轻度积水;5例(55.56%)同侧型DEH患者耳蜗内淋巴重度积水,3例(33.33%)耳蜗内淋巴轻度积水,1例(11.11%)耳蜗内淋巴无积水;所有同侧型DEH患者对侧耳均未见积水(表1)。图1为3号同侧型DEH患者的内耳内淋巴显像图。
1例对侧型DEH患者左耳出现极重度听力下降5年后右耳出现波动性听力下降,MRI示双侧前庭内淋巴重度积水,右侧重于左侧,其右侧耳蜗内淋巴显示轻度积水,而左侧耳蜗无积水(图2)。
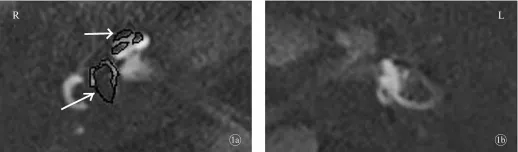
图1 3号同侧型DEH患者内淋巴3D-real IR MRI显像图
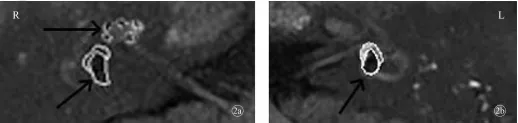
图2 10号对侧型DEH患者内淋巴3D-real IR MRI显像图
3 讨论
3D-FLAIR序列MRI与3D-real IR序列MRI成像均能有效地显示内耳的内外淋巴情况,但是两者各有其优缺点,3D-FLAIR序列MRI可以区分内淋巴间隙与外淋巴间隙,但是却不能将其区别于周围的骨质,而3D-real IR序列MRI可以区分内、外淋巴间隙及外周骨质,在识别耳蜗前庭内外淋巴时3D-real IR序列MRI一般比3D-FLAIR序列更佳,但是当造影剂进入外淋巴不足时前者又比后者更难观察内淋巴积水状态[7];故本研究选择3D-FLAIR和3D-real IR两种序列MRI扫描综合评判患者内淋巴积水状况。
Nonoyama等[12]报道通过静脉钆造影剂注射4小时后行3D-FLAIR MRI扫描成像,显示4例同侧型DEH患者出现双侧内淋巴积水。本组10例DEH患者均经双鼓室钆造影剂注射24小时后行颞骨MRI轴位3D-FLAIR和3D-real IR序列扫描均明确存在内淋巴积水;其中,9例同侧型DEH患者均显示患耳内淋巴积水,而对侧未发现积水征象。至今未有组织病理学研究显示同侧型DEH患者对侧内耳存在内淋巴积水的组织病理学改变及机制,故还需增加样本量来进一步分析这一现象。Schuknecht[5]对2例对侧型DEH患者进行尸检后发现患者先聋侧内耳的病理改变与腮腺病毒性或风疹病毒性迷路炎相似,而出现波动性听力下降的对侧内耳的病理改变与梅尼埃病相似,双侧耳蜗、前庭膜迷路均显示出不同程度积水;Harris[13]、Suzuki等[14]认为自身免疫因素可能是对侧型DEH患者最终双侧耳均出现病变的重要原因之一。本研究中唯一的1例对侧型DEH患者的影像学检查显示双侧耳内淋巴积水,其中双侧前庭均重度积水,且右耳重于左耳,右耳耳蜗内淋巴轻度度积水,而左耳耳蜗内淋巴未见积水;总之,初始听力下降耳的内淋巴积水程度不及随后的听力下降耳。对于对侧型DEH患者来说,此现象是对侧型DEH患者在整个病程中的特征性表现还是仅为病程中某一阶段的表现还需进一步研究。本研究提示,通过影像学检查对比对侧型DEH患者病程的不同阶段(如:出现对侧耳症状前后)双侧内耳内淋巴积水程度,可以观察疾病的发展规律,判断病情严重程度并有助于选择治疗方案;对于先后出现双侧耳听力下降的DEH患者,可明确患者是否为对侧型DEH。
DEH病因多种多样,其中[15]儿童或青少年时期不明原因的耳聋者所占比例最大,突发性聋次之,其他病因[5,16,17]还包括细菌性和病毒性(腮腺病毒、风疹病毒、流感病毒等)迷路炎、噪声性内耳损伤、头部创伤、乳突手术、耳硬化、先天性巨细胞病毒感染等。本组DEH病例中90%患者在儿童时期出现不明原因的耳聋症状,1例同侧型DEH患者在中年时期出现患突聋1年后出现眩晕症状,该患者的潜伏期在所有患者中最短,并且MRI图像上显示其前庭内淋巴积水程度均为轻度。内淋巴积水程度是否与其发病年龄、潜伏期或病因相关还有待通过增加样本量来进一步考察。
前庭诱发肌源性电位(c VEMP和o VEMP)检查可以显示出球囊前庭下神经通路以及椭圆囊前庭上神经通路的情况;Ohki等[8,19]研究发现75%的同侧型DEH患者患耳及67%的对侧型DEH患者患耳VEMP检查异常。本研究中,88.9%的同侧型DEH患者VEMP异常,而100%DEH患者通过鼓室内钆造影剂注射后MRI扫描显示前庭内淋巴积水。相对而言,内耳显影的影像学检查能够更直观的判断前庭内淋巴积水范围及严重程度,对DEH的诊断及DEH类型的判断能提供更直接的诊断依据。
1 Kamei T,Noro H,Yabe K,et al.Statistical observation of unilateral total deafness and characteristics of unilateral total deafness among young children with tendency toward dizziness[J].Jibiinkoka,1971,43:349.
2 Nadol JJ,Weiss AD,Parker SW.Vertigo of delayed onset after sudden deafness[J].Ann Otol Rhinol Laryngol,1975,84:841.
3 Wolfson RJ,Leiberman A.Unilateral deafness with subsequent vertigo[J].Laryngoscope,1975,85:1762.
4 Schuknecht HF.Delayed endolymphatic hydrops[J].Ann Otol Rhinol Laryngol,1978,87:743.
5 Schuknecht HF,Suzuka Y,Zimmermann C.Delayed endolymphatic hydrops and its relationship to Meniere's disease[J].Ann Otol Rhinol Laryngol,1990,99:843.
6 Nakashima T,Naganawa S,Sugiura M,et al.Visualization of endolymphatic hydrops in patients with Meniere's disease[J]. Laryngoscope,2007,117:415.
7 Nakashima T,Naganawa S,Katayama N,et al.Clinical significance of endolymphatic imaging after intratympanic gadolinium injection[J].Acta Otolaryngol,2009,129:9.
8 Giannoni B,Pagnini P,Vannucchi P.Delayed endolymphatic hydrops[J].Acta Otorhinolaryngol Ital,1998,18:66.
9 Albernaz PL.Unusual cases of delayed endolymphatic hydrops[J].Acta Otolaryngol,2007,127:355.
10 Komatsuzaki A,Futaki T,Harada Y,et al.Delayed endolymphatic hydrops.The guideline for standardization of diagnostic criteria in vertiginous diseases.The Committee for Standardization of Diagnostic Criteria in 16 Vertiginous Disease[J].Equilibrium Res(Kyoto),1987,47:249.
11 Nakashima T,Naganawa S,PyykköI,et al.Grading of endolymphatic hydrops using magnetic resonance imaging[J]. Acta Oto-laryngologica,2009,129:5.
12 Nonoyama H,Tanigawa T,Tamaki T,et al.Evidence for bilateral endolymphatic hydrops in ipsilateral delayed endolymphatic hydrops:preliminary results from examination of five cases[J].Acta Otolaryngol,2014,134:221.
13 Harris JP,Aframian D.Role of autoimmunity in contralateral delayed endolymphatic hydrops[J].Am J Otol,1994,15:710.
14 Suzuki M,Hanamitsu M,Kitanishi T,et al.Autoantibodies against inner ear proteins in patients with delayed endolymphatic hydrops and unilateral juvenile deafness[J].Acta Otolaryngol,2006,126:117.
15 Shojaku H,Watanabe Y,Takeda N,et al.Clinical characteristics of delayed endolymphatic hydrops in Japan:A nationwide survey by the Peripheral Vestibular Disorder Research Committee of Japan[J].Acta Otolaryngol,2010,130:1135.
16 Huygen PL,Admiraal RJ.Audiovestibular sequelae of congenital cytomegalovirus infection in 3 children presumably representing 3 symptomatically different types of delayed endolymphatic hydrops[J].Int J Pediatr Otorhinolaryngol,1996,35:143.
17 Kamei T.Delayed endolymphatic hydrops as a clinical entity[J].Int Tinnitus J,2004,10:137.
18 Ohki M,Matsuzaki M,Sugasawa K,et al.Vestibular evoked myogenic potentials in ipsilateral delayed endolymphatic hydrops[J].ORL J Otorhinolaryngol Relat Spec,2002,64:424.
19 Ohki M,Matsuzaki M,Sugasawa K,et al.Vestibular evoked myogenic potentials in patients with contralateral delayed endolymphatic hydrops[J].Eur Arch Otorhinolaryngol,2002,259:24.
(2014-09-05收稿)
(本文编辑 周涛)
The AppIication of EndoIymphatic Space Imaging in the Diagnosis of DeIayed EndoIymphatic Hydrops
Wu Qianru*,Zhang Guoming,Zhao MengIong,Sha Yan,Dai Chunfu
(*Department of OtoIogy and SkuII Base Surgery,Key Laboratory of Hearing Science,Ministry of HeaIth,Eye Ear Nose&Throat HospitaI,Fudan University,Shanghai,200031,China)
Objective To investigate the pathological mechanism of delayed endolymphatic hydrops(DEH),and clarify the clinical value of endolymphatic space imaging after intratympanic injection of gadolinium in the diagnosis of delayed endolymphatic hydrops.Methods Twenty-four hours after bilateral intratympanic injection of gadolinium,the locations and severity of endolymphatic hydrops of all patients were evaluated by using three dimensional fluid-attenuated inversion recovery(3D-FLAIR)and three dimensional real inversionrecovery(3D-real IR).ResuIts All patients had unilateral or bilateral endolymphatic hydrops.Among 9 ipsilateral DEH patients,only 1(11.1%)patient was identified as mild endolymphatic hydrops and the rest(88.9%)examined had significant endolymphatic hydrops in vestibule of their affected ears;Endolymphatic hydrops appeared in cochlea of the affected ear in 8(88.9%)patients,except for 1 patient.Endolymphatic hydrops were not observed in the contralateral ears of 9 ipsilateral DEH patients.Mild endolymphatic hydrops in bilateral vestibule,severe in right cochlear and none in left cochlea of contralateral DEH patient were identified.ConcIusion Endolymphatic hydrops is the primary pathological factors of DEH.Endolymphatic space imaging after intratympanic injection of gadolinium can intuitively reflect the locations and severity of endolymphatic hydrops in DEH patients.
Delayed endolymphatic hydrops(DEH); Endolymphatic space imaging; Intratympanic injection
戴春富(Email:cfdai66@163.com)
10.3969/j.issn.1006-7299.2015.01.001
时间:2014-12-31 11:28
R764.33
A
1006-7299(2015)01-0001-05
△ 国家自然科学基金(81070785、81170909)和卫生公益行业专项基金(201202001)资助
1 复旦大学附属眼耳鼻咽喉科医院耳神经颅底外科,卫生部听觉医学重点实验室(上海 200031); 2 浙江省绍兴市第五人民医院耳鼻咽喉科; 3 复旦大学附属眼耳鼻咽喉科医院放射科
吴倩如,女,江西人,硕士研究生,主要研究方向为听觉医学。
·信 息·
