二咖啡酰奎宁酸对脑缺血后星形胶质细胞Porimin 指标的影响观察
2015-03-11付学军黄巧英褚晓凡
付学军,黄巧英,黄 莹,张 睿,褚晓凡
二咖啡酰奎宁酸(dicaffeoylquinic acids,DCQ)是一类由奎宁酸(quinc acid)与数目不等的咖啡酸(caffeic acid)通过酯化反应缩合而成的酚酸类天然成分。二咖啡酰奎宁酸是临床常用的治疗缺血性脑血管病等疾病的药物如灯盏细辛、脉络宁等的主要成分,研究表明其与血清蛋白结合情况良好。目前通过化学方法能从中药中提炼出二咖啡酰奎宁酸单体。若能够证明二咖啡酰奎宁酸单一成分制剂对脑缺血治疗有效,将具有极佳的临床应用前景。本研究,在持续脑缺血大鼠模型的基础上,应用1,5-二咖啡奎宁酸啡酸酯,将各组大鼠的存活率、固定大脑切片梗死面积、组织学改变以及promin 表达情况作为主要观察指标,探讨该药物对持续性缺血后脑损伤、细胞免疫指标等方面的影响。
1 材料和方法
1.1 实验动物及分组 32 只雄性SD 大鼠(健康清洁级,体重250~300 g,鼠龄3~4 m,广东省动物中心提供);3,5 二咖啡奎宁酸由深圳市生物谷医药研究院有限公司提供;动物分组:实验动物随机分为空白组(正常)6 只、对照组(生理盐水组)、药物组,对照组及药物组又按照缺血时间(6 h 及24 h)分成2 个亚组。空白组、对照组每个亚组各6 只大鼠,药物组各亚组7 只大鼠。空白组不做任何处理,对照组及药物组均制成左大脑中动脉阻塞模型(middle cerebral artery occlusion,MCAO)。给药方法:各组均在造模并缝合皮肤后即刻尾静脉注射相应药物;药物组给予3,5-二咖啡奎宁酸(0.36mg/kg)[1]尾静脉注射,对照组予生理盐水。采用盲法给药,给药由专人负责,造模者回避。分别于MCAO后6 h、24 h 进行行为学检测及神经功能评分;然后取脑作组织学检查及免疫荧光检测。
1.2 实验方法
1.2.1 MCAO 模型制备 MCAO 模型制备采用褚晓凡教授在Zea Longa 基础上改良的颈内动脉线栓加环扎法[2]。术前动物禁食12 h,但可以自由饮水。10%水合氯醛0.3 ml/100 g 腹腔麻醉。通过使用反馈控制的热垫保持肛温在37.5 ℃。
1.2.2 神经功能评分 采用Menzies 等[3]描述的方法并做了一些改良进行神经功能评分:0 分:无明显改变;1 分:向后拖拽尾巴时对侧上肢弯曲;2分:向后拖拽尾巴时对侧前肢抓力减弱;3 分:可自发向各方向移动,但向后拖拽尾巴时向对侧转圈;4分:自发向对侧转圈;5 分:死亡。
1.2.3 组织学检查 MCAO 后6 h 及24 h,动物被再麻醉,经心脏灌注4%多聚甲醛(溶于0.1 mol/L PBS 溶液)固定。取脑,放入4%多聚甲醛中4 ℃浸泡6 h,然后移到4 ℃的25%蔗糖中3~4 d直至沉底。用25%蔗糖和O.C.T 的混合物(2∶1)包埋脑,弃掉大脑前部分2 mm,而后恒冷箱行冠状连续切片,片厚20 μm,每2 mm 间隔取一张贴于玻片上,每张玻片共有5 片脑组织,分别行Cresyl Violet 染色及HE 染色(按照Cresyl Violet 及HE 染色试剂盒方法进行)。HE 染色用于观察细胞形态,确定缺血半暗带区。Cresyl Violet 染色用于评定造模是否成功并通过Image J 软件测量脑梗死体积。为避免脑水肿的影响,采用如下计算方法:梗死体积=对侧半球体积-同侧半球非梗死区体积,脑肿胀比率=梗死侧半球体积/对侧半球体积。
1.2.4 免疫荧光检测 从-80 ℃冰箱中取出切片,回温后,切成厚度为20μm 脑片;洗片后[0.1 mol/LPBS(pH=4)洗3 次,每次5 min]以10%胎羊血清、0.3% TritonX-100、0.1 mol/L PBS 封闭液,室温摇床封闭60 min;应用抗体稀释液(含0.1%TritonX-100、0.1 mol/L PBS)稀释一抗(Porimin 及GFAP),每张切片200 μl,4 ℃过夜。冲洗后应用抗体稀释液稀释荧光第二抗体。室温孵育3 h。此整个荧光抗体稀释及添加过程需注意避光。冲洗后加入DAPI 染色液室温避光作用2 min;用免疫荧光洗涤液在室温避光漂洗3 次,每次5 min;封片后在共聚焦荧光显微镜下观察拍照。分别观察5个视野的平均面积内Porimin 与GFAP、DAPI 阳性细胞并计数。
1.3 统计学方法 采用SPSS 16.0 版统计软件包进行统计,计量资料采用±s 表示,各组间均数比较采用t 检验及方差分析,组间两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 实验动物存活情况 实验共选用实验动物32 只,成活30 只。对照组(6 h)6 只和药物组6 h 组7 只均成活。对照组及药物组24 h 组各有1 只大鼠死亡;两组死亡大鼠解剖后均可见颅底血凝块同时见脑组织肿胀明显。进入统计学分析30 只。
2.2 行为学分析 空白组实验动物神经功能评分为0 分,对照组和药物组动物在缺血6 h 评分中位数4 分,四分位间距(QR)为0.75,缺血24 h 组评分中位数为3 分,四分位间距(QR)为1.5 分,建模成功。
2.3 脑梗死体积及脑肿胀比率 空白组Cresyl Violet 染色未见梗死灶。对照组和药物组可见左侧大脑中动脉区域明显梗死灶,提示造模成功。且在两组中,缺血6 h 脑梗死体积显著小于缺血24h脑梗死体积。相对于药物组,对照组各亚组大脑半球脑肿胀比率(6 h 与24 h)显著大于药物组(均P<0.01);比较药物组各亚组大脑半球脑肿胀比率发现,缺血6h 组脑肿胀比率小于缺血24 h 组,差异有统计学意义。
2.4 形态学分析 空白组:脑切片HE 染色未见缺血病灶,细胞形态学与正常对照组比较无明显变化。对照组及药物组:两组脑切片HE 染色均可见明显缺血灶,非缺血侧未见细胞形态改变,缺血中心区大体观察染色偏淡,组织疏松,与正常组织存在差异,两组的缺血时间越长,变化越为明显。对照组缺血6 h 中心区细胞疏松,星形胶质细胞肿胀明显、核仁偏移、核变形、染色变浅;半暗带区细胞水肿,散在肿胀的星形胶质细胞,部分星形胶质细胞呈空泡变。药物组缺血6 h 中心区细胞轻度疏松,星形胶质细胞肿胀、核仁变形、核略深染;半暗带区6 h 星形胶质细胞肿胀,细胞周围间隙略宽。对照组缺血24 h 中心区可见大空泡样变化细胞,细胞正常结构消失,星形胶质细胞难以辨认;缺血半暗带区细胞水肿明显,可见有肿胀的星形胶质细胞。药物组缺血24 h 中心区也可见大空泡样变化细胞,细胞正常结构亦消失;缺血24 h 半暗带区细胞水肿明显,可见有肿胀的星形胶质细胞。
2.5 免疫荧光检测 空白组可见形态正常的GFAP 表达阳性细胞,未见明确Porimin 表达阳性的细胞;对照组MCAO 后6 h,大脑中动脉栓塞中心区可见大量破碎的GFAP 阳性细胞,半暗带区偶可见GFAP 阳性细胞突触消失,胞体明显肿胀,偶见Porimin 与GFAP、DAPI 三标阳性细胞;MCAO 后24 h,中心区细胞大多破碎,半暗带区可见较多Porimin 与GFAP、DAPI 三标阳性肿胀细胞。药物组MCAO 后6 h,大脑中动脉栓塞中心区可见同对照组,半暗带区亦偶可见肿胀的GFAP 阳性细胞,偶见Porimin 与GFAP、DAPI 三标阳性细胞;MCAO 后24h,中心区未见正常细胞结构,半暗带区亦可见GFAP、DAPI 三标阳性肿胀细胞。
比较对照组与药物组MCAO 后24 h 半暗带区Porimin 与GFAP、DAPI 三标阳性细胞数目发现,药物组Porimin 与GFAP、DAPI 三标阳性细胞数目显著低于对照组,两者间差异有统计学意义(P=0.01)。

图1 MCAO 后半暗带区Porimin 与GFAP 的表达
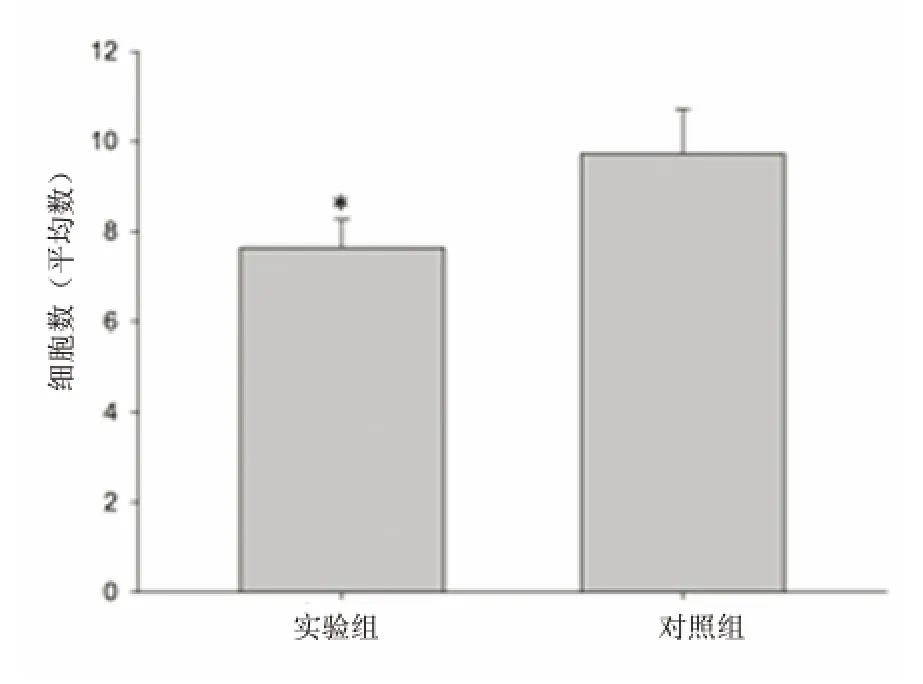
图2 MCAO 后24h 药物组与对照组半暗带区Porimin 与GFAP、DAPI 三标阳性细胞数目比较
3 讨论
脑卒中是人类的常见病和多发病,其以较高的发病率、致残率和病死率,严重威胁着人类健康。脑卒中患者不同程度的丧失各种活动功能,对其生活、工作能力及精神心理状态都有极大影响。据统计,我国目前急性脑血管病发病总人数超过百万例,而其中急性缺血性脑卒中(脑梗死)约占全部脑卒中的60%~80%[4]。急性缺血性脑卒中由中心坏死区及其周围的缺血半暗带区组成,脑梗死治疗的最主要靶点就是抢救缺血半暗带。研究表明,缺血半暗带区与星形胶质细胞关系紧密,星形胶质细胞连接血管内皮细胞和血管周围的神经元,共同组成“神经血管单元”,在脑缺血的早期起着脑保护的关键作用[5]。
星形胶质细胞广泛存在于大脑灰质及白质中,对神经细胞起着支持隔离、营养代谢、信号传递等重要作用。本研究中HE 染色结果显示,在对照组和药物组中,缺血24h 半暗带区星形胶质细胞的肿胀与缺血6h 相比均有差异,这与我们前期研究中得出就结论相一致,就是脑缺血时间越长,半暗带区星形胶质细胞损伤越重。由于星形胶质细胞在神经血管单元中的位置,使其成为遭受缺血打击后直接受损的脑细胞[5]。因此,在研究缺血性脑血管病的治疗措施的过程中,应提高对保护和抢救星形胶质细胞的认识。
在前期的研究中[6,7],我们通过形态学的观察和免疫学的验证提出了星形胶质细胞在脑缺血过程中存在胀亡的死亡形式。胀亡(oncosis)主要表现为细胞受损后体积扩大,膜通透性增加、完整性破坏,DNA 裂解成为非特异性片段,最后细胞溶解,胞质漏出并伴有周围组织炎症反应。研究表明星形胶质细胞胀亡这一转归与细胞膜上Porimin 受体激活相关[8,9]。Porimin 是一种高度糖基化的跨膜受体蛋白,包含189 个氨基酸,属于细胞膜相关粘蛋白家族。其可在缺氧、底物缺乏、ATP 进行性减少等情况下被激活,并迅速与其配体抗-Porimin mAb 结合,造成各种膜性结构的损伤,譬如胞膜起泡,胞膜通透性增加,孔道形成等,从而启动细胞胀亡。该蛋白特异表达在将要发生胀亡的细胞表面。Porimin 与缺血损伤的发生密切相关,目前对于心肌细胞、肾细胞缺血后胀亡发生与Porimin 表达的相关研究较多[10,11],但在神经系统方面的研究相对较少。本实验结果中,对照组在MCAO 后6h 组DAPI、GFAP 与Porimin 阳性表达细胞不多,而24h 后半暗带区存在着数量尚可的DAPI、GFAP 和Porimin 三重标记的阳性细胞,这提示星形胶质细胞在半暗带区存在胀亡。随着缺血时间延长,三标阳性细胞的增加可能与缺血后细胞的损伤程度相关。针对这一特性,本研究选取Porimin 作为星形胶质细胞是否得到有效保护的指标,以1,5-二咖啡奎宁酸啡酸为保护剂做一观察。
二咖啡酰奎宁酸(dicaffeoylquinic acids,DCQ)是一类由奎宁酸(quinc acid)与数目不等的咖啡酸(caffeic acid)通过酯化反应缩合而成的酚酸类天然成分。咖啡酸酯是灯盏花等植物的主要成分。目前已从灯盏花提炼出单体1,5 二咖啡酰氧基奎宁酸。二咖啡酰奎宁酸作为一种来源于天然植物的中药有效活性成分,具有抗氧化、抗病毒、抗纤维化、抗血小板活性、抗炎症反应、降血脂、血糖等多种药理作用[12~15],具有极佳的临床应用前景。萃取、分离纯化技术的发展,更重要的是化学合成二咖啡酰奎宁酸技术的出现使得获得大量纯品成为可能。本研究中,药物组在MCAO 后24 h 半暗带区DAPI、GFAP与Porimin 阳性表达细胞明显少于对照组在MCAO后24 h 半暗带区的数量,表明二咖啡酰奎宁酸可减少半暗带区星形胶质细胞胀亡的发生,提示二咖啡奎宁酸对脑缺血半暗带区星形胶质细胞起到一定保护作用。二咖啡奎宁酸对脑缺血半暗带区胶质细胞保护的可能机制是通过提高GSH(glutathione,细胞谷胱甘肽)合成、减少ROS(reactive oxygen species,活性氧族),从而保护缺血导致的星形胶质细胞损伤[16]。目前认为缺血性损伤后首先出现的病理生理变化即包括了ROS 生成过多,而且ROS 生成量与缺血损伤导致的星形胶质细胞功能障碍和迟发性死亡显著相关[17,18]。GSH 是细胞抗氧化防御系统的重要成分之一,它既能直接与ROS 结合发挥抗氧化效应,也能作为多种过氧化物酶的底物参与抗氧化[19~21]。二咖啡奎宁酸通过提高GSH 合成、减少ROS,改善氧化应激损伤,起到保护脑缺血半暗带区胶质细胞的作用。
通过本研究,我们认识到随着脑缺血时间的延长,半暗带区星形胶质细胞损伤逐渐加重,在二咖啡酰奎宁酸作用下,与星形细胞胀亡相关的porimin 指标有显著意义的下降,表明二咖啡酰奎宁酸对脑缺血中星形胶质细胞的保护可能起一定积极作用。
[1]王晓明,王跃飞,潘桂湘,等.HPLC 同时测定灯盏细辛注射液中4 种成分的含量[J].中国中药杂志,2008,33(14):1681-1683.
[2]Chu X,Qi C,Zou L.Intraluminal suture occlusion and ligation of the distal branch of internal carotid artery:an improved rat model of focal cerebral ischemia-reperfusion[J].J Neurosci Methods,2008,15(168):1-7.
[3]Menzies SA,Hoff JT,Betz AL.Middle cerebral artery occlusion in rats:a neurological and pathological evaluation of a reproducible mod-el[J].Neurosurgery,1992,31(1):100-106.
[4]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(1):1-8.
[5]Lee SR,Lo EH.Interactions between p38 mitogen-activated protein kinase and caspase-3 in cerebral endothelial cell death after hypoxiareoxygenation[J].Stroke,2003,34(11):2704-2709.
[6]付学军,褚晓凡,亓传洁,等.胀亡——持续性局灶脑缺血星形胶质细胞的死亡方式[J].中华神经医学杂志,2005,4(10):979-982.
[7]付学军,黄巧英,徐铅辉,等.持续脑缺血后半暗带区星形胶质细胞的转归[J].华中科技大学学报(医学版),2014,43(5):532-536.
[8]Halliwell B.Oxidative stress and neurodegeneration:where are we now[J]?Journal of Neurochemistry,2006,97:1634-1658.
[9]Ma F,Zhang C,Prasad KV,et al.Molecular cloning of porimin,a novel cell surface receptor mediating oncotic cell death[J].Proc Natl Acad Sci USA,2001,98(17):9778-9783.
[10]Zhang C,Xu Y,Gu J,et al.A cell surface receptor defined by a mAb mediates a unique type of cell death similar to oncosis[J].Proc Natl Acad Sci,1998,95(11):6290-6295.
[11]Majno G,Joris I.Apoptosis,oncosis and necrosis.An overview of cell death[J].Am J Pathol,1995,146(1):3-15.
[12]Majno G,Joris I.Cells tissues and disease-principles of general pathology[M].2nd.New York,Oxford University Press,2004.186-245.
[13]Ferrante RJ,Shinobu LA,Schulz JB,et al.Increased 3-nitrotyrosine and oxidative damage in mice with a human copper/zinc superoxide dismutase mutation[J].Annals of Neurology,1997,42:326-334.
[14]Ho YS,Magnenat JL,Bronson RT.et al.Mice deficient in cellular glutathione peroxidase develop normally and show no increased sensitivity to hyperoxia[J].Journal of Biological Chemistry,1997,272:16644-16651.
[15]Dringen R,Pawlowski PG,Hirrlinger J.Peroxide detoxification by brain cells[J].Journal of Neuroscience Research,2005,79:157-165.
[16]Cole SP.Deeley RG.Transport of glutathione and glutathione conjugates by MRP1[J].Trends in Pharmacological Sciences,2006,27:438-446.
[17]Keelan J,Bates TE,Clark JB.Heightened resistance of the neonatal brain to ischemia-reperfusion involves a lack of mitochondrial damage in the nerve terminal[J].Brain Res,1999,821(1):124-133.
[18]Piantadosi CA,Zhang J.Mitochondrial generation of reactive oxygen species after brain ischemia in the rat[J].Stroke,1996,27:327-331.
[19]Bains JS,Shaw CA.Neurodegenerative disorders in humans:the role of glutathione in oxidative stress-mediated neuronal death[J].Brain Res,1997,(25):335-358.
[20]Schulz JB,Lindenau J,Seyfried J,et al.Glutathione,oxidative stress and neurodegeneration[J].Eur J Biochem,2000,267:4904-4911.
[21]Dringen R.Metabolism and functions of glutathione in brain[J].Neurobiol,2000,62:649-671.
