人羊膜间充质干细胞移植治疗帕金森病模型大鼠的疗效评价
2015-03-11陈代雄赵春华
陈 勇,方 宁,陈代雄,赵春华
帕金森病(Parkinson’s disease,PD)是一种以黑质多巴胺(dopamine,DA)能神经元进行性死亡为特征的神经退行性疾病,主要临床表现为静止性震颤、肌僵直和运动障碍。目前PD 尚无根治方法,传统治疗以药物为主,疗效减退后可行手术治疗,但都只能控制症状,而且有发生不良反应和并发症风险。随着干细胞技术的发展,采用胚胎干细胞、神经干细胞、间充质干细胞(mesenchymal stem cells,MSCs)移植治疗PD 患者或动物模型已取得很大进展,可望成为治疗PD 的新手段[1~3]。近年来,人羊膜间充质干细胞(human amniotic mesenchymal stem cells,hAMSCs)的生物学特性及其在再生医学领域的应用价值越来越受到关注。hAMSCs 来源于胚外中胚层,除具有多向分化潜能外,还具有低免疫原性和免疫调节作用[4,5]。此外,hAMSCs 来源丰富、易于制备、无伦理限制等优势。近期几项研究证明,hAMSCs 原位移植可促进脑、脊髓、外周神经损伤模型动物病损神经组织的修复和明显改善运动功能[6~8],表明hAMSCs 对神经性疾病具有潜在的治疗价值。移植途径对hAMSCs 治疗效应的影响、生物效应的持续时间及其在宿主体内的命运等是临床前研究值得关注的重要问题。本实验通过动态观察,进一步评价原位和静脉hAMSCs 对PD 模型大鼠的疗效及其在脑组织中的存活、分化。
1 材料与方法
1.1 材料 清洁级雌性Wistar 大鼠40 只,体重220~250 g,购自第三军医大学大坪医院动物实验中心[许可证号:SCXK(渝)2007-0005]。LGDMEM 培养基和FBS(GIBCO,乌拉圭);GlutaMax(GIBCO 公司,美国);小鼠抗人细胞核抗体(MAB1281;Chemcion,美国);兔抗人神经元微管结合蛋白(microtubule associated protein-2,MAP-2)抗体(SANTA CRUZ,美国);阿朴吗啡(Apomorphine,APO)、Ⅱ型胶原酶、6-羟基多巴胺(6-hydroxydopamine,6-OHDA)和小鼠抗人波形蛋白抗体(Sigma,美国);流式细胞术检测抗体CD29-PE、CD34-PE、CD45-FITC、CD44-FITC、CD73-PE、CD90-FITC、CD105-PE、CD80-FITC、CD86-PE 和HLA-DR-FITC(BD,美国);兔抗大鼠酪氨酸羟化酶(Tyrosine hydroxylase,TH)抗体(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 hAMSCs 的分离、培养及表型分析 经产妇知情同意采集足月剖宫产羊膜,参照文献[9]采用胰蛋白酶-胶原酶消化法分离hAMSCs,将分离的hAMSCs 悬浮于含10%FBS、1%GlutaMAX、55 μmol/L β-巯基乙醇、1% NEAA 和5 ng/ml bFGF 的LDMEM 培养基中,按5×105/cm2接种于培养瓶,于37 ℃、5%CO2、饱和湿度条件下培养。细胞生长面积达80%以上即进行传代培养,至第3 代用于细胞治疗,并采用流式细胞仪(FACS Calibur.BD)检测其表型。取第3 代hAMSCs,按组合方案加入荧光素标记的CD29-PE、CD34-PE、CD45-FITC、CD44-FITC、CD73-PE、CD90-FITC、CD105-PE、CD80-FITC、CD86-PE 和HLA-DR-FITC 的抗体振荡混匀,每份样品的采集细胞数≥104个,Cell Quest 软件进行表型分析。同型对照抗体为相应的荧光素标记的小鼠IgG。制备第3 代hAMSCs 爬片,进行免疫组化染色检测波形蛋白。
1.2.2 模型制备 大鼠用7%水合氯醛腹腔麻醉(0.5 ml/100 g),固定于大鼠脑立体定位仪上,按Leaver 等[10]方法,参照大鼠脑立体定向图谱确定右侧前脑内侧束(medial forebrain bundle,MFB)坐标:前囟后4.6 mm,矢状缝左侧1.2 mm,颅骨骨膜下8.2 mm。用微量注射器3μl 6-OHDA(0.1% Vit C 临用前配制,浓度4 μg/μl)注入MFB,注射速度1 μl/min,留针15 min,退针速度为1 mm/min。建模后1 w,腹腔注射多巴胺受体激动剂APO 0.5 mg/kg(0.1% V it C 生理盐水临用时配制)诱导旋转,每周1 次连续4 w。若每次大鼠均以损毁侧下肢为支撑点向健侧(左侧)旋转,而且30 min 内平均旋转次数超过7 转/min,视为造模成功[11]。假手术组以生理盐水代替6-OHDA,其余操作同模型组。
1.2.3 实验分组与细胞移植 PD 模型大鼠随机分为模型组(model)、hAMSCs 原位移植组(in situ)和舌下静脉移植组(in vein),另设假手术组(sham)作为对照,每组10 只。取第3 代hAMSCs 用不含血清的L-DMEM 培养基悬浮,原位移植组于造模注射位点注射8 μl hAMSCs 悬液(含3×105个细胞),模型组同步注射等体积L-DMEM 培养基,静脉移植组注射的细胞数同原位移植组。
1.2.4 行为学观察 细胞移植后各组PD 大鼠每周定时腹腔注射APO(0.5 mg/kg)诱导PD 样症状,待大鼠旋转稳定后,摄像记录5 min 内大鼠旋转次数。连续诱导、观察10 w。
1.2.5 hAMSCs 存活及分化检测 分别于hAMSCs 移植后2 w 和12 w 每组取5 只大鼠,腹腔注射7%水合氯醛麻醉,经心插管依次用生理盐水和4%多聚甲醛后,取脑组织置于4%多聚甲醛4 ℃固定,梯度蔗糖脱水,原位移植区连续冰冻切片,片厚20 μm。切片经通透、封闭,滴加MAB1281 和MAP-2 抗体混合液4℃孵育过夜,用PBS 替代一抗作为对照。滴加PE 标记的羊抗小鼠IgG(针对MAB1281)与FITC 标记的羊抗兔IgG(针对MAP-2)混合液,DAPI 复染,甘油封片,荧光显微镜下观察。
1.2.6 酪氨酸羟化酶免疫组化染色 冰冻切片3%H2O2去离子水孵育10 min,PBS 漂洗,滴加TH 抗体(1∶300 稀释),4 ℃孵育过夜,PBS 漂洗,DAB 显色,冲洗,光学显微镜下观察。
1.2.7 统计学方法 采用SPSS 17.0 统计软件进行分析,数据以±s 表示,组间比较采用独立样本t 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 hAMSCs 形态及表型特征 hAMSCs 呈典型的贴壁生长特性,形态呈成纤维样,呈放射状或旋窝状生长(见图1A)。第3 代hAMSCs 表达间充质标志波形蛋白(见图1B)。流式细胞术分析结果显示,第3 代hAMSCs 几乎不表达CD34、CD19、CD14、CD45、CD80、CD86 和 HLA-DR,高表达 CD73、CD44、CD90 和CD105(见图2)。
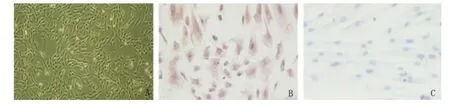
图1 hAMSCs 形态

图2 hAMSCs 流式细胞术表型分析
2.2 hAMSCs 移植后PD 大鼠行为学变化 假手术组无1 例出现旋转行为。hAMSCs 原位移植组和舌下静脉移植组大鼠于移植后2 w 开始旋转次数均明显减少(均P<0.05);至8 w,原位移植组大鼠旋转次数仍明显低于模型组(均P<0.05),而静脉移植组旋转次数6 w 则开始反弹,至7 w 已与模型组无明显差异(见图3)。
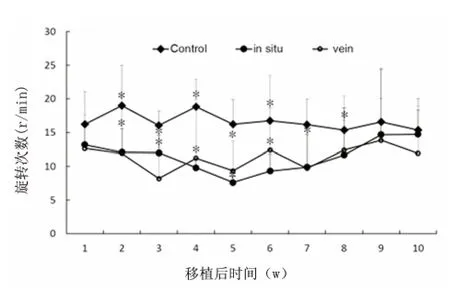
图3 hAMSCs 移植后PD 大鼠行为学变化
2.3 hAMSCs 在脑内存活与分化 hAMSCs 移植后2 w 和12 w,原位移植组移植区脑组织均可见人细胞核特异性抗原阳性细胞(呈红色荧光),其中部分阳性细胞表达MAP-2(呈绿色荧光)。静脉移植组以上两个时间点均未检测到人细胞核特异性抗原阳性细胞(见图4)。

图4 hAMSCs 原位移植后表达MAP-2(免疫荧光染色,×400)
2.4 酪氨酸羟化酶的表达 hAMSCs 移植后2 w,原位移植组大鼠黑质纹状体TH 表达为强阳性,静脉移植组为弱阳性,假手术组为强阳性,模型组无明显TH 表达。至移植后12 w 可见原位移植组和静脉移植组表达均下调(见图5)。

图5 各组大鼠黑质酪氨酸羟化酶的表达(免疫组化染色,×40)
3 讨论
MSCs 的分离、培养和鉴定是移植过程中重要的质控环节。本实验采用胰蛋白酶-胶原酶消化法分离,并通过贴壁培养纯化的第3 代hAMSCs 不表达CD14、CD19、CD34、CD45 和HLA-DR,高表达CD44、CD73、CD90 和CD105,完全符合国际细胞治疗协会(International Society for Cellular Therapy,ISCT)对MSCs 表型特征的界定[12]。实验进一步显示所分离hAMSCs 表达间充质标志波形蛋白,说明本实验中用于PD 大鼠治疗的hAMSCs 是典型的MSCs。
黑质DA 能神经元缺失是PD 主要的病理学特征。目前公认的PD 造模方法主要有两种:一种是经静脉或腹腔注射神经毒素MPTP 诱导建模;一种是于黑质纹状体或MFB 注入甲肾上腺素同系物6-OHDA 建立偏侧PD 模型[13]。这两种方法均可造成黑质DA 能神经元损毁。相对于前者而言,尽管后者操作难度较大,但细胞损伤严重,由此产生的偏侧旋转等一系列类似于人类PD 症状和特征性病变稳定、持久[14],更适合于较长时间的治疗实验观察。MFB是通过下丘脑外侧区的一束神经纤维,连接隔区、下丘脑和中脑的被盖部位,黑质致密部的DA 神经元的轴突可以通过MFB 投射到纹状体。本实验采用单侧MFB 注射6-OHDA 建立PD 大鼠模型,行为学动态观察显示,hAMSCs 原位移植组和舌下静脉移植组大鼠于移植后,2 w 开始旋转次数均明显减少;原位移植组大鼠行为学改善可维持至移植后8 w,而静脉移植组则只能维持至5 w。蔡哲等[15]报道hAMSCs 纹状体内移植后2 w,MPTP 诱导的PD 模型小鼠的运动行为有明显改善。本室早先的研究证明,hAMSCs 侧脑室移植可促进实验性自身免疫性脑脊髓炎模型大鼠病损神经组织的修复和改善运动功能[16]。还有报道,hAMSCs 静脉移植能改善阿尔茨海默病转基因小鼠的学习记忆能力[17]。这些研究结果表明,无论hAMSCs 原位移植还是静脉移植,对中枢神经系统退行性或免疫性疾病均有明显疗效。本实验结果显示,尽管静脉移植hAMSCs 对PD 模型大鼠行为学改善的效应不如病损原位移植持久,但从应用角度讲,“无创”静脉移植更简便安全。目前有关hAMSCs 治疗效应的检测时点多为移植后4 w 内,最多为1 m[18],其治疗效应究竟能持续多久尚不清楚。本实验连续10 w 的动态观察发现,静脉输注3×105hAMSCs 的治疗效应可维持5 w,原位移植可持续8 w,说明hAMSCs 治疗具有较长的效应期。细胞治疗的生物效应除取决于供体细胞生物学特性外,还受移植途径、移植细胞数、宿主机能状态、靶组织微环境、供体细胞在体内的命运等因素的影响。因此,进一步通过大动物疾病模型评价hAMSCs 量-效关系,以及靶组织微环境对hAMSCs 效应的反馈影响很有必要。
hAMSCs 在异基因宿体体内的存活、归巢、分化是学科界关注的重要问题。一般对hAMSCs 移植在宿主体内存活时间的观察周期为2~4 w,最长不超过6 w[18,19]。本实验观察到原位移植后12 w,移植区脑组织仍可见人细胞核特异性抗原阳性细胞,说明hAMSCs 在宿主靶组织至少可存活12 w。值得提出,本实验在未使用任何免疫抑制剂的情况下,hAMSCs 在大鼠体内存活较长时而不被排斥,说明hAMSCs 在异基因个体间移植具有良好的免疫豁免特性。表型分析结果显示,hAMSCs 不表达HLADR,也不表达共剌激分子CD80(B7-1)和CD86(B7-2)。也许正是这样的免疫表型特征赋予了hAMSCs的免疫豁免特性。本实验中未发现静脉移植组脑组织中有hAMSCs 存活的证据,这可能与舌下静脉移植后大量hAMSCs 滞留于肺组织有关[20]。体外实验证明,hAMSCs 在特定的诱导条件下可分化为神经元、胶质细胞和少突胶质细胞[21]。MAP-2 主要表达于成熟神经元的胞浆和树突。本实验发现原位移植区部分人细胞核特异性抗原阳性细胞表达MAP-2,提示原位移植的hAMSCs 可分化为DA 能神经元样细胞。TH 既是多巴胺合成的限速酶,也是DA 能神经元特异性标志之一,黑质TH 含量和活性降低及由此导致的DA 匮乏是PD 发病的主要环节[22]。实验进一步观察到模型组黑质纹状体无TH 表达,而原位移植组则明显表达,静脉移植组也有弱表达。提示hAMSCs 改善PD 模型大鼠运动行为可能与其促进黑质TH 表达有关。
关于hAMSCs 移植治疗神经损伤的机制尚不明确。一种推测是hAMSCs 移植到宿主体内没有归巢到病变部位,而是通过旁分泌机制修复病损神经组织;另一种推测是供体细胞移植或归巢到宿主受损神经,在靶组织微环境诱导下分化为神经细胞进行补偿性修复。已有研究提示,无论hAMSCs 是否定植于靶组织,通过旁分泌机制产生神经营养/调节因子、抑炎因子等可性溶性因子在促进病损神经组织的修复中都起着重要作用[8,23]。至于由hAMSCs 分化而来的神经元样细胞能否起到对病损部位神经元缺失的补偿,并重建新的神经环路,目前还缺乏证据,值得深入研究。
[1]Newman MB,Bakay RA.Therapeutic potentials of human embryonic stem cells in Parkinson’s disease[J].Neurotherapeutics,2008,5(2):237-251.
[2]Bjugstad KB,Teng YD,Redmond DE Jr,et al.Human neural stem cells migrate along the nigrostriatal pathway in a primate model of Parkinson’s disease[J].Exp Neurol,2008,211(2):362-369.
[3]邱 云,汪 铮,路红社.脐带间充质干细胞移植治疗帕金森病8例[J].中国组织工程研究,2011,15(36):6833-6836.
[4]Miki T,Strom S.Amnion-derived pluripotent/multipotent stem cells[J].Stem Cell Rev,2006,2(2):133-142.
[5]Niwa H,Masui S,Chambers I,et al.Phenotypic complementation establishes requirements for specific POU domain and generic transactivation function of Oct-3/4 inembryonic stem cells[J].Mol Cell Biol,2002,22(5):1526-1536.
[6]王公平,杨 波,关方霞,等.量子点标记神经生长因子纳米化颗粒修饰羊膜间充质干细胞移植治疗大鼠实验性脑损伤[J].中国组织工程研究与临床康复,2008,12(10):1806-1810.
[7]喻皇飞,方 宁,陈代雄,等.人羊膜间充质干细胞移植对大鼠脊髓损伤神经功能恢复的影响[J].中华神经外科杂志,2012,28(4):411-415.
[8]Pan HC,Yang DY,Chiu YT,et al.Enhanced regeneration in injured sciatic nerve by human amniotic mesenchymal stem cell[J].J Clin Neurosci,2006,13(5):570-575.
[9]张 路,方 宁,陈代雄,等.人羊膜间充质细胞具有向心肌样细胞分化的特性[J].中国生物工程杂志,2007,27(12):84-89.
[10]Leaver KR.,Allbutt HN,Creber NJ,et al.Oral pre-treatment with epigallocatechin gallate in 6-OHDA lesioned rats produces subtle symptomatic relief but neuroprotection[J].Brain Res Bull,2009,80(6):397-402.
[11]Truong L,Allbutt H,Kassiou M,et al.Developing a preclinical model of Parkinson’s disease:a study of behaviour in rats with graded 6-OHDA lesions[J].Behav.Brain Res,2006,169(1):1-9.
[12]Dominici M,Le BK,Mueller I,et al.Minimal criteria for difining multipotent mesenchymal stromal cells.The international Society for Celluar Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[13]王彦永,顾 平,王铭维.建立帕金森病动物模型的研究进展[J].中风与神经疾病杂志,2004,21(4):379-381.
[14]Litvan I,Halliday G,Hallett M,et al.The etiopathogenesis of Parkinson disease and suggestions for future research[J].J Neuropathol Exp Neurol,2007,66(4):251-257.
[15]蔡 哲,周忠蜀,向 青,等.人羊膜间充质细胞的生物学特性及其治疗帕金森模型小鼠的实验研究[J].中国康复理论与实践,2010,16(4):318-321.
[16]方 宁,李 丹,余丽梅,等.羊膜间充质干细胞对大鼠实验性自身免疫性脑脊炎的疗效及免疫调节作用[J].免疫学杂志,2014,30(1):6-12.
[17]李祥生,关方霞,李国栋,等.人羊膜间充质干细胞移植对阿尔茨海默病转基因小鼠的行为学和β-淀粉样蛋白的影响[J].中国组织工程研究与临床康复,2008,12(51):10068-10072.
[18]Parolini O,Caruso M.Review:Preclinical studies on placenta-derived cells and amniotic membrane:An update[J].Placenta,2011,25(32 Suppl B):S186-S195.
[19]方 宁,王钰莹,陈代雄,等.静脉移植人羊膜间充质干细胞改善大鼠心肌梗死后心功能[J].基础医学与临床,2013,33(12):1516-1522.
[20]Studeny M,Marini FC,Denbinski JL,et al.Mesenchymaly stem cells:potential precursors for tumor stroma and targeted delivery vehicles for auticancer agents[J].J Natl Cancer Inst,2009,96(21):1539-1603.
[21]史明霞,李维佳,李炳宗,等.人羊膜来源成体干细胞的多向分化潜能[J].生物工程学报,2009,25(5):754-760.
[22]Carvey PM,Punati A,Newman MB.Progressive dopamine neuron loss in Parkinson disease:the multiple hit hypothesis[J].Cell Transplant,2006,15(3):239-250.
[23]Paradowska E,Blach OZ,Gejdel E.Constitutive and induced cytokine production by human placenta and amniotic membrane at term[J].Placenta,1997,18(5-6):441-446.
