急性缺血性脑血管病患者血清ox-LDL 及PAPP-A水平与颈动脉粥样硬化的相关性研究
2015-03-11生晓娜张晓炜王斌斌艾田妹张国华
生晓娜,杨 扬,张晓炜,王斌斌,艾田妹,张国华
大动脉粥样硬化性卒中是临床上较为常见的卒中类型。短暂性脑缺血发作(TIA)被认为是脑梗死的危险信号,其中大约有三分之一患者最终发展为不可逆脑梗死,其发病也与动脉粥样硬化密切相关。动脉粥样硬化不稳定斑块破裂继发血栓形成和脱落栓子的栓塞是缺血性脑血管病的主要病理生理基础。氧化应激可以通过诱导、加剧炎症反应并与之交互作用导致斑块去稳定化和破裂。氧化型低密度脂蛋白(ox-LDL)可以通过损伤血管内皮细胞、促进病变区炎症反应及泡沫细胞的形成使斑块去稳定化,并能刺激血管内皮细胞和巨噬细胞表达基质金属蛋白酶(matrix metalloproteinase,MMP)[1]。已经证明,ox-LDL 所诱导的毒性反应贯穿于动脉粥样硬化发生直至血栓事件形成的整个过程[2]。妊娠相关血浆蛋白A(PAPP-A)作为MMP 锌指多肽超家族成员之一,以多种途径参与动脉粥样硬化斑块的去稳定化和破裂。目前PAPP-A 已被建议作为识别冠状动脉不稳定斑块的候选标志物[3,4],但其与颈动脉粥样硬化及急性缺血性脑血管病的关系,目前尚不明确。本文旨在研究血清ox-LDL 及PAPP-A 水平与动脉粥样硬化性缺血性脑血管病的关系,并探讨这两者之间是否存在相互作用以及对脑血管事件的预测作用。
1 资料和方法
1.1 一般资料 选择2011 年4 月~2011 年12 月期间于河北医科大学第二医院神经内科门诊和住院治疗的急性脑梗死患者90 例及TIA 患者60例作为研究对象。脑梗死患者均符合1995 年全国第四届脑血管病学术会议制定的《脑血管病诊断标准》中脑梗死的诊断要点,并经详细的病史采集、神经系统查体及颅脑CT 或MRI 等检查而确诊,病程均在72 h 以内,其中男51 例,女39 例,年龄45~78岁,平均59.44±10.64 岁,高血压者58 例,糖尿病者22 例,吸烟者24 例。TIA 患者均符合颈内动脉系统或椎-基底动脉系统及其分支的缺血性临床表现,符合美国心脏协会(AHA)/美国脑卒中协会(ASA)2009 年在新的指南中对TIA 的临床定义,经头部CT 或MRI 证实无相关责任病灶,距最后一次发作小于24 h,其中男38 例,女22 例,年龄47~82岁,平均58±11.86 岁,高血压者36 例,糖尿病者14例,吸烟者20 例。选择同期来我院体检中心的健康体检者30 例作为正常对照组,其中男20 例,女10例,年龄51~79 岁,平均60.6±8.32 岁,其中高血压者16 例,糖尿病者6 例,吸烟者9 例,CT 检查均无卒中影像学证据,病史中无TIA(见表1)。排除标准:(1)脑出血及脑梗死后出血者;(2)无症状性脑梗死及腔隙性脑梗死;(3)严重自身免疫性疾病及其所致的脑血管疾病;(4)严重的感染性疾病者;(5)有明确栓子来源的脑栓塞,包括感染性心内膜炎、心房纤颤、空气、脂肪及癌细胞栓塞及动脉-动脉栓塞等;(6)血管先天发育异常所导致的脑血管疾病:血管畸形或动脉瘤等;(7)高粘血症及各种凝血机制异常;(8)严重的心、肝、肾、血液系统疾病;(9)同时合并有急性冠脉综合征或周围血管性疾病;(10)其他原因不明的脑梗死;(11)临床以及生化检查资料不完整者。
所有入选患者及健康体检者均由其本人或监护者签署知情同意书,并提供血样,过程符合人权及人道主义和医学伦理。
1.2 方法
1.2.1 血液指标测定 住院患者于入院次日晨抽取空腹静脉血标本,门诊及体检者均空腹12 h抽取静脉血标本。所得标本一部分进行血常规、生化全项及凝血常规检查,另一部分分离血清后冻存于-80 ℃,用ELISA 法检测血清ox-LDL 及PAPP-A水平。ox-LDL 试剂盒购自美国Rapidbio(RB)公司,PAPP-A 试剂盒购自上海朗顿公司,严格按照说明书进行操作。
1.2.2 颈动脉超声检查 对入选的急性脑梗死和TIA 患者进行颈动脉超声检查。采用飞利浦IU 22 型彩色多普勒超声诊断仪,宽频变频线阵探头频率为7.5 MHz。颈动脉内-中膜厚度(IMT):正常值<1.0 mm;≥1.0 mm 为增厚;局部隆起增厚向管腔内突起,IMT≥1.5 mm 为内膜动脉粥样硬化斑块形成。根据颈动脉彩色多普勒超声检查显示斑块性质可以将斑块分为(1)均质的低回声脂质型软斑块;(2)均质等回声的纤维型斑块;(3)均质强回声或伴有声影的钙化型硬斑块;(4)不均质回声的溃疡型混合斑块。纤维型斑块和钙化型斑块属于稳定斑块,软斑块和混合斑块属于易损斑块。根据颈动脉彩色多普勒超声检查结果将患者分为IMT 正常组、IMT 增厚组、稳定斑块组和易损斑块组。
2 结果
2.1 急性缺血性脑血管病患者与正常对照组之间血清ox-LDL、PAPP-A 水平比较 急性脑梗死患者(90 例)血清PAPP-A、ox-LDL 水平明显高于TIA 组(60 例)(P<0.01),后者又高于正常对照组(30 例)(P<0.01),3 组血清ox-LDL 及PAPP-A 水平分别为523.4±207.4、451.1±166.8、339.5±136.9 μg/L 和7.52±3.39、5.68±2.22、3.98±1.90 mUI/L(见表2)。
2.2 颈动脉粥样硬化与血清ox-LDL 和PAPPA 水平的关系 颈动脉硬化组(81 例)血清ox-LDL及PAPP-A 水平明显高于IMT 增厚组(47 例)(P<0.01),后者又高于IMT 正常组(22 例)(P<0.01),3 组血清ox-LDL 及PAPP-A 水平分别为570.7±134.2、452.1±103.5、373.8±89.6 μg/L 和8.54±3.11、6.16±2.38、4.31±1.97 mUI/L(见表3)。
2.3 不同性质颈动脉斑块之间血清PAPP-A和ox-LDL 水平的比较 在颈动脉斑块形成患者中,易损斑块组血清PAPP-A 及ox-LDL 水平高于稳定斑块组(P<0.01),两组血清ox-LDL 及PAPP-A 水平分别为611.2±127.5、508.7±98.6 μg/L 和9.79±3.17、6.62±2.44 mUI/L(见表4)。
2.4 血清ox-LDL 和PAPP-A 水平的相关性分析 采用Spearman 分析检验ox-LDL 和PAPP-A 的相关性,结果显示:血清ox-LDL 和PAPP-A 水平存在相关关系(r=0.839,P<0.05)。
2.5 血清ox-LDL 及PAPP-A 水平与发生颈动脉粥样硬化的关系 分别以是否存在急性缺血性脑血管病和颈动脉粥样硬化为因变量,ox-LDL、PAPPA、性别、年龄、高血压病、高脂血症、糖尿病和吸烟作为自变量,采用Logistic 回归分析,发现ox-LDL、PAPP-A 与发生颈动脉粥样硬化关系密切(OR=2.549,95% CI 1.12~3.79;OR=1.317,95% CI 1.15~2.11)。

表1 研究对象的一般资料
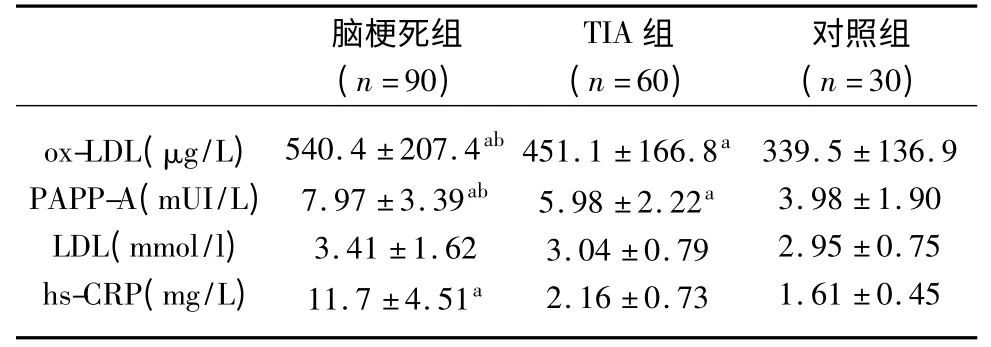
表2 脑梗死组、TIA 组以及对照组之间血液学指标的比较

表3 不同颈动脉病理改变下血清ox-LDL和PAPP-A 的比较

表4 易损斑块组和稳定斑块组之间血清ox-LDL和PAPP-A 的比较
3 讨论
氧化应激和慢性炎症反应贯穿于动脉粥样硬化发生发展的整个过程,两者之间具有相互协同作用。在各种危险因子的作用下,血管壁产生损伤,血管内皮通透性增强并大量释放氧自由基而形成氧化应激,循环中的LDL 向内皮下聚集的过程中被氧化修饰成为ox-LDL,从而导致脂纹的出现。脂纹的出现是产生动脉粥样硬化的第一步,也是最重要的一步[5]。ox-LDL 可以通过凝集素样ox-LDL 受 体(LOX-1)介导内皮细胞的激活和损伤从而导致炎症反应,并能介导单核细胞的募集、激活和向内皮下的迁移。这些单核细胞通过其表面的清道夫受体大量吞噬ox-LDL 而转化为巨噬细胞和泡沫细胞。ox-LDL 还可以抑制一氧化氮合酶的表达[6],诱导粘附分子的表达[7],刺激成纤维细胞表达胶原等细胞外基质[8],这些都促进斑块纤维帽的形成,使脂纹变为粥样斑块[8]。已有研究证明ox-LDL 可以激活血小板[9],ox-LDL 还通过刺激多种细胞包括内皮细胞、血管平滑肌细胞、白细胞、和血小板等产生氧自由基[10~12],从而加速动脉粥样硬化的进程。ox-LDL还可以促进基质金属蛋白酶(MMPs)的表达,后者属于锌指蛋白超家族成员,通过介导斑块细胞外基质中蛋白成分和以及靶细胞基膜的降解加速斑块破裂[13],并能促进狭窄部位血小板凝集而造成不良血管事件。研究表明,不仅循环中ox-LDL 的浓度,斑块局部的ox-LDL 含量也可以影响冠状动脉动脉粥样硬化斑块的稳定性[14]。局部病变越严重,病变处ox-LDL 阳性巨噬细胞的百分比越高[15]。本次研究发现,脑梗死急性期患者和TIA 患者血清ox-LDL 水平较对照组明显升高。与颈动脉IMT 正常组相比,颈动脉IMT 增厚组和斑块形成组血清ox-LDL 水平均明显升高,且以斑块形成组升高最为明显,其中不稳定斑块组又明显高于稳定斑块组,故而推测循环中ox-LDL 水平与颈动脉及脑动脉粥样硬化的进展及斑块破裂有关,且能在一定程度上反应局部病变的严重程度。
PAPP-A 是胰岛素样生长因子(IGF)轴的一员。作为锌结合金属蛋白酶的新成员,PAPP-A 可以特异性降解IGF 结合蛋白4 和5(IGFBP-4、5)释放IGF,进而激活IGF 受体和信号转导途径使斑块去稳定化,并且此降解过程是IGF 依赖性的。另有学者认为PAPP-A 也能像其他基质金属蛋白酶那样降解细胞外基质而导致斑块去稳定化。还有一些学者认为PAPP-A(单独或通过IGFs)介导炎症反应导致斑块去稳定化。总之,PAPP-A 可能以多种机制参与动脉粥样硬化形成及斑块的破裂过程。急性冠脉综合征(ACS)冠状动脉不稳定斑块破裂的同时,PAPP-A 也被释放入血使循环中PAPP-A 水平升高,这使得PAPP-A 有可能成为ACS 超早期的血清标志物。Bayes-Genis 等于2001 年首次阐明PAPP-A 是ACS 的候选标志物,并证明PAPP-A 在侵蚀斑块和破裂斑块中大量表达,而在稳定斑块中却少量表达[6]。Elseber 等观察到不稳定心绞痛和急性心肌梗死患者血清PAPP-A 水平显著高于正常人[16]。这些研究结果提示血清PAPP-A 水平升高反映了冠状动脉粥样硬化斑块的不稳定性,很可能是急性冠脉综合征的特异性标记物。然而PAPP-A 与颈部及颅内动脉粥样硬化斑块之间的关系,至今尚未被完全阐明。Sangiorgi 等[17]通过RT-PCR 证实PAPP-A mRNA 表达于局部颈动脉粥样硬化斑块,同时循环中PAPP-A 水平与颈动脉斑块纤维帽厚度呈负相关,与斑块局部炎症程度呈正相关。Heider 等[18]证实PAPP-A 可由局部颈动脉粥样硬化斑块(尤其是纤维帽)处被激活的巨噬细胞表达,斑块破裂时,PAPP-A 可被释放使血清PAPP-A 水平升高。故而推测PAPP-A 水平升高很可能发生于神经功能缺损症状出现之前,这使得PAPP-A 有可能成为一种超早期标志物。循环中PAPP-A 水平升高与血管造影所见复杂斑块[19]以及超声检查所见强回声或等回声斑块[20]之间均存在相关性。在本次研究中,脑梗死急性期患者及TIA 患者血清PAPP-A 水平均较对照组升高,在入选患者中颈动脉斑块组和颈动脉IMT 增厚组血清PAPP-A 均高于IMT 正常组,同时颈动脉斑块组又高于IMT 增厚组。对于颈动脉存在斑块者,不稳定斑块组血清PAPP-A 水平明显高于稳定斑块组。该结果提示血清PAPP-A 水平与颈动脉粥样硬化的进展程度成正相关,其水平升高可能是不稳定斑块形成的危险因素之一。
在本次研究中通过logistic 回归分析,显示ox-LDL 与PAPP-A 之间存在相关性。推测这两者在动脉粥样硬化进程中可能存在协同作用。据文献报道,ox-LDL 通过抑制miR-490-3p 上调PAPP-A 的表达,从而加速IGFBP-4 的分解[21]。但是否存在其他作用机制,仍需进一步研究。
综上所述,ox-LDL 和PAPP-A 可能参与了急性缺血性脑血管病和颈动脉粥样硬化的发生和进展,并能在一定程度上反映急性缺血性脑血管病患者颈动脉粥样硬化的程度。两者在促动脉粥样硬化的过程中,可能产生协同作用。检测血清中ox-LDL 和PAPP-A 水平可能提示急性缺血性脑血管病的早期发生。积极寻找降低ox-LDL 和PAPP-A 的治疗措施,可能会对急性缺血性脑血管病以及颈动脉粥样硬化的防治产生积极作用。
[1]Hagemann C,Anacker J,Ernestus RI,et al.A complete compilation of matrix metalloproteinase expression in human malignant gliomas[J].World J Clin Oncol,2012,3(5):67-79.
[2]Mitra S,Deshmukh A,Sachdeva R,et al.Oxidized low-density lipoprotein and atherosclerosis implications in antioxidant therapy[J].Am J Med Sci,2011,342(2):135-142.
[3]Lund J,Qin QP,Llva T,et al.Circulating Pregnancy-Associated Plasma Protein A Predicts Outcome in Patients With Acute Coronary Syndrome but No Troponin I Elevation[J].Circulation,2003,108(16):1924-1926.
[4]von Haehling S,Doehner W,Jankowska EA,et al.Value of serum pregnancy-associated plasma protein A for predicting cardiovascular events among patients presenting with cardiac chest pain[J].CMAJ,2013,185(7):295-303.
[5]Mitra S,Goyal T,Mehta JL.Oxidized LDL,LOX-1 and Atherosclerosis[J].Cardiovasc Drugs Ther,2011,25(5):419-429.
[6]Cominacini L,Rigoni A,Pasini AF,et al.The binding of oxidized low density lipoprotein(oxLDL)to oxLDL receptor-1 reduces the intracellular concentration of nitric oxide in endothelial cells through an increased production of superoxide[J].J Biol Chem,2001,276(17):13750-13755.
[7]Chen H,Li D,Saldeen T,et al.Transforming growth factor-beta modulates oxidatively modified LDL-induced expression of adhesion molecules:role of LOX-1[J].Circ Res,2001,89(12):1155-1160.
[8]Hu C,Dandapat A,Sun L,et al.Regulation of TGFbeta1-mediated collagen formation by LOX-1:studies based on forced overexpression of TGFbeta1 in wild-type and lox-1 knock-out mouse cardiac fibroblasts[J].J Biol Chem,2008,283(16):10226-10231.
[9]Marwali MR,Hu CP,Mohandas B,et al.Modulation of ADP induced platelet activation by aspirin and pravastatin:role of lectin-like oxidized low-density lipoprotein receptor-1,nitric oxide,oxidative stress,and inside-out integrin signaling[J].J Pharmacol Exp Ther,2007,322(3):1324-1332.
[10]Roy Chowdhury SK,Sangle GV,Xie X,et al.Effects of extensively oxidized low-density lipoprotein on mitochondrial function and reactive oxygen species in porcine aortic endothelial cells[J].Am J Physiol Endocrinol Metab,2010,298(1):89-98.
[11]Hsieh CC,Yen MH,Yen CH,et al.Oxidized low density lipoprotein induces apoptosis via generation of reactive oxygen species in vascular smooth muscle cells[J].Cardiovasc Res,2001,49(1):135-145.
[12]Bae YS,Lee JH,Choi SH,et al.Macrophages generate reactive oxygen species in response to minimally oxidized low-density lipoprotein:toll-like receptor 4-and spleen tyrosine kinase dependent activation of NADPH oxidase 2[J].Circ Res,2009,104(2):210-218.
[13]Hagemann C,Anacker J,Ernestus RI,et al.A complete compilation of matrix metalloproteinase expression in human malignant gliomas[J].World J Clin Oncol,2012,3(5):67-79.
[14]Yang H,Mohamed AS,Zhou SH,et al.Oxidized low density lipoprotein,stem cells,and atherosclerosis[J].Lipids Health Dis,2012,11:85.
[15]Ehara S,Ueda M,Naruko T,et al.Elevated levels of oxidized low density lipoprotein show a positive relationship with the severity of acute coronary syndromes[J].Circulation,2001,103(15):1955-1960.
[16]Elesber AA,Conover CA,Denktas AE,et al.Prognostic value of circulating pregnancy associated plasma protein levels in patients with chronic stable angina[J].Eur Heart J,2006,27(14):1678-1684.
[17]Sangiorgi G,Mauriello A,Bonanno E,et al.Pregnancy-associated plasma protein-A is markedly expressed by monocyte-macrophage cells in vulnerable and ruptured carotid atherosclerotic plaques:a link between inflammation and cerebrovascular events[J].J Am Coll Cardiol,2006,47(11):2201-2211.
[18]Heider P,Pfaffle N,Pelisek J,et al.Is Serum Pregnancy-Associated Plasma Protein A Really a Potential Marker of Atherosclerotic Carotid Plaque Stability[J].Eur J Vasc Endovasc Surg,2010,39(6):688-675.
[19]Cosin SJ,Christiansen M,Kaminski P,et al.Pregnancy-associated plasma protein A and its endogenous inhibitor,the proform of eosinophil major basic protein(proMBP),are related to complex stenosis morphology in patients with stable angina pectoris[J].Circulation,2004,109(14):1724-1728.
[20]Beaudeux JL,Burc L,Imbert BF,et al.Serum plasma pregnancy associated protein A:a potential marker of echogenic carotid atherosclerotic plaques in asymptomatic hyperlipidemic subjects at high cardiovascular risk[J].Arterioscler Thromb Vasc Biol,2003,23(1):7-10.
[21]Sun Y,Chen D,Cao L,et al.MiR-490-3p modulates the proliferation of vascular smooth muscle cells induced by ox-LDL through targeting PAPP-A[J].Cardiovasc Res,2013,100(2):272-279.
