应用噬菌体展示7 肽文库技术进行蓝舌病1 型病毒VP2 蛋白表(拟)位分析
2015-03-09熊和丽宋建领王金萍苗海生李华春
熊和丽,宋建领,王金萍,苗海生,李华春
(云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
蓝舌病是由蓝舌病病毒(Bluetongue virus,BTV)引起的严重危害牛、羊等反刍动物的虫媒病毒病,在热带、亚热带及温带地区分布广泛。该病主要侵害绵羊,尤其对纯种细毛羊敏感,发病率约30 %,部分血清型死亡率高达80 %。BTV 属于呼肠孤病毒科环状病毒属病毒,病毒粒子呈二十面体对称,由10 个分节段的双股RNA 组成,病毒基因组由19 200 bp 组成,编码7 种结构蛋白(VP1-VP7)和4种非结构蛋白(NS1、NS2、NS3a 和NS3b),总分子量为1.3×104ku,是迄今认为分子量最大的RNA 病毒[1]。病毒颗粒外层衣壳由VP2 和VP5 两种蛋白组成,其中VP2 由L2 基因编码,是病毒的主要型特异性抗原和血凝素蛋白[2],与病毒的毒力、受体结合[3-5]、细胞吸附作用和宿主特异性免疫有关[6-7],VP2 蛋白长956 个氨基酸、不同血清型VP2 序列差异最大,约占病毒总蛋白的40 %。因此,对VP2蛋白表位的研究具有重要的意义,将对构建有效的亚单位疫苗、型特异性诊断方法提供科学依据,为该病的防控奠定理论基础。本研究在获得BTV1 特异性抗体的基础上,应用BTV1 特异性抗体淘选M13 噬菌体展示的7 肽随机肽库,获得与BTV1 特异性抗体结合的噬菌体拟位,比对分析噬菌体拟位的共有序列,在病毒VP2 蛋白中查找相同(似)区域,结合不同噬菌体拟位与BTV1 特异性抗体的免疫反应性分析结果,进行VP2 蛋白表(拟)位分析。
1 材料和方法
1.1 主要实验材料 利用蔗糖密度梯度离心纯化BTV1病毒,将纯化的病毒用MEM 液稀释为50 μg/mL 抗原含量,灭活、乳化,免疫绵羊,制备BTV1 高免血清,经硫酸铵沉淀法纯化,纯化后血清中和效价为1∶512,并且与其他血清型BTV 无交叉反应。
蓝舌病阴性对照抗体和BTV 由本实验室保存;包被重组蛋白G 的磁性珠、噬菌体展示的7 肽随机肽库和ER2738 大肠埃希氏菌购自美国Beverly New England 生物实验室;辣根过氧化物酶(HRP)标记的鼠抗M13 抗体购自Amersham-Pharmacia 公司。
1.2 肽库库容量滴定及评价 利用TBS 将待滴定肽库作10-1~10-12稀释,取100 μL 稀释液与100 μL处于对数生长期的ER2738 大肠埃希氏菌悬液混合,室温孵育20 min 后,加至3 mL 融化后于42 ℃水浴箱保温的Agarose Top(顶层琼脂糖营养液),立即涂布LB/Agar/Tet/X-gal/IPTG 平板,37 ℃过夜培养,滴定噬菌体蚀斑形成单位(pfu),计算噬菌体浓度。随机挑选20 个蓝色的孤立蚀斑对携带的插入序列进行测序,评价7 肽插入序列的随机性和肽库的库容量。
1.3 生物淘选 参照7 肽随机肽库试剂盒说明及文献[8]的方法进行,并做部分调整。10 μL BTV 1 型特异性抗体、30 μL 噬菌体肽库(约含9×1010pfu)及160 μL 含2 %脱脂奶粉的TBS(pH7.5)混合,室温震荡孵育30 min,与蛋白G 包被磁性珠混合,室温震荡孵育20 min,缓冲液洗涤,用100 μL 0.2 mol/L HCl(pH2.2)溶液(含1 mg/mL BSA)洗脱结合于磁性珠上的噬菌体,并迅速中和至中性。对每一轮淘选获得的洗脱液,除少量稀释后按1.2 方法涂布平板,其余用ER2738 增殖、纯化后,进行下一轮淘选。第2 轮和第3 轮分别使用5 μL 和2 μL BTV1 型 特异性抗体,以增强淘选的特异性。经3 轮“淘选--扩增--淘选”,可富集与BTV1 型特异性抗体特异性结合的噬菌体。
1.4 噬菌体克隆的ELISA 检测 在第3 轮淘选后涂布的平板上分别随机挑选48 个孤立的蓝色噬菌体蚀斑,增殖培养后,以BTV1 特异性抗体及阴性对照BTC 阴性抗体为包被抗体,HRP 标记的鼠抗M13 抗体为检测抗体,OPD 为底物,进行ELISA 检测。当样品针对BTV1 特异性抗体OD490nm值与针对阴性抗体的OD490nm值存在2 倍或2 倍以上差异时,判为阳性。
1.5 外源插入多肽序列分析 根据野生型噬菌体pIII 基因中对所有fd-tet 衍生载体均保守的区域,设计引物 FUSE-U:5'-GCAAGCTGATAAACCGATA C-3'/FUSE-D:5'-CCATGTACCGTAACACTGAG-3',经PCR 扩增包含外源插入多肽序列(7 肽编码序列)的基因片段(产物大小约330 bp),PCR 产物纯化后,以FUSE-D 为引物进行测序。采用DNAMAN Version 5.2.2 软件进行序列比对,分析7 肽序列中的共有序列。
1.6 竞争性ELISA 以BTV1 特异性抗体为包被抗体,BTV1 和BTV16 抗原为竞争剂或阻断剂,同时设BHK 细胞冻融裂解液为缓冲液对照,HRP 标记的抗M13 抗体为检测抗体,OPD 为底物,对噬菌体拟位进行竞争性ELISA 分析。检测OD490nm值。按以下公式计算抑制率:抑制率(%)=(OD490nm缓冲液对照-OD490nm试验)/OD490nm缓冲液对照×100 %。设置阳性、阴性及空白对照,同步进行。
2 结果
2.1 噬菌体展示随机肽库的库容量评价 通过肽库库容量滴定,显示肽库噬菌体浓度为8.8×1011pfu/mL。随机挑选20 个克隆的序列比对分析结果显示:20个噬菌体克隆中有1 个无插入序列,其余19 个克隆展示的7 肽序列各不相同,并且序列与序列之间无相同(相似或共有)序列。
2.2 BTV1 特异性抗体淘选获得噬菌体克隆的ELISA分析 BTV1 特异性抗体第3 轮淘选获得的噬菌体洗脱液,经稀释涂布培养后,随机挑选96 个蚀斑增殖培养,经ELISA 检测与BTV1 特异性抗体发生特异性结合的噬菌体克隆,结果显示58 个噬菌体克隆为阳性,部分检测结果见图1。
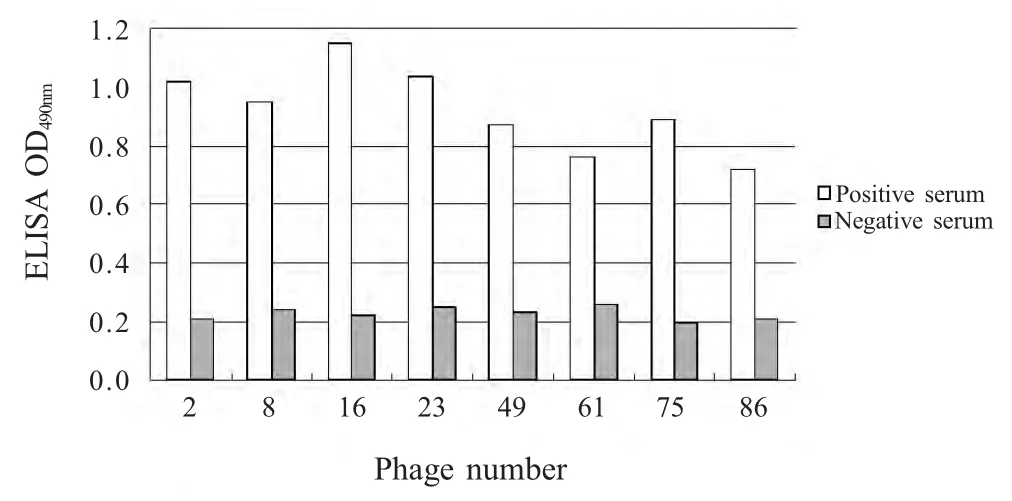
图1 BTV1 特异性抗体淘选后噬菌体克隆ELISA 分析Fig.1 ELISA analysis of phage clones after panning by serotype-specific antibody against BTV1
2.3 阳性噬菌体克隆外源插入序列的PCR 扩增挑选24 个阳性噬菌体克隆,经PCR 扩增包含外源插入序列(7 肽编码序列)的基因片段,分别获得大小约330 bp 的扩增产物(图2)。
2.4 阳性噬菌体克隆展示的7 肽序列比对分析对第3 轮淘选后的24 个阳性噬菌体,经PCR 扩增纯化后进行测序,根据获得的核苷酸序列推导7 肽氨基酸序列,结果表明24 个阳性克隆展示的7 肽氨基酸序列在有11 种不同的7 肽序列,TPNDHQT 11个(11/24)、SPNSSDK 4 个(4/24)、TSTPNEQ 1 个(1/24)、TTTPNAT 1 个(1/24)、TTTPNSF 1 个(1/24)、MTTPNDK 1 个(1/24)、TPNDHQT 1 个(1/24)、FKQNPNQ 1 个(1/24)、AVKDNVS 1 个(1/24)、QPDASNN 1 个(1/24)、PYNKYAP 1 个(1/24)。含有共有序列TPN 的有16 个7 肽序列,共有序列PN 的有21 个7 肽序 列(表1)。经比较分析,在BTV1 VP2蛋白的第865 位氨基酸至873 位氨基酸序列为865THPNKCLVA873,与获得BTV1 特异性抗体识别的共有序列TPN 相似。
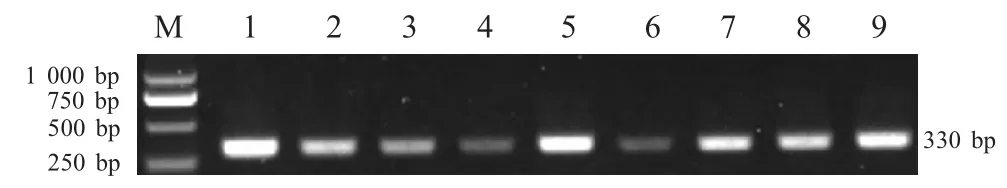
图2 阳性噬菌体克隆插入序列PCR 扩增Fig.2 PCR amplification of insert sequence from positive phage clones
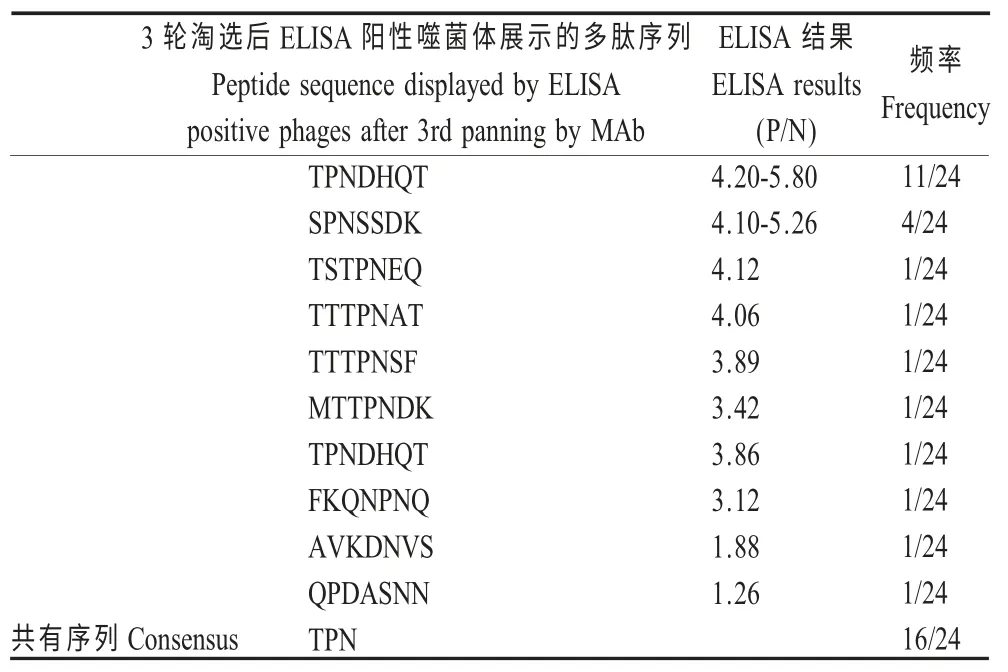
表1 淘选后噬菌体展示的7 肽序列比对分析Table 1 Alignment of peptide sequences displayed by phage after panning
2.4 竞争性ELISA 检测 对噬菌体拟位(TPNDHQT)进行竞争性ELISA 分析,结果显示:在缓冲液空白对照成立的前提下,噬菌体拟位(TPNDHQT)与BTV1 特异性抗体间的结合,能够被BTV1 特异性抑制或阻断,抑制率随病毒抗原浓度降低而降低,而不能被BTV16 抑制或阻断(图3)。BTV1 VP2蛋白865THPN868与淘选的噬菌体共有序列TPN 相似。BTV 其他22 个亚型病毒阻断结果证明:BTV12 和BTV22 也能阻断7 肽TTTPNSF 与BTV1 阳性血清的结合,其他20 个血清型BTV 均不能阻断7 肽TTTPNSF 与BTV1 阳性血清的结合。
3 讨论
图3 噬菌体拟位(KVMDRWL)竞争性ELISA 分析Fig.3 Analysis of phage mimotope(NLPHLRTHTALS)by competitive ELSIA
VP2 蛋白是BTV 主要型特异性抗原,大多数能够诱导产生中和抗体的抗原表位均存在于VP2 蛋白上,国内有采用单克隆抗体进行BTV VP2 抗原表位鉴定的报告[8-9]。采用多克隆抗体也可筛选获得具有免疫原性的噬菌体克隆,Mennuni 等采用糖尿病恢复期病人血清中的免疫球蛋白获得多个对糖尿病特异的多肽片段[10]。采用分子生物学软件预测病毒蛋白可能的表位区域,需要进一步研究确证。采用噬菌体肽库进行病毒表位分析,可获得表位及其关键性氨基酸准确定位结果[11]。
本研究采用针对BTV1 特异性抗体淘选获得共有序列TPN 与BTV1 VP2 蛋白865THPN868与淘选的噬菌体共有序列TPN 相似。经ELISA、竞争性ELISA 分析,携带TPN 基序的噬菌体能与BTV1 特异性抗体发生特异性结合,并且该结合能被天然病毒抗原特异性抑制或阻断,表明TPN 序列及其侧翼序列真实模拟病毒蛋白上与BTV1 特异性抗体结合的抗原决定簇或表位的结构和功能,提示BTV1 VP2 蛋白865THPN868氨基酸区域构成BTV1 特异性表位。使用BTV1~24 的24 个血清型病毒对噬菌体拟位TTTPNSF 进行阻断分析,结果表明BTV12 和BTV22 也能阻断7 肽TTTPNSF 与BTV1 阳性血清的结合,其他21 个血清型BTV 均不能阻断7 肽TTTPNSF 与BTV1 阳性血清的结合。通过序列比对分析,发现BTV1、BTV12、BTV22 的VP2 蛋白均含有共有序列TPN,但其他21 个血清型BTV VP2蛋白均不含有共有序列TPN,BTV1、BTV12 和BTV22 可能存在共有的表位氨基酸序列。这与Maan 等研究结果不同血清型BTV 具有相同的核酸型相一致[12]。本研究结果将为BTV1 基因工程疫苗开发和型特异性诊断方法的建立奠定基础。
[1]Roy P.Bluetongue virus:Dissection of the polymerase complex[J].J Gen Virol,2008,89:1789-1804.
[2]Cowley J A,Gorman B M.Genetic reassortants for identification of the genome segment coding for the bluetongue virus hemagglutinin[J].Virol,1987,61(7):2304-2306.
[3]Zhang Xing,Boyce M,Bhattacharya B,et al.Bluetongue virus coat protein VP2 contains sialic acid-binding domains,and VP5 resembles enveloped virus fusion proteins[J].PNAS,2010,107(14),6292-6297.
[4]Eaton B T,Crameri G S.The site of bluetongue virus attachment to glycophorins from a number of animal erythrocytes[J].J Gen Virol,1989,70:3347-3353.
[5]Hassan S H,Roy P.Expression and functional characterization of bluetongue virus VP2 protein:Role in cell entry[J].Virol,1999,73(12):9832-9842.
[6]Marshall J J,Roy P.High level expression of the two outer capsid proteins of bluetongue virus serotype 10:their relationship with the neutralization of virus infection[J].Virus Res,1990,15(3):189-195.
[7]Pierce C M,Rossitto P V,MacLachlan N J.Homotypic and heterotypic neutralization determinants of bluetongue virus serotype 17[J].Virol,1995,209(1):263-267.
[8]孙晶,孙成恩,刘二战,等.蓝舌病病毒3 型VP5 蛋白单克隆抗体的制备及其抗原表位鉴定[J].中国预防兽医学报,2014,36(5):387-390.
[9]席娜,赵国辉,孙成恩,等.蓝舌病病毒8 型VP2 蛋白单克隆抗体的制备及其抗原表位鉴定[J].中国预防兽医学报,2014,36(4):318-322.
[10]Mennuni C,Santini C.Selection of phage-displayed peptides mimicking type 1 diabetes-specific epitopes[J].J Autommun.1996,9:431-436.
[11]宋建领,张文东,张富强,等.禽流感病毒M1 蛋白型特异性表位分析[J].中国人兽共患病学报,2008,24(07):626-630.
[12]Maan S,Maan N,Samuel A,et al.Analysis and phylogenetic comparisons of full-length VP2 genes of the 24 bluetongue virus serotype[J].J Gen Virol,2007,88:621.
