肠炎沙门氏菌非编码小RNA STnc640 对菌毛相关基因的调控分析
2015-03-09孟宪臣朱春红王金秋王勇祥朱国强
孟 霞,孟宪臣,朱春红,王 亨,王金秋,倪 杰,王勇祥,朱国强
(1.扬州大学 兽医学院,江苏 扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;3.江苏省家禽科学研究所 家禽遗传育种重点实验室,江苏 扬州 225125;4.北京农业职业学院 畜牧兽医系,北京 102442)
肠炎沙门氏菌(Salmonella enteritidis,SE)是一种重要的人畜共患病原菌,可以长期定居于家禽的肠道和生殖道,并长时间排毒[1-2],呈现隐性感染,同时也可表现为有临床症状的致死疾病,严重影响养殖业的经济效益。SE 致病性取决于其宿主特异性肠吸附菌毛(黏附素)介导的定居能力和毒素产生能力,黏附素通过与宿主肠上皮细胞表面受体结合,使SE定居于特定段小肠并局灶性大量增殖,同时介导宿主细胞信号传递和适当途径的毒素传递,从而引发机体一系列的病理过程[3]。因此,黏附是SE 感染机体至关重要的第一步。SE 基因组包含13 个菌毛相关的操纵子以及外膜蛋白ompD 基因等,其编码蛋白均不同程度地参与了黏附和定植宿主小肠上皮细胞的过程[4-5]。
细菌非编码小RNA(Small non-coding RNA,sRNA)为一类在基因组中被转录但不编码蛋白的RNA 分子[6]。绝大多数sRNA 的主要作用方式是通过碱基的不完全互补配对与靶标mRNA 结合在5' 或3' 非翻译区(UTR),调控靶标mRNA 的翻译、降解或稳定性[7],其具有调节速度快,消耗能量少,可在转录后水平调控等优点[6-7]。STnc640 是鼠伤寒沙门氏菌中的一种sRNA[8],目前STnc640 的功能尚未见报道。作者前期研究发现SE 中也存在STnc640 基因,靶标基因预测表明STnc640 可能调控菌毛相关基因的表达。因此,本研究通过构建stnc640 缺失突变株及相应的回补株,进一步分析STnc640 在SE 主要菌毛亚单位基因表达中的作用,为STnc640 在菌毛基因以及毒力调控方面的研究提供实验依据。
1 材料和方法
1.1 菌株及质粒 SE 国内标准株CMCC(B)50336、大肠杆菌DH5α 及表达质粒pBR322 均由本实验室保存;Red 同源重组[9-10]所需质粒包括:含有温度敏感复制子的同源重组辅助质粒pKD46,该质粒经阿拉伯糖诱导后可表达Gam、Beta 和Exo 3 个λ 噬菌体重组酶;pKD3 为重组转化子提供筛选标志,含氯霉素抗性(Cmr)基因和FRT 位点(FLP 重组酶识别位点);pCP20 为含氨苄青霉素抗性(Ampr)和Cmr基因的温度敏感型质粒,42 ℃诱导下可表达FLP 重组酶,以消除FRT 位点间的Cm 基因。以上质粒均由美国宾夕法尼亚大学兽医学院微生物实验室馈赠。
1.2 主要试剂 pMD18-T 载体、Taq DNA 聚合酶、Prime Script RT reagent Kit with gDNA Eraser、荧光定量PCR(qRT-PCR)试剂盒、DNA Marker DL2000均购自TaKaRa 公司;DNA 凝胶回收试剂盒购自天根生化科技(北京)有限公司;MicroPulser Electroporator 购 自Bio-Rad 公司。
1.3 Red 同源重组构建stnc640 突变株
1.3.1 引物设计及同源重组打靶DNA 片段的制备和纯化 根据GenBank 中登录的SE P125109 株stnc640 基因上下游序列设计引物P1/P2,用于克隆SE 标准株50336 中stnc640 的DNA 序列。根据 测序结果设计用于Red 同源重组的引物P3/P4,其中5'端下划线处的序列与stnc640 两侧的序列同源,3' 端无下划线的序列与质粒pKD3 的Cmr基因的序列互补。引物P1/P2 也用于基因缺失菌株的鉴定。引物均由上海基康生物技术公司合成(表1)。以质粒pKD3 为模板,P3/P4 为引物,PCR 扩增同源重组打靶DNA 片段。PCR 产物经琼脂糖凝胶电泳检测回收后测定浓度。
1.3.2 Red 重组功能的诱导和第一次同源重组 将pKD46 质粒热击转化至SE50336 株感受态细胞,利用Ampr(50 μg/L)LB 培养基筛选单个菌落并鉴定,鉴定正确的阳性克隆经30 mmol/L L-阿拉伯糖诱导,充分表达Exo、Bet 和Gam 蛋白后制备成电转化感受态细胞,然后将1.3.1 中制备的同源重组打靶DNA 片段电转化入其中,利用CmrLB 平板筛选单菌落,然后分别进行Ampr和Cmr检测,挑选对Amp 敏感而Cmr的克隆,重组菌命名为SE50336△stnc640::cat。

表1 PCR 引物序列和扩增片段大小Table 1 The primers for the PCR and the sizes of PCR products
1.3.3 FLP 位点专一性重组 将质粒pCP20 转化至重组菌SE50336△stnc640::cat 的感受态细胞中,转化产物涂布于含Ampr和Cmr的LB 平板上,30 ℃培养筛选阳性转化子,然后将获得的阳性转化子转接至无抗性的LB 中,42 ℃培养过夜,37 ℃划线培养分离单菌落,并对其进行Ampr和Cmr检测,筛选对两种抗生素均敏感的突变株SE50336△stnc640,进一步对其进行PCR 和测序鉴定。
1.4 回补株的构建 以亲本株SE50336 基因组DNA 为模板,采用引物P5/P6 扩增stnc640,经测序验证后克隆至表达载体pBR322 中,将鉴定正确的重组质粒pBR-stnc640 电转化至突变株SE50336△stnc640 中,构建回补株50336△stnc640/p stnc640。
1.5 不同生长时期STnc640 表达水平检测 根据SE STnc640 序列和解旋酶gyrA 内参基因序列设计qRT-PCR 引物(表1)。将亲本株50336 接种于普通LB 液体培养基中培养至菌液OD600nm分别为0.5、1.0、1.5、2.0、2.5 和3.0 时,收集菌液提取RNA,以gyrA 的表达量为内参,进行qRT-PCR 检测STnc640在细菌不同生长时期的表达水平。
1.6 黏附相关基因表达量的检测 根据发表的SE主要菌毛亚单 位sefA、safA、stbA、sthA、csgA、csgD、pegA 和外膜蛋白ompD 基因设计qRT-PCR 引物(表1)。将亲本株SE50336、突变株SE50336△stnc640 及回补株SE50336 △stnc640/p stnc640 培养至OD600nm值为2.5 时,收集菌液,提取RNA 进行qRT-PCR,检测3 个菌株中菌毛相关基因和外膜蛋白ompD 基因的表达情况。采用2-△△Ct法计算突变株与亲本株的差异,试验重复3 次。
2 结果
2.1 stnc 640 基因缺失菌株的构建及鉴定 以pKD3 质粒为模板,P3/P4 为引物PCR 扩增同源重组打靶DNA 片段,结果显示目的片段约为1.1 kb,与预期大小一致(图1),该产物两端为同源臂,与stnc640 基因上下游序列同源,中间为Cmr基因片段。将PCR 产物转入含质粒pKD46 的SE50336 株中,通过CmrLB 固体培养基筛选阳性克隆,采用引物P1/P2 进行PCR 鉴定,结果显示,以亲本株和stnc640 一次重组菌为模板的PCR 产物分别约为800 bp和1 500 bp(图1),表明获得具有Cmr的重组子50336△stnc640::cat。
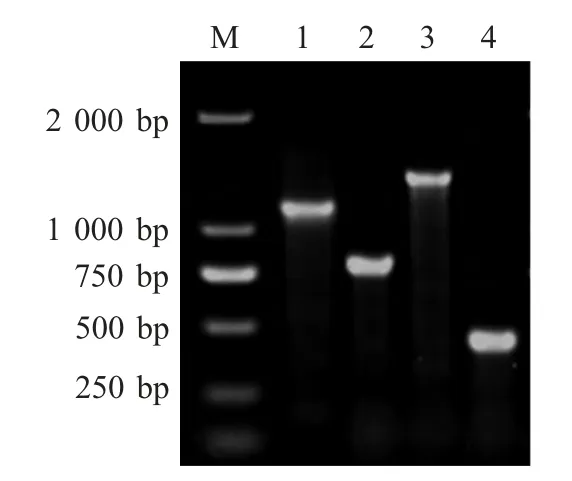
图1 stnc640 缺失突变株的构建Fig.1 Construction of stnc640 deletion mutant
2.2 缺失菌株中抗药基因的敲除及鉴定 将质粒pCP20 转化于重组子50336△stnc640::cat 中,诱导重组酶的表达,筛选对Amp 和Cm 均敏感的菌株,采用引物P1/P2 对筛选的单菌落进行PCR 扩增并经琼脂糖凝胶电泳检测,结果显示缺失了抗性基因的重组菌PCR 产物约为400 bp(图1),测序结果显示缺失株Cmr基因丢失,仅在同源序列区中留下FRT 位点,表明SE50336△stnc640 缺失突变株构建正确。
2.3 回补质粒和回补株的构建 以SE50336 基因组DNA 为模板,PCR 扩增stnc640 基因,将PCR 产物克隆于表达载体pBR322 中,构建回补质粒pBRstnc640,并对其进行双酶切鉴定(图2)。将鉴定正确的回补质粒pBR-stnc640 转化于缺失突变株50336△stnc640 中,构建回补菌株50336△stnc640/p stnc640。
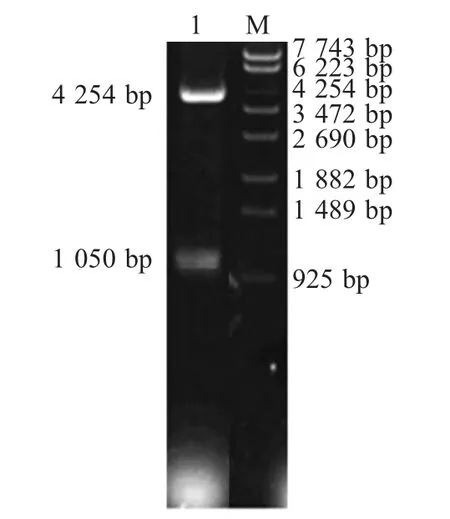
图2 回补质粒pBR-stnc640 的双酶切鉴定Fig.2 Enzyme digestion analysis of pBR322-stnc640
2.4 不同生长时期STnc640 表达水平检测 利用qRT-PCR 检测亲本株SE50336 内STnc640 在细菌不同生长时期的表达量。结果显示,随着时间的延长,STnc640 表达量逐渐升高,并且在稳定期(OD600nm=2.5)表达量最高(图3),为对数早期(OD600nm=0.5)表达量的16.5 倍,因此选择该时期进行STnc640 功能研究。
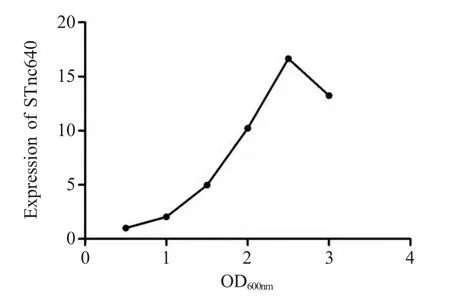
图3 亲本株50336 STnc640 在不同生长时期的表达情况Fig.3 Expression characteristics of STnc640 at different growth phase in the parental strains
2.5 Stnc640 调控黏附相关因子的表达 利用qRT-PCR 方法对亲本株SE50336、50336△stnc640 和50336 △stnc640/p stnc640 中主要菌毛亚单位sefA、safA、stbA、sthA、csgA、csgD 和pegA 以及外膜蛋白基因ompD 的表达水平进行检测。结果显示,相比亲本株,50336△stnc640 中菌毛亚单位sefA、csgD和外膜蛋白ompD 的表达均显著下调,mRNA 水平分别为亲本株的27.1 %、54 %和37 %,而50336△stnc640/p stnc640 中以上各基因的表达均得到恢复。其余基因无明显变化(图4)。
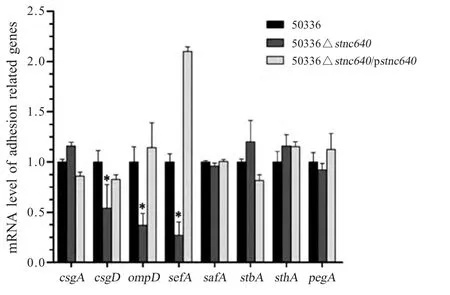
图4 50336、50336△stnc640 和50336△stnc640/p stnc640 菌株中黏附相关基因的mRNA 水平Fig.4 The adhesion related genes mRNAs levels of 50336,50336△stnc640 and 50336△stnc640/p stnc640 strains
3 讨论
本研究克隆了SE50336 菌株的stnc640 基因,构建了stnc640 基因缺失突变株50336△stnc640 和回补株50336△stnc640/p stnc640,分析了STnc640 在细菌生长不同时期的表达情况以及该sRNA 对黏附相关因子的调控情况。结果显示,STnc640 在稳定期后期表达量较高,因此选择该时期细菌,利用qRT-PCR 检测了亲本株、突变株和回补株主要菌毛亚单位sefA、safA、stbA、sthA、csgA、csgD、pegA和外膜蛋白ompD 的表达情况。结果显示,相比亲本株,50336△stnc640 中菌毛亚单位sefA、csgD 和外膜蛋白ompD 均表现下调,mRNA 水平分别为亲本株的27.1 %、54 %和37 %,其余基因无明显变化,表明STnc640 可以增强sefA、csgD 和ompD 的表达。sefA 是SEF14 菌毛主要亚单位基因,主要分布于D 血清型沙门氏菌中[11],该基因与SE 毒力相关,sefA 基因的缺失导致细菌对猪空肠上皮细胞系IPEC-J2 的侵袭力和在鼠腹腔巨噬细胞内的存活力增强[12]。CsgD 基因与沙门氏菌在鸡肠道内定植有关[13]。OmpD 与沙门氏菌黏附有关[5]。因此,STnc640 可能与沙门氏菌毒力调控相关,其能否调控沙门氏菌对宿主细胞的黏附和毒力,调控机制如何,有待于进一步的研究。
[1]Braden C R.Salmonella enterica serotype Enteritidis and eggs:a national epidemic in the United States[J].Clin Infect Dis,2006,43:512-517.
[2]Gantois I,Ducatelle R,Pasmans F,et al.Mechanisms of egg contamination by Salmonella enteritidis[J].FEMS Microbiol Rev,2009,33:718-738.
[3]Wagner C,Hensel M.Adhesive mechanisms of Salmonella enterica[J].Adv Exp Med Biol,2011,715:17-34.
[4]Clayton D J,Bowen A J,Hulme S D,et al.Analysis of the role of 13 major fimbrial subunits in colonisation of the chicken intestines by Salmonella enterica serovar Enteritidis reveals a role for a novel locus[J].BMC Microbiol,2008,8:228.
[5]Hara-Kaonga B,Pistole T G.OmpD but not OmpC is involved in adherence of Salmonella enterica serovar Typhimurium to human cells[J].Can J Microbiol,2004,50(9):719-727.
[6]Waters L S,Storz G.Regulatory RNAs in bacteria[J].Cell,2009,136:615-628.
[7]Majdalani N,Vanderpool C K,Gottesman S,et al.Bacterial small RNA regulators[J].Crit Rev Biochem Mol Biol,2005,40(2):93-113.
[8]Sittka A,Lucchini S,Papenfort K,et al.Deep sequencing analysis of small noncoding RNA and mRNA targets of the global post-transcriptional regulator,Hfq[J].PLoS Genet,2008,4:e1000163.
[9]朱春红,孙晓庆,何素芬,等.基于Red 同源重组和高效自杀性载体系统构建肠炎沙门氏菌突变株方法的比较[J].中国预防兽医学报,2009,31(2):81-84.
[10]Datsenko K A,Wanner B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proc Natl Acad Sci U S A,2000,97:6640-6645.
[11]厚华艳,朱春红,孟霞,等.肠炎沙门氏菌SEF14 菌毛研究进展[J].中国预防兽医学报,2013,35(10):855-858.
[12]Zhu Chun-hong,Meng Xia,Duan Xiao-li,et al.SEF14 fimbriae from Salmonella enteritidis play a role in pathogenitic to cell model in vitro and host in vivo[J].Microb Pathog,2013,64:18-22.
[13]Morgan E,Campbell J D,Rowe S C,et al.Identification of host-specific colonisation factors of Salmonella enterica serovar Typhimurium[J].Mol Microbiol,2004,54:994-1010.
