尼帕病毒N基因的原核表达
2015-03-07作者单位400038重庆第三军医大学流行病学教研室成都军区疾病预防控制中心石清明张超雄陈锚锚邓成玉范泉水军事医学科学院军事兽医研究所涂长春
作者单位:400038 重庆,第三军医大学流行病学教研室(梁 栋);成都军区疾病预防控制中心(梁 栋,石清明,张超雄,陈锚锚,邓成玉,范泉水);军事医学科学院军事兽医研究所(涂长春)
尼帕病毒N基因的原核表达
作者单位:400038 重庆,第三军医大学流行病学教研室(梁栋);成都军区疾病预防控制中心(梁栋,石清明,张超雄,陈锚锚,邓成玉,范泉水);军事医学科学院军事兽医研究所(涂长春)
梁栋,涂长春,石清明,张超雄,陈锚锚,邓成玉,范泉水
[摘要]目的利用尼帕病毒(NiV)的N基因进行原核表达,探讨NiV N蛋白作为检测NiV存在的抗原的可能性。方法利用pET-28a(+)作为表达载体,构建pET-NiV N重组质粒,通过IPTG诱导使其表达蛋白,并用Western blot方法进行原核表达NiV N蛋白的检测。结果通过PCR、酶切和连接反应,成功构建N蛋白的pET-NiV N重组质粒,大小为1596 bp;利用IPTG诱导pET-NiV N重组质粒在宿主菌中表达N蛋白,SDS-PAGE结果显示,55 kD有特异蛋白条带,与蛋白预计大小相符,经Bandscan软件扫描分析,重组蛋白量占菌体总蛋白量的12%;Western blot法检测显示,55 kD的条带显色良好,证明是本实验所需要得到的目的蛋白。结论使用原核表达系统成功表达了NiV的N蛋白,为其进一步的抗体制备、活性鉴定及研究应用奠定了基础。
[关键词]尼帕病毒;N基因;原核表达
Prokaryotic expression of Nipah virus N gene
Liang Dong1,2, Tu Changchun3, Shi Qingming2, Zhang Chaoxiong2, Chen Maomao2, Deng Chengyu2, Fan Quanshui21. Research Room of Epidemiology, Third Military Medical University, Chongqing, 400038, China; 2. The Center for Disease Prevention and Control, Chengdu Military Command, Chengdu, Sichuan, 610021, China; 3. Military Veterinary Research Institute of Military Medical Science Academy of the PLA, Changchun, Jilin, 130000, China
[Abstract]ObjectiveTo explore the possibility of Nipah virus (NiV) N protein as an antigen to detect the presence of NiV by using the prokaryotic expression of NiV N gene.MethodspET-28a (+) was used as an expression vector in order to construct the recombinant plasmid of pET-NivN, which was induced by IPTG to express the protein; and then, Western blot method was used to detect the prokaryotic expression of NivN protein.ResultsBy means of PCR, enzyme digestion and ligation reaction, the recombinant plasmid of pET-NivN was constructed successfully, with a size of 1596 bp; IPTG was used to induce the recombinant plasmid of pET-NivN to express N protein in the host bacteria. SDS-PAGE results showed that 55 kD has a specific protein band with the expected protein size; according to the Bandscan software scanning and analysis, the amount of recombinant protein was 12% of the total bacteria protein. Western blot assay showed that the band of 55 kD has a good color, and this proved that it was just the protein to be obtained in the experiment.ConclusionThe prokaryotic expression system can express N protein of NiV successfully, and this lays solid foundation for further antibody preparation, activity evaluation, and research application.
[Key words]Nipah virus; N gene; prokaryotic expression
尼帕病毒(Nipah virus,NiV)是一种新发现的、人兽共患的副粘病毒,可导致人或动物的脑炎或呼吸道炎症,其致死率很高。由于该种病毒的自然宿主为狐蝠科(Pteropid)的食果蝠蝇(fruit bat)[1],活动范围较广,NiV有可能在一定区域内的食果蝙蝠中相互传播,因此,相同种类蝙蝠分布的国家和地区会面临病毒突变、疫病暴发流行的危险。近年来,NiV在周边国家的流行态势对我国造成了潜在威胁[2-8]。我国目前尚未检出NiV,但是我国东南沿海地区和云南地区具有适合NiV流行的生态环境和宿主动物,且已发现NiV的自然宿主,因此,有必要开展针对NiV检测手段的相关研究。NiV属副粘病毒科成员,为不分节段的负链RNA病毒,其总基因组大小为18.2 kb,共有6个转录单位,编码6个蛋白:磷酸化蛋白(P)、核衣壳蛋白(N)、基质蛋白(M)、融合蛋白(F)、大蛋白(L)和糖蛋白(G),其基因组结构顺序为3'-N-P-M-F-G-L-5'[9]。
NiV病毒N基因全长1596 bp,其编码的N蛋白全长为532个氨基酸。N蛋白为NiV结构蛋白中含量最丰富的蛋白,其产生的抗体中和活性较差[10],但是N蛋白的免疫原性较强,能在早期刺激机体产生抗体,且抗体滴度高、持续时间长,因此,可以作为NiV的检测抗原[11]。
本研究通过基因工程的方法,对NiV的N蛋白进行了原核表达,表达的蛋白可用于建立相应抗体检测方法、开展野生动物的抗体监测以及单克隆抗体的制备。且原核表达的蛋白成本低廉,适合后续研发相应的检测试剂盒。
1材料与方法
1.1材料与设备NiV(澳大利亚动物健康实验室);含有NiV核蛋白基因(N)的质粒pFBHa-NiVN由上海生工合成;表达载体PET-28a(+)购自Novagen;感受态细胞DH5α、BL21(DE3)购自Tiangen公司;T4DNA连接酶购自Promaga公司;ExTaq聚合酶、IPTG、各种核酸内切酶、DL2000购自TaKaRa大连公司;DNA凝胶片段回收试剂盒购自Axygen公司。PCR细胞仪(CD3221)购自珠海欧雷电子科技有限公司。兔抗NiV全病毒血清,HRP标记的羊抗兔IgG和蛋白印迹Western blot检测所需试剂由上海威奥生物有限公司提供。
1.2方法
1.2.1引物设计参照已经发表的NiV株全序列[12],设计了一对引物(上游引物:NiVNFP;下游引物:NiVNRP),用于NiVN基因的PCR克隆,引物序列见表1。

表1 扩增NiVN基因的引物序列及酶切位点
1.2.2目的基因的PCR扩增和产物回收PCR反应采用25 μl反应体系(共10管,以供PCR产物回收),体系的组成为:10×buffer 2.5 μl,dNTP 2 μl,NiVNFP(10 pmol/μl)1 μl,NiVNRP(10 pmol/μl)1 μl,ExTaq DNA聚合酶1 μl,含有目的基因的质粒1 μl,补加ddH2O至25 μl。PCR反应条件:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 3 min,35个循环;最后72 ℃ 5 min延伸后结束反应。取5 μl的PCR产物在1%琼脂糖凝胶中电泳,拍照后用DNA凝胶片段回收试剂盒进行回收。
1.2.3PCR回收产物和表达载体的双酶切及产物回收将PCR回收产物进行双酶切,反应体系如下:PCR回收产物10 μl,两种核酸内切酶各1 μl,缓冲液2.5 μl,最后补加ddH2O至25 μl,37 ℃水浴酶切1 h,65 ℃灭活15 min,置于-20 ℃超低温冰箱冻存。将表达载体pET-28a(+)进行双酶切,反应体系如下:pET-28a(+)10 μl,两种核酸内切酶各1 μl,缓冲液2.5 μl,最后补加ddH2O至25 μl,37 ℃水浴酶切1 h,65 ℃灭活15 min,电泳观察酶切效果,将切开的载体用DNA凝胶片段回收试剂盒回收。
1.2.4构建重组质粒取酶切好的目的基因片段和表达载体片段,进行连接反应,反应体系如下:目的基因DNA 7.5 μl,表达载体片段0.5 μl,10×T4DNA连接酶1 μl,T4DNA连接酶1 μl,最后补加ddH2O至10 μl,置于16 ℃水浴中过夜连接。
1.2.5诱导目的基因表达取构建好的重组表达质粒PET-NN转化到感受态细胞BL21(DE3)中,将转化子涂平板后接种LB培养基,方法同前。进行菌液PCR和PCR产物双酶切鉴定,并将菌液送检测序。将PCR阳性的菌落接种5 ml Kan+的LB培养基中,培养过夜后,重组菌加入70%的甘油进行保种,剩余的菌种按照0.1%的比例接种于50 ml的Kan+ LB培养基中,37 ℃、160 r/min摇床培养至细菌浓度达到对数生长中期(OD600=0.6~1.0)时,加入终浓度为1 mmol/L的IPTG进行诱导3 h后,取3 ml菌液离心后,去上清,加入1 ml PBS悬浮细菌,离心,去上清,再加入100 μl的SDS-PAGE上样缓冲液,4 ℃裂解10 min,然后煮沸10 min,离心,取8 μl上清进行SDS-PAGE(浓缩胶浓度5%,分离胶浓度12%)。
1.2.6Western blot蛋白印迹检测首先进行SDS-PAGE电泳,电泳完成后,小心将胶取出置于转膜槽中,转膜条件为15 V,电转20 min后用脱脂牛奶封闭,37 ℃ 2 h。用1∶100稀释的兔抗NiV全病毒血清共孵育2 h,用PBS洗涤3次;二抗为HRP标记的羊抗兔IgG(1∶10 000)孵育30 min,用PBS洗涤3次后,将膜加入底物溶液,显色完毕后拍照记录。
2结果
2.1目的基因的PCR扩增目的基因PCR扩增后,取5 μl进行琼脂糖凝胶电泳,从图1可以看到,PCR扩增产物条带大小约为1596 bp,与预期结果相符。
2.2构建重组质粒PCR扩增的目的基因与pET-28a(+)质粒双酶切后进行连接,连接产物转化BL21(DE3)后,挑取单克隆菌落进行PCR鉴定,得到阳性结果,见图2;提取重组质粒进行双酶切鉴定,双酶切产物的大小和预期相符,见图3。将PCR产物进行测序,结果与NiV N蛋白序列完全一致,命名为pET-NiVN。
2.3重组质粒pET-NiVN的诱导表达pET-NiVN经过IPTG诱导后,进行SDS-PAGE。从图4可以看出,PET-NiVN在55 kD上面有特异性的蛋白条带,与目的蛋白预计大小相符合。
2.4Western blot测定结果为确定本研究中原核表达系统是否成功表达了NiV的N蛋白,将兔抗NiV全病毒血清作为一抗进行定性检验。结果发现55 kD的条带显色良好(图5)。
1:PCR扩增的目的基因产物(图中划圈处);2:阴性对照;M:DNA Marker DL2000

图2 重组质粒PCR鉴定
M:DNA Marker DL2000;1:阴性对照;2:重组质粒pET-NiVN的PCR扩增产物(图中划圈处)
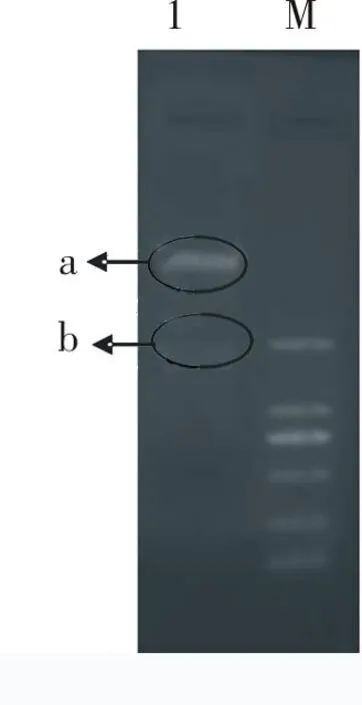
图3 重组质粒的双酶切鉴定
1:重组质粒pET-NiVN双酶切产物(图中划圈处a:PET-28a(+)载体;b:目的基因);M:DNA Marker DL2000
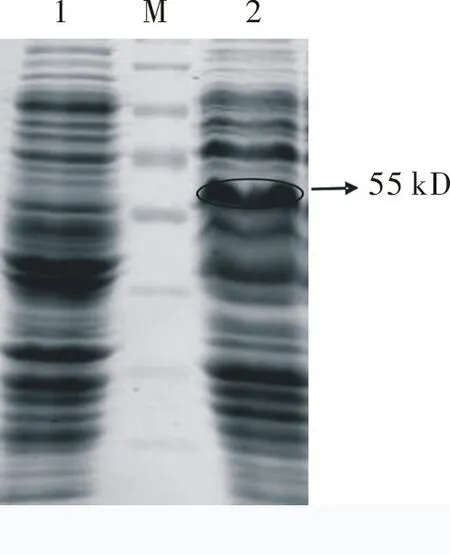
图4pET-NiVN经过IPTG诱导后的SDS-PAGE
1:pET-28(a)+转化BL21(DE3)诱导对照;M:蛋白Marker;2:pET-NiVN转化BL21(DE3)诱导后产物(图中划圈处)
图5Western blot测定结果
1:pET-28(a)+转化BL21(DE3)诱导对照;M:蛋白Marker;2:目的蛋白(图中划圈处)
3讨论
NiV是近年来新出现的副粘病毒,能感染多种动物,对人有较高的致死率,因而具有重要的公共卫生学意义。如果直接对NiV的蛋白进行纯化,有一定的危险性,同时纯化成本高、风险大,也为法律所禁止。如果通过基因工程的方法表达N蛋白,不仅生物危险性低,且价格低廉。只要基因工程抗原具有足够高的敏感性,那么利用重组蛋白座位检测用抗原是完全可行的,同时也利于实验的标准化。
本实验将N基因与pET-28a(+)载体的His-Taq基因融合,对重组菌进行诱导表达和SDS-PAGE分析可以清楚看到相对于阴性对照,55 kD处有特异的N蛋白条带,重组蛋白在菌体中主要是以包涵体的形式存在。本研究使用原核表达系统成功表达了NiV的N蛋白,且能在Western blot反应中与阳性血清反应,说明以原核表达的重组N蛋白座位检测抗原是可行的,这为以后建立针对NiV的血清抗体检测的ELISA方法打下了基础。
当然,原核表达出来的N蛋白与NiV的N蛋
白还是存在一定的差异性,这些差异性是否会导致检测方法的假阳性或假阴性,还需要进一步验证。希望在将来的实验中,将表达出来的N蛋白免疫动物,得到抗N蛋白血清,为研制尼帕病毒早期检测试剂奠定研究基础。
【参考文献】
[1]Chua KB,Koh CL,Hooi PS,et al.Isolation of Nipah virus from Malaysian Island flying-foxes[J].Microbes Infect,2002,4(2):145-151.
[2]Ahmad K.Malaysia culls pigs as Nipah virus strikes again[J].Lancet,2000,15:230.
[3]Hsu VP,Hossain MJ,Parashar UD,et al.Nipah virus encephalitis reemergence,Bangladesh[J].Emerg Infect Dis,2004,12:2082-2087.
[4]WHO.Nipah virus outbreak(s)in Bangladesh,January-April 2004[R].WHO's weekly Epidemiological Report,2004,79(17):168-171.
[5]Chadha MS.Nipah virus-associated encephalitis outbreak,Siliguri,India[J].Emerg Infect Dis,2006,12(2):235-240.
[6]Olson JG,Rupprecht C,Rollin PE,et al.Antibodies to Nipah-like virus in bats(Pteropus lylei)in Cambodia[J].Emerg Infect Dis,2002,8:987-988.
[7]Reynes JM,Counor D,Ong S,et al.Nipah virus in Lyle's flying foxes,Cambodia[J].Emerg Infect Dis,2005,11:1042-1047.
[8]Wacharapluesadee S,Lumlertdacha B,Boongird K,et al.Bat Nipah virus,Thailand[J].Emerg Infect Dis,2005,11:1949-1951.
[9]Wang LF,Harcourt BH,Yu M,et al.Molecular biology of Hendra and Nipah viruses[J].Microbes and Infection,2001,3:279-287.
[10]Bossart KN,Crameri G,Dimitrov AS,et al.Receptor-binding,fusion inhibition and induction of cross-reactive neutralizing antibodies by a soluble G glycoprotein of Hendra virus[J].J Virol,79:6690-6702.
[11]Eshaghi M,Tan WS,Ong ST,et al.Purification and characterization of Nipah virus Nucleocapsid proteinProduced in insect cells[J].J Clini Microbio,2005,11:3172-3177.
[12]Harcourt BH,Tamin A,Halpin K,et al.Molecular characterization of the polymerase gene and genomic termini of Nipah virus[J].Virology,2001,287:192-201.
(收稿日期:2014-10-24)
文章编号1004-0188(2015)03-0255-04
doi:10.3969/j.issn.1004-0188.2015.03.009
中图分类号R 373
文献标识码A
通讯作者:范泉水,E-mail:fqs168@126.com
