鲁氏耶尔森氏菌口服微球疫苗特性分析及免疫效果研究
2015-03-01磊汪开毓周燕王二龙王均陈德芳耿毅赖为民
阳 磊汪开毓周 燕王二龙王 均陈德芳耿 毅赖为民
(1. 四川农业大学鱼病研究中心, 成都 611130; 2. 四川省广元市农业局, 广元 628017)
鲁氏耶尔森氏菌口服微球疫苗特性分析及免疫效果研究
阳 磊1 , 2汪开毓1周 燕1王二龙1王 均1陈德芳1耿 毅1赖为民1
(1. 四川农业大学鱼病研究中心, 成都 611130; 2. 四川省广元市农业局, 广元 628017)
为制备并评价鲁氏耶尔森氏菌口服微球疫苗的免疫效果, 实验采用天然高分子聚合物海藻酸钠为疫苗载体, 鲁氏耶尔森氏菌灭活疫苗为抗原, 制备鲁氏耶尔森氏菌口服疫苗。以拌料口服方式进行免疫, 通过血清非特异免疫指标、抗体效价、免疫保护率等综合评价疫苗的免疫效果。结果表明, 鲁氏耶尔森氏菌口服微球疫苗成球性好, 粒径均匀, 粒径(8.76±1.73) μm, 跨距0.47, 包封效率94.51%, 具备良好的抗酸性、肠溶性及高安全性的特点。将疫苗免疫斑点叉尾
鲁氏耶尔森氏菌; 口服疫苗; 非特异性免疫功能; 免疫保护
鲁氏耶尔森氏菌(Yersinia ruckeri)为肠杆菌科(Enterobacteriaceae)耶尔森氏菌属(Yersinia), 革兰氏阴性短杆菌, 该菌主要引起鲑鳟类(尤其是虹鳟)发生红嘴病, 也称肠炎红嘴病(Entericredmouth, ERM)[1], 1999年Danley等[2]首次报道该菌可感染斑点叉尾并引起严重死亡。近年来, 该病已逐渐成为危害斑点叉尾
(Ictalurus punctatus)健康养殖的重要疾病。长期以来, 对于水产动物细菌病的防控主要采用抗生素和化学药物, 但也带了细菌耐药性产生、食品安全、药物残留等诸多问题, 作为最为有效的疾病防控方式, 疫苗的使用势在必行[3—5]。渔用疫苗免疫方式主要分为注射、浸泡和口服 3种, 其中口服疫苗因其操作方便、应激小、成本低以及可对各阶段鱼类进行免疫的优点而备受关注。但是口服疫苗免疫效果易受胃肠环境影响[6], 这严重制约了口服疫苗的发展。目前, 为解决这一问题, 较多学者利用多种材料作为口服疫苗载体, 开发口服疫苗传递系统, 并取得了较多的成绩[7—11]。鱼类属于低等脊椎动物, 特异性免疫系统尚不健全, 非特异性免疫在鱼类免疫防御中起着重要作用, 可分为细胞免疫和体液免疫[8], 对于非特异性免疫能力的评价, 主要以超氧化物歧化酶活性、溶菌酶活力、ACH50活性等作为主要评价指标[12, 13]。本研究以海藻酸钠为口服疫苗载体, 制备鲁氏耶尔森氏菌口服微球疫苗, 并对疫苗的免疫效果进行研究, 期望开发一种新的渔用口服疫苗, 为鱼类口服疫苗研究提供更多的参考资料。
1 材料与方法
1.1 实验材料
致病性 Y. ruckeri由四川农业大学鱼病研究中心自行分离保存, 实验用健康斑点叉尾购自雅安某斑点叉尾养殖基地, 体质量(50±5) g。
1.2 鲁氏耶尔森氏菌灭活疫苗制备
将复壮后的Y. ruckeri接种于于LB液体培养基中, 28℃震荡培养24h, 革兰氏染色镜检验纯。生理盐水调整菌液浓度为 3×109cfu/mL, 用锥形瓶分装适量菌液加入终浓度为 0.30%的福尔马林, 摇床120 r/min, 28℃灭活24h后, 用无菌生理盐水洗涤3 次, 置于4℃冰箱备用。
1.3 鲁氏耶尔森氏菌口服微球疫苗及疫苗饲料制备
参照阳磊等[14]采用响应面法优化后的制备工艺,制备Y. ruckeri口服微球疫苗以及海藻酸钠空微球。
将Y. ruckeri微球疫苗、Y. ruckeri灭活疫苗以及海藻酸钠空微球分别按所需免疫剂量与粉碎后的饲料混合再成型、干燥制成口服疫苗饲料, 按照体重的2%进行投喂。
1.4 口服微球疫苗特性分析
微球疫苗形态及粒径分析 取少量微球溶液于载玻片上, 于显微成像系统下观察并拍照, 随机选取600个微球, 利用图像分析软件Image-pro-plus测量粒径大小, SPSS软件对粒径进行分析。粒径分布用跨距表示, 计算公式为:
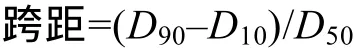
式中, D10, D50和D90分别指粒径累积分布图中10%、50%和90%处所对应的粒径。
包封效率测定 将制备的微球重悬, 取3 mL微球悬液离心, 将得到的微球加入到55 mmol/L柠檬酸钠溶液中, 120 r/min摇床过夜, 充分溶解。再将溶液10000 r/min离心10min, 将所收集细菌用紫外分光光度计于600 nm处测定细菌OD值, 按照公式计算包封效率:

疫苗安全性检验 取少量微球疫苗涂布于BHI平板, 于28℃下培养48h, 观察有无细菌生长。将40尾健康斑点叉尾分为4组, 每组10尾。
分别将制备好的微球疫苗以 1×109cfu/尾的浓度灌胃、腹腔注射接种, 设置无菌PBS灌胃、腹腔注射对照组, 观察统计 14d内接种鱼的发病情况及存活率。
体外模拟释放实验 为了检测微球疫苗在胃肠条件下的释放情况, 参照Rodrigues等[6]以及Tian 等[11]的方法, 配置模拟胃液(pH 2.0的PBS溶液)及肠液(pH 9.0的Tris-HCl溶液)检测微球疫苗的释放率。
参照Leal等[15]的方法, 分别取适量制备好的微球疫苗分散于5 mL模拟胃液、模拟肠液中, 于22℃下先在模拟胃液中反应 6h后再转移至模拟肠液中继续反应, 分别于1h、3h、6h、9h、12h、15h、18h、21h和24h取上清液, 500 r/min离心1min, 用紫外分光光度计于600 nm处测定细菌的OD值, 重复测定3次取平均值, 根据公式计算微球疫苗的释放率,并绘制释放曲线。
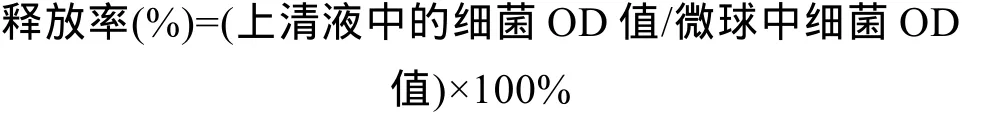
1.5 免疫程序及样品采集与处理
1.6 血清总超氧化物歧化酶(Total superoxide disumutase activity, T-SOD)活力检测
利用 T-SOD试剂盒(购自南京建成生物工程研究所)测定受免鱼血清 T-SOD酶活力。按下列公式计算T-SOD活力:

表1 免疫程序Tab. 1 The immunization program
T-SOD活力(U/mL)=(对照管OD值–测定管OD 值)/(对照管OD值)/50%×反应体系的稀释倍数×样本测试前的稀释倍数
1.7 血清溶菌酶活力检测
血清溶菌酶活力测定, 利用冻干的微球菌粉通过浊度分析法进行测定[8, 17]。
1.8 血清补体替代途径活性(Alternative pathway
complement activity, ACH50)检测
参照 Sitjà-Bobadilla 等[18]的方法测定血清中补体替代途径活性。
1.9 微量凝集实验检测血清抗体水平
参照Huang等[19]方法, 向96孔板1—12孔中加入50 μL PBS, 再向第1孔中加入50 μL待测血清,吹打8—10次, 取50 μL加入第2孔, 依次倍比稀释,至第10孔, 弃去50 μL, 末尾2孔不加血清作为抗原对照, 然后每孔中加入一定浓度的抗原50 μL, 同时设阳性、阴性对照, 混匀后反应, 过夜, 观察记录结果。
1.10 攻毒试验及相对免疫保护效果测定
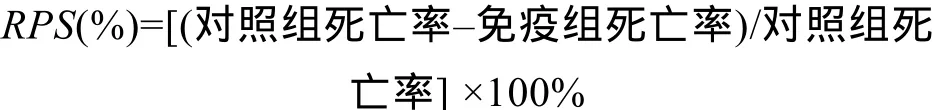
2 结果
2.1 微球疫苗形态及粒径分析结果
本实验制备的Y. ruckeri口服微球疫苗粒径分布较集中, 微球成球性好(图 1), 粒径(8.76±1.73) μm,跨距0.47(图2)。
2.2 疫苗安全性检验
将制备好的 Y. ruckeri口服疫苗和灭活疫苗涂布于LB平板, 各设3个重复, 28℃条件下培养48h后观察, 均无细菌生长。
将制备好的 Y. ruckeri口服疫苗以将制备好的微球疫苗以1×109cfu/尾灌胃、腹腔注射接种健康斑点叉尾, 设置无菌PBS腹腔注射对照组, 14d内接种鱼未见任何异常, 均无发病或死亡, 证明疫苗安全性良好。
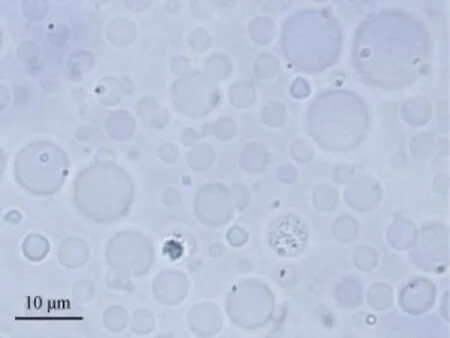
图1 鲁氏耶尔森氏菌微球疫苗形态(1000×)Fig. 1 The shape of the microparticles vaccine of Y. ruckeri
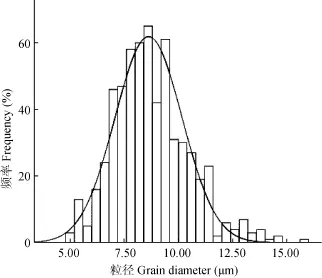
图2 鲁氏耶尔森氏菌微球疫苗粒径分布Fig. 2 The size distribution of the microparticles vaccine of Y. ruckeri
2.3 体外模拟释放
本实验制备的 Y. ruckeri口服疫苗在模拟胃液(pH 2.0)中, 释放率极低, 24h内释放率仅为12.90%,在模拟肠液(pH 9.0)中时, 出现了起始的突释现象(26.00%), 之后持续快速的释放, 24h累积释放率分别为89.00%(图3)。
为更准确地模拟疫苗口服后在鱼类胃肠道中的释放, 将微球首先在模拟胃液中处理 6h, 再转移至模拟肠液中继续处理, Y. ruckeri微球疫苗在模拟胃液中处理6h后转移至模拟肠液中, 24h累积释放率92.00%, 转移至模拟胃液中18h累积释放率87.90%,远高于仅在模拟肠液中处理的微球18h累积释放率70.00% (图3)。
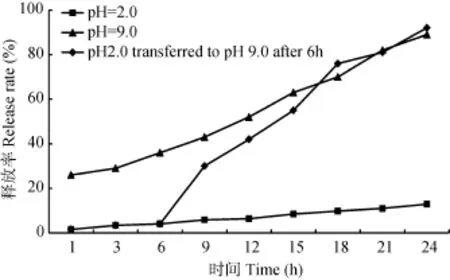
图3 在不同条件下鲁氏耶尔森氏菌微球疫苗体外模拟释放曲线Fig. 3 The release profile of microparticles vaccine of Y. ruckeri under different conditions in vitro
2.4 血清总超氧化物歧化酶(T-SOD)活力检测结果
在实验中, 各免疫组血清T-SOD活力在前3周都极显著高于对照组(P<0.01), 但在第4周后, 仅有Y. ruckeri微球疫苗组血清T-SOD活力仍极显著高于对照组(P<0.01), 且持续到第7周时, 与对照组差异不显著(P>0.05)(图4)。
2.5 血清溶菌酶活力检测结果
在免疫后第1周Y. ruckeri灭活疫苗组血清溶菌酶活力高于微球疫苗组和空微球组, 第 2周时 Y. ruckeri微球疫苗组溶菌酶活力达到峰值, 之后开始下降, 但下降速度明显慢于灭活疫苗及空微球组,至第7周时, 与对照组差异不显著(P>0.05), 而灭活苗组和空微球组分别于第6周和第5周时即与对照组差异不显著(P>0.05)。
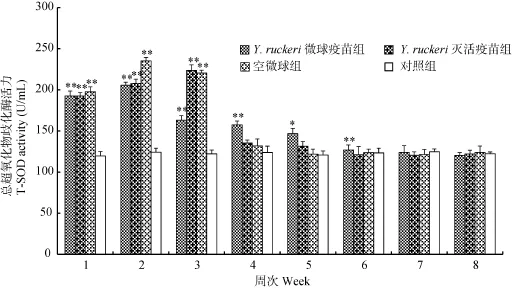
图4 斑点叉尾血清总超氧化物歧化酶活力变化Fig. 4 The difference in the activity of serum T-SOD of I. punctatus
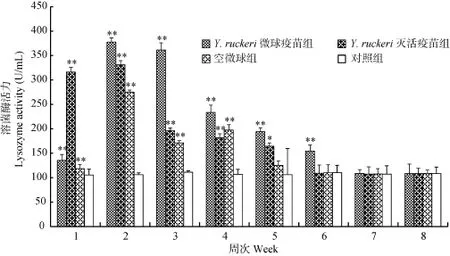
图5 斑点叉尾血清溶菌酶活力变化Fig. 5 The difference in the activity of serum lysozyme of I. Punctatus
2.6 血清补体替代途径活性(ACH50)检测结果
在免疫后第1、2周, 各实验组ACH50活性均极显著高于对照组(P<0.01), 在第 2周达到峰值后, ACH50活性开始降低, Y. ruckeri微球疫苗组至第 6周时 ACH50活性仍极显著高于对照组(P<0.01), 灭活疫苗组在第 5周时与对照组差异不显著(P>0.05),空微球组仅第1、2周极显著高于对照组(P<0.01), 之后与对照组差异不显著(P>0.05)。
2.7 微量凝集实验检测血清抗体
通过微量凝集实验检测, Y. ruckeri微球疫苗组在第4周时检测到特异性抗体, 效价1∶4, 第5周时达到峰值 1∶8, 之后抗体水平开始降低, 至第 8周时仍能检测到低水平的特异性抗体。Y. ruckeri灭活疫苗组仅在第4周时检测到特异性抗体, 效价1∶2。空微球组和对照组在整个实验中均无特异性抗体检出。
2.8 相对免疫保护率
3 讨论
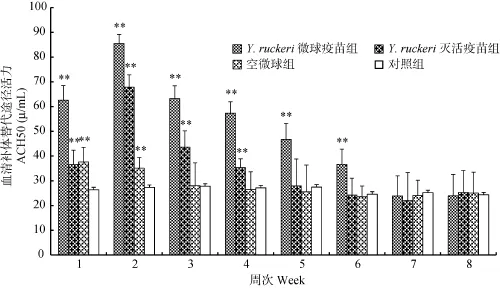
图6 斑点叉尾血清补体替代途径活性变化Fig. 6 The difference in the activity of serum ACH50of I. punctatus
表2 攻毒后斑点叉尾死亡率和相对免疫保护率Tab. 2 The mortality and the relative survival rate of I. punctatus after the challenge with Y. ruckeri

表2 攻毒后斑点叉尾死亡率和相对免疫保护率Tab. 2 The mortality and the relative survival rate of I. punctatus after the challenge with Y. ruckeri
分组Groups数量(尾) Quantity (tail)死亡数量(尾)The amount of death (tail)死亡率Mortality (%)相对免疫保护率RPS (%) Y. ruckeri微球疫苗组 30 10 33.33 65.52 Y. ruckeri灭活疫苗组 30 25 83.33 13.80空微球组 30 26 86.67 10.34对照组 30 29 96.67 0.00
本研究以海藻酸钠为载体材料, 制备Y. ruckeri口服微球疫苗, 得到的微球疫苗粒径分布集中, 成球性好, 粒径(8.76±1.73) μm, 跨距 0.47, 包封效率94.51%。相比采用单因素和正交优化, 本实验采用响应面法优化工艺制备微球疫苗, 相比 Rodrigues 等[6]研究结果(包封效率 100%), 包封效率略低, 但微球粒径相比Rodrigues等[6]、Romalde等[16]、李义等[9]有了较大的降低, 有研究显示与哺乳动物相比,鱼类免疫接种需要粒径小于10 μm装载大量抗原的微球疫苗[6], 粒径小的微球疫苗更有利于鱼类肠道后段对其吸收, 本实验制备的Y. ruckeri口服疫苗粒径小, 免疫斑点叉尾相对免疫保护率为 65.52%,高于曲向阳[20]制备的嗜水气单胞菌(Aeromonas hydrophila)口服疫苗[粒径(11.01±0.15) μm], 保护率50.00%, 丁诗华等[21]制备的聚乳酸-乙醇酸共聚物[(poly(lactide-co-glycolide), PLG)]嗜水气单胞菌口服疫苗(粒径约10 μm), 但保护率仅为32.10%, 这可能与疫苗制备方法与载体材料不同有关。在体外模拟释放试验中, 微球疫苗在模拟胃液中仅有较低的释放率(12.90%), 而在模拟肠液中释放率高(89.00%),这与海藻酸钠微球具有的低pH收缩, 高pH溶胀特性有关[22]。为更好的模拟微球疫苗在胃肠道种的释放, 将微球疫苗先在模拟胃液中处理 6h, 再转移至模拟肠液中处理可发现微球具有了更快的释放速率,推测酸性条件下的孵育, 将有助于海藻酸钠微球在碱性环境中的释放, 这与Gombotz等[23]的研究结果相似。
鱼类为低等脊椎动物, 非特异性免疫在鱼类免疫系统中起着重要的作用。超氧化物歧化酶是鱼类清除机体自由基的重要物质, 当 SOD活力下降时,机体消除自由基的能力减弱, 从而影响免疫功能;溶菌酶是一种碱性蛋白, 能水解细胞壁中的黏肽的乙酰氨基多糖并使之裂解释放, 从而消除侵入机体的异物, 实现机体防御功能, 作为鱼类非特异性免疫的重要组成, 其广泛分布于血清、黏液及部分淋巴组织中, 鱼体内溶菌酶的活力和水平, 直接关系到鱼类的免疫功能和健康[24]; 鱼类补体直接参与机体防御, 其生物学活性影响机体抵抗微生物的能力、免疫复合物的形成和持续时间等, 而 ACH50是衡量鱼类非特异性免疫力的一项重要指标[25]; 在本实验中免疫 Y. ruckeri口服微球疫苗的实验组血清T-SOD活力、溶菌酶活力、ACH50活性均至第6周时仍极显著高于对照组(P<0.01), 说明免疫后的鱼体内能较长时间保持机体对自由基的清除能力, 对入侵病原菌的裂解并能有效的激活补体系统发挥免疫功能, 从而提高机体非特异性免疫能力; 同时,对血清中特异性抗体的检测可知, 在第 4周时, 可检测到特异性抗体, 至免疫后的第 8周仍有特异性抗体存在, 因此, 在整个实验中非特异性免疫和特异性免疫的共同作用, 为鱼体提供了更为长期有效的免疫保护。在本实验中使用的疫苗载体材料海藻酸钠, 是一种天然的高分子聚合物, 其具有的生物黏附性、低免疫原性、无刺激、生物无毒等优点使其已较多的应用于鱼类疫苗开发[8, 11], 从本实验结果可以看出, 免疫空微球的斑点叉尾非特异性免疫功能在短时间内也得到了提高, 并能提供10.34%的免疫保护率, 这也表明海藻酸钠具有一定的免疫增强作用。
本研究制备了鲁氏耶尔森氏菌口服微球疫苗并对其免疫效果进行研究, 证明该疫苗可对斑点叉尾提供较好的免疫保护。
[1] Furones M D, Rodgers C J, Munn C B. Yersinia ruckeri, the causal agent of enteric redmouth disease (ERM) in fish [J]. Annual Review of Fish Diseases, 1993, 3: 105—125
[2] Danley M L, Goodwin A E, Killian H S. Epizootics in farm-raised channel catfish, Ictalurus punctatus (Rafinesque), caused by the enteric redmouth bacterium Yersinia ruckeri [J]. Journal of Fish Diseases, 1999, 22(6): 451—456
[3] Wang X H, He J G. Fish vaccinology research [J]. Freshwater Fisheries, 2001, 31(2): 36—38 [王晓红, 何建国.鱼类疫苗学研究. 淡水渔业, 2001, 31(2): 36—38]
[4] Ren Y, Zhang X J, Chang O Q, et al. Partial characteristics of PELA-OmpK microsphere vaccine and its immune effect in crucian carp inoculated by oral route [J]. Chinese Journal of Biologicals, 2011, 24(11): 1306—1309 [任燕, 张小江,常藕琴, 等. PELA-OmpK微球疫苗的部分特征及其对鲫鱼的口服免疫效果. 中国生物制品学杂志, 2012, 24(11): 1306—1309]
[5] Huang L Y, Wang K Y, Xiao D, et al. Safety and immunogenicity of an oral DNA vaccine encoding Sip of Streptococcus agalactiae from Nile tilapia Oreochromis niloticus delivered by live attenuated Salmonella typhimurium [J]. Fish & Shellfish Immunology, 2014, 38(1): 34—41
[6] Rodrigues A P, Hirsch D, Figueiredo H, et al. Production and characterisation of alginate microparticles incorporating Aeromonas hydrophila designed for fish oral vaccination [J]. Process Biochemistry, 2006, 41(3): 638—643
[7] Adomako M, St Hilaire S, Zheng Y, et al. Oral DNA vaccination of rainbow trout, Oncorhynchus mykiss (Walbaum), against infectious haematopoietic necrosis virus using PLGA [Poly (D, L-Lactic-Co-Glycolic Acid)] nanoparticles [J]. Journal of Fish Diseases, 2012, 35(3): 203—214
[8] Behera T, Swain P. Alginate–chitosan–PLGA composite microspheres induce both innate and adaptive immune response through parenteral immunization in fish [J]. Fish & Shellfish Immunology, 2013, 35(3): 785—791
[9] Li Y, Liu Y G, Yu Q Y, et al. Preparation technology andcharacterization of microencapsulated oral vaccine of Aeromonas hydrophila from Eriocheir sinensis [J]. Freshwater Fisheries, 2011, 41(3): 77—82 [李义, 刘永贵,俞泉宇, 等. 中华绒螯蟹嗜水气单胞菌微胶囊口服疫苗制备工艺及特性研究. 淡水渔业, 2011, 41(3): 77—82]
[10] Behera T, Nanda P K, Mohanty C, et al. Parenteral immunization of fish, Labeorohita with Poly d, l-lactideco-glycolic acid (PLGA) encapsulated antigen microparticles promotes innate and adaptive immune responses [J]. Fish & Shellfish Immunology, 2010, 28(2): 320—325
[11] Tian J, Sun X, Chen X. Formation and oral administration of alginate microspheres loaded with pDNA coding for lymphocystis disease virus (LCDV) to Japanese flounder [J]. Fish & Shellfish Immunology, 2008, 24(5): 592—599
[12] Pang L J. Effects of xylooligosaccharide on the non-specific immunity function and the expression of immune related genes on Ctenopharyngodon idellus [D]. Thesis for Master of Science. Huazhong Agricultural University, Wuhan. 2011 [庞丽姣. 低聚木糖对草鱼非特异性免疫功能及免疫相关基因表达的影响. 硕士学位论文, 华中农业大学, 武汉. 2011]
[13] Wang Q K, Zhao H Y, Lü Z M, et al. Effects of dietary angelica sinensis Polysaccharide on nonspecific immunity of Epinephelus malabaricus [J]. Journal of Anhui Agricultural Science, 2012, 39(22): 13857—13860 [王庆奎, 赵海运, 吕志敏, 等. 口服当归多糖对点带石斑鱼非特异性免疫力的影响. 安徽农业科学, 2012, 39(22): 13857—13860] [14] Yang L, Wang K Y, Pan Y L, et al. Optimization of
preparation conditions by response surface methodology and characterization of oral microsphere vaccine of Edwardsiella ictaluri [J]. Journal of Fisheries of China, 2015, 39(3): 136—145 [阳磊, 汪开毓, 潘延乐, 等. 响应面法优化爱德华菌口服微球疫苗制备工艺及其特性分析. 水产学报, 2015, 39(3): 136—145]
[15] Leal C, Carvalho-Castro G A, Sacchetin P, et al. Oral and parenteral vaccines against Flavobacterium columnare: evaluation of humoral immune response by ELISA and in vivo efficiency in Nile tilapia (Oreochromis niloticus) [J]. Aquaculture International, 2010, 18(4): 657—666
[16] Romalde J L, Luzardo-Alvárez A, Ravelo C, et al. Oral immunization using alginate microparticles as a useful strategy for booster vaccination against fish lactoccocosis [J]. Aquaculture, 2004, 236(1): 119—129
[17] Swain P, Dash S, Sahoo P K, et al. Non-specific immune parameters of brood Indian major carp Labeorohita and their seasonal variations [J]. Fish & Shellfish Immunology, 2007, 22(1): 38—43
[18] Sitjà-Bobadilla A, Mingarro M, Pujalte M J, et al. Immunological and pathological status of gilthead sea bream (Sparusaurata L.) under different long-term feeding regimes [J]. Aquaculture, 2003, 220(1): 707—724
[19] Huang H, Chen Y, Wang P, et al. Efficacy of a formalin-inactivated vaccine against Streptococcus iniae infection in the farmed grouper Epinephelus coioides by intraperitoneal immunization [J]. Vaccine, 2014, 32(51): 7014—7020
[20] Qu X Y. Study on preparation and immune efficacy of chitosan-coated alginate microspheres incorporating Aeromonas hydrophila [D]. Thesis for Master of Science. Nanjing Agricultural University, Nanjing. 2008 [曲向阳. 嗜水气单胞菌微囊口服疫苗的制备及其免疫效应研究. 硕士学位论文, 南京农业大学, 南京. 2008]
[21] Ding S H, Wang Y D, Peng Y Y, et al. Immunogenecity and protective effects of an oral vaccine microparticle against Aeromonas hydrophilain grass carp (Ctenopharyngodon idella) [J]. Journal of Southwest Agricultural University (Natural Science), 2006, 27(6): 888—891 [丁诗华, 王一丁,彭远义, 等. 鱼用嗜水气单胞菌口服疫苗的免疫保护效应.西南农业大学学报, 2006, 27(6): 888—891]
[22] Thu B, Bruheim P, Espevik T, et al. Alginate polycation microcapsules: II. Some functional properties [J]. Biomaterials, 1996, 17(11): 1069—1079
[23] Gombotz W R, Wee S F. Protein release from alginate matrices [J]. Advanced Drug Delivery Reviews, 2012, 64: 194—205
[24] Zhou J, Song X, Huang J, et al. Effects of dietary supplementation of A3α-peptidoglycan on innate immune responses and defense activity of Japanese flounder (Paralichthys olivaceus) [J]. Aquaculture, 2006, 251(2): 172—181
[25] Wang Z P, Zhang S C, Wang G F. Advances on the complement components, characteristic and function of complement system in fish [J]. Acta Hydrobiologica Sinica, 2008, 32(5): 760—769 [王志平, 张士璀, 王光锋. 鱼类补体系统成分及补体特异性和功能的研究进展. 水生生物学报, 2008, 32(5): 760—769]
THE CHARACTERISTICS AND IMMUNE EFFICACY OF AN ORAL MICROSPHERES VACCINE OF YERSINIA RUCKERI
YANG Lei1,2, WANG Kai-Yu1, ZHOU Yan1, WANG Er-Long1, WANG Jun1, CHEN De-Fang1,
GENG Yi1and LAI Wei-Min1
(1. Fisheries Department of Sichuan Agricultureal University, Chengdu 611130, China; 2. Sichuan Guangyuan Agricultural Bureau, Guangyuan 628017, China)
Yersinia ruckeri is major pathogenic bacterium that is harmful to the aquaculture of Ictalurus punctatus. The conventional treatment such as antibiotics and chemicals often cause issues in, for example, food safety and drug resistance. The vaccine has been considered to be the most effective method of disease prevention and control. Currently, natural polymer materials have been used as the carrier for fish oral vaccine, and sodium alginate is regarded as an ideal material and has become a hotspot in research. In this study, we prepared the oral microspheres vaccine of Y. ruckeri by using formalin-inactivated Y. ruckeri as the antigen and sodium alginate as the carrier. We also studied the characteristics of this vaccine and evaluated its immune efficacy that was indicated by the serum non-specific immune parameters, the antibody titers and the relative survival rate. We found that the microspheres had a good form with a homogeneous distribution of the particle diameter; the average diameter was (8.76±1.73) μm and the span was 0.47; and the encapsulation efficiency of the vaccine was 94.51%. Moreover, this vaccine exhibited characteristics such as high acid resistance, good enteric solubility, and being safe. The activities of the serum lysozyme, the total superoxide disumutase (T-SOD) and the alternative pathway complement (ACH50) were significantly increased in the vaccinated I. punctatus. The serum agglutination titers reached the peak value of 1: 8 in the 5th week, and the specific antibodies were detected in the 8th week after vaccination. The relative survival rate of the I. punctatus was 65.52%. In conclusion, the oral microspheres vaccine of Y. ruckeri effectively protects the fish form the Y. ruckeri disease.
Yersinia ruckeri; Oral vaccine; Non-specific immunity function; Relative percent survival
S942.5
A
1000-3207(2015)06-1142-08
10.7541/2015.150
2015-02-10;
2015-06-18
教育部《长江学者和创新团队发展计划》创新团队专项(IRT0848); 四川省科技厅产业链(2014NZ003); 四川省科技厅应用基础专项(2014JY0143)资助
阳磊(1989—), 男, 四川苍溪人; 硕士研究生; 主要研究方向为水产动物疾病与免疫。E-mail: yangleigy@163.com
汪开毓(1955—), 教授, 博士生导师, E-mail: kywangsicau@126.com
