玉屏风散对鱼类非特异性免疫和免疫相关基因表达的影响
2015-03-01张倩倩刘天强李彤彤徐静龙梦王谢昊龚小宁李爱华
张倩倩刘天强李彤彤徐 静龙 梦王谢昊龚小宁李爱华
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 通威股份有限公司, 成都 610041)
玉屏风散对鱼类非特异性免疫和免疫相关基因表达的影响
张倩倩1, 2刘天强3李彤彤1, 2徐 静3龙 梦1, 2王谢昊1, 2龚小宁1李爱华1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 通威股份有限公司, 成都 610041)
为探究传统中药玉屏风散在水产养殖上的生物学功效, 在基础饲料中分别添加2.5%、5%和10%的玉屏风散和1%的芪参散配成实验饲料, 饲喂实验鱼2周, 然后分别观察两种中药对罗非鱼(体重约220 g)的生长、非特异性免疫及免疫相关基因表达的影响以及对草鱼(体重约20 g)免疫保护率的影响。结果显示: 各中药组均提高了罗非鱼增重率, 10%玉屏风散组效果最显著; 各实验组中罗非鱼肝、肾、脾体指数和各血液学指标与对照组无显著差异; 各中药组罗非鱼谷草转氨酶(AST)和谷丙转氨酶(ALT)含量均不高于空白对照组; 2.5%、10%玉屏风散组和1%芪参散组碱性磷酸酶(AKP)含量均高于对照组(P>0.05); 各药物组罗非鱼溶菌酶活性均高于对照组, 且2.5%玉屏风散组与对照组差异显著(P<0.05); 玉屏风散各剂量组罗非鱼呼吸暴发活性均高于对照组(P>0.05); 罗非鱼肝脏中热休克蛋白70 (HSP70)在各实验组中表达量均上调, 肾脏中HSP70在2.5%和 5%玉屏风散组表达量上调, 脾脏中 HSP70在各实验组中表达量均下调; 肝脏中转化生长因子受体TGFRⅢ在 2.5%玉屏风散组表达量上调, 肾脏中 TGFRⅢ在 2.5%玉屏风散组和 1%芪参散组表达量上调, 脾脏中 TGFRⅢ在各实验组中表达量均上调; 玉屏风散各剂量组能够提高草鱼对嗜水气单胞菌的抵抗能力, 表现为死亡率降低和进入血液的细菌减少, 其中 5%玉屏风散组效果最佳。实验表明, 玉屏风散能够有效促进罗非鱼生长, 对其非特异性免疫指标以及免疫相关基因表达均有不同程度的促进作用, 并能够有效地提高草鱼的免疫保护率。
罗非鱼; 草鱼; 玉屏风散; 芪参散; 生理生化指标; 非特异性免疫; 免疫基因; 免疫保护率
随着我国鱼类养殖业的不断扩大, 高密度、集约化的养殖模式导致病害的频繁发生与流行, 近年来病毒性疾病、细菌性疾病、寄生虫病造成鱼类养殖业的巨大损失。传统的化学药物和抗生素在治疗鱼病过程中会造成环境污染、病原生物耐药性增强和组织药物残留等问题, 严重威胁人类的健康和安全。中药添加剂具有成本低、副作用小、使用安全、应用范围广的特点, 可以直接添加到饲料中, 不仅可以抑杀病原微生物, 还可以增强鱼体免疫系统,提高鱼体的抗应激能力和防御机能, 从而达到预防疾病的目的。近年来中药添加剂广泛应用于水产养殖, 符合健康无公害水产品生产的要求, 在鱼病防治上具有广阔的应用前景。
中药复方玉屏风散由黄芪、白术、防风组成[1],有补脾实卫、益气、固表、止汗的功效[2], 在我国已有近 700年的历史。关于玉屏风散在小鼠(Mus musculus)[3]、雏鸡(Gus gallus)[4]、人类(Homo sapiens)鼻炎[5]上的应用已有报道, 但在水产动物养殖中应用的报道却不多。为此, 本研究预以玉屏风散为中药饲料添加剂, 研究投喂含不同剂量中药的饲料对罗非鱼非特异性免疫指标及免疫相关基因表达的影响, 为玉屏风散在水产养殖中的应用提供理论依据。芪参散主要成分是黄芪、人参、甘草, 具有扶正固本的功效, 用于增强水产动物的免疫功能, 提高抗应激能力。芪参散是首批转正的国标渔药。在此实验中, 用芪参散为阳性对照, 以此来探究传统方剂玉屏风散的生物学功效。
1 材料与方法
1.1 实验材料
实验鱼及饲养条件 实验用鱼来自湖北省武汉市江夏汤逊湖某养殖场, 体质健壮, 无病无伤,选取规格相近的鱼体为实验对象, 罗非鱼平均体重为(220±20) g, 草鱼平均体重为(18±2) g。养殖水缸体积约为 200 L, 以充分曝气除氯的自来水作为循环水源, 全天24h充氧。实验鱼暂养2周适应环境后进行实验。每天投喂2次(09:00和17:00), 日总投喂量为鱼体重的2%, 每天吸污换水1次, 实验期间水温维持在28℃左右。
实验药物 玉屏风散的配方为: 防风 1份,黄芪2份(蜜炙), 白术2份, 粉碎至60目, 由四川通威股份有限公司提供。
实验饲料 实验组中向基础饲料中分别添加2.5%、5%和 10%的玉屏风散以及 1%的芪参散, 对照组为基础饲料, 用小型颗粒机制成颗粒状饲料, 在55℃烘箱中烘干后于4℃密封保存。基础饲料购自武汉九州神农药业有限公司, 配方及各成分含量为粗蛋白质 30%、粗纤维 12%、粗灰分 15%、钙0.40%—2.50%、总磷 0.7%、食盐 0.30%—1.20%、水分12.5%、总赖氨酸1.2%。
1.2 实验方法
实验设计 实验分4个实验组和一个对照组,每组12尾, 实验组分别投喂含2.5%、5%和10%的玉屏风散以及 1%的芪参散, 折合成每千克体重日投喂0.5、1.0、2.0 g和0.2 g相应的药物, 分别设为A1、A2、A3和 A4组; 对照组投喂基础饲料设为 A0组。饲养15d后进行罗非鱼相关免疫指标的测定。
样品的采集 每组随机取5尾鱼, 80 mg/L的MS 222麻醉后, 尾静脉采血, 将每尾鱼所采的血液分2份, 其中一份于采血管中4℃保存; 另一份分装于 2 mL无菌 Ep管中, 室温放置 1h后, 4 , ℃3500 r/min离心20min, 取血清。采血管及部分血清送往湖北省武汉大学中南医院测定血液学及血清学生化指标。分离头肾、肝脏、脾脏, 称重, 计算脏器指数。另取 5尾鱼取其肾脏、肝脏、脾脏于 Trizol 中, –80℃保存; 取头肾, 分离头肾细胞。
脏器指数[6]将分离的头肾、肝脏、脾脏分别称重, 计算脏器指数。头肾体指数(%)=MHK/MT× 100%; 肝脏体指数(%)=ML/MT×100%; 脾体指数(%)=MS/MT×100%, 式中: MT为实验结束时鱼体重(g); MHK为头肾重量(g); ML为肝脏重量(g); MS为脾脏重量(g)。
血液学指标 取全血样品和血清样品送湖北省武汉大学中南医院检测, 全血样品用美国雅培Ruby全自动血球分析仪进行白细胞计数、红细胞计数、红细胞压积、血红蛋白含量及淋巴细胞百分比,血清样品用美国贝克曼AU5400全自动生化分析仪检测总蛋白、白蛋白、血糖、尿素氮、碱性磷酸酶、总胆固醇、丙氨酸转氨酶及谷草转氨酶活性。
血清溶菌酶活性[7]用磷酸钠缓冲液(0.05 mol/L pH 6.2)将溶壁微球菌(Sigma)配成0.3 mg/mL的菌液, 分别向96孔板中加入10 μL的测试血清后, 加入 250 μL菌液, 快速混匀后, 25℃下490 nm波长测定0.5min和4.5min后的吸光值,以一分钟内吸光值下降0.001为一个活性单位U。
呼吸暴发[8]分离头肾组织, 用L-15培养液(含2%胎牛血清, 10 μ/mL肝素(sigma)和100 μg/mL青链霉素)清洗组织两次后, 过0.2 μm滤筛。细胞悬液平铺到事先准备好的 34%/51% Percoll梯度分离液上, 4 , 400℃ ×g, 离心40min。收集34%和51%分离液之间的细胞, 用L-15培养液4 , 400℃ ×g, 离心10min清洗两遍, 用L-15培养液(含0.1%胎牛血清, 100 μg/mL青链霉素)调节细胞浓度为2×106cells/mL, 28℃细胞培养箱培养。
细胞悬液 28℃培养 2h后, 移除培养液, 用HBSS清洗掉未贴壁细胞, 每孔加入 100 μL 含Zymson A(1 mg/mL)和NBT(1 mg/mL)的HBSS, 28℃培养1h后移除液体, 用甲醇固定10min后, 分别用100%、70%、70%的甲醇清洗各孔, 室温风干, 每孔加120 μL KOH和140 μL DMSO, 充分混匀后于630 nm处测吸光值。
免疫相关基因表达[9]将储存在–80℃的组织取出解冻后, 于研钵中用液氮研磨, 用 Trizol (Invitrogen)试剂提取头肾、肝脏、脾脏组织中的总RNA, 用超微量紫外分光光度计进行 RNA纯度测定, 并用无RNase活性的DNase去除基因组DNA。逆转录酶(Takara)将 RNA反转录成 cDNA, 合成反应终体积为20 μL, 于–20℃保存备用。
采用 Primer Premier 5.0软件进行 Real-time PCR中的引物(表1)设计, 引物设计所依据的基因模板序列均来自于NCBI DNA数据库, 各基因NCBI登录号分别为 β-actin (KJ 126772)、Hsp70 (XM 005466767)、TGFRⅢ (XM 005451165)。Real-time PCR反应采用荧光染料SYBR Green, 在Bio-Rad荧光定量PCR仪上进行, 以β-actin为内参基因。在总体积为25 μL的反应液体中, 含有2 μL cDNA模板, 1 μL正反向引物(引物浓度为 10 μm/L), 12.5 μL SYBR Mix以及8.5 μLddH2O。反应条件如下: 95℃变性30s; 95 ℃ 5s, 60 ℃ 30s, 40个循环。最终免疫基因的表达量用 2–ΔΔCt的方法进行分析, 其中ΔΔCt= (Ct,目标基因–Ct, β-actin)实验组–(Ct,目标基因–Ct, β-actin)对照组。
1.3 攻毒实验
为探究投喂玉屏风散对鱼体细菌感染的保护效果, 用草鱼作为实验对象, 用分别含 2.5%、5%和10%和 0%玉屏风散(A1、A2、A3、A0)的饵料投喂两周, 在结束投喂的第 2天进行攻毒实验。同时另设一组, 一直投喂饲喂空白饲料, 但在攻毒前1天饲喂一次含 10%玉屏风散的饵料(记为B组)。将嗜水气单胞菌(Aeromonas hydrophila DLNG101)接种于BHI固体培养基, 28℃培养16—18h, 用PBS缓冲液洗下菌苔, 离心去上清后用 PBS重悬浮, 调节细菌浓度为2×107cfu/mL。每尾鱼腹腔注射0.2 mL菌液, 每组20尾, 水温为23℃。注射后观察并记录各组死亡时间、数量。统计96h内各组的“尾×时”数(鱼的尾数乘以存活的小时数), 并统计感染 7d内各组累积死亡率, 计算RPS, 并进行卡方检验分析。另外, 对即将死亡的草鱼(记入死亡数)采集尾静脉血, 分离细菌。
1.4 数据统计与分析
数据用SPSS 19统计软件进行单因素方差分析(One-Way ANOVA), 用Duncan’s多重比较分析组间差异, 差异显著水平为P<0.05。
2 结果
2.1 玉屏风散对罗非鱼脏器指数的影响
由表2可知, 对照组罗非鱼增重率为0.39%, 实验组鱼体增重率明显高于对照组。头肾体指数除A3组外均低于对照组, 但差异不显著(P>0.05); 肝体指数A1组、A4组与A2组差异显著(P<0.05), 其他各组差异不显著(P>0.05); 脾体指数A4组明显高于其他各组, 且差异显著(P<0.05)。

表1 Real time PCR引物Tab. 1 Primers used in real time PCR

表2 玉屏风散对罗非鱼脏器指数的影响Tab. 2 The effects of Jade screen powder on the viscera index of Tilapia
2.2 玉屏风散对罗非鱼血液学指标的影响
由表3可知, 罗非鱼全血中的白细胞、红细胞、血红蛋白、红细胞压积和淋巴细胞百分比实验组与对照组均差异不显著(P>0.05)。在罗非鱼血清各指标影响中, 各组实验组中总蛋白和血糖含量差异不显著(P>0.05), A1、A4组丙氨酸转氨酶和谷草转氨酶含量明显低于A2、A3和A0组, 且差异显著(P<0.05), A4、A0组白蛋白含量差异显著(P<0.05), 而 A1、A2、A3组差异不显著(P>0.05), A1组碱性磷酸酶水平与A2差异显著(P<0.05), 与其他各组差异不显著(P>0.05), 而A2组与A1、A3、A4差异显著(P<0.05), 与A0差异不显著(P>0.05), A2、A4组血清总胆固醇含量差异显著(P<0.05), 其他各组不显著(P>0.05)。
2.3 玉屏风散对罗非鱼血清溶菌酶活性的影响结果显示(图1): 实验组血清溶菌酶活性均高于对照组, 其中 A1组溶菌酶活性与对照组差异显著(P<0.05), 其溶菌酶活力高低次序为A1组、A4组、A3组、A2组、A0组。

表3 玉屏风散对罗非鱼血液学指标的影响Tab. 3 The effects of Jade screen powder on hematological indexes of Tilapia
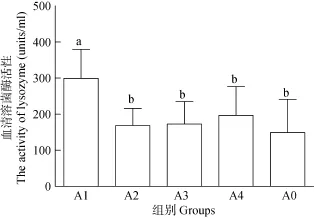
图1 玉屏风散对罗非鱼血清溶菌酶活性的影响Fig. 1 The effects of Jade screen powder on the activity of lysozyme in Tilapia
2.4 玉屏风散对罗非鱼淋巴细胞呼吸暴发的影响
结果显示(图2): A1组、A2组、A3组呼吸暴发强度均高于A0组, 但差异不显著(P>0.05); A4组呼吸暴发强度低于对照组, 但差异也不显著(P>0.05)。
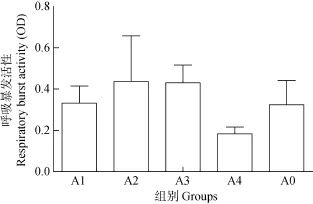
图2 玉屏风散对罗非鱼淋巴细胞呼吸暴发的影响Fig. 2 The effects of Jade screen powder on the respiratory burst activity in Tilapia
2.5 玉屏风散对罗非鱼免疫基因(Hsp 70和TGFRⅢ)表达量的影响
结果显示(图3): 肝脏中各组Hsp70表达均上调, 且A1、A2与A3组差异显著(P<0.05), A3组达到最高, 是对照组的17.52倍, 肾脏中A1和A2组Hsp70表达上调, A3和 A4组下调但差异不显著(P>0.05),脾脏中各组Hsp 70表达量均下调; 肝脏中A1、A2组与A3、A4组差异显著(P<0.05), 且A1组TGFRⅢ表达量上调, 为对照组的1.42倍, 肾脏中除A3组下调, 其他各组表达均上调, 但各组间差异不显著(P>0.05), 脾脏中各组 TGFRⅢ表达量均上调, 但差异不显著(P>0.05)。
2.6 玉屏风散对草鱼免疫保护率的影响
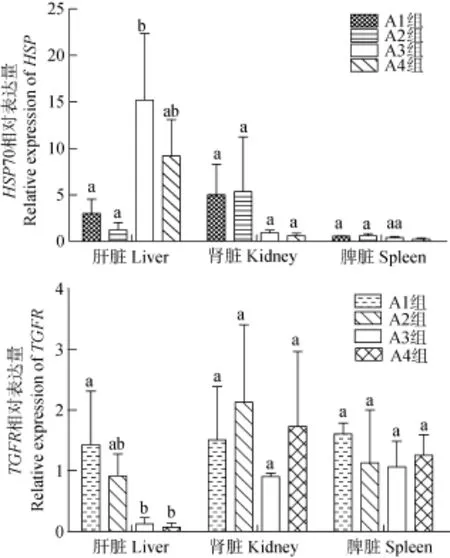
图3 玉屏风散对罗非鱼肝脏、肾脏、脾脏中Hsp70和TGFRⅢ基因表达的影响Fig. 3 The effects of Jade screen powder on the expression of Hsp 70 and TGFRⅢ relative to β-actin in the liver, the kidney, and the spleen of tilapia

表4 攻毒后鱼体的死亡时间与死亡数量Tab. 4 The number and time of death after infection
实验鱼在注射嗜水气单胞菌后, 不同时间的死亡情况见表4。在注射攻毒28h后, A0组有5尾死亡, A1组1尾、A2组0尾、A3组3尾、B组2尾死亡; 90h后, A0组有11尾死亡, A1组4尾、A2组0尾、A3组6尾、B组6尾死亡, 计算各组实验鱼在注射攻毒后所有鱼的累计存活时间, 则 A1组为181、A2组为0、A3组为210、A0组为507、B组为 337; 玉屏风散各浓度组的保护率分别为 A1组63%、A2组为100%、A3组为45%、B组为45%。从 2.5%玉屏风散组和对照组即将死亡的草鱼尾静脉血中分离出细菌且对照组菌落数明显多于 2.5%玉屏风散组, 其他各组血液中未分离出细菌。这也说明了两种中药都有促进机体杀灭细菌的作用。
3 讨论
本研究选用经典方剂玉屏风散和芪参散作为实验鱼饲料添加剂, 通过对组织相关物质含量、酶活性、呼吸暴发等指标及HSP70和TGFRⅢ基因的表达量分析, 研究中药添加剂对罗非鱼生理生化指标、非特异性免疫及免疫相关基因表达的影响, 通过攻毒实验研究中药添加剂对草鱼免疫保护率的影响, 以期较全面的分析中药添加剂对鱼类生长及免疫方面的作用和效果。
3.1 玉屏风散对罗非鱼生长指数的影响
近年来, 中草药在水产养殖领域的应用受到广泛关注。研究表明, 中草药对水产动物的生长性能有明显促进作用。如刘爱君等[10]在奥尼罗非鱼饲料中添加 0.50%甘露寡糖使稚鱼、鱼种的增重率分别提高 13.7%和 18.4%; 刘兴国等[11]在罗非鱼的饲料中分别添加 0.25%、0.50%、1.00%和 2.00%的壳聚糖, 发现壳聚糖显著降低了罗非鱼的饲料系数, 添加量以 0.50%最为适宜。本实验用含不同剂量玉屏风散和芪参散的饲料饲喂罗非鱼 2周后, 实验组鱼体体重增加率明显高于对照组, 且鱼体体重增加率随着玉屏风散剂量的增加而增加, 10%玉屏风散组促进效果最佳, 说明玉屏风散和芪参散均对罗非鱼的生长具有良好的促进作用, 而最适的添加剂剂量还需要进一步探讨; 各组的头肾、肝脏、脾脏指数差异不明显。
3.2 玉屏风散对罗非鱼血液生理生化指标的影响
血细胞在鱼类疾病防御过程中发挥重要作用,是免疫能力和疾病诊断[12]的指标之一。血红蛋白是鱼类非特异性免疫的一项指标, 可以在一定程度上反映鱼类健康状况, 高含量的血红蛋白是鱼体健康的表征[13]。实验结果显示, 中药组血红蛋白含量虽与对照组虽无显著差异, 但均高于对照组, 说明玉屏风散和芪参散均可在一定程度上促进罗非鱼的健康。血清中的AST、ALT作为反映鱼类肝功能的重要指标[14], 同时也可以反映体内蛋白质的代谢情况[15, 16]。ALT和AST在转氨酶中作用最强, 在机体蛋白质代谢中起着重要作用。5%、10%玉屏风散组和对照组AST、ALT含量无显著差异, 2.5%玉屏风散组和芪参散组还甚至低于对照组。鱼体新陈代谢部分是由物质的磷酸化和去磷酸化调节的, AKP是鱼体生长代谢、维持内环境稳态所必需的酶。除5%玉屏风散组外, 其他各实验组虽与对照组差异不显著, 但 AKP含量均高于对照组, 说明 2.5%、10%玉屏风散和芪参散均可提高罗非鱼体内AKP活性。实验组与对照组中白细胞、红细胞、血红蛋白、红细胞压积和淋巴细胞百分比均差异不显著, 且均在健康范围之内[17]。
3.3 玉屏风散对罗非鱼血清溶菌酶的影响
作为鱼类免疫的第一道防线, 血清溶菌酶阻止细菌的附着和定植, 是鱼类重要的防御因子。溶菌酶是一种裂解酶, 可以水解细菌细胞壁中N-乙酰胞壁酸和N-乙酰氨基葡糖之间的B-1,4糖苷键, 导致细胞壁破裂, 主要作用于革兰氏阳性菌[18]。吴英瑞等[19]发现用含 0.1%苦参的饲料饲喂罗非鱼 20d后,能显著提高血清溶菌酶活性; László Ardó等[20]发现黄芪和金银花可以显著提高罗非鱼血清溶菌酶活性。本实验结果显示, 实验组血清溶菌酶活性均高于对照组, 且 2.5%玉屏风散组与对照组差异显著,说明玉屏风散和芪参散均可以促进罗非鱼血清溶菌酶活性, 且玉屏风散添加量在2.5%时促进作用最明显。
3.4 玉屏风散对罗非鱼细胞呼吸暴发活性的影响
在吞噬细胞吞噬入侵异源物质的过程中会产生大量的呼吸暴发, 鱼类吞噬细胞在呼吸暴发过程中会产生氧自由基, 产生的 O2–对鱼类病原微生物毒性不大, 但其所产生的H2O2有很强的毒性[21]。超氧化物阴离子是呼吸暴发过程中的第一产物, 因此产生的氧负离子的量成为精确测定呼吸暴发的指标。Vera-Jimenez NI等[22]发现β-谷氨酸可以促进草鱼头肾细胞的呼吸暴发活性; Yin等[23]发现, 用含 0.5%灵芝多糖饲喂鲤(Cyprinidae)1周后能显著提高鲤头肾巨噬细胞的呼吸暴发活性。本实验结果显示, 除芪参散组外, 玉屏风散各实验组呼吸暴发强度均高于对照组, 说明玉屏风散可有效促进罗非鱼淋巴细胞的呼吸暴发强度, 提高鱼类免疫力, 其中以5%添加量效果最佳。
3.5 玉屏风散对罗非鱼免疫相关基因HSP70和TGF-β表达量的影响
HSP70是一种保守蛋白, 在正常情况下, HSP70在细胞内呈基础表达, 表达水平较低, 而在各种应激因素如温度陡变、病原菌感染或组织损伤时, 其表达量明显上升[24]。HSP70在先天性免疫和获得性免疫中发挥重要作用, 有研究指出中药可以提高团头鲂(Megalobrama amblycephala)[25]和白对虾(Penaeus orientalis)[26]的 HSP70的表达量。本实验结果显示,各实验组均能提高肝脏中HSP70的表达量, 尤其是10%玉屏风散组和芪参散组, 提高倍数分别为17.52 和9.18; 在肾脏中, 2.5%、5%玉屏风散组HSP70表达量上调, 10%玉屏风散组和芪参散组表达量下调;在脾脏中各组基因表达量均明显下调。
TGF-β是一种多功能的细胞因子, 在细胞生长和分化、组织修复和凋亡中起到重要作用[27]。TβR是一种细胞膜表面受体, TGF-β要发挥生物学作用必须与其受体结合, TGF-βR的改变是TGF-β发生功能变化的关键。最新发现TβR存在TβRⅠ、TβRⅡ、TβRⅢ三种形式, TβRⅢ是一种蛋白聚糖, 起到信号放大的作用[28], 是TGF-β发挥生物学作用所不可或缺的。实验结果显示, 肝脏中 TGFRⅢ的表达量除2.5%玉屏风散组小幅度上调外, 其他各实验组表达量均下调, 肾脏中除 10%玉屏风散组小幅下调外,其他各实验组均上调, 脾脏中各实验组 TGFRⅢ表达量均小幅上调。
3.6 玉屏风散对草鱼免疫保护率的影响
攻毒实验结果显示, 用含不同剂量玉屏风散和芪参散的饲料饲喂草鱼两周后, 实验组鱼体死亡率明显低于对照组, 饲喂两周含玉屏风散饲料后的草鱼对嗜水气单胞菌的抵抗能力显著增强, 其中 5%玉屏风散组效果最佳, 饲喂 10%玉屏风散一次组嗜水气单胞菌感染率低于对照组, 说明短时服用玉屏风散对鱼体抵抗细菌感染也有一定的促进作用; 从保护率结果看, 5%玉屏风散组保护率最高为 100%, 2.5%玉屏分散组次之为 63%, 10%玉屏风散组为45%, 说明保护率与玉屏风散浓度并非呈正相关,浓度过高可能对鱼体的肝脏有一定的损伤; 仅从2.5%玉屏风散组和对照组尾静脉血液中分离出细菌且对照组细菌数明显高于2.5%玉屏风散组, 说明高剂量的玉屏风散可以有效提高草鱼的抵抗力, 防止细菌对鱼体的感染。
综上所述, 玉屏风散不同剂量实验组对罗非鱼体重增加率、生理生化指标、非特异性免疫及免疫相关基因的表达均有不同程度的增强和调节作用,也能有效地提高草鱼免疫保护率, 说明玉屏风散作为饲料添加剂用于促进鱼类生长、提高其免疫力方面具有一定应用价值。但这些作用与添加剂量密切相关, 而且各指标之间不存在一致性, 也就是说不存在一个可以使各种指标都呈现最理想变化的剂量。
[1] Wang D, Li S W, Lu T Y, et al. Effect of Jade screen power on the blood biochemical indicators and non-specific immunity of Acipenser schrencki [J]. Journal of Northwest A&F University, 2012, 40(3): 39—46 [王狄, 李绍戊, 卢彤岩, 等. 玉屏风散对施氏鲟血液生化指标及非特异性免疫功能的影响. 西北农林科技大学学报, 2012, 40(3): 39—46]
[2] Zhao H Y, Xu Q H, Wang Y F, et al. Effect of the biotransformatic mixture of jade screen power on the function of humoral immunity in immunosuppreessed mice [J]. Acta Chinese Medicine and Pharmacology, 2010, 38(5): 26—29 [赵红晔, 徐启华, 王月飞, 等. 玉屏风散生物转化液对免疫抑制小鼠体液免疫功能的影响. 中医药学报, 2010, 38(5): 26—29]
[3] Liang C M, Wang X X, Dong Q, et al. A serum pharmacologiacal study on the immunoregulatory effects of Yupingfeng Pulvis in mice [J]. Shanghai Journal of Immunology, 2003, 23(6): 385—388 [梁春敏, 王贤喜, 董群, 等. 玉屏风散对小鼠免疫调节作用的血清药理学研究.上海免疫学杂志, 2003, 23(6): 385—388]
[4] Yang H, Chen Z L, Deng Y. Effect of Plus Yupingfeng Powder on immune function of red blood cell and oxygen free radicals in chickens [J]. Veterinary Science in China, 2006, 36(1): 70—73 [杨鸿, 陈杖榴, 邓桦. 加味玉屏风散对鸡红细胞免疫和自由基的影响. 中国兽医科学, 2006, 36(1): 70—73]
[5] Yan X L. Allergic rhinieis treated with Modified Yu Ping Feng San in 115 cases [J]. Journal of Beijing University of Traditional Chinese Medicine, 2011, 34(5): 358—360 [闫锡联. 玉屏风散加味治疗变应性鼻炎115例临床观察. 北京中医药大学学报, 2011, 34(5): 358—360]
[6] Liu T Z, Zhang X K, Wang G C, et al. Effects of different chinese herbal compounds on growth, nonspecific immunity and lymphocyte transformation in common carp Cyprinus carpio [J]. China Academic Journal Electronic, 2011, 30(8): 445—450 [刘铁铮, 张小葵, 王桂春, 等. 不同中药组方对鲤鱼生长、非特异性免疫及淋巴细胞转化的影响. 水产科学, 2011, 30(8): 445—450]
[7] Christybapita D, Divyagnaneswari R, Dinakaran M R. Oral administration of Eclipta alba leaf aqueous extract enhances the non-specific immune responses and disease resistance of Oreochromis mossambicus [J]. Fish & Shellfish Immunology, 2007, 23: 840—852
[8] Vera-Jimenez N I, Pietretti D, Wiegertjes G F, et al. Comparative study of β-glucan induced respiratory burst measured by nitroblue tetrazolium assay and real-time luminal-enhanced chemiluminescence assay in common carp (Cyprinus carpio L.) [J]. Fish & Shellfish Immunology, 2013, 34: 1216—1222
[9] Truter J C, va Wyk J H, oberholster P J, et al. The impacts of neutralized acid mine drainage contaminated water on the expression of selected endocrine-linked genes in juvenile Mozambique tilapia Oreochromis mossambicus exposed in vivo [J]. Ecotoxicology and Environmental Safety, 2014, 100: 209—217
[10] Liu A J, Leng X J, Li X Q, et al. Effect of mannan oligosaccharides on growth performance, intestinal structure and nonspecific immunity of tilapia, Oreochromis niloticus [J]. Journal of Zhejiang University (Agric & Life Sci), 2009, 35(5): 329—336 [刘爱君, 冷向军, 李小勤, 等. 甘露寡糖对奥尼罗非鱼生长、肠道结构和非特异性免疫的影响. 浙江大学学报(农业与生命科学版), 2009, 35(5): 329—336]
[11] Liu X G, Song L P, Zhou H Q. The effect of SMW-chitosan on the oxidation resistance capability and fat content in tne liver tissue of Tilapia nilotica [J]. Marine Fisheries, 2004, 26(4): 291—294 [刘兴国, 宋理平, 周洪琪. 低分子壳聚糖对罗非鱼肝组织抗氧化能力和肝脂含量影响的研究. 海洋渔业, 2004, 26(4): 291—294]
[12] Yildirima M, Lima C, Wanb Peter J, et al. Growth performance and immune response of channel catfish (Ictaluruspuctatus) fed diets containing graded levels of gossypolacetic acid [J]. Aquaculture, 2003, 219(1-2): 751—768
[13] Baldi A, Bontempo V, Dell’orto V, et al. Effects of dietary chromium-yeast in weaning-stressed piglets [J]. Canadian Journal of Animal Science, 1999, 79(3): 369—374
[14] Meng Z N, Chen Y C, Guan X T, et al. Effect of Chinese herb compounds on activities of transaminase in-serum and antioxidase in erythrocyte of Cyprinus carpio L [J]. Journal of Northeast Agricultural University, 2010, 41(8): 75—80[孟兆娜, 陈玉春, 管雪婷, 等. 复方中草药对镜鲤(Cyprinus carpio L.)血清转氨酶及红细胞抗氧化酶活性的影响. 东北农业大学学报, 2010, 41(8): 75—80]
[15] Sun H M. Effect of starvation on the blood indices and immunity function of Yellow catfish (Pseudobagrus fulvidraco Richardson) [D]. Thesis for Master of Science. College of animal science and technology, Jilin Agricultural University, Jilin. 2004 [孙红梅. 饥饿对黄颡鱼血液指标及免疫机能的影响. 硕士学位论文, 吉林农业大学动物科技学院, 吉林. 2004]
[16] Li Q, Xiao D Y, Mao H M. The effect of bio-active peptide on the blood physiological-biochemical index in carp [J] Journal of Yangtze University (Nat Sci Edit), 2005, 2(5): 27—29 [李清, 肖调义, 毛华明. 生物活性肽对鲤鱼血液生理生化指标的影响. 长江大学学报(自然科学版), 2005, 2(5): 27—29]
[17] Nie G X, Ming H, Zheng J L, et al. Effects of xylanase on blood physiological-biochemical parameters of Nile tilapia Oreochromis niloticus [J]. Journal of DaLian Fisheries Univeristy, 2007, 22(5): 361—365 [聂国兴, 明红, 郑俊林, 等. 木聚糖酶对尼罗罗非鱼血液生理生化指标的影响. 大连水产学院学报, 2007, 22(5): 361—365]
[18] Alexander J B, Ingram G A. Non-cellular and non-specific defense mechanisms of fish [J]. Annual Review of Fish Diseases, 1992, 2: 249—280
[19] Wu Y R, Gong Q F, Fang H, et al. Effect of Sophora flavescens on non-specific immune response of tilapia (GIFT Oreochromis niloticus) and disease resistance against Streptococcus agalactiae [J]. Fish & Shellfish Immunology, 2013, 34: 220—227
[20] László Ardó, Yin G J, Xu P, et al. Chinese herbs (Astragalus membranaceus and Lonicera japonica) and boron enhance the non-specific immune response of Nile tilapia (Oreochromis niloticus) and resistance against Aeromonas hydrophila [J]. Aquaculture, 2008, 275: 26—33
[21] Liu M, Pan J L, Zhang S R. Phagocytes and phagocytosis in fish [J]. Ludong University Journal, 2010, 26(2): 167—172[刘敏, 潘俊丽, 张士璀. 鱼类吞噬细胞和吞噬作用的研究进展. 鲁东大学学报, 2010, 26(2): 167—172]
[22] Vera-Jimenez N I, Pietretti D, Wiegertjes G F, et al. Comparative study of β-glucan induced respiration burst measured by nitroblue tetrazolium assay and real-time luminal-enhanced chemiluminescence assay in common carp (Cyprinus carpio L.) [J]. Fish & Shellfish Immunology, 2013, 34: 1216—1222
[23] Yin G J, Ardo L, Thompson K D, et al. Chinese herbs (Astragalus radix and Ganoderma lucidum) enhanced immune response of carp, Cyprinuscarpio, and protection against Aeromonas hydrophila [J]. Fish & Shellfish Immunology, 2008, 275: 26—33
[24] Iwama G K, Afonso L O, Todgham A, et al. Are hsps suitable for indicating stressed states in fish [J]. Experimental Biology, 2004, 207: 15—19
[25] Ming J H, Xie J, Xu P, et al. Effects of emodin and vitamin C on growth performance, biochemical parameters and two HSP70s mRNA expression of Wuchang bream (Megalobrama amblycephala Yih) under high temperature stress [J]. Fish Shellfish Immunol, 2012, 32: 651—661
[26] Lei A Y, Zeng D G. Effects of compound Chinese herbal on the expression of heat stress protein 70 gene in white shrimp (litopenaeus vannamei) [J]. Guangxi Agricultural Sciences, 2008, 6: 830—833 [雷爱莹, 曾地刚. 复方中草药对凡纳滨对虾热应激蛋白70基因表达的影响. 广西水产科技, 2008, 6: 830—833]
[27] Xiang S W, Huang G D, Huang R F, et al. Effect of compound xiancao granules on expression of TGF-β1and TβR-Ⅱ in renal tissue among rats with IgA nephropathy [J]. Journal of Anhui TCM College, 2013, 32(4): 65—69 [向少伟, 黄国东, 黄仁发, 等. 复方仙草颗粒对 IgA肾病大鼠转化生长因子β及其Ⅱ型受体表达的影响. 安徽中医学院学报, 2013, 32(4): 65—69]
[28] Sun Y, Song J X, Wang Z M, et al. Expression of TGF-betaRⅠ, Smad2, Smad3 and Smad7 in keloids [J]. Chinese Journal of Plastic Surgery, 2006, 22(5): 368—370
THE EFFECTS OF JADE SCREEN POWER ON THE NON-SPECIFIC IMMUNE RESPONSE AND THE EXPRESSION OF THE RELATED GENES IN FISH
ZHANG Qian-Qian1, 2, Liu Tian-Qiang3, Li Tong-Tong1,2, Xu Jing3, Long Meng1, 2,
Wang Xie-Hao1,2, Gong Xiao-Ning1and Li Ai-Hua1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Science, Beijing 100049, China; 3.Tongwei Limited Company, Chengdu 610041, China)
In this study, we investigated the effects of Jade screen powder on the non-specific immune response and the expression of the related genes in tilapia (Oreochromis niloticus) as well as the effects on the resistance to the infection in grass carps. In order to explore the bio-activity of traditional Chinese herb Jade screen powder on aquaculture, the fish was fed with the four groups of diets supplemented with Chinese herbs (2.5%, 5%, 10% Jade screen powder and 1% Qishen powder) for 2 weeks. For tilapia, all four Chinese herb groups exhibited increase in the rate of the body weight gain, and 10% Jade screen powder had the most significant effect. There was no difference in the index of liver, kidney, spleen and in the haematological parameters between the treated groups and the control. Compared to the control group, the levels of AST and ALT were lower in the treated groups, but the level of AKP in the 2.5% and 10% Jade screen powder groups and 1% Qishen powder group was higher. There was an insignificant increase in the activity of the serum lysozyme in tilapia treated with jade screen powder at all three concentrations. Moreover, the activity of plasma lysozyme increased significantly in the group fed with 2.5% Jade screen powder compared to the control (P<0.05). The herbal treatment also insignificantly elevated the production of ROS (reactive oxygen species) (P>0.05). The expression of HSP70 was affected by the herbal treatments in a tissue-specific pattern: it was up-regulated in the liver, and in the kidney 2.5% and 5% Jade screen powder boosted the expression, however the expression was down-regulated in the spleen. The expression of TGFRⅢ was also differently regulated by the herbs in various organs: 2.5% Jade screen powder up-regulated the expression in the liver and the kidney, and 1% Qishen powder also had a stimulating effect in the kidney, and the expression could be enhanced by all treatments in spleen. Jade screen powder improved the resistance to the infection of Aeromonas hydrophila in grass carps, which was represented by the lower mortality rate and less bacteria in the blood, and 5% Jade screen powder was especially effective. These results suggested that Jade screen powder may improve the growth, the non-specific immune response and the expression of related genes in tilapia.
Tilapia; Grass Carp; Jade Screen Power; Qishen powder; Physiology and biochemical index; Non-specific immune response; Gene expression; Disease resistance
S965.1
A
1000-3207(2015)06-1076-09
10.7541/2015.142
2014-11-26;
2015-03-12
国家开放实验室(FEBL)课题(2011FBZ26); 国家自然科学基金项目 (No. 31070112)资助
张倩倩(1989—), 女, 山东青岛人; 硕士; 主要研究方向为中药鱼类免疫。E-mail: zhangqiantianyu623@163.com
李爱华, E-mail: liaihua@inb.ac.cn
