CuSO4和ZnSO4对尼罗罗非鱼N-乙酰-β-D-氨基葡萄糖苷酶的影响
2015-03-01张伟妮谢璐娜黄小红
张伟妮 谢璐娜 黄小红
(福建农林大学, 中西兽医结合与动物保健福建省高校重点实验室, 福州 350002)
CuSO4和ZnSO4对尼罗罗非鱼N-乙酰-β-D-氨基葡萄糖苷酶的影响
张伟妮 谢璐娜 黄小红
(福建农林大学, 中西兽医结合与动物保健福建省高校重点实验室, 福州 350002)
以分离自尼罗罗非鱼(Oreochromis niloticus)精巢的N-乙酰-β-D-氨基葡萄糖苷酶(EC 3.2.1.52, NAGase)为研究对象, 探讨了两种水产常用药物CuSO4和ZnSO4对NAGase的影响。研究结果表明CuSO4和ZnSO4对该酶抑制的 IC50分别为(1.23±0.05)和(0.28±0.02) mmol/L, 都能改变酶的构象从而影响到其内源荧光的发射。这两种药物对该酶的抑制机理均为可逆抑制, 其中CuSO4对酶的抑制类型为非竞争型, ZnSO4为竞争型,且均能明显影响该酶的pH稳定性和热稳定性。研究结果为罗非鱼养殖过程中CuSO4和ZnSO4的使用和监控提供了参考。
尼罗罗非鱼; N-乙酰-β-D-氨基葡萄糖苷酶; CuSO4; ZnSO4
N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase, EC 3.2.1.52, 简称NAGase), 隶属于糖基水解酶家族, 是广泛存在于微生物、植物和动物体内的一种重要的溶酶体酶, 主要水解各种糖分子内以β-1,4-糖苷键连接的N-乙酰-β-D-氨基葡萄糖苷键[1, 2]。即使在动物体内, 该酶的功能也因机体的不同或同一机体部位的不同而千差万别[2]。例如,在节肢动物, 该酶参与了孵化、消化和蜕皮过程[3, 4]。在人类, N-乙酰-β-D-氨基己糖苷酶A可以降解脑和外周神经组织的GM2神经节苷脂, 缺少这种酶会导致神经障碍的出现[5]。然而, 更多研究表明该酶的功能与动物的繁殖过程有关。在哺乳动物中, NAGase能够调节生殖细胞的活性, 参与以酶解为基础的精子对卵母细胞透明带的渗透及精子最初与卵母细胞膜的结合[6]。海鞘的卵子受精时释放的 NAGase被认为可能通过改变卵子表面精子受体的糖蛋白从而阻止多精入卵[7]。Sarosiek等[8]研究指出, 抑制虹鳟(Oncorhynchus mykiss)精子NAGase的活力会直接减少受精卵的数量, 且虹鳟和西伯利亚鲟(Acipenser baerii)的精子和卵子中 NAGase的活力下降, 更会直接降低受精率。
硫酸铜和硫酸锌均为重金属盐类, 其水溶液中游离的二价金属离子, 能阻碍寄生虫的生理代谢最终起到杀虫或抑制其增殖的作用, 因此往往作为传统的杀虫药和水质净化剂在水产养殖过程中被广泛应用[9—11]。其中硫酸铜的使用方式为 0.5—0.7 mg/L全池泼洒或 8 mg/L浸浴, 硫酸锌泼洒浓度为 0.3—2.8 mg/L、浸浴浓度为200 mg/L[9]。另外, 地壳元素的自然释放和人为活动的影响也是水中铜和锌的主要来源[12]。药物的使用和环境的污染常使得养殖水体中铜和锌的含量超标, 从而被养殖动物富集进而威胁其生存。本文以分离自“新吉富”尼罗罗非鱼(Oreochromis niloticus)精巢的 NAGase为研究对象, 以 CuSO4和ZnSO4为效应物, 研究其对该酶的影响, 旨在为罗非鱼的健康养殖管理和科学合理用药提供理论依据。
1 材料与方法
1.1 实验材料
经40%—55%的硫酸铵分级沉淀、DEAE纤维素(DE-32)离子交换层析、Sephadex G-200凝胶过滤层析、DEAE-Sephadex(A-50)层析柱从“新吉富”尼罗罗非鱼精巢组织分离纯化得到比活力为4100 U/mg、
PAGE检测为单一纯的 NAGase制剂[13], 作为本实验的实验材料。
1.2 试剂
对-硝基苯-N-乙酰-β-D-氨基葡萄糖苷(p-nitrophenyl-N-acetyl-β-D-glucosaminide, pNP-NAG)购自上海医药工业研究所, CuSO4和 ZnSO4购自国药集团化学试剂有限公司, 其他试剂均为国产分析纯。所有溶液均采用双蒸去离子水配制。
1.3 对尼罗罗非鱼NAGase活力的影响
活力测定参照文献[14]的方法进行。在37℃下, 0.1 mol/L的磷酸盐测活体系(pH 5.7, 含0.2 mmol/L pNP-NAG)中, 加入不同浓度的CuSO4和ZnSO4, 以不加药物的作对照, 测定这两种常用药物对罗非鱼NAGase活力的影响。重复测定3次。
1.4 对尼罗罗非鱼NAGase荧光发射光谱的影响
分别在3 mL含不同CuSO4和ZnSO4的磷酸盐缓冲液中(pH 5.7)中, 加入一定量的罗非鱼NAGase,混合均匀, 4℃放置30min后, 以波长285 nm的荧光为激发光, 用Hitachi F-4010型荧光分光光度计扫描记录波长为300—400 nm的罗非鱼NAGase的荧光发射光谱。以不含酶的对应缓冲液做空白对照。
1.5 对尼罗罗非鱼NAGase的抑制机理
在含不同浓度CuSO4和ZnSO4的上述测活体系中, 改变加入的酶量, 研究剩余酶活力与酶量之间的关系, 探讨这两种常用药物对该酶抑制作用的机理。
1.6 对尼罗罗非鱼NAGase的抑制类型
固定反应体系温度为 37 , ℃ 在 pH 5.7 磷酸盐的测活体系中, 改变底物[S]浓度, 固定酶量为8 μg/mL, 探讨不同浓度的CuSO4和ZnSO4对该酶催化底物水解反应的影响, 测定酶促反应的初速度, 以Lineweaver-Burk双倒数法作图, 测定其对罗非鱼NAGase的抑制类型和抑制常数。
1.7 对尼罗罗非鱼NAGase热稳定性和pH稳定性的影响
分别在酶液中加入一定浓度的CuSO4和ZnSO4,放置不同温度下(5—80 )℃保温 30min, 测定酶的剩余活力, 以酶的剩余活力对保温温度作图, 确定其对该酶热稳定性的影响。
取10 μL酶液与含有不同浓度CuSO4和ZnSO4的缓冲液(pH 2.1—10.6)等体积混合, 4℃放置24h后,正常测活体系下测定处理后酶的剩余活力, 确定其对该酶pH稳定性的影响。
2 结果
2.1 CuSO4和 ZnSO4对尼罗罗非鱼 NAGase活力的影响
通过测定CuSO4和ZnSO4对尼罗罗非鱼NAGase活力的影响, 发现这两种药物对该酶均表现出强抑制作用。在3 mmol/L的浓度下, 两种药物对该酶抑制率已经达到80%以上, CuSO4和ZnSO4导致该酶活力降低 50%的 IC50分别为(1.23±0.05)和(0.28± 0.02) mmol/L(图1A)。
2.2 CuSO4和 ZnSO4对尼罗罗非鱼 NAGase荧光发射光谱的影响

图1 CuSO4和ZnSO4对尼罗罗非鱼NAGase的影响Fig. 1 Effects of CuSO4and ZnSO4on tilapia NAGase
在3 mL含不同浓度CuSO4的磷酸盐缓冲液中(pH 5.7)中, 加入30 µL尼罗罗非鱼NAGase, 混合均匀, 4℃放置30min后, 以波长285 nm的荧光为激发光, 用Hitachi F-4010型荧光分光光度计扫描记录该酶的荧光发射光谱, 以含有不同浓度 CuSO4的缓冲液做空白对照, 研究其对尼罗罗非鱼 NAGase荧光发射光谱的影响。结果如图1B所示, 天然酶的荧光发射峰值在338 nm处, 随着CuSO4浓度的增大,该酶的荧光发射峰值迅速降低, 当 CuSO4浓度增大到50 µmol/L时, 该酶的特征性荧光发射峰已经消失。
同法探讨ZnSO4对罗非鱼NAGase荧光发射光谱的影响, 结果如图1C所示。随着ZnSO4浓度的增大, 该酶的荧光发射强度反而升高, 而且出现明显的红移现象, 当ZnSO4浓度增大至100 mmol/L时,该酶的特征性荧光发射峰值红移至350 nm处。
2.3 CuSO4和 ZnSO4对尼罗罗非鱼 NAGase的抑制机理
在含不同浓度CuSO4(0、0.5、1、1.5和2 mmol/L)的测活体系(0.1 mol/L磷酸盐缓冲液, pH 5.7, 含0.2 mmol/L pNP-NAG)中, 改变加入的酶量, 以剩余酶活力对加入的酶量作图, 得到一组通过原点的直线(图2A)。且随着CuSO4浓度的增大, 直线的斜率降低。这说明在测试浓度范围内, CuSO4对尼罗罗非鱼NAGase的抑制是可逆的。同样方法测得ZnSO4在测试的浓度范围内(0—0.3 mmol/L), 对尼罗罗非鱼NAGase的抑制也是可逆过程(图2B)。
2.4 CuSO4和 ZnSO4对尼罗罗非鱼 NAGase的抑制类型
进一步通过改变CuSO4浓度(0、0.5、1、1.5和2 mmol/L), 测定CuSO4存在的条件下不同底物浓度对酶促反应的影响效果, 从而研究 CuSO4对尼罗罗非鱼 NAGase的抑制作用类型。通过 Lineweaver-Burk双倒数作图得到交于横坐标轴的一组直线(图3A), 说明 CuSO4对该酶催化底物水解反应的米氏常数 Km不产生影响, 只影响其最大反应速度 Vm,酶促反应的催化速度随着抑制剂CuSO4浓度的增加而逐渐降低, CuSO4对罗非鱼NAG酶的抑制作用表现为非竞争型抑制。以1/v-1/[S]关系图中直线的斜率(Slope)对抑制剂 CuSO4浓度作图得到一条直线(图3A内插图), 通过直线横轴截距求得CuSO4对该酶的抑制常数KI为1.11 mmol/L。
在0、0.05、0.1、0.2和0.3 mmol/L的ZnSO4浓度下, 改变底物的量, 研究 ZnSO4对尼罗罗非鱼NAGase的抑制作用类型, 通过Lineweaver-Burk双倒数作图得到交于纵轴的一组直线(图 3B), 说明ZnSO4浓度改变并不会影响酶促反应的最大反应速度Vm值, 而是影响米氏常数Km值, 且Km随着抑制剂ZnSO4浓度的增大而增大, 由此可见ZnSO4对该酶的抑制作用属于竞争型抑制。底物与ZnSO4可以竞争性地结合在自由酶分子上, ZnSO4的存在不影响该酶催化底物反应的速度, 而是影响其与底物的亲和力。以 Km值对抑制剂 ZnSO4浓度作图得到一条直线(图 3B内插图), 通过直线横轴截距求得ZnSO4对该酶的抑制常数KI为0.20 mmol/L。
2.5 CuSO4对尼罗罗非鱼NAGase热稳定性和pH稳定性的影响
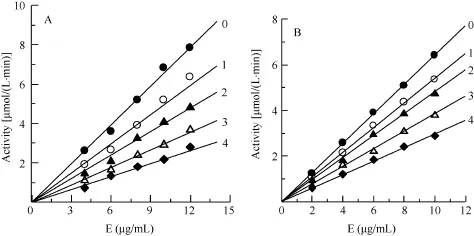
图2 CuSO4(A)和ZnSO4(B)对尼罗罗非鱼NAGase的抑制机理Fig. 2 The mechanism of CuSO4(A) and ZnSO4(B) on NAGase
在0、0.01和 0.02 mmol/L CuSO4存在的条件下, 将尼罗罗非鱼 NAGase放置在不同温度下(5—80 )℃ 保温 30 min后, 测定酶的剩余活力, 研究CuSO4对该酶热稳定性的影响。如图 4(A)所示, 在不含CuSO4的情况下, 罗非鱼NAGase在低于45℃时都是稳定的, 当温度达到 70℃时酶活力才完全丧失; 当CuSO4浓度为0.01 mmol/L时, 该酶只在低于20℃时保持稳定, 当温度达到 50℃时酶活力完全丧失; 当CuSO4浓度达到0.02 mmol/L时, 该酶的稳定范围缩小至低于10 , ℃ 酶活力在35℃时即已完全丧失。
在0、0.02和 0.04 mmol/L CuSO4存在的条件下, 将尼罗罗非鱼NAGase放置在等量不同pH的缓冲液(pH 2.1—10.6)中4℃放置24h后测定酶的剩余活力, 研究 CuSO4对该酶 pH稳定性的影响。如图4(B)所示, 在不含CuSO4的情况下, 罗非鱼NAGase的pH稳定范围很广, 达到3.3—8.1; 随着CuSO4浓度的增加, 该酶的pH稳定范围在碱性区域内变窄。当CuSO4浓度为0.02 mmol/L时, 该酶的pH稳定范围缩小至3.3—6.9; 当CuSO4浓度为0.04 mmol/L时,该酶的pH稳定范围仅为3.3—6.3。
2.6 ZnSO4对尼罗罗非鱼NAGase热稳定性和pH稳定性的影响
在0、0.01和 0.05 mmol/L ZnSO4存在的条件下,探讨ZnSO4对该酶热稳定性的影响。如图5(A)所示,在不含 ZnSO4的情况下, 尼罗罗非鱼 NAGase在4 5℃以下时都是稳定的; 当 Z n S O4浓度为0.01 mmol/L时, 该酶只在低于 30℃时保持稳定, 45℃时酶活力仅存约15%, 当温度达到50℃时酶活力完全丧失; 当ZnSO4浓度达到0.05 mmol/L时, 该酶活力从25℃已开始下降, 酶活力在45℃时即已完全丧失。

图3 CuSO4(A)和ZnSO4(B)对酶的抑制类型Fig. 3 Inhibition type of CuSO4(A) and ZnSO4(B) on tilapia NAGase by Lineweaver-Burk plots

图4 CuSO4对酶热稳定性(A)和pH稳定性(B)的影响Fig. 4 Effects of CuSO4on thermal stability (A) and pH stability (B) of tilapia NAGase

图5 ZnSO4对酶热稳定性(A)和pH稳定性(B)的影响Fig. 5 Effects of ZnSO4on thermal stability (A) and pH stability (B) of tilapia NAGase
在0、0.05和 0.2 mmol/L ZnSO4存在的条件下,将尼罗罗非鱼NAGase放置在等量不同pH的缓冲液(pH 2.1—10.6)中4℃放置24h后测定酶的剩余活力,研究ZnSO4对该酶pH稳定性的影响。如图5B所示,随着ZnSO4浓度的增加, 该酶的pH稳定范围在碱性区域内变窄, 当ZnSO4浓度为0.05 mmol/L时, 该酶的pH 稳定范围缩小至 3.3—6.3; 当 ZnSO4浓度为0.2 mmol/L时, 该酶的pH稳定范围仅为3.3—5.7。
3 讨论
荧光发射光谱实验表明, CuSO4的加入导致了该酶特征性荧光发射光谱的消失, 说明 CuSO4使酶的构象发生了改变。而且比较图 1A和图 1B发现, CuSO4为500 µmol/L时该酶的特征性荧光发射峰早已经消失, 而此时酶活力尚有 80%, 说明 CuSO4使酶的构象变化要快于使酶的活力变化, 揭示维持该酶构象稳定的某些基团比酶水解底物的基团对CuSO4更敏感。这与 CuSO4对锯缘青蟹(Scylla serrata)NAGase的作用效果是一致的[15]。而随着ZnSO4浓度的增大, 该酶的荧光发射强度反而升高, 说明ZnSO4与酶分子的结合可能更好地暴露了该酶分子的荧光发射基团。
笔者之前的试验已经证明SO42¯、Cl¯、NO¯3等酸根并不会影响尼罗罗非鱼 NAGase的活力, 说明试验结果是由金属离子造成的[13]。重金属离子对许多酶都有抑制作用, 往往会使酶变性失活, 然而其对酶的抑制类型却各不相同。本文发现CuSO4对罗非鱼 NAGase 的抑制类型为非竞争型, 说明底物和Cu2+与酶结合的部位不同, 酶与底物的结合并不影响Cu2+的结合位点, 反之亦然。这与Cu2+对锯缘青蟹NAGase的竞争型抑制不同[15]。
Xie等[16]发现在一定浓度内 Zn2+对分离自南美白对虾的 NAGase表现为可逆的非竞争型抑制; Zhang等[17]报道Zn2+对锯缘青蟹NAGase为混合型抑制; 而笔者之前研究发现 Zn2+对于克氏原螯虾(Procambarus clarkii)NAGase则为反竞争型抑制[18]。本文结果显示ZnSO4对尼罗罗非鱼NAGase 表现为竞争型抑制效应, 这说明 Zn2+与该酶的结合位点可能和底物与该酶的结合位点相同, 或者 Zn2+与底物虽不是结合在酶的同一位点, 但当 Zn2+结合在该酶分子上时, 酶分子发生了空间构象的变化, 使得底物与该酶的结合受阻; 反之, 底物与酶的结合也可以导致Zn2+与酶的结合受阻。即使是同种金属离子对不同来源的特定酶, 其抑制作用也不尽相同, 具体机理还有待于进一步研究。
本实验还发现CuSO4和ZnSO4都可以显著缩短尼罗罗非鱼NAGase的热稳定性和pH稳定性且呈浓度依赖关系, 但跟其对酶活力的影响相比, CuSO4对其稳定性的影响要快于 ZnSO4, 可能也是由于低浓度的CuSO4即可使酶的构象发生变化从而引起酶稳定性的急剧变化。
低于 μg/L的低剂量 Cu2+即可在鱼体内脏器官中富集造成内脏器官一定程度的损伤[19], 且已被证明可以在泥鳅(Misgurnus anguillicaudatus)卵巢中蓄积, 造成卵细胞的DNA损伤[20]; 而Zn2+也已被证实会造成雄性动物生殖系统的组织损伤和功能降低[21]。本实验发现Cu2+和Zn2+对尼罗罗非鱼精巢NAGase也有明显的抑制作用, 其对罗非鱼生殖功能的影响还有待深入研究。
[1] Nguyen H A, Nguyen T H, Křen V, et al. Heterologous expression and characterization of an N-Acetyl-β-D-hexosaminidase from Lactococcus lactis ssp. lactis IL1403 [J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3275—3281
[2] Slamova K, Bojarova P, Petraskova L, et al. β-NAcetylhexosaminidase: What’s in a name... [J]? Biotechnology Advances, 2010, 28(6): 682—693
[3] Hogenkamp D G, Arakane Y, Kramer K J, et al. Characterization and expression of the β-N-acetylhexosaminidase gene family of Tribolium castaneum [J]. Insect Biochemistry and Molecular Biology, 2008, 38(4): 478—489 [4] Zhang J P, Hu Y H, Wang Q, et al. Inhibitory kinetics of β-N-Acetyl-D-glucosaminidases from green crab (Scylla serrata) by Zinc ion [J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8763—8767
[5] Lemieux M J, Mark B L, Cherney M M, et al. Crystallographic structure of human β-hexosaminidase A: interpretation of Tay-Sachs mutations and loss of GM2 ganglioside hydrolysis [J]. Journal of Molecular Biology, 2006, 359(4): 913—929
[6] Zitta K, Wertheimer E V, Miranda P V. Sperm N-acetylglucosaminidase is involved in primary binding to the zona pellucida [J]. Molecular Human Reproduction, 2006, 12(9): 557—563
[7] Koyanagi R, Honegger T G. Molecular cloning and sequence analysis of an ascidian egg β-N-acetylhexosaminidase with a potential role in fertilization [J]. Development, Growth & Differentiation, 2003, 45(3): 209—218
[8] Sarosiek B, Glogowski J, Cejko B I, et al. Inhibition of β-N-acetylglucosaminidase by acetamide affects sperm motility and fertilization success of rainbow trout (Oncorhynchus mykiss) and Siberian sturgeon (Acipenser baerii) [J]. Theriogenology, 2014, 81(5): 723—732
[9] NY 5071-2002 pollution-free food. Application guideline of fishery drugs [S]. Beijing: Chinese Standards Press. 2002 [NY 5071-2002无公害食品. 渔用药物使用准则. 北京:中国标准出版社. 2002]
[10] Zhou Y H, Zhou W Y, Pan G P, et al. Acute toxicity testing of Trichlorhpon, copper sulfate and ferrous sulfate mixture to Patichthys stellatus [J]. Journal of Anhui Agriculture Science, 2012, 40(28): 13809—13810 [周裕华, 周文玉, 潘桂平, 等.敌百虫和硫酸铜与硫酸亚铁合剂对星斑川鲽的急性毒性.安徽农业科学, 2012, 40(28): 13809—13810] [11] Nie Z J, Xu G C, Gu R B. Acute toxicity of copper culphate
and potassium permanganate to the larva of Hemibarbus maculates [J]. Anhui Agricultural Science Bulletin, 2011, 17(18): 111—113 [聂志娟, 徐钢春, 顾若波. 硫酸铜和高锰酸钾对花幼鱼的急性毒性试验. 安徽农学通报, 2011, 17(18): 111—113]
[12] Shen M, Yu H X, Deng X H. Heavy metals in surface sediments from lower reach of the Yangtze River [J]. The Administration and Technique of Environmental Monitoring, 2006, 18(5): 15—18 [沈敏, 于红霞, 邓西海. 长江下游沉积物中重金属污染现状与特征. 环境监测管理与技术, 2006, 18(5): 15—18]
[13] Zhang W N, Bai D P, Huang Y Y, et al. Enzymic Characterizations and activity regulations of N-Acetyl-β-D-glucosaminidase from the Spermary of Nile Tilapia (Oreochromis niloticus) [J]. Journal of Bioscience and Bioengineering, 2014, 17(2): 153—157
[14] Zhang W N. Studies on characterizations of N-acetyl-β-D-glucosaminidase from New GIFT Nile tilapia [D]. Thesis for Docter of Science. Fujian Agriculture and Forestry University, Fuzhou. 2014 [张伟妮. “新吉富”尼罗罗非鱼N-乙酰-β-D-氨基葡萄糖苷酶的性质研究. 博士学位论文,福建农林大学, 福州. 2014]
[15] Zhang J P. Studies on the properties and the activity regulation of N-Acetyl-β-D-glucosamini-dase from Green Crab (Scylla serrata) [D]. Thesis for Docter of Science. Xiamen University, Xiamen. 2006 [张继平. 锯缘青蟹N-乙酰-β-D-氨基葡萄糖苷酶的性质及活力调控的研究.博士学位论文, 厦门大学, 厦门. 2006]
[16] Xie X L, Huang Q S, Gong M, et al. Inhibitory kinetics of β-N-acetyl-D-glucosaminidase from prawn (Litopenaeus vannamei) by zinc ion [J]. IUBMB Life, 2009, 61(2): 163—170
[17] Zhang J P, Hu Y H, Wang Q, et al. Inhibitory kinetics of β-N-Acetyl-D-glucosaminidases from green crab (Scylla serrata) by zinc ion [J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8763—8767
[18] Zhang W N, Chen X Y, Huang X H, et al. Effects of four heavy metal ions on the NAGase of Procambarus clarkii [J]. Chinese Journal of Applied and Environmental Biology, 2012, 18(6): 943—947 [张伟妮, 陈欣颖, 黄小红, 等. 4种重金属离子对克氏原螯虾(Procambarus clarkii)NAGase活力的影响. 应用与环境生物学报, 2012, 18(6): 943—947]
[19] Grosell M, McGeer J C, Wood C M. Plasma copper clearance and biliary copper excretion are stimulated in copper-acclimated trout [J]. AJP Integrative and Comparative Physiology, 2001, 280(3): R796—R806
[20] Tang J X, Tang Y Y, Sun H X, et al. Effects of Cu2+and Pb2+(Single factor and joint toxicity) on DNA damage in Misgurnus anguillicaudatus oocytes [J]. Acta Hydrobilogica Sinica, 2013, 37(3): 501—506 [唐建勋, 唐奕扬, 孙红祥, 等. 重金属 Cu2+、Pb2+单因子及联合毒性对泥鳅卵细胞
DNA的损伤效应. 水生生物学报, 2013, 37(3): 501—506] [21] Wei Q, Fan R Q, Yang X F, et al. Effect of zinc on
reproductive toxicity in rats [J]. Journal of Hygiene Research, 2003, 32(6): 618—619 [魏青, 范瑞泉, 杨杏芬, 等. 锌对大鼠生殖毒性的影响. 卫生研究, 2003, 32(6): 618—619]
EFFECTS OF CuSO4AND ZnSO4ON N-ACETYL-β-D-GLUCOSAMINIDASE FROM OREOCHROMIS NILOTICUS
ZHANG Wei-Ni, XIE Lu-Na and HUANG Xiao-Hong
(University Key Lab for Integrated Chinese Traditional and Western Veterinary Medicine and Animal Healthcare in Fujian Province, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
N-Acetyl-β-D-glucosaminidase (EC 3.2.1.52, NAGase), hydrolyzing the oligomers of N-Acetyl-β-D-glucosamine (NAG) into monomer, is correlated with animal reproduction. In the current study, we investigated the effect of two common drugs (CuSO4and ZnSO4) on NAGase from spermary of Nile tilapia (Oreochromis niloticus). The results showed that the IC50of CuSO4and ZnSO4were (1.23±0.05) mmol/L and (0.28±0.02) mmol/L, respectively. Both CuSO4and ZnSO4regulated the conformation of tilapia NAGase, which affected the fluorescence emission of the enzyme. The inhibitory activities of these two drugs were reversible, and the inhibition type of CuSO4was noncompetitive but ZnSO4was competitive. Both CuSO4and ZnSO4had significant influences on the thermal and pH stability of the enzyme. The results contribute to the use and control of CuSO4and ZnSO4in tilapia culture.
Oreochromis niloticus; N-acetyl-β-D-glucosaminidase; CuSO4; ZnSO4
Q556.2
A
1000-3207(2015)06-1093-07
10.7541/2015.144
2014-11-23;
2014-12-28
福建省科技重点项目(2012N0002)资助
张伟妮(1980—)女, 山东招远人; 博士; 主要从事水产动物疾病学方面的研究。E-mail: weinizhang@hotmail.com
黄小红(1966—), 女, 福建建瓯人; 教授, 博士; 主要从事动物生物化学方面的研究。E-mail: xhhuang@vip.sina.com
